| Антиген | Структура | Терминальные углеводные группировки | |
| Лактозилцерамид (Gb2) | Galβ → 4Glc-Cer | ||
| ПАРАГЛОБОЗИДЫ | |||
| Р1 | Параглобозид | Galβ → 4GlcNAcβ1 → 3Galβ1 → 4Glc-Cer | |
| Галактозилпараглобозид | Galβ → 4Galβ1 → 4GlcNAcβ1 → 3Galβ1 → | ||
| 4Glc-Cer | |||
| Сиалозилпараглобозид | NeuAcα2 → 3Galβ1 → 4GlcNAcβ1 → 3Galβ1→ | ||
| 4Glc-Cer | |||
| ГЛОБОЗИДЫ | |||
| P k | Глоботриозилцерамид (Gb3) | Galα1 → 4Galβ1 → 4Glc-Cer | |
| P | Глобозид | GalNAcβ1 → 3Galα1 → 4Galβ1 → 4Glc-Cer | |
| LKE, | Сиалозилгалактозилглобозид | NeuAcα2 → 3Galβ1 → 3GalNAcβ1 → 3Galβ1 → | |
| SSEA-4 | 4Galβ1 → 4Glc-Cer | ||
| Дисиалозилгалактозилглобозид | NeuAcα2 → 3Galβ1 → 3(NeuAcα2 → 6) → | ||
| GalNAcβ1 →3 Galα1 → 4Galβ1 → 4Glc-Cer | |||
| Н | Глобо-Н (тип 4Н) | Fucα1 → 2Galβ1 → 3GalNAcβ1 → 3Galα1 → | |
| 4Galβ1 → 4Glc-Cer | |||
| Антиген | (Gb5) | Gal-NAcα1 → 3GalNAcβ1 → 3Galα1 → | |
| Форссмана | 4Galβ1 → 4Glc-Cer | ||
508
Антигены Р, относящиеся к параглобозидам
Параглобозид (лакто-N-неотетразилцерамид) является предшественником АВН-субстанций типа 2, некоторых ганглиозидов, а также антигена Р1. Первые сведения о природе Р-антигенов были получены в тестах с ингибицией спец-ифических антител. Изучая ингибирующее действие моно -, ди- и трисахари-дов на активность антител анти-Р1, Morgan и Watkins [116, 168] показали, что специфическая активность всех сахаров обусловлена α -D-галактозой. Авторы получили из жидкости эхинококка овец гликопротеин, специфически ингиби-ровавший анти-Р1-антитела. При кислотном гидролизе указанного гликопро-теина было установлено, что детерминанта Р1, распознаваемая антителами анти -Р1, является трисахаридом: Galα1 → 4Galβ1 → 4GlcNAc (Cory и соавт. [33], Schenkel-Brunner [144].
Антиген Р1 на эритроцитах представлен гликосфинголипидом ‒ пента-мерным церамидом (см. табл. 7.2) с трисахаридным терминальным участ-ком, распознаваемым специфическими антителами (Naiki и соавт. [122, 124]). Пространственная структура представляет собой параглобозид с дополнитель-ным остатком α-галактозы. Трисахаридная структура, определяющая специфич-ность, обладала выраженным ингибирующим эффектом по отношению к моно-клональным анти-Р1-антителам (Bailly и соавт. [10, 11], Rouger и соавт. [139]).
Brodin и соавт. [18]) получили Р1-специфический трисахарид синтетиче-ским путем и с успехом использовали для иммунизации мышей с целью полу-чения моноклональных антител. Синтетический трисахарид, коньюгированный
у иммуносорбентом, извлекал антитела анти-Р1 из аллоиммунных сывороток
(Cowles и соавт. [34]).
Описаны антитела, реагирующие с эритроцитами нулевого фенотипа р. Эти антитела специфически ингибировались сиалозилпараглобозидом (Metaxas и соавт. [111], Schwarting и соавт. [145]), терминальная часть которого содержала остатки сиаловых кислот. Упомянутый сиалозилпараглобозид найден в высокой концентрации на эритроцитах лиц, имеющих нулевой фенотип р. При этом син-тез вещества P k (Gb3) блокирован.
Антигены Р, относящиеся к глобозидам
Антигены Р, P k и Р1 между собой тесно связаны, однако имеют разную при-роду: Р и P k относятся к глобозидам, а Р1 ‒ к параглобозидам. На эритроцитах они представлены гликолипидами, в жидкости эхинококковых кист они присут-ствуют в составе гликопротеинов.
Используя очищенные гликолипиды для ингибиции антител анти-PP1P k, Naiki и Matson [125], Yang и соавт. [175] установили, что глобозид и тригек-созид церамида (Gb3) свойственны эритроцитам, несущим антигены Р и P k. Субстанция P k трансформируется в антиген Р, а антиген Р1 синтезируется на основе параглобозидов (рис. 7.1).
509
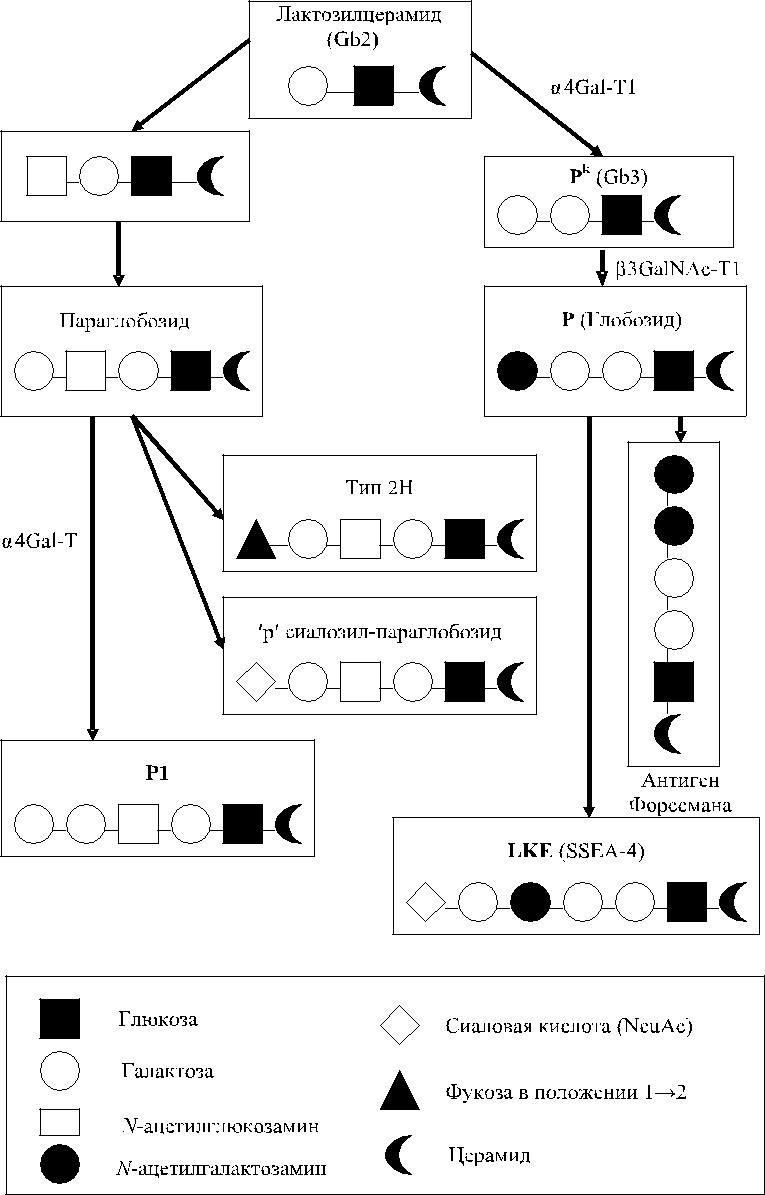
Рис. 7.1. Синтез антигенов Р и GLOB по Daniels [37].
Антиген P k
Формирование антигенной детерминанты P k происходит с участием α-D-галактозы (Furukawa [49], Kundu и соавт. [86], Voak и соавт. [161], Watkins, Morgan [168]). Активность антител анти-P k, так же как и анти-Р, ингибировалась жидкостью кист эхинококка (Matson и соавт. [108]). Частичный кислотный гидролиз гликопроте-ина, выделенного из эхинококковых кист, позволил получить 2 субстанции: трисаха-рид, обладающий способностью специфически инактивировать антитела анти-Р1 и анти-P k, и дисахарид Galα1 → 4Gal, связывающий антитела анти-Р1, но инертный по отношению к анти-P k-антителам [168]. Другие олигосахариды, содержавшие терми-нальные α-галактозные группы, также нейтрализовали активность анти-P k-антител, что подтверждало участие α-галактозы в формировании эпитопов P k [168].
510
Naiki, Marcus [125] идентифицировали антиген P k как Gb3 (глобозид 3) с на-личием галактозного остатка.
Анализ мембранных гликосфинголипидов показал, что Gb3 отсутствует на эритроцитах нулевого фенотипа р, однако содержится в повышенном количе-стве на эритроцитах P k + (Koscielak и соавт. [85], Marcus и соавт. [107]). Как было показано Nudelman и соавт. [128], моноклональные антитела анти-P k хоро-шо связываются с Gb3.
Brodin и соавт. [18] получили несколько образцов мышиных моноклональ-ных анти-P k-антител иммунизацией животных синтетическими гликопротеина-ми с присоединенной трисахаридной группировкой Galα1 → 4Galβ1 → Clc.
При изучении мембранных гликосфинголипидов, выделенных из эритроци-тов Р1 и Р2, установлено присутствие на обоих типах клеток глобозида 3 в ка-честве общего компонента мембраны (Naiki, Markus [124, 125], Markus и соавт. [105, 106]). Полученные авторами данные свидетельствуют о том, что антиген P k в действительности встречается чаще, чем это было ранее показано с помо-щью серологических методов исследования.
Антиген Р (глобозид)
Гликопротеины, угнетающие активность антител анти-Р1 и анти-P k, не реагировали с антителами анти-Р. Причина такого реагирования вскоре стала понятной . Naiki и Matson [125], используя технику ингибиции анти-тел , установли, что антиген P k представлен глобозидом 3 (Gb3), а антиген P – глобозидом 4 (Gb4). Было показано, что Gb4 отсутствует на эритроцитах P k и содержится в следовых количествах на клетках р (Kundu и соавт. [86], Marcus и соавт. [107]).
Глобозиды являются наиболее представительными мембранными гликоли-пидами: на одной клетке может присутствовать до 14 млн молекул (Anstee [6, 8], Fletcher и соавт. [45]). Вариант глобозида Gb3 (P k) содержит дополнитель-ный N-ацетилгалактозаминовый остаток (см. табл. 7.2).
Моноклональные антитела анти-Р ингибировались глобозидами, имею-щими терминальные группировки GalNAcβ1 → 3Galα1 → 4Gal и Galβ1 → 3GalNAcβ1 → 3Gal (Kannagi и соавт. [73]). Один из образцов моноклональных анти-Р-антител нейтрализовался иммуносорбентом Galβ1 → 3GalNAc-R, об-ладающим специфичностью Т -антигена (Inglis и соавт. [66]). Анти-Р-антитела аллогенного происхождения с указанным дисахаридом не реагировали.
Эритроциты р, несмотря на отсутствие в их мембране глобозидов Gb3 и Gb4, каких-либо морфологических и функциональных отклонений от нормы не име-ют. Они содержат лактозилцерамид и другие комплексные гликолипиды в более высокой концентрации, чем эритроциты Р1 (Kundu и соавт. [89], Marcus и соавт. [107], Wiels и соавт. [171]).
Высокая концентрация глобозидов зарегистрирована в почках (Kundu и со-авт. [87]).
511
Антиген LKE
Антиген LKE [см. Антиген LKE (Luke)] перекрестно реагирует с монокло-нальными антителами к мышиному стадиоспецифическому эмбриональному антигену (SSEA-4). Химическая структура позволила отнести его к глобозидам (Daniels [37], Kannagi и соавт. [73]).
Генетика
Подобно тому, как это имеет место в системе АВО, продуктом генов ло-куса Р являются не сами антигены, а гликозилтрансферазы. Антигены, рас-познаваемые специфическими антителами, образуются в результате при-соединения углеводных группировок к терминальным участкам субстрата-предшественника. Возникновение нулевого фенотипа р связано с мутациями гена α4Gal-T (табл. 7.3).
| Таблица 7.3 | |||
| Молекулярная основа фенотипа р* | |||
| Позиция нуклеотидных и аминокислотных замен | Популяция | ||
| Экзон 2 C 752 T, Pro 251 Leu; G 903 C, Pro 301 Pro | Японцы | ||
| Экзон 2 A 109 G, Met 37 Val; C 752 T; Pro 252 Leu; G 987 A, Thr 329 Thr | Японцы | ||
| Экзон 2 T 548 A, Met 183 Lys | Шведы | ||
| Экзон 2 T 548 A, Met 183 Lys; 987 G > A, Thr 329 Thr | Шведы | ||
| Экзон 2 | G 560 A, Gly 187 Asp | Шведы | |
| Экзон 2 | G 783 A, Trp 261, возникновение стоп-кодона | Японцы | |
| Экзон 2 | 237-239 делеция CTT, делеция Phe 81 | Японцы | |
| Экзон 2 | 1029-1030 ins C, изменение рамки считывания с образованием | Японцы | |
| продукта, состоящего из 92 дополнительных аминокислот | |||
| * По Reid, Lomas-Francis [136]. | |||
P k -синтаза
Ген α4Gal-T1, обусловливающий фенотипические различия Р1 и Р2, карти-рован на хромосоме 22 (22q13.2). В этом регионе секвенирован участок , коди-рующий α1,4-галактозилтрансферазу, которая присоединяет галактозу к лак-тозилцерамиду (глобозиду 2) с образованием глоботриозилцерамида (глобози-да 3), или антигена P k(Gb3) (Furukawa и соавт. [50], Steffenson и соавт. [155]). Ген α4Gal-T1 представлен двумя экзонами, его гомологи, помимо млекопита-ющих, найдены у насекомых и растений (Keuch и соавт. [79]).
Р-синтаза
и последние годы удалось картировать и клонировать ген, кодирующий трансферазу β3GalNAc-T1. Указанный фермент обеспечивает присоедине-ние N-ацетилгалактозаминового остатка к глобозиду 3 (P k), в результате чего происходит превращение вещества P k в антиген Р (Almeida и соавт. [4, 5],
512
Kijimoto-Ochiai и соавт. [82], Okajama и соавт. [129]). Ген β3GalNAc-T1 незави-сим от других групповых антигенов крови, он представлен одним экзоном, рас-положенным в позиции 3q25. Последнее послужило основанием присвоить ан-тигену Р статус групповой системы эритроцитов – GLOB (028) [136]. Вещество P присутствует в различных тканях организма: головном мозге, миокарде, лег-ких, тестикулах, почках, печени, селезенке, желудке, плаценте. Степень экс-прессии в органах варьирует в широких пределах.
Р1-синтаза
Считается, что Р1-синтаза представляет собой разновидность α1,4-галакто-зилтрансферазы, которая способна превращать параглобозид в антигенную субстацию Р1 (Furukawa и соавт. [50], Steffenson и соавт. [155]) и, возможно, р (Iizuka и соавт. [64]).
Предложены 2 генетические модели биосинтеза вещества Р1, Р и ассоции-рованных с ними антигенов, которые в той или иной мере объясняют зависи-мость Pp-фенотипа от синтеза глобозидов и параглобозидов (Fletcher и соавт. [45], Kundu и соавт. [89] и др.).
Одна из моделей, предложенная Graham и Williams [51], предполагает суще-ствование 2 локусов: Р и Р1.
Локус Р1 представлен тремя аллелями – P 1 k , P k и р:
–– P 1 k кодирует α1,4-галактозилтрансферазу, которая превращает парагло-бозид и лактозилцерамид в вещества P k и Р1;
–– P k кодирует α1,4-галактозилтрансферазу, способную преобразовать лак-тозилцерамид в вещество P k;
–– р – молчащий аллель, в присутствии которого антигены P k и Р1 не об-разуются.
Локус Р представлен двумя аллелями: Р + и Р–, последний из них – мол-чащий.
Согласно этой модели, у родителей р × Р2 не должно быть детей с груп-пой Р1, что подтверждено результатами посемейных исследований.
Naiki и Marcus [124] предложили трехлокусную модель: Р, P k и Р1 с вариан-том Р1 +. Эта модель допускает возможность рождения детей с группой Р1 у ро-дителей р × Р2. Однако в действительности такой комбинации ни разу не наблю-дали. Предположение о сцепленности генов P k и Р1 на хромосоме не подтвер-дилось в экспериментах по секвенированию региона 22q13.2 генома человека (Steffenson и соавт. [155]).
513
Дата: 2019-02-24, просмотров: 485.