Рецепторы для микробов и вирусов
Кишечная палочка (Escherichia coli), вызывающая пиелонефрит и другие рециди-вирующие воспаления мочеполового тракта, прилипает к эпителию слизистой обо-лочки с помощью адгезинов – лектиноподобных веществ, расположенных на по-верхности бактериальной клетки (Lingwood и соавт. [102], Stapleton и соавт. [154]).
Адгезины связываются с гликоконъюгатами глобозидов, содержащими диса-харид Galα1 → 4Gal, а также сиалозил- и дисиалозилгалактозил (Elder, Spitalnik [40], Lindstrom и соавт. [101], Moulds и соавт. [118]). Указанные вещества со-ставляют основу специфичностей Р1, Р, P k, LKE и других антигенов, объеди-ненных в систему Р и GLOB.
Как показали Kallenius и соавт. [72], способность уропатогенных штаммов Escherichia coli связываться с эритроцитами и эпителиальными клетками лиц, имеющих фенотип р, снижена. Следовало ожидать, что лица, имеющие груп-пу крови р, резистентны к урогенитальным инфекциям, однако изучение корре-лятивной связи фенотипа Р1 с урогенитальными инфекциями не дало однознач-ных результатов (Kallenius и соавт. [72]) .
Некоторые штаммы Escherichia coli выделяют энтеротоксины, в частности веротоксин, подобный токсину Шига, который продуцируют бациллы Shigella dysenteriae. Веротоксин вызывает воспаление слизистой оболочки тонкой киш-ки, диарею, инициирует гемолитический уремический синдром (Green [52], Elder, Spitalnik [40]). Р-группоспецифический дисахарид Galα1 → 4Gal высту-пает в роли лиганда, фиксирующего веротоксин на эпителии слизистой обо-лочки.
Свиной стрептококк (Streptococcus suis), один из возбудителей менинги-та человека, способен связываться с веществом P k – трисахаридом Galα1 → 4Galβ1 → 4Glc. Препараты их этих бактерий сильнее агглютинировали эритро-циты P1 k и P2 k по сравнению с Р1 и Р2, но не вызывали склеивания эритроцитов р (Haataja и соавт. [53]).
Антиген Р (глобозид) является клеточным рецептором для парвовируса В19, проявляющего высокую тропность к костномозговым клеткам, особенно к эри-троидным предшественникам, в которых он реплицируется (Brown и соавт. [20]). Оболочки лизированного вируса В19 вызывали агглютинацию эритроци-тов Р1 и Р2, но не реагировали с эритроцитами P k и р. Цитотоксичность парвови-руса в клеточной культуре удавалось предотвратить с помощью моноклональ-ных антител анти-Р. Антитела анти-Р1 и анти-P k цитотоксичность указанного вируса не отменяли. Цитотоксичность не наблюдали в культурах костномозго-вых клеток, полученных от лиц р (Brown и соавт. [19–21]).
При двойном иммунном окрашивании клеток костного мозга, инфицирован-ных парвовирусом В19, установлено, что вирусные частицы адсорбируются на клетках, экспрессирующих антиген Р (Kerr и соавт. [78]).
514
Лица, имеющие фенотип р, оказались невосприимчивы к парвовирусной ин-фекции В19 (Kerr и соавт. [78]).
Имеются данные, что лиганд Gb3 (P k) может выступать в роли кофактора, способствующего проникновению вируса иммунодефицита человека HIV-1 в Т-клетки (Hammache и соавт. [54], Puri и соавт. [132]).
Невынашивание беременности
Частота привычных выкидышей (ранних спонтанных абортов) существенно выше среди женщин с фенотипом р, чем в популяции в целом. У многих жен-щин фенотип р были выявлен именно по этой причине.
Прерывание беременности, обусловленное анти -Р-антителами, проис-ходит в I триместре беременности. Если этого не происходит, беремен-ность развивается нормально и завершается рождением здорового ребенка.
большинства детей Р1 и Р2, родившихся от матерей группы р, ГБН не раз-вивается (Sheedan и соавт. [148], Yamaguchi и соавт. [174]), хотя легкие фор-мы указанной патологии в ряде случаев были описаны (Hayashida и соавт. [56], Levene и соавт. [91]).
Установлено (Cantin, Lyonnais [24], Levine и соавт. [97], Weiss и соавт. [169]),
что причиной ранних самопроизвольных выкидышей у женщин, имеющих группу крови р, являются антитела анти-РР1P k. Какая именно фракция этих ан-тител обусловливает указанную патологию, пока неизвестно.
Ikin и соавт. [65] и Levine [92] полагали, что невынашивание беременности обусловлено анти-Р1-фракцией, поскольку антиген Р1 формируется у эмбриона на ранних стадиях внутриутробного развития. Sanger и Tippett [143] не разделя-ли эту точку зрения, поскольку у женщин р, имевших мужей Р1 и Р2, рождались
и здоровые дети, при этом соотношение детей Р1:Р2 не отличалось от имеюще-гося в популяции в целом.
Kato и соавт. [76] связывают невынашивание беременности с анти-P k-антителами: антиген P k также хорошо выражен в растущих тканях раз-вивающегося эмбриона.
Lopez и соавт. [103]) установили, что в 75 % случаев антитела анти-P k обла-дают in vitro цитотоксическими свойствами и, следовательно, способны вызвать патологию in vivo.
Энзимные и радиоиммунные тесты показали, что сыворотки крови почти всех лиц, имеющих фенотип р, содержат антитела анти-РР1P k IgG3-субкласса
(Rydberg и соавт. [140], Soderstrom и соавт. [151]), которые, как известно, могут преодолевать плацентарный барьер.
гликосфинголипидах, выделенных из тканей спонтанно абортированных 12- и 17-недельных плодов, антигены Р и P k обнаруживали в следовых количествах. В то же время гликосфинголипиды, выделенные из плацент, хорошо экспрессировали ука-занные антигены (Lindstrom и соавт. [100]). Таким образом, мишенью для антител, обусловливающих невынашивание беременности, является не плод, а плацента.
515
Антитела анти-Р у женщин с фенотипом P k не вызывали угнетения беремен-ности и лишь в редких случаях служили причиной легких форм ГБН (Nakagima
а соавт. [126], Yamaguchi и соавт. [174]).
Антитела анти-Р, ассоциированные с привычными выкидышами, были опи-саны у японской женщины с фенотипом P2 k и женщины с фенотипом P1 k жи-тельницы Кувейта (Shirey и соавт. [150], Yoshida и соавт. [176]). У 1-й женщи-ны было 4 самопроизвольных выкидыша, у 2-й – 13. Ни та, ни другая не име-ли детей. В дальнейшем обеим женщинам с 5–6 недели очередной беременно-сти проводили плазмаферез с целью снижения титра антител. Обе женщины ро-дили жизнеспособных детей, не нуждающихся в каком-либо специальном лече-нии, кроме фототерапии. В сыворотке крови женщины из Кувейта присутство-вали IgM, IgG (главным образом IgG3) и IgA; такие же анти-Р-антитела были элюированы из тканей плаценты. Плазму японской женщины адсорбировали Р-положительными эритроцитами, после чего производили реинфузию (Yoshida
в соавт. [176]). Имеются другие сообщения об эффективном применении плаз-мафереза у женщин, имеющих р-фенотип и страдающих невынашиванием бе-
ременности (Fernandez-Jimenez и соавт. [43], Rydberg и соавт. [140], Shechter [147], Yoshida и соавт. [177]).
Необычные антитела выявили Vos и соавт. [167] в Перте (Западная Австралия) у женщин с привычным невынашиванием беременности. Эти анти-тела вызывали гемолиз, но не агглютинировали эритроциты Р1 и Р2; тесты с эри-троцитами р были отрицательными. Женщины имели фенотип Р1. Гемолизины обнаруживали в сыворотках крови только в момент самопроизвольного выки-дыша, вне беременности антитела не обладали гемолитической активностью. Гемолитическая активность не была опосредована комплементом. Vos и соавт. [164–167], обследовавшие женщин, не нашли какого-либо объяснения указан-ному феномену.
В женщин Канады, США и Венгрии, страдавших невынашиванием бере-менности, подобных гемолизинов не обнаружено (Horvath и соавт. [63], Vos et al [167]).
Список литературы
с Пискунова Т.М., Ичаловская Т.А. Фенотип крови Джей (Tj) и его взаимоотношения с групповой системой крови Р // Пробл. гематол. – 1975. – № 7. – С. 30–33.
с Adinolfi M., Polley M.J., Hunter D.A., Mollison P.L. Classification of blood-group antibodies as β2M or gamma globulin // Immunology. – 1962. – V. 5. – P. 566–579.
с Allen F.H., Marsh W.L., Jensen L., Fink J. Anti-IP: an antibody defining another product of interaction between the genes of the I and P blood group systems // Vox Sang. – 1974. – V. 27. – P. 442–446.
с Almeida R., Amado M., David L. et al. A family of human β4-galactosyltransferases: cloning and expression of two novel UDP-galactose: β-N-acetylglucosamine β1, 4-galactosyltransferases, β4Gal-T3 // J. Biol. Chem. – 1997. – V. 272. – P. 31979–31991.
516
с Amado M., Almeida R., Carneiro F. et al. A family of human β3-galactosytransferases. Characterization of four members of a UDP-galactose:β-N-acetylglucosamine / β-N-acetyl-galactosamine β-1,3-galactosyltransferase family // J. Biol. Chem. – 1998. – V. 273. – P. 12770– 12778.
с Anstee D.J. Blood group-active surface molecules of the human red blood cells // Vox Sang. – 1990. – V. 58. – P. 1–20.
с Anstee D.J., Holt P.D.J., Pardoe G.J. Agglutinins from fish ova defining blood groups B and P // Vox Sang. – 1973. – V. 25. – P. 347–360.
с Anstee D.J., Tanner M.J.A. The distribution of blood-group antigens on butanol extraction of human erythrocyte ‘ghosts’ // Biochem. J. – 1974. – V. 138. – P. 381–386.
с Arndt P.A., Garratty G., Marfoe R.A., Zeger G.D. An acute hemolytic transfusion reaction caused by anyi-P1 that reacted at 37 oC // Transfusion. – 1998. – V. 38. – P. 373–377.
с Bailly P., Bouhours J.-F. P blood group and related antigens // Blood Cell Biochemistry / J.-P. Cartron, P. Rouger, eds. – N.Y.: Plenum Press. – 1995. – V.6. – P. 299–329.
с Bailly P., Chevaleyre J., Sondag D. et al. Characterization of a murine monoclonal antibody specific for the human P1 blood group antigen // Mol. Immunol. – 1987. –
24. – P. 171–176.
с Beck M.L. ed. Third International Workshop and Symposium on Monoclonal Antibodies Against Human Red Blood Cells an Related Antigens // Transfus. Clin. Biol. – 1997. –
4. – P. 13–54 (8 papers).
с Ben-Ismail R., Rouger P., Carme B. et al. Comparative automated assay of anti-P1 antibodies in acute hepatic distomiasis (fasciolasis) and in hydatidosis // Vox Sang. – 1980. – V. 38. –
165–168.
в Bevan B., Hammond W., Clarke R.I. Anti-P1-associated with liver-fluke infection // Vox Sang. – 1970. – V. 18. – P. 188–189.
в Bono R., Cartron J.P., Mulet C. et al. Selective expression of blood group antigens on human teratocarcinoma cells // Rev. Franc. Transfus. Immunohemat. – 1981. – V. 24. –
и 97–107.
в Booth P.B. Anti-I TP1: an antibody showing a further association between the I and P blood group systems // Vox Sang. – 1970. – V. 19. – P. 85–90.
в Bouhours D., Bouhours J.F., Wikkem C. et al. Over expression of the P1 blood group antigen on red cells from CDAII patient [Abstract] // Vox Sang. – 1994. – V. 67 (Suppl. 2). – P. 118.
в Brodin N.T., Dahmen J., Nilsson B. et al. Monoclonal antibodies produced by immunization with neoglycoproteins containing Galα1- 4Galβ1-4Glcβ-O and Galα1- 4Galβ1-4GlcNAcβ-O residues: useful immunochemical and cytochemical reagents for blood group P antigens and a differentiation marker in Burkitt lymphoma and other B-cell malignancies // Int. J. Cancer. – 1988. – V. 42. – P. 185–194.
в Brown K.E. Haematological consequences of parvovirus B19 infection // Bailliere Best Pract. Res. Clin. Haematol. – 2000. – V. 13. – P. 245–259.
в Brown K.E., Anderson S.M., Young N.S. Erythrocyte P antigen: cellular receptor for B19 parvovirus // Science. – 1993. – V. 262. – P. 114–117.
в Brown K.E., Hibbs J.R., Gallinella G. et al. Resistance to parvovirus B19 infection due to lack of virus receptor (erythrocyte P antigen) // N. Engl. J. Med. – 1994. – V. 330. –
и 1192–1196.
в Bruce M., Watt A., Gabra G.S. et al. LKE red cell antigen and its relationship to P1 and P k: serological study of a large family // Vox Sang. – 1985. – V. 55. – P. 237–240.
в Cameron G.L., Staveley J.M. Blood group P substance in hydratid cyst fluids // Nature. – 1957. – V. 179. – P. 147–148.
в Cantin G., Lyonnais J. Anti-PP1P k and early abortion // Transfusion. – 1983. – V. 23. –
и 350–351.
517
\endash \e Catino M.L., Busch S., Huestis D.W., Stern K. Transmission of the blood group genotype pp (Tj a-negative) in a kinship with multiple consanguineous marriages // Amer. J. Hum. Genet. – 1965. – V. 17. – P. 36–41.
\endash \e Cedergren B. Population studies in northern Sweden. IV. Frequency of the blood type P // Hereditas. – 1973. – V. 73. – P. 27–30.
\endash \e Chandeysson P.L., Flye M.W., Simpkins S.M., Holland P.V. Delayed hemolytic transfusion reaction caused by anti-P1 antibody // Transfusion. – 1981. – V. 21. – P. 77–82.
\endash \e Cheng M.S. Potent anti-P1 following blood transfusion // Transfusion. – 1984. – V. 24. – P. 183.
\endash \e Chester M.A., Johnson U., Lundblad A. et al. // Proc. 2-nd. Int. Workshop and Symposium on Monoclonal Antibodies Against Human Red Blood Cells an Related Antigens., 1990. – P. 86–92.
\endash \e Cohen D.W., Nelson L. Auto-anti-P reacting only by low-ionic-strength solutions in a patient with hemolysis // Transfusion. – 1983. – V. 23. – P. 79–80.
\endash \e Contreras M., Tippett P. The Lu(a −b −) syndrome and an apparent upset of P1 inheritance // Vox Sang. – 1974. – V. 27. – P. 369–371.
\endash \e Cooling L.L.W., Zhang D., Koerner T.A.W. Human platelets express gangliosides with LKE activity and ABH blood group activity // Transfusion. – 2001. – V. 41. – P. 504–516.
\endash \e Cory H.T., Yates A.D., Donald A.S.R. et al. The nature of the human blood group P1 determinant // Biochem. Biophys. Res. Commun. – 1974. – V. 61. – P. 1289–1296.
\endash \e Cowles J.W., Blumberg N. Neutralization of P blood group antibodies by synthetic solid-phase antigens // Transfusion. – 1987. – V. 27. – P. 272–275.
\endash \e Cox M.T., Roberts M., LaJoie J. et al. An apparent primary immune response involving anti-Jk a and anti-P1 detected 10 days after transfusion // Transfusion. – 1992. – V. 32. – P. 874.
\endash \e Crawford M.N., Tippett P., Sanger R. Antigens Au, I and P1 of cells of the dominant type of Lu(a −b −) // Vox Sang. – 1974. – V. 26. – P. 283–287.
\endash \e Daniels G.L. Human Blood Groups. – 2-nd. ed. – Oxford: Blackwell Science, 2002. – 560 p.
\endash \e DiNapoli J.B., Nichols M.E., Marsh W.L. et al. Hemolytic transfusion reaction caused by IgG anti-P1 [Abstract] // Transfusion. – 1978. – V. 18. – P. 383.
\endash \e Dunstan R.A. Status of major red cell blood group antigens on neutrophils, lymphocytes and monocytes // Brit. J. Haemat. – 1986. – V. 62. – P. 301–309.
\endash \e Elder A.F., Spitalnik S.L. Blood group antigens as receptors for pathogens // Molecular Biology and Evolution of Blood Group and MHC Antigens in Primates / A. Blancher, J. Kein, W.W. Socha eds. – Berlin: Springer-Verlag, 1997. – P. 268–304.
\endash \e Engelfriet C.P., von Beckers D., dem Borne A.E.G.K. et al. Haemolysins probably recognizing the antigen p // Vox Sang. – 1971. – V. 23. – P. 176–181.
\endash \e Fellous M., Gerbal M., Nobillot G., Weils J. Studies on the biosynthetic pathway of human P erythrocyte antigen using genetic complementation tests between fibroblasts from rare, p and P k phenotype donors // Vox Sang. – 1977. – V. 32. – P. 262–268.
\endash \e Fernandez-Jimenez M.C., Jimenez-Marco M.T., Hernandez D. et al. Treatment with plasmapheresis and intravenous immunoglobulin in pregnancies complicated with anti-PP1P k or anti-K immunization: a report of two patients // Vox sang. – 2000. – V. 80. – P. 117–120.
\endash \e Fisher R. The variation in strength of the human blood group P // Heredity. – 1953. – V. 7. – P. 81–89.
\endash \e Fletcher K.S., Brener E.G. Schwarting G.A. P blood group regulation of glycosphingolipid level in human erythrocytes // J. Biol. Chem. – 1979. – V. 254. – P. 11196–11198.
\endash \e Francois-Gerard C., Brocteur J., Andre A. et al. Demonstration of the existence of a specific blood-group P1 antigenic determinant in turtle-dove ovomucoid // Rev. Franc. Transfus. Immunohemat. – 1980. – V. 23. – P. 579–588.
\endash \e Francois-Gerard C., Brocteur J., Andre A. Turtledove: a new source of P1-like material cross-reacting with the human erythrocyte antigen // Vox Sang. – 1980. – V. 39. – P. 141–148.
518
\endash \e Francois-Gerard C., Gerday C., Beeley J.G. Turtle-dove ovomucoid, a glycoprotein proteinase inhibitor with P1-blood group antigen activity // Biochem. J. – 1979. – V. 177. –
679–685.
\endash \e Furukawa K. Properties of P blood group antigen and antibodies // Jpn. J. Hum. Genet. – 1975. – V. 20. – P. 32–33.
\endash \e Furukawa K., Iwamura K., Uchikawa M. et al. Molecular basis for the p phenotype: identification of distinct and multiple mutations in the α1,4-Galactosyltransferase-gene in Swedish and Japanese individuals // J. Biol. Chem. – 2000. – V. 275. – P. 37752–37756.
\endash \e Graham H.A., Williams A.N. A genetic model for the inheritance of the P, P1 and P k antigens
Immunol. Commun. – 1980. – V. 9. – P. 191–201.
\endash \e Green D.A. P1 blood group and haemolytic uraemic syndrome // Clin. Lab. Haemat. – 2000. – V. 22. – P. 55.
\endash \e Haataja S., Tikkanen K., Liukkonen J. et al. Characterization of a novel bacterial adhesin specificity of Streptococcus suis recognizing blood group P receptor oligosaccharides //
Biol. Chem. – 1993. – V. 268. – P. 114–117.
в Hammache D., Yahi N., Maresca M. et al. Human erythrocytes glycosphingolipids as alternative cofactor for human immunodeficiency virus type 1 (HIV-1) gp120 and reconstituted membrane microdomains o glycosphingolipids (Gb3 and GM3) // J. Virol. – 1999. – V. 73. – P. 5244–5248.
в Hansson G.C., Wasniowska K., Rock J.A. et al. The glycosphingolipid composition of the placenta of a blood group P fetus delivered by a blood group P1 k woman and analysis of the anti-globoside antibodies found in maternal serum // Arch. Biochem. Biophys. – 1988. –
260. – P. 168–176.
в Hayashida Y., Waanabe A. A case of p Taiwanese woman delivered of an infant with hemolytic disease of the newborn // Jpn. J. Legal. Med. – 1968. – V. 22. – P. 10–15.
в Heddle N.M. Acute paroxysmal cold hemoglobinuria // Transfus. Med. Rev. – 1989. –
3. – P. 219–229.
в Heiken A. Observations on the blood group receptor P1 and its development in children // Hereditas. – 1966. – V. 56. – P. 83–98.
в Hellberg A., Poole J., Olsson M.L. Molecular basis of the globoside-deficient P k blood group phenotype. Identification of four inactivating mutations in the UDP-N-acetylgalactosamine: 6globotriaosylceramide 3-β-N-acetylgalactosaminyltransferase gene // J. Biol. Chem. – 2002. – V. 277. – P. 29455–29459.
в Henningsen K. Etude d’ensemble du facreur sanguin P // Rev. Hemat. – 1950. – V. 5. –
76–284.
В Henningsen K. Investigations on the blood factor P // Acta Path. Microbiol. Scand. – 1949. –
26. – P. 639–654.
В Henningsen K. On the heredity of blood factor P // Acta Path. Microbiol. Scand. – 1949. –
26. – P. 769–785.
В Horvath E., Paisz I. Absence of anti-Tj a-like hemolysin in pregnant aborters in Budapest // Transfusion. – 1966. – V. 6. – P. 499–500.
В Iizuka S., Chen S.-H., Yoshida A. Studies on the human blood group P system: an existence
of UDP-Gal: Lactosylceramide α1→4 galactosyltransferase in the small p type cells // Biochem. Biophys. Res. Commun. – 1986. – V. 137. – P. 1187–1195.
В Ikin E.W., Kay H.E.M., Playfair J.H.L., Mourant A.E. P1 antigen in the human foetus // Nature. – 1961. – V. 192. – P. 883.
В Inglis G., Fraser R.H., Mitchell A.A.B. et al. Serological characterization of a mouse monoclonal anti-P-like antibody // Vox Sang. – 1987. – V. 52. – P. 79–82.
В Issitt C.H., Duckett J.B., Osborne B.M. et al. Another example of an antibody reactive optimally with p red cells // Brit. J. Haemat. – 1976. – V. 34. – P.19–23.
519
А Issitt P.D., Anstee D.J. Applied Blood Group Serology. – 4-th ed. – Durham, NC, USA: Montgomery Sc. Publ., 1998. – 1208 p.
А Issitt P.D., Tegoli J., Jackson V. et al. Anti-IP1: antibodies that show an association between I and P blood group systems // Vox Sang. – 1968. – V. 14. – P. 1–8.
А Judd W.J. A pH-dependent auto-agglutinin with anti-p specificity // Transfusion. – 1975. –
15. – P. 373–376.
А Judd W.J., Steiner E.A., Capps R.D. Autoagglutinins with apparent anti-P specificity reactive only by low-ionic-strength salt techniques // Transfusion. – 1982. – V. 22. – P. 185–188.
А Källenius G., Svenson S.B., Möllby R. et al. Structure of carbohydrate part of receptor of human uroepitelial cells for pyelonephritogenic Echerichia coli // Lancet. – 1981. – V. ii. –
604–606.
MMM Kannagi R., Cochran N.A., Ishigami F. et al. Stage-specific embryonic antigens (SSEA-3 and -4) are epitopes of unique globo-series ganglioside isolated from human teratocarcinoma cells // EMBO J. – 1983. – V. 2. – P. 2355–2361.
NNN Kannagi R., Levine P., Watanabe K., Hakomori S. Recent studies of glycolipids and glycoprotein profiles and characterization of the major glycolipid antigen in gastric cancer of a patient of blood group phenotype (Tj a-) first studied in 1951 // Cancer Res. – 1982. – V. 42. –
5249–5254.
OOO Kasai K., Galton J., Terasaki P.I. et al. Tissue distribution of the P k antigen as determined by a monoclonal antibody // J. Immunogenet. – V. 12. – P. 213–220.
PPP Kato M., Kubo S., Naiki M. Complement fixation anti-bodies to glycosphingolipids in sera of rare blood group p and P k phenotypes // J. Immunogenet. – 1978. – V. 5. – P. 31–40.
QQQ Kelus A., Gurner B.W., Coombs R.R.A. Blood group antigen on HeLa cells shown by mixed agglutination // Immunology. – 1959. – V. 2. – P. 262–267.
RRR Kerr J.R., McQuaid S., Coyle P.V. Expression of P antigen in parvovirus B19 infected bone marrow // N. Engl. J. Med. – 1995. – V. 332. – P. 128.
SSS Keuch J.J., Manzella S.M., Nyame K.A. et al. Cloning of Gb3 synthase, the key enzyme in globo-series glycosphingolipid synthesis, predicts a family of α1,4-glycosyltransferases conserved in plants, insects and mammals // J. Biol. Chem. – 2000. – V. 275. – P. 25315– 25321.
TTT Khine A.A., Firtel M., Lingwood C.A. CD77-dependent retrograde transport of CD19 to the nuclear membrane: functional relationship between CD77 and CD19 during terminal center B-cell apoptosis // J. Cell. Physiol. – 1998. – V. 176. – P. 281–292.
UUU Khoo K.-H., Nieto A., Morris H.R., Deil A. Structural characterization of the N-glycans from Echinococcus granulosis hydatid cyst membrane and protoscoleces // Mol. Biol. Parasitol. – 1997. – V. 86. – P. 237–248.
VVV Kijimoto-Ochiai S., Naiki M., Makita A. Defects of glycosyltransferase activities in human fibroblasts of P k and p blood group phenotypes // Proc. Nat. Acad. Sci. USA. – 1977. – V. 74. –
5407–5410.
WWW Kortekangas A.E., Kaarsalo E., Melartin L. et al. The red cell antigen P k and its relationship with to the P system: the evidence of three more P k families // Vox Sang. – 1965. – V. 10. –
385–404.
XXX Kortekangas A.E., Noades J., Tippett P. et al. A second family with the red cell antigen P k // Vox Sang. – 1959. – V. 4. – P. 337–349.
YYY Koscielak J., Miller-Prodraza H., Krauze R., Cedergren B. Glycolipid composition of blood group P // FEBS Lett. – 1976. – V. 66. – P. 250–253.
ZZZ Kundu S.K., Evans A., Rizvi J. et al. A new P k phenotype in the P blood group system //
Immunogenet. – 1980. – V. 7. – P. 431–439.
7. Kundu S.K., Jovall P.-A., Chardashkani S. et al. Blood group glycosphingolipid expression in kidney of an individual with the rare blood group A1Le(a −b + )p phenotype: absence of blood group structures based on globoseries // Glycocon. J. – 1996. – V. 13. – P. 307–313.
520
14. Kundu S.K., Steane S.M., Bloom J.E.C., Marcus D.M. Abnormal glycolipid composition of erythrocytes with a weak P antigen // Vox Sang. – 1978. – V. 35. – P. 160–167.
15. Kundu S.K., Suzuki A., Sabo B. et al. Erythrocyte glycosphingolipids of four siblings with the rare blood group, p phenotype and their parents // J. Immunogenet. – 1981. – V. 8. –
357–365.
16. Landsteiner K., Levine P. Further observations on individual differences of human blood // Proc. Soc. Exp. Biol. NY. – 1927. – V. 24. – P. 941–942.
17. Levene C., Sela R., Rudolphson Y. et al. Hemolytic disease of the newborn due to anti-PP1P k (anti-Tj a) // Transfusion. – 1977. – V. 17. – P. 569–572.
18. Levine P. Comments on hemolytic disease of the newborn due to anti-PP1P k (anti-Tj a) // Transfusion. – 1977. – V. 17. – P. 573–578.
19. Levine P. Illegitimate blood group antigens P1, A and MN(T) in malignancy: a possible therapeutic approach with anti-Tj a, anti-A, and anti-T // Ann N.Y. Acad. Sci. – 1976. –
277. – P. 428–435.
с Levine P., Bobbitt O.B., Waller R.K., Kuhmichel A. Isoimmunization by a new factor in tumor cells // Proc. Soc. Exp. Biol. NY. – 1951. – V. 77. – P. 403–405.
с Levine P., Celano M.J., Falkowski F. The specificity of the antibody in paroxysmal cold hemoglobinuria (PCH) // Transfusion. – 1963. – V. 3. – P. 278–280.
с Levine P., Celano M.J., Staveley J.M. The antigenicity of P substance in Echinococcus cyst fluid coated on to tanned red cells // Vox Sang. – 1958. – V. 3. – P. 434–438.
с Levine P., Koch E.A. The rare human isoagglutinin anti-Tj a and habitual abortion // Science. – 1954. – V. 120. – P. 239–241.
с Lin C.K., Mak K.H., Cheng C.K., Yang C.P. The first case of the p phenotype in a Churla Nepalese // Immunohematology. – 1999. – V. 14. – P. 30–32.
с Lindgren S., Zimmerman S., Gibbs F., Garratty G. An unusual Donath – Landsteiner antibody detectable at 37 oC by the antiglobulin test // Transfusion. – 1985. – V. 25. –
142–144.
с Lindström K., dem Borne A.E.G.K., Breimer M.E. et al. Glycosphingolipid expression in spontaneously aborted fetuses and placenta from blood group p women: evidence for placenta being the primary target for anti-Tj a antibodies // J. Glycocon. – 1992. – V. 9. –
325–329.
с Lindström K., Jovall P.-A., Chardashkani S. et al. Blood group glycosphingolipid expression in kidney of an individual with the rare blood group A1Le(a −b + )p phenotype: absence of blood group structures based on globoseries // J. Glycocon. – 1996. – V. 13. – P. 307–313.
с Lingwood C.A., Law H., Richardson S. et al. Glycolipid binding of purified and recombinant Echerichia coli produced verotoxin in vitro // J. Biol. Chem. – 1987. – V. 262. – P. 8834–8839.
с Lopez M., Cartron J., Cartron J.P. et al. Cytotoxicity of anti-PP1P k antibodies and possible relationship with early abortions of p mothers // Clin. Immunol. Immunopath. – 1983. –
28. – P. 296–303.
К Mangeney M., Lingwood C.A., Taga S. et al. Apoptosis induced in Burkitt’s lymphoma cells via Gb3 / CD77, a glycolipid antigen // Cancer Res. – 1993. – V. 53. – P. 5314–5319.
К Marcus D.M. Isolation of a substance with blood-group P1 activity from human erythrocyte stroma // Transfusion. – 1971. – V. 11. – P. 16–18.
К Marcus D.M., Kundu S.K., Suzuki A. The P blood group system: recent progress in immunochemistry and genetics // Semin. Hematol. – 1981. – V. 18. – P. 63–71.
К Marcus D.M., Naiki M., Kundu S.K. Abnormalities in the glycosphingolipid content of human P k and p erythrocytes // Proc. Natl. Acad. Sci. USA. – 1976. – V. 73. – P. 3263–3267.
К Matson G.A., Swanson J., Noades J. et al. A ‘new’ antigen and antibody belonging to the P blood group system // Amer. J. Hum. Genet. – 1959. – V. 11. – P. 26–34.
521
с McDonald D.F., Thompson J.M., Lowe J.A. A murine monoclonal antibody agglutinates P1-ve cord blood red cells of pp phenotype [Abstract] // Transfus. Med. – 1996. – V. 6 (Suppl. 2). – P. 25.
с Mensinger E., Lerner W., Leger R. et al. Serological profile associated with fatal case of paroxysmal cold hemoglobinuria [Abstract] // Transfusion. – 1995. – V. 35. – P. 21S.
с Metaxas M.N., Metaxas-Buehler M., Tippett P. A ‘ new’ in the P blood group system [Abstract] // 14-th Congr. International Soc. Blood Transfus., 1975. – P. 95.
с Miwa S., Matuhasi T., Yasuda J. The p phenotype in two generations of a Japanese family // Vox Sang. – 1974. – V. 26. – P. 565–567.
с Miyamoto D., Ueno T., Takashima S. et al. Establishment of a monoclonal antibody directed against Gb3Cer / CD77: a useful immunochemical reagent for a differentiation marker in Burkitt’s lymphoma and germinal centre B cells // Glycocon J. – 1997. –
14. – P. 379–388.
с Moller B., Jorgensen J. Anti-LKE in a pregnant woman // Transfusion. – 1988. – V. 28. –
88.
У Mollison P.L., Cutbush M. The use if isotope-labelled red cells to demonstrate incompatibility in vivo // Lancet. – 1955. – V. i. – P. 1290–1295.
У Morgan W.T.J., Watkins W.M. Blood group P1 substance. I. Chemical properties // Proc. 9-th Congr. Int. Soc. Blood Transfus, 1962. – P. 225–229.
У Mori T., Kiyokawa N., Katagiri Y.U. et al. Globotrianosyl ceramide (CD77 / Gb3) in the glycolipid-enriched membrane domain participates in B-cell receptor-mediated apoptosis by regulating Lyn kinase activity in human B cells // Exp. Hemat. – 2000. – V. 28. –
1260–1268.
У Moulds J.M., Nowicki S., Moulds J.J., Nowicki B.J. Human blood groups: incidental receptors for viruses and bacteria // Transfusion. – 1996. – V. 36. – P. 362–364.
У Moullec J., Muller A., Garetta M. et al. L’antigene P k chez trois members d’une meme fratrie // Ann. Genet. – 1974. – V. 2. – P. 95–98.
У Mourant A.E., Kopec A.C., Domaniewska-Sobczak K. The Distribution of Human Blood Groups and Other Polymorphisms. – 2-nd. ed. – London: Oxford University Press, 1976.
У Moureau P. Les reactions post-transfusionelles // Rev. Belge. Sci. Med. – 1945. – V. 16. – P. 258– 300.
У Naiki M., Fong J., Ledeen R., Marcus D.M. Structure of the human erythrocyte blood group
1 glycosphingolipid // Biochemistry. – 1975. – V. 14. – P. 4831–4837.
в Naiki M., Kato M. Immunological identification of blood group P k antigen on normal human erythrocytes and isolation of anti-P k with different affinity // Vox Sang. – 1979. –
37. – P. 30–38.
в Naiki M., Marcus D.M. An immunochemical study of the human blood group P1, P and P k glycosphingolipid antigens // Biochemistry. – 1975. – V. 14. – P. 4837–4841.
в Naiki M., Markus D.M. Human erythrocyte P and P k blood group antigens: identification as glycosphingolipids // Biochem. Biophys. Res. Commun. – 1974. – V. 61. – P. 1105–1111.
в Nakagima H., Yokota T. Two Japanese families with P k members // Vox Sang. – 1977. –
32. – P. 56–58.
в Norman P., MacIntyre D., Poole J., Mallan M. Allo-anti-P1 in a P1-positive person // Vox Sang. – 1985. – V. 49. – P. 211–214.
в Nudelman E., Kannagi R., Hakomori S. et al. A glycolipid antigen associated with Burkitt lymphoma defined by a monoclonal antibody // Science. – 1983. – V. 220. – P. 509–511.
в Okajama T., Nakamura Y., Uchikawa M. et al. Expression cloning of human globoside synthase cDNAs: identification of β3Gal-T3 as UDP-N-acetylgalactosamine: globotriosylceramide β1,3-N-acetylgalactosaminil-transferase // J. Biol. Chem. – 2000. –
275. – P. 40498–40503.
522
С Petir A., Duong T.H., Bremond J.L. et al. Allo-anticorps irreguleres anti-P1 et Clonorchiase a clonorchis sinensis // Rev. Franc. Transfus. Immunohemat. – 1981. – V. 24. – P. 197–208.
С Prokop O., Schlesinger D. P1 blood group substance in Lumbricus terrestris (eathworm) and Ascaris suum // Nature. – 1966. – V. 209. – P. 1255.
С Puri A., Hug P., Jernigan K. et al. The neutral glycosphingolipid globotrialosylceramide promotes fusion mediated by a CD4-dependent CXCR4-utulizing HIV type 1 envelope glycoprotein // Proc. Natl. Acad. Sci. USA. – 1998. – V. 95. – P. 14435–14440.
С Race R.R., Sanger R. Blood Groups in Man. – 6-th ed. – Oxford: BSP, 1975. – 659 p.
С Radermecker M., Bruwier M., Francois C. et al. Anti-P1 activity in pigeon breeders’ serum // Clin. Exp. Immunol. – 1975. – V. 22. – P. 546–549.
С Ramos R.R., Curtis B.R., Eby C.S. et al. Fatal outcome in a patient with autoimmune hemolytic anemia associated with an IgM bithermic anti-I TP // Transfusion. – 1994. – V. 34. – P. 427–431.
С Reid M.E., Lomas-Francis C. The Blood Group Antigen: FactsBook. – 2-nd ed. – London: Academic Press, 2004. – 561 p.
С Ries C.A., Garratty G., Petz L.D., Fudenberg H.H. Paroxysmal cold hemoglobinuria: report of a case with an exceptionally high thermal range Donath – Landsteiner antibody // Blood. – 1971. – V. 38. – P. 491–499.
С Roelcke D., Riesen W., Geisen H.P., Ebert W. Serological identification of the new cold agglutinin specificity anti-Gd // Vox Sang. – 1977. – V. 33. – P. 304–306; 372.
С Rouger P., Anstee D.J., Salmon C., eds. First International Workshop on Monoclonal Antibodies Against Human Red Blood Cell and Related Antigens //Rev. Franc. Transfus. Immunohemat. – 1987. – V. 30. – P. 627–708.
С Rydberg L., Cedergren B., Breimer M.E. et al. Serological and immunochemical characterization of anti-PP1P k (anti-Tj a) antibodies in blood group p individuals: blood group A Type 4 recognition due to internal binding // Mol. Immunol. – 1992. – V. 29. – P. 1273–1286.
С Salmon D., Bouchmel S., Hafsia A. et al. p phenotypes observed in two generations of tunisian family with a high rate of inbreeding // Rev. Franc. Transfus. Immunohemat. – 1979. – V. 22. – P. 563–570.
С Sanger R. An association between the P and Jay systems of blood // Nature. – 1955. – V. 176. – P. 1163–1164.
С Sanger R., Tippett P. Live children and abortions of p mothers // Transfusion. – 1979. – V. 19. – P. 222–223.
С Schenkel-Brunner H. Human Blood Groups. Chemical and Biochemical Basis of Antigen Specificity. – 2-nd. ed. – Wien, NY: Springer-Verlag, 2000. – 637 p.
С Schwarting G.A., Marcus D.M., Metaxas M. Identification of sialosylparagloboside as the erythrocyte receptor for an ‘anti-p’ antibody // Vox Sang. – 1977. – V. 32. – P. 257–261.
С Shaw M.A., Leak M.R., Daniels G.L., Tippett P. The rare Lutheran blood group phenotype Lu(a −b −): a genetic study // Ann. Hum. Genet. – 1984. – V. 48. – P. 229–237.
С Shechter Y., Timor-Tritsch I.E., Lewit N. et al. Early treatment by plasmapheresis in a woman with multiple abortions and the rare blood group p // Vox sang. – 1987. – V. 53. – P. 135–138.
С Sheedan J., Pochedley M., Toy E. A retrospective study of cord blood samples from infants born to p phenotype mothers [Abstracts] // Joint. Cong. Int. Soc. Blood Transfus. And Am. Assoc. Blood Banks. – 1990. – P. 84.
С Shevinsky L.H., Knowles B.B., Damjanov I., Solter D. Monoclonal antibody to murine embryo defines a stage-specific embryonic antigen expressed on mouse embryos and human teratocarcinoma cells // Cell. – 1982. – V. 30. – P. 697–705.
С Shirey R.S., Ness P.M., Kickler T.S. et al. The association of anti-P and early abortion // Transfusion. – 1987. – V. 27. – P. 189–191.
523
и Söderström T., Enskog A., Samuelsson B.E., Matsuura S. Immunoglobulin subclass (IgG3) restriction of anti-P and anti-P k antibodies in patient of the rare p blood group // J. Immunol. – 1985. – V. 134. – P. 1–3.
и Sokol R.J., Booker D.J., Stamps R. Paroxysmal cold hemoglobinuria and the elusive Donath – Lansteiner antibody // Immunohematology. – 1998. – V. 14. –P. 109–112.
и Spitalnik P.F., Spitalnik S.L. The P blood group system: biochemical, serological and clinical aspects // Transfus. Med. Rev. – 1995. – V. 9. – P. 110–122.
и Stapleton A., Nudelman E., Clausen H. et al. Binding of uropathogenic Echerichia coli R45 to glycolipids extracted from vaginal epithelial cells is dependent on histo-blood group secretor status // J. Clin. Invest. – 1992. – V. 90. – P. 965–972.
и Steffenson R., Carlier K., Wiels J. et al. Cloning and expression of the histo-blood group P k UDP-galactose: Ga1β1-4Glcβ1-Cer α1,4-Galactosyltransferase-molecular basis of the p phenotype // J. Biol. Chem. – 2000. – V. 275. – P. 16723–16729.
и Tippett P. Antibodies in sera of p and P k people // Abstracts from 14-th. Cong. Int. Soc. Blood Transfus., 1975. – P. 94.
и Tippett P. Contributions of monoclonal antibodies to understanding one new and some old blood group systems // Red Cell Antigens and Antibodies / G. Garratty, ed. – Arlington: AABB, 1986. – P. 83–98.
и Tippett P., Andrews P.W., Knowles B.B. et al. Red cell antigens P (globoside) and Luke: identification by monoclonal antibodies defining the murine stage-specific embryonic antigens – 3 and –4 (SSEA-3 and SSEA-4) // Vox Sang. – 1986. – V. 51. – P. 53–56.
и Tippett P., Sanger R., Race R.R. et al. An agglutinin associated with the P and the ABO blood group system // Vox Sang. – 1965. – V. 10. – P. 269–280.
и van der Hart M., van der Giessen M., van der Veer M. et al. Immunochemical and serological properties of biphasic haemolysins // Vox Sang. – 1964. – V. 9. – P. 36–39.
и Voak D., Anstee D., Pardoe G. The α-galactose specificity of anti-P k // Vox Sang. – 1973. –
25. – P. 263–270.
и Voak D., Todd G.M., Pardoe G.J. A study of the serological behavior and nature of the anti-B / P / P k activity of Salmonidae roe protectins // Vox Sang. – 1974. – V. 26. – P. 176–188.
и von dem Borne A.E.G.K., Bos M.J.E., Joustra-Maas N. et al. A murine monoclonal IgM antibody specific for blood group P antigen (globoside) // Brit. J. Haemat. – 1986. –
63. – P. 35–46.
и Vos G.H. A comparative observation of the presence of anti-Tj a-like hemolysins in relation to obstetric history, distribution of various blood groups and occurrence of immune anti-A or anti-B hemolysins among aborters and nonaborters // Transfusion. – 1965. – V. 5. –
m 327–335.
и Vos G.H. A study related to the significance of hemolysins observed among aborters, nonaborters and infertility patients // Transfusion. – 1967. – V. 7. – P. 40–47.
и Vos G.H. The serology of anti-Tj a-like hemolysins observed in the serum of threatened aborters in Western Australia // Acta Haemat. – 1966. – V. 35. – P. 272–283.
и Vos G.H., Celano M.J. Falkowski F., Levine P. Relationship of a hemolysin resembling anti-Tj a to threatened abortion in Western Australia // Transfusion. – 1964. – V. 4. – P. 87–91.
и Watkins W.M., Morgan W.T.J. Blood-group P1 substance. II. Immunological properties // Pro. 9-th Cong. Int. Soc. Blood Transfus, 1962. – P. 230–234.
и Weiss D.B., Levene C., Aboulafia Y., Isacsohn M. Anti- PP1P k (anti-Tj a) and habitual abortion // Fertil. Steril. – 1975. – V. 26. – P. 901–904.
и Wiels J., Fellous M., Tursz T. Monoclonal antibody against a Burkitt lymphoma-associated antigen // Proc. Nat. Acad. Sci. USA. – 1981. – V. 78. – P. 6485–6488.
и Wiels J., Taga S., Tetaud C. et al. Histo-blood group p: biosynthesis of globoseries glycolipids in EBV-transformed B cell lines // Glycocon. J. – 1996. – V. 13. – P. 529–535.
524
В Wiener A.S., Unger L.J. Isoimmunization to factor P by blood transfusion // Amer. J. Clin. Path. – 1944. – V. 14. – P. 616–618.
В Worlledge S.M., Rousso C. Studies on the serology of paroxysmal cold haemoglobinuria (PCH) with special reference to its relationship with the P blood group system // Vox Sang. – 1965. – V. 10. – P. 293–298.
В Yamaguchi H., Okubo Y., Tanaka M. et al. Rare blood type p and P k in Japanese family // Proc. Jpn. Acad. – 1974. – V. 50. – P. 764–767.
В Yang Z., Bergström J., Karlsson K.-A. Glycoproteins with branes, indicating that glycolipids are the sole carriers of blood group P activities // J. Biol. Chem. – 1994. – V. 269. – P. 14620–14624.
В Yoshida H., Ito K., Emi N. et al. A new therapeutic antibody removal method using antigen-positive red cells. II. Application to P-incompatible pregnant woman // Vox Sang. – 1984. – V. 47. – P. 216–223.
В Yoshida H., Ito K., Kusakari T. et al. Removal of maternal antibodies from a woman with fetal loss due to P blood group incompatibility // Transfusion. – 1994. – V. 34. – P. 702–705.
525
Глава 8.
Система Lutheran
с систему Lutheran (Лютеран) включено 19 антигенов (табл. 8.1). Некоторые из них образуют антитетичные пары: Lu a и Lu b, Lu6 и Lu9, Lu8 и Lu14, Au a и Au b. Известен нулевой фенотип – Lunull, или Lu(a −b −), при котором все антиге-ны LU отсутствуют.
| Таблица 8.1 | ||||||
Антигены системы Lutheran
Обозначение антигенов
Год открытия
Частота, %
авторское
традиционное
ISBT
Антигены системы Lutheran располагаются на 2 гликопротеинах с мол. мас-сой 78 кДа (CD239) и 85 кДа, выполняющих роль рецепторов межклеточной ад-гезии (рис. 8.1).
Локус LU картирован на хромосоме 19; показана его взаимосвязь с генами других групповых систем, расположенных на этой хромосоме: LE, H, LW, а так-же с локусом Se, контролирующим выделительство.
526
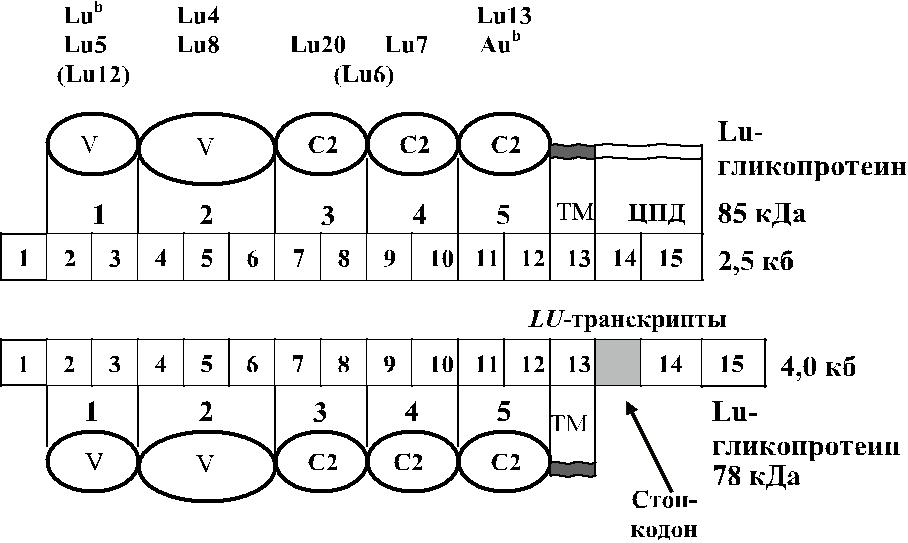
Рис. 8.1. Ген LU и домены гликопротеина Lutheran. Квадратами обо-значены транскрипты эзонов, овалами – домены гликопротеинов:
а – вариабельные домены, С2 – константные, ТМ – трансмембран-ные, ЦПД – цитоплазматический домен Lu-гликопротеина 85 кДа.
Гликопротеин LU
Изомеры гликопротеина удалось выделить из мембраны эритроцитов по-средством иммунопреципитации моноклональными антителами анти-Lu b, а также анти-Lu3, -Lu4, -Lu6, -Lu8, -Lu12, -Au a, -Au b (Daniels и соавт. [33, 38], Parsons и соавт.[106]). Указанные компоненты отсутствовали в цитоскелете эри-троцитов Lunull.
Отмечено некоторое снижение мол. массы гликопротеинов после обработ-ки сиалидазой (Daniels и соавт. [38]). Гликопротеины разрушались сульфидре-дуцентами, что указывало на наличие в их структуре дисульфидных связей. Обработка мембран эритроцитов эндогликозилазой-F приводила к появлению 2 компонентов с мол. массой 73 и 66 кДа, что было связано с утратой части N-связанных олигосахаридных цепей (Parsons и соавт. [106]).
Parsons и соавт. [105], изучив аминокислотную последовательность полипеп-тида LU, создали олигонуклеотидные праймеры и с помощью ПЦР выделили клон ДНК (2417 пн) из библиотеки ДНК плаценты человека. Кодируемый про-теин с мол. массой 85 кДа состоял из 597 аминокислот; 518 из них составляли экстрацеллюлярные домены, 19 – трансмембранный домен, 59 – цитоплазмати-ческий. Цитоплазматический участок протеина непосредственно связан с цито-скелетом (Gane и соавт. [55]).
Изомер с мол. массой 78 кДа лишен части цитоплазматического домена (Parsons и соавт. [105]). Позднее было показано, что антиген эпителиального рака (В-САМ) также представляет собой изоформу гликопептида с мол. массой 78 кДа (Campbell и соавт. [18], Rahuel и соавт. [115]).
Гликопротеины LU отсутствуют на лейкоцитах, но в то же время имеются
527
на многих других клетках в виде нескольких повторяющихся экстрацеллюляр-ных доменов, имеющих высокую гомологию с иммуноглобулинами. Подобно последним они имеют вариабельные (V) и константные (С1 и С2) домены. Каждый из доменов состоит приблизительно из 100 аминокислот и структури-рован в виде двух β-цепей, связанных между собой дисульфидными мостиками. Считается, что эти гликопротеины выполняют функцию молекул межклеточной адгезии и участвуют в передаче межклеточных сигналов (Barclay и соавт.[7], Williams, Barclay [147]). Экстрацеллюлярный домен гликопротеинов LU состо-ит из двух вариабельных и трех константных доменов (см. рис. 8.1). Имеется 5 потенциальных участков N-гликозилирования: один – в домене 3, остальные – в домене 4. Рядом с веществом LU на мембране эритроцитов присутствуют дру-гие гликопротеины, также являющиеся рецепторами межклеточной адгезии: LW, CD147 (групповая система Ok), CD47 и CD58 (LFA-3).
Parsons и соавт. [104] сконструировали кДНК с делециями, при которых глико-протеин LU синтезировался без одного, двух, трех или четырех доменов. Образцы таких дефицитных гликопротеинов авторы исследовали в проточной цитофлюо-рометрии с антителами анти-LU разной специфичности, что позволило устано-вить локализацию антигенных эпитопов на том или ином домене (см. рис. 8.1).
| Таблица 8.2 | |||||
| Организация гена LU | |||||
| Экзон | Кодируемый домен | Число | Размер | ||
| кодонов | интрона, кб | ||||
| 1 | 5'UT + лидер-пептид | 105 | 2,0 | ||
| 2 | 1 | IgSF(V) | 122 | 0,7 | |
| 3 | 1 | IgSF(V) | 229 | 0,09 | |
| 4 | 2 | IgSF(V) | 71 | 0,5 | |
| 5 | 2 | IgSF(V) | 95 | 0,09 | |
| 6 | 2 | IgSF(V) | 185 | 0,53 | |
| 7 | 3 | IgSF(C2) | 137 | 0,31 | |
| 8 | 3 | IgSF(C2) | 157 | 3,5 | |
| 9 | 4 | IgSF(C2) | 116 | 0,1 | |
| 10 | 4 | IgSF(C2) | 142 | 0,17 | |
| 11 | 5 | IgSF(C2) | 137 | 0,15 | |
| 12 | 5 | IgSF(C2) | 145 | 0,09 | |
| 13 | Трансмембранный и 19 позиций цитоплазматического | 145 | 0,97 | ||
| 14 | Цитоплазматический | 118 | 0,09 | ||
| 15 | Один аминокислотный остаток в цитоплазматическом | 498 | |||
| (для изоформы 85 кДа) | |||||
Ген LU состоит из 15 экзонов размером 12,5 кб (см. рис. 8.1, табл. 8.2). Экзон 1 кодирует сигнальный пептид, экзоны 2–12 кодируют 5 доменов; вариабельный домен 2 кодируется экзонами 4, 5 и 6. Экзон 13 кодирует трансмембранный домен
528
обеих изоформ гликопротеина LU; экзоны 14 и 15 – терминальный участок, со-стоящий из 40 аминокислот (см. табл. 8.2). Терминальный участок присутствует только в изоформе с мол. массой 85 кДа (El Nemer и соавт. [51], Parsons и соавт. [104]). Выделены два транскрипта гена LU. Один из них, величиной 2,5 кб, коди-ровал гликопротеин с мол. массой 85 кДа, другой гликопротеин, величиной 4,0 кб, кодировал гликопротеин 78 кДа (Rahuel и соавт. [115]). Транскрипты отличались альтернативным сплайсингом интрона 13. В транскрипте 2,5 кб интрон 13 отсут-ствовал, экзоны 14 и 15 кодировали С-терминальный участок из 40 аминокислот.
Дата: 2019-02-24, просмотров: 403.