ENEN / Vw / Hut
Thr 28 Met / Lys
3
T 140 A
Гликофорин В
Нулевые фенотипы
Делеция в GYPA (экзоны 2–7), GYPB (экзоны 1–5) и GYPE (экзон 1)
Делеция в GYPA (экзоны 2–7) и GYPB (экзон 1)
Делеция в GYPВ (экзоны 2–4) и GYPЕ (экзон 1)
Рекомбинации иногда затрагивают псевдоэкзоны и фрагменты интро-нов GYPA, GYPB и GYPE, в результате чего вновь появившаяся генетиче-ская структура может создавать антигенные варианты (Huang и соавт. [97]). Обнаружены варианты гибридных генов : GYP(А-В-А), GYP(В-А-В), GYP(В-А-В-А), GYP(A-E-A) и др. Их трансляция приводит к заменам аминокислот в различных позициях. Вновь образовавшиеся пептидные цепи одного и того же типа, например GYP(А-В-А), могут отличаться друг от друга. Отдельные фрагменты цепей гликофоринов с измененной последовательностью ами-нокислот оказываются иммуногенными. Фенотипически это проявляется в виде качественно новых, как правило , редких антигенов системы MNS, ко-торые распознаются специфическими антителами (Huang и соавт. [97, 99, 101–107]). Новые последовательности аминокислот влияют на гликозилирова-ние гликофоринов, что приводит к появлению новых редких специфичностей
у сказывается на экспрессии антигенов M, N, S и s. Один из вариантов гибри-дизации генов приведен на рис. 6.4.
457
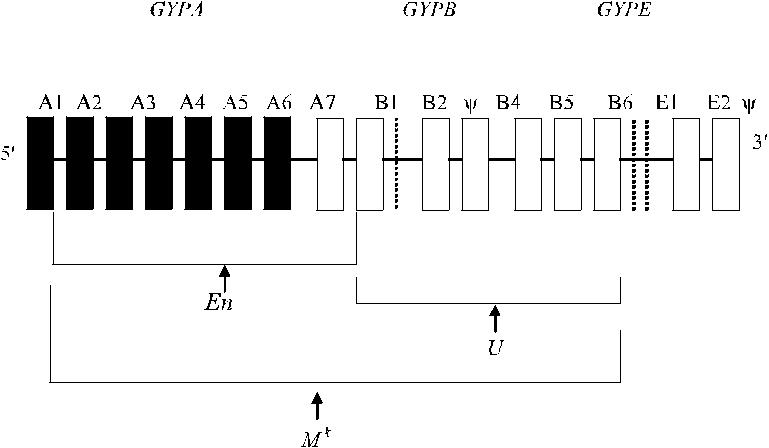
Рис. 6.3. Генетическая основа нулевых фенотипов MNS. Стрелки указывают на участки генов гликофоринов, под-вергшиеся делеции (по Daniels [56]). Ψ – псевдогены глико-форинов B и Е.
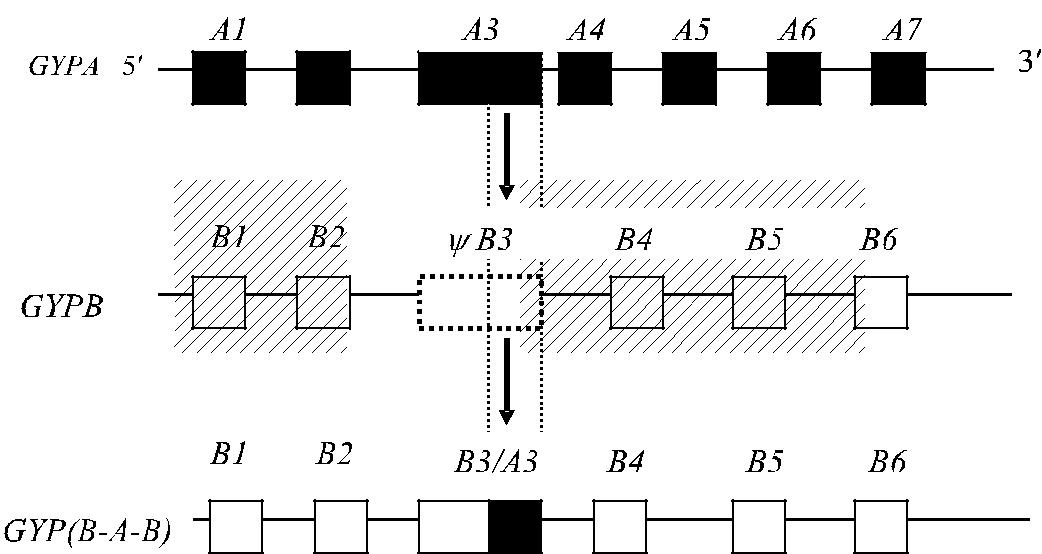
Рис. 6.4. Рекомбинация локусов GYPA и GYPB с образованием гибридного гена GYP(B-A-B). Черными прямоугольниками обозначены экзоны гена гликофорина А, заштрихованны-ми – гена гликофорина В. Белый прямоугольник, обрамленный пунктиром, – псевдоэк-зон ΨВ3, частично вовлеченный в гибридный продукт В3 / А3.
458
| Табл. 6.5 | |||||||||||||
| Подсистема Мильтенбергер (варианты гликофоринов и ассоциированных с ними редких антигенов MNS) | |||||||||||||
|
| |||||||||||||
| Присутствие в гликофорине антигенов | |||||||||||||
| Типы | Типы | ||||||||||||
| Mt a | Vw | Hut | Mur | MUT | Hil | TSEN | MINY | Hop | Nob | DANE | |||
| Мильтенбергер | гликофорина | ||||||||||||
| MNS | MNS | MNS | MNS | MNS | MNS | MNS | MNS | MNS | MNS | MNS | |||
| 8 | 9 | 19 | 10 | 35 | 20 | 33 | 34 | 26 | 27 | 32 | |||
| Mi.I | GP.Vw | + | + | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Mi.II | GP.Hut | + | 0 | + | 0 | + | 0 | 0 | 0 | 0 | 0 | 0 | |
| Mi.III | GP.Mur | + | 0 | 0 | + | + | + | 0 | 0 | 0 | 0 | 0 | |
| Mi.IV | GP.Hop | + | 0 | 0 | + | + | 0 | + | + | + | 0 | 0 | |
| Mi.V | GP.Hil | 0 | 0 | 0 | 0 | 0 | + | 0 | 0 | 0 | 0 | 0 | |
| Mi.VI | GP.Bun | + | 0 | 0 | + | + | + | 0 | + | + | 0 | 0 | |
| Mi.VII | GP.Nob | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | + | 0 | |
| Mi.VIII | GP.Joh | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | + | + | 0 | |
| Mi.IX | GP.Dane | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | + | |
| Mi.X | GP.HF | + | 0 | 0 | + | + | + | 0 | + | 0 | 0 | 0 | |
| Mi.XI | GP.JL | 0 | 0 | 0 | 0 | 0 | 0 | + | + | 0 | 0 | 0 | |
Примечание. + антиген присутствует, 0 – отсутствует.
| 459 |
Гликофориндефицитные фенотипы
Низкое содержание гликофоринов А и В на эритроцитах обусловлено ча-стичной или полной делецией генов GYPA и GYPB.
GPА-дефицитные фенотипы
En(a −)
В 1969 г. Darnborough и соавт. [63] обнаружили в сыворотке крови бере-менной женщины, англичанки по происхождению, антитела к антигену очень высокой частоты. Исследователи обратили внимание на необычное реагиро-вание эритроцитов женщины и некоторых членов ее семьи. В серологических тестах эритроциты проявляли повышенную агглютинабельность и напомина-ли клетки, предварительно обработанные протеолитическими ферментами. Авторы предположили, что эти эритроциты, подобно энзимированным, лишены определенного поверхностно расположенного оболочечного вещества, назван-ного ими клеточным конвертом (cell envelope). Новый антиген и выявляющие его антитела обозначены En a и анти-En a соответственно.
Лица редкого фенотипа En(a −) c наличием антител анти-En a вскоре были найдены другими исследователями (Furuhjelm и соавт. [75], Gahmberg и со-
авт. [76], Inglis и соавт. [111], Issitt и соавт. [116], Moulds и соавт. [171], Tanner
и соавт. [244]), в том числе среди японцев (Okubo и соавт. [179]), пакистан-цев (Rapmi и соавт. [192]), финнов (Walker и соавт. [255]) и во французско-канадской семье (Taliano и соавт. [243]).
В основе возникновения редкого фенотипа En(a −) могут лежать разные при-чины. Одна из них – гомозиготность по редкому гену En, отличающемуся соче-танной делецией экзонов 2–7 гена GYPA и экзона 1 гена GYPB. В результате та-кой делеции на эритроцитах отсутствует гликофорин A (cell envelope).
Позднее установлено (Daniels [56]), что лица En(a −), выявленные
Darnborough и соавт. [63], имели генотип GYP(A-B)/M k.
Для дифференциации генных нарушений, приводящих к возникновению фе-нотипа En(a −), ген En предложено обозначать как En(UK) и En(Fin) – ген En английского и ген En финского типов соответственно (Schenkel-Brunner [223], Walker и соавт. [256]).
На эритроцитах En(a −) отсутствуют антигены, ассоциированные с антиге-ном М, за исключением антигенов S и s, которые выражены нормально.
Эритроциты En(a −) не содержат антигенов Wr a и Wr b системы Diego, т. е. они одновременно En(a −) и Wr(a −b −) (Issitt и соавт. [116]).
Эритроциты En(a −) имеют, как указано выше, характерную особенность. Они, подобно энзимированным эритроцитам, непосредственно агглютинируют-ся в солевой среде сыворотками анти-D, анти-C, анти-c, анти-E, анти-e и други-ми, содержащими неполные IgG-антитела. Эритроциты обычных людей (En + ) такую способность не проявляют, их мембрана экранирована гликофоринами
460
и становится доступной для агглютинирующего действия неполных антител только после обработки протеолитическими ферментами.
Ген En редкий, известно лишь несколько несвязанных родством индивидов,
имеющих генотип En / En [75, 76, 111, 116, 171, 179, 192, 244, 255].
M k
Символ M k предложен в 1964 г. Heiken и соавт. [92] для обозначения молчащего аллеля в локусе MN. В присутствии гена M k синтеза антигенов М, N, S и s не про-исходит. Найдены лица гетеро- и гомозиготные по гену M k (Hodson и соавт. [94], Metaxas и соавт. [159, 162, 163], Okubo и соавт. [178], Tokunaga и соавт. [248]).
На эритроцитах гомозигот M k / M k гликофорины A и B отсутствуют. В сероло-гических реакциях эритроциты M k ведут себя так же, как и эритроциты En(a −) (Metaxas и соавт. [159], Norling и соавт. [176]).
Присутствие редких генов M k и En может быть причиной ошибок при экспер-тизе спорного родства. Как правило, супружеская пара M × N, не может иметь де-тей M и N, а супружеская пара S × s не может иметь детей S и s, поскольку гено-тип лиц, имеющих фенотип М, N, S и s, расценивается как M / M, N / N, S / S и s / s. Присутствие молчащего гена у одного из родителей может сопровождаться фено-меном, именуемым судебными медиками как противоположная гомозиготность. Родители M / − × N / N могут иметь ребенка N, а родители S/ − × s / s – ребенка s, что может послужить основанием для исключения родства родителя М и S.
Все лица M k и En(a −) были соматически здоровы, каких-либо аномалий эри-троцитов у них не выявлено (Walker и соавт. [255]).
Причиной возникновения гена M k является сочетанная делеция экзонов 2–7 гена GYPA, экзонов 1–6 гена GYPB и экзона 1 гена GYPE (Huang и соавт. [97], Reid [199]).
Обозначение анти-En a является собирательным и распространяется на ан-титела, направленные к различным участкам гликофорина А. В зависимости от устойчивости антигенного субстрата к действию трипсина и фицина антитела анти-En a подразделяют на анти-En aTS (трипсинчувствительные), анти-En aFS (фицинчувствительные) и анти-En aFR (фицинрезистентные).
Аллоиммунные анти-En a-антитела описаны как причина посттрансфузион-ной гемолитической реакции (Postoway и соавт. [189]). Аутоантитела анти-En a обнаруживали у больных аутоиммунной гемолитической анемией.
GPВ-дефицитные фенотипы
U −
Антиген U описали в 1953 г. Wiener и соавт. [262], обнаружившие соответ-ствующие анти-U-антитела. Обозначение U (universal) было дано этому антиге-ну из-за его универсальной встречаемости среди представителей разных рас. У 1 % негроидов этот антиген отсутствовал (Hoekstra и соавт. [95], Lowe и соавт. [152], Wiener и соавт. [262]).
461
В 1954 г. Wiener и соавт. [262] нашли 2-й образец антител анти-U. Серологические реакции показывали, что антиген, открываемый указанными антителами, ассоциирован с системой MNS. Все U-отрицательные лица не име-ли также антигенов S и s. Стало очевидным, что фактор U – еще один серологи-ческий продукт локуса Ss (Wiener и соавт. [262]).
Антитела анти-U имеют, как правило, иммунное происхождение и считают-ся клинически значимыми, поскольку были причиной как трансфузионных ре-акций, так и ГБН, в ряде случаев с летальным исходом (Giblett и соавт. [81], Pillay [184], Rothman и соавт. [211, 212], Smith и соавт. [231], Taliano [242], Wiener и соавт. [262]).
В отличие от антител к антигенам M, N, S и s анти-U-антитела сохраняют свою активность и специфичность в тестах с энзимированными эритроцитами. Эффекта дозы у антигена U не отмечено (Issitt и соавт. [117]).
Лица, не имеющие антигена U (все фенотипы S −s −), встречаются почти ис-ключительно в негроидных популяциях (Allen и соавт. [12], Francis и соавт. [71], Hoekstra и соавт. [95], Reid и соавт. [208], Sanger и соавт. [222], Wiener и соавт. [261]). Фенотип S −s −U − среди европеоидов регистрируют крайне редко (Moores
а соавт. [168], Sondag-Thull и соавт. [232]). Примерно 42 % негроидов S −s − со-
держат слабый антиген U (U var), обнаруживаемый адсорбцией – элюцией (Allen и
соавт. [12], Francis и соавт. [71], Reid и соавт. [208], Storry и соавт. [239]).
Проблема поиска совместимой крови для реципиентов с антителами анти-U актуальна для стран, где диаспора негроидов значительна по числен-ности. Так, в США наиболее частыми запросами в регистр редких доноров Американского Красного Креста являются заявки на U-отрицательную кровь. Например, с сентября 1995 г. по август 1996 г. запросов на U-отрицательную кровь было почти в 4 раза больше, чем заявок на эритроциты редких феноти-пов Vel − и Yt(a −) – 49 и 13 соответственно. При лечении ГБН, обусловленной антителами анти-U, из-за редкой встречаемости U-отрицательных доноров в США прибегают к обменному переливанию U-положительной крови. Для по-лучения удовлетворительного клинического эффекта достаточно 2–4 доз до-норской крови (Reid и соавт. [208]).
При сравнительном изучении образцов анти-U-антител выявлена их гетеро-генность. Для обозначения вариантов антигена U и анти-U-антител предложены обозначения U A, U B, U X U Z (Issitt, Anstee [113], Mentor и соавт. [158], Read и
соавт. [193], Storry и соавт. [238]). Результаты дальнейших исследований показа-ли, что перечисленные антигены и соответственно антитела отличаются друг от друга по количественным, но не качественными параметрам (Issitt [112]).
Помимо аллоиммунных, описаны также аутоантитела анти-U (Bell и со-
авт. [24], Chiofolo и соавт. [42], Kessey и соавт. [129], Marsh и соавт. [155], Nugent и соавт. [177], Roush и соавт. [214], Sacher и соавт. [216]).
Эритроциты S −s −U − лишены гликофорина В, клетки S −s −U var + содержат его в следовых количествах (Blanchard [26]).
462
Фенотип S −s −U − является следствием делеции экзонов 2–6 GYPB и 1 GYPE (Huang и соавт. [101], Reid, Lomas-Francis [202]). Возникновение фенотипа S −s −U var + связывают с эффектом GYPB-подобного гена, экзон 2 которого со-держит кодон для антигена Не (MNS6) (Huang и соавт. [99]). Этот фенотип обозначают как GP.He(P2) (см. Гибридные гликофорины).
Варианты антигенов М и N
Специфичность и экспрессия антигенов М и N обусловлена последователь-ностью аминокислот в пептидных цепях гликофорина А, а также характером гликозилирования 5 терминальных аминокислотных остатков (Dahr и соавт. [52, 54, 55]).
M g (Gilfeather)
Впервые редкий антиген M g и антитела к нему описали Allen и соавт. в 1958 г. [11]. Эритроциты больного по фамилии Gilfeather агглютинировались сывороткой крови одного из доноров. Позднее лица, имеющие антиген M g, были найдены среди представителей итальянской диаспоры в Швейцарии (об-следовано 6530 доноров) и Бельгии (6300 обследованных) (Metaxas и соавт. [160, 161]). Интересно, что 3 из 4 итальянцев M g + были выходцами с остро-ва Сицилия (Brocteur [34]). Двоих человек M g + выявили среди 9000 жителей Индии (Joshi и соавт. [123], двоих среди американцев (Winter и соавт. [264]). Несмотря на исключительную редкость гена M g, найден 1 человек, гомозигот-ный по этому гену – M g / M g (Issitt и Anstee [113]).
Специфичность антигена M g обусловлена валином в позиции 6 и метиони-ном в позиции 8 гликофорина А. Экспрессию антигена обеспечивает гибридный гликофорин GPA N(1-4)-GPB(5)-GPA(6-13). Характер мутации в контролирую-щем гене GYP(A N -B-A) окончательно не расшифрован (Furthmayr и соавт. [74], Green и соавт. [86], Reid, Lomas-Francis [202]).
Антитела анти-M и анти-N как ксеногенные (кроличьи), так и аллогенные (полученные от человека) с антигеном M g не реагируют.
Эритроциты M g + несут еще 1 редко встречающийся антиген – DANE (MNS32). В противоположность исключительной редкости антигена M g есте-ственные антитела к нему встречаются очень часто: примерно в 1 случае на 70 образцов сывороток крови здоровых лиц. Большинство антител представля-ет собой IgM и непосредственно агглютинирует эритроциты в солевой среде. Анти-M g-антитела, относящиеся к IgG, проявляли активность при 37 оС в не-прямом антиглобулиновом тесте. Трансфузионных реакций и ГБН, обусловлен-ных анти-M g-антителами, не описано. Антитела анти-M g были получены также иммунизацией кроликов (Ikin [108]).
Как и в случаях с En и M k , присутствие редкого гена M g может привести к ошибкам при экспертизе спорного отцовства. У родителей M g / M × N / N возмож-но рождение детей с генотипом M g / N. Эритроциты таких лиц имеют группу
463
M −N +. Поскольку генотипы лиц с группами M + N − и M −N + судебные медики обычно интерпретируют как M / M и N / N, отцовство может быть ошибочно ис-ключено (Прокоп, Гёллер [7]).
M c (Common)
Несмотря на то что антиген M c внесен в номенклатуру ISBT под индексом MNS8, специфические антитела, распознающие его, не выделены. Этот антиген идентифицируют как промежуточный между M и N, поскольку он реагирует с определенными образцами антител анти-М и анти-N.
M c как редкий аллель M и N впервые обнаружен в 1953 г. у членов англий-ской семьи. Эритроциты M c + агглютинировались большинством сывороток анти-М, в то время как с сыворотками анти-N реагировали редко (Figur и со-авт. [70]). В результате посемейных исследований идентифицированы гаплоти-пы M c s и M c S (Daniels [56]).
Характер реагирования эритроцитов M c + в серологических тестах удалось объяс-нить в 1981 г. McDougall и соавт. [156] и Furrthmayr и соавт. [74]. Исследователями была расшифрована последовательность аминокислот в терминальной части глико-форина А лиц M c +. Оказалось, что в положении 1 присутствует серин (формирую-щий М-антиген), в то время как позицию 5 занимает глютаминовая кислота (фор-мирующая N-антиген). Антиген М с присущ особому гликофорину – GPA M(1-4)-GPB(5)-GPA(6-13), его синтез контролирует гибридный ген GYP(A-B-A).
Лица с фенотипом M c выявлены только среди европеоидов. Поскольку спец-ифические анти-M c-антитела отсутствуют, соответственно нет данных о частоте этого антигена у европеоидов и представителей других рас.
He (Henshaw)
Антиген получил свое обозначение по имени мужчины, у которого он был впервые обнаружен, – Henshaw. Антитела анти-He были найдены как дополни-тельный компонент в иммунной кроличьей сыворотке анти-М. Позднее были получены моноспецифические сыворотки анти-He иммунизацией кроликов эритроцитами Henshaw (Ikin и соавт. [109], MacDonald и соавт. [153]).
Marsh и соавт. [155] описали анти-He-антитела аллогенного происхождения. Получено также несколько образцов моноклональных анти-He-антител (Reid и соавт. [201], Rouger и соавт. [213]).
Антиген He выявляли с частотой 2,0–3,08 % почти исключительно в негро-идных популяциях (Nijenhuis и соавт. [175]). Ген He в разных семьях был ас-социирован с разными гаплотипами: MS, Ms, Ns, однако в пределах одной семьи сцепление гена He наблюдали с одним и тем же гаплотипом. Антиген Не анти-тетичен по отношению к антигену ′N′ (MNS30), имеющемуся почти у всех лиц S + и s + (Greenwalt [87]).
Антиген Не присутствует у 23–25 % лиц (исключительно негроидной расы), имеющих редкий фенотип S −s −U var + (Francis и соавт. [71]). Эритроциты таких
464
лиц содержат пониженное количество гликофорина В. Данных о клинической значимости антител анти-Не нет.
Вещество Не формируется под действием варианта гена GYPB, в котором ко-роткий сегмент, включающий часть экзона 2 заменен гомологичным участком гена GYPA (Huang и соавт. [99]) (см. Гибридные гликофорины).
М е
В 1961 г. Wiener и Rosenfield [260], изучая сыворотку, полученную от им-мунизированного кролика, обнаружили, что, помимо M-положительных эри-троцитов, она агглютинировала некоторые образцы N +. Последующие ис-следования показали, что эритроциты М −, реагирующие с антителами сы-воротки содержали антиген He. Антитела анти-М и анти-Не не удавалось разделить перекрестной адсорбцией. Позднее Levene и соавт. [143] наш-ли анти-М- и анти-М е-антитела, которые могли быть разделены адсорбцией эритроцитами М + Не − и М −Не +.
Биохимические исследования позволили объяснить результаты сероло-гических тестов. Антиген Не является продуктом аллелей S и s. Антиген
в на гликофорине А детерминирован глицином в позиции 5. Вариант Ss-сиалогликопротеина, несущий антиген Не, детерминирован триптофаном в позиции 1. Моноклональные антитела анти-М, реагирующие с эритроци-тами М −Не +, распознают глицин в положении 1. Некоторые образцы этих антител способны выявить глициновый остаток на гликофорине В в пози-ции 5 (Dahr и соавт. [52, 54, 55]). Фенотипически это выражается наличи-ем антигена Не.
ENEV
Антитела, открывающие часто встречающийся антиген ENEV, описа-ны Lomas-Francis и соавт. [150] в 2005 г. Они найдены у больного с ред-ким фенотипом MNS: −45. Молекулярно -генетическими исследованиями установлено, что обладатель антител был гомозиготным по точковой мутации, которая привела к замене валина на глицин в положении 81 внутри цепи гликофорина А. Данных о клиническом значении антител анти-ENEV нет.
MNTD
Антитела к редкому антигену MNTD выявлены в 2006 г. Uchikawa и соавт.
с у здоровых лиц – японских доноров. Среди указанного контингента эти антитела встречались с частотой 0,02 % и, по-видимому, имели естественное происхождение. Молекулярно-генетическими исследованиями было показа-но, что лица MNTD + являются гетерозиготами по точковой мутации внутри гена GYPA. Последняя приводит к замене треонина на аргинин в положении 36 внутри цепи гликофорина А.
465
Подсистема Мильтенбергер
Подсистема Мильтенбергер представляет собой серию редких антиге-нов и фенотипов, ассоциированных с антигенами системы MNS и друг с дру-гом. Антитела, реагирующие с антигенами подсистемы, иногда дают пере-крестные реакции (Chandanyingyong и соавт. [36–38], Giles и соавт. [84]). Систематизация антигенов Мильтенбергер начата в 1966 г. с выделения первых четырех классов антигенов, вошедших в указанную подсистему (Cleghorn [44]).
с последующие десятилетия идентифицировано еще 7 классов подсистемы
(Akane и соавт. [10], Anstee и соавт. [16], Blackall и соавт. [25], Blanchard и соавт. [27], Broadberry и соавт. [32, 33], Chandanayingyong и соавт. [36– 38], Crossland и соавт. [51], Dahr [53], Giles и соавт. [84], Johe и соавт. [121], Langley и соавт. [141], Skov и соавт. [229], Vengelen-Tyler и соавт. [254], Webb и соавт. [258]).
Редкие антигены, входящие в подсистему, присутствовали преимущественно у монголоидов (Akane и соавт. [10], Baldwin и соавт. [19], Judd и соавт. [125], Konugres и соавт. [131], Kornstad и соавт. [132], Lewis и соавт. [146], Lin и со-авт. [147], Lin-Chu и соавт. [148], Metaxas-Buhler и соавт. [163], Nguen Thi Huingh и соавт. [174]).
Выделение классов в подсистеме Мильтенбергер основывалось на различи-ях, улавливаемых серологическими методами, другие методы исследования в те годы не применяли. В настоящее время ряд специалистов считают способ обо-значения антигенов Мильтенбергер устаревшим и не находят целесообразным выделение в ней новых классов (Dahr [53], Reid и соавт. [209], Tippett и соавт. [247]). Предложен другой способ обозначения гликофоринов: после аббревиату-ры GP пишут сокращенное имя первого пробанда (табл. 6.6). Например, старое обозначение Mi.III пишут как GP.Mur, обозначение GP(B-A-B)Mur соответству-ет варианту гликофорина, обозначение GYP(B-A-B)Mur – варианту гена, контро-лирующего фенотипические проявления (Reid и соавт. [209]).
Дата: 2019-02-24, просмотров: 365.