Серологически выявляемая М-антигенная активность обусловлена присут-ствием серина в позиции 1 и глицина в позиции 5 на экстрацеллюлярном до-мене гликофорина А (Dahr и соавт. [55]). На N-положительных клетках в этих позициях находятся лейцин и глютаминовая кислота соответственно (рис. 6.1).
и экспрессии антигенов важную роль играют О-гликаны и сиаловые кислоты. Позиции 2–4 пептидной цепи гликофорина A гликозилированы (Dahr и соавт. [55], Issitt, Anstee [113], Schenkel-Brunner [223]).
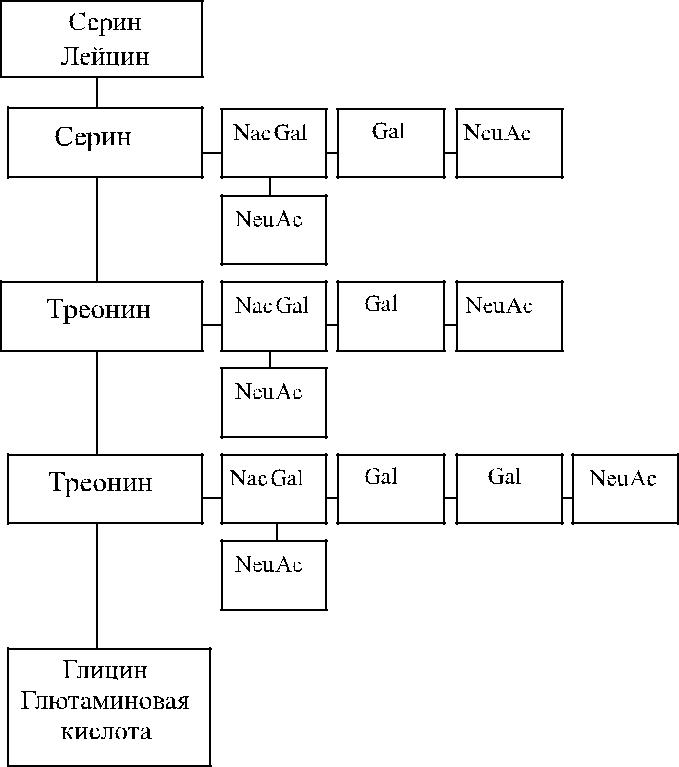
Рис. 6.1. Строение терминальных участков гликофорина А.
Нередко антитела анти-M и анти-N обнаруживают у лиц , не имевших бе-ременностей и гемотрансфузий (Garratty [78], Kao и соавт. [128]). Такие ан-титела естественные, часто представляют собой IgM и реагируют при ком-натной температуре как агглютинины. Описаны IgG-антитела той же спец-ифичности (Garratty [78], Issitt, Anstee [113]). Многим антителам, особенно анти- М , свойствен эффект дозы. Эритроциты гомозигот M / M и N / N реаги-руют с антителами анти-М и анти -N сильнее, чем эритроциты гетерозигот. Большинство образцов указанных антител не обладает способностью акти-вировать комплемент. Считается, что антитела анти-M и анти-N, относящи-еся к холодовым, не имеют клинического значения, поскольку не способ-ны вызвать гемолиз эритроцитов in vivo (Garratty [78], Issitt, Anstee [113]). Случаи ГБН (Duguid и соавт. [65], Stone и соавт. [234], Teleschi и соавт.
452
[246]) и трансфузионные реакции (Alperin и соавт. [13], Ballas и соавт. [20], Furlong и соавт. [73], Sancho и соавт. [217]), обусловленные указан-ными антителами, редки.
отечественной литературе имеется 2 сообщения об аллоиммуниза-ции антигеном М в результате беременности. Выраженных клинических про-явлений ГБН при этом не наблюдали (А.А. Михайлова, Т.А. Ичаловская [6], А.Е. Скудицкий [8]).
Антитела анти-М обнаруживали у детей и взрослых, перенесших бактери-альные инфекции (Kao и соавт. [128]). Антитела выявляли у беременных, дети которых, как позже выяснилось, не имели антигена М. Анти-М-антитела ино-гда сопутствовали другим антителам (Rh, Kell, Kidd, Duffy) у гематологиче-ских больных, получивших многочисленные переливания компонентов крови (А. Майский, Л. Кучера [5], Gales и соавт. [77]).
Помимо естественных и аллоиммунных антител описаны аутоантитела анти-М и анти-N (Chapman и соавт. [39], Garratty и соавт. [79], Immel и соавт. [110], Sacher и соавт. [215]). В некоторых случаях течение аутоиммунной гемо-литической анемии, обусловленной этими антителами, было тяжелым (Garratty
22. соавт. [79], Immel и соавт. [110]).
Различают рН-зависимые и глюкозозависимые антитела анти-M и анти-N (Beattie и соавт. [22], Reid и соавт. [200]). В отличие от обычных антител, для которых кислотность среды не столь существенна, рН-зависимые анти-М и анти-N-антитела наиболее активно реагируют с эритроцитами, несущими соот-ветствующий антиген, при значении рН 6,5. Глюкозозависимые антитела прояв-ляют свое действие лишь с эритроцитами, инкубированными в растворе глюко-зы. Установлено, что активность некоторых образцов антител анти-М и анти-N ингибируется растворами мальтозы и маннита, но остается неизмененной в присутствии фруктозы, рибозы, галактозы, лактозы и сахарозы. Такие антитела выявляли главным образом у больных сахарным диабетом.
46. больных почечной недостаточностью, находившихся на гемодиализе, об-наруживали особые антитела анти-N, реагирующие с эритроцитами, обработан-ными формальдегидом (Dzik и соавт. [66], Howell и соавт. [96], McLeish и со-
авт. [157], Sandler и соавт. [218], White и соавт. [259]). Такие антитела были
обозначены как анти-Nform. Дальнейшие исследования показали, что анти-Nform-антитела образовались в результате модификации мембраны эритроцитов боль-
ных следами формальдегида в гемодиализной системе (стерилизацию систем для гемодиализа проводили с использованием формальдегида).
Анти-N-подобную специфичность имеют лектины растительного происхо-ждения – Vicia graminea (А.К. Туманов, В.В. Томилин [9], Prigent [190]).
60. настоящему времени получено большое количество образцов моно-клональных антител анти-M и анти-N (Lisowska [149], Reid и соавт. [201]). Последние с успехом используют для фенотипирования эритроцитов, одна-ко некоторые из них, в частности анти-М, не строго специфичны и в высоких
453
концентрациях реагируют с эритроцитами M −N +, т. е. диспецифичны. Для при-дания им анти-М-специфичности прибегают к их разведению, что вполне при-емлемо для рутинного анализа, но не для метода адсорбции – элюции. На ак-тивность моноклональных анти-M- и анти-N-антител влияют рН среды и тем-пературные условия постановки реакции. Поликлональные антитела анти-M и анти-N алло- и ксеногенного происхождения менее зависимы от этих условий.
Протеолитические ферменты, применяемые в практике иммуносерологи-ческих лабораторий (папаин, фицин, бромелин , протеаза), разрушают антиге-ны M и N, в связи с чем энзимные пробы при работе с антителами анти-M и анти-N не используют (Hirsch и соавт. [93], Issitt, Anstee [113], Race, Sanger [191], Reid и соавт. [201]).
Дата: 2019-02-24, просмотров: 381.