Ограничивается прием поваренной соли независимо от того, имеет ли подросток артериальную гипер-тензию или нет.
При легком течении заболевания на фоне диеты назначают поливитамины, глютаминовую кислоту.
При среднетяжелом течении проводят дегидрата-ционное лечение (алъдактон, верошпирон или три-ампур, а при симптомах внутричерепной гипертен-зии— диакарб или фонурит). Спиронолактоны оказывают антиандрогенное действие, что особенно важно для страдающих ожирением с розовыми стриями девушек.
При нормальной пробе на толерантность к глюкозе можно назначать бигуаниды (метформин, глифор-мин, сиофор) в небольших дозах (по 125-250 мг 2 раза в день во время еды), которые у подростков с гипота-ламическим синдромом пубертатного периода не только уменьшают массу тела, но и устраняют булимию, подавляя избыточную продукцию инсулина, а также нормализуют повышенное артериальное давление.
При наличии признаков гипофункции щитовидной железы и при выраженной степени ожирения показано лечение синтетическими гормонами щитовидной железы (левотироксин, эутирокс, старшим под-
8
росткам можно при необходимости назначать тире-отом), которые рекомендуется давать в максимально переносимых дозах под контролем уровней свободных Т3 и Т4, ТТГ, пролактина и кортизона.
Эффективны балънеолечение (циркулярный душ, солено-хвойные ванны), дарсонвализация. Показаны лечебное плавание в бассейне и водная аэробика.
Лечение повторяют каждые 2-3 месяца в первый год и каждые 6 месяцев — в последующие годы.
Тяжелое течение заболевания лечат длительно и непрерывно.
Аноректики применяют под строгим контролем лишь в исключительных случаях, при ожирении III и IV степени {амфетамин, дезопимон, фепранон, реге-нон, мирапронт, теронак, мизандол, пондерал). Если аноректики не дают эффекта в течение 3-6 недель, то лечение ими следует прекратить как бесполезное и вредное. Многие аноректики обладают свойством вызывать эйфорию, а при длительном приеме — наркотическую зависимость.
Есть положительные отзывы на использование ин гибиторов желудочно-кишечных липаз, которые подавляют всасывание пищевых жиров (ксеникал, ор- листат).
Помимо строгой диеты, назначают давно хорошо известный в неврологии препарат дифенин в таблетках, содержащих 100 мг препарата. Дифенин нормализует нейромедиаторный обмен, синтез дофамина и тормозит продукцию кортиколиберина в гипоталамусе и соответственно АКТГ— в гипофизе, что вызывает уменьшение секреции кортизола и андроге-нов в надпочечниках и способствует регрессу розовых стрий. Начинать лечение следует с малых доз дифе-нина — по 1/2 таблетки 2-3 раза во время еды, постепенно повышая дозу до 1 таблетки 3 раза в день. Лечение обычно переносится хорошо. Дифенином лечат 2-3 месяца. При стойких розовых стриях лечение повторяют.
При гиперпролактинемии показан прием бромо-криптина (парлодела, абергина, каберголина или достинекса). Эти препараты могут оказать положительный эффект и при гиперандрогении, в частности, в борьбе с гирсутизмом и вульгарными угрями у девушек. Они эффективно снимают боли в молочных железах во время месячных, на которые нередко жалуются девушки, уменьшают проявления фиброаде-номатоза молочных желез.
При наличии легкого снижения толерантности к глюкозе бывает достаточно диеты № 9.
При признаках постпрандиальной гипергликемии, кроме диеты № 9, назначают бигуаниды в небольших
86
дозах, ксеникал (орлистат). В целях подавления вса-сывания углеводов можно назначать акарбозу, глю-кобай. К пероральных противодиабетическим суль-фаниламидам приходится прибегать крайне редко Потребности в инсулинотерапии у таких подростка в мы вообще не наблюдали.
Девушки с этой патологией не должны пользо ваться гормональными контрацептивами.
Артериальную гипертензию лечат на фоне низкосо-левой или даже бессолевой диеты блокаторами каль- циевых каналов, салуретиками, калийсберегающи-ми средствами. Показано назначение ингибиторов ангиотензин-конвертирующего фермента (капо-тен, каптоприл, энап, эднит, лизиноприл и др.в не-больших дозах).
Коррекция нарушений вегетативных функций дос-тигается с помощью обычных средств — барбиту- ратов, эрготамина, алкалоидов красавки (белло-ид, беллатаминал, бекарбон), настоек валерианы, пустырника, пиона, боярышника. Можно назначать ново-пассит, гомеопатическое средство из зверо-боя — негрустин.
Больным подросткам рекомендуется прием препа ратов, улучшающих микроциркуляцию, трофику и обмен веществ в головном мозге — ноотропила (пирацета- ма), кавинтона (винпоцетина), аминалона, пиками- лона, глицина, фитина, глютаминовой кислоты, це- ребролизина.
Показана санация очагов латентной инфекции.
Нежелательны поездки на курорты с тропическим и субтропическим климатом, после которых могут наступать выраженные обострения болезни (увеличиваются количество, распространенность и выраженность стрий, что свидетельствует о нарастании продукции кортизола).
Обследование подростков с гипоталамическим синдромом пубертатного периода должно проводиться в эндокринологическом стационаре.
Профилактика. Нужно оберегать детей и подростков от переедания, травм головы, инфекций и стрессов. Нежелательны ранняя половая жизнь, беременности и аборты.
Противопоказаны тяжелые виды спорта.
Категорически запрещаются анаболики, допинги и наркотики.
Нельзя чрезмерно загорать, нежелательны поезд-ки летом в жаркие края.
Очень важны ранние диагностика заболевания и его лечение, почему родители подростков не должны быть равнодушными к избыточному весу своих чад.
Диспансеризация. Диспансерная группа — Д-2.
Подростки с гипоталамическим синдромом пубертатного периода наблюдаются эндокринологом и другими специалистами до выздоровления.
По нормализации веса и артериального давления они с учета снимаются, но при условии нормального уровня всех по возможности определяемых гормонов крови.
При тяжелом течении синдрома показаны регулярные госпитализации в эндокринологический стационар.
Вопросы экспертизы. Группа здоровья — 4 или 3.
К первой степени ожирения относят превышение должной массы на 10-29 %, ко II—на 30-49 %, к III — на 50-99 %, к IV — на 100 % и более.
Показаны ЛФК и регулярные занятия легкими видами спорта. Категорически запрещена простая аэробика (провоцирует обострение!), но показана аэробика водная. По этой же причине запрещено участие в спортивных состязаниях, в кроссах. При выраженном ожирении желательно посещение групп здоровья.
Показаны все виды интеллектуального труда, а также работа лаборантом, чертежником, слесарем. Нельзя работать в горячих цехах, с профвредностями (шум и вибрация), с предписанными темпами работы (конвеер), не показана работа в вынужденных позах, в ночные смены.
Противопоказана работа, связанная со стрессами и командировками.
При повышенном артериальном давлении нужно освобождать больного подростка не только от переводных экзаменов, но даже от экзаменов на аттестат зрелости, что решает специальная комиссия по заявлению родителей подростка.
При желании подростков с этим синдромом вступить в брак им не следует это запрещать категорически во избежание психотравмы. Практика показывает, что ранние браки у таких подростков обычно прочные, но ранние беременность и аборты нежелательны, так как в дальнейшем может наступить бесплодие.
При III и IV степенях ожирения подростку дают отсрочку от призыва в армию. При меньшей степени ожирения вопрос о призыве решается индивидуально с учетом состояния гемодинамики, толерантности к глюкозе, к нагрузкам и стрессам. В каждом случае при призыве в армию проводится медицинское освидетельствование в эндокринологическом стационаре с привлечением кардиолога, офтальмолога, невропатолога и других специалистов.
СИНДРОМ ГИПЕРПРОЛАКТИНЕМИИ
Определение. Гиперпролактинемический синдром — клинический симптомокомплекс, возникающий в результате избыточной продукции пролактина. Эта нозологическая единица прежде считалась редким расстройством и дробилась на три синдрома — синдром Форбса-Олбрайта, синдром Хиари-Фроммеля и синдром Арагона-делъ-Кастильо. Ныне эти состояния объединены в один синдром.
Синонимы: синдром персистирующей галактореи-аменореи, пролактинома, гиперпролактинемический синдром, синдром гиперпролактинемии, лактация вне-послеродового периода, патологическая лактация.
Распространение. Синдром гиперпролактинемии — одно из самых частых гормональных расстройств, которое наблюдается при различных патологических состояниях нейроэндокринной системы. Частота гиперпролактинемии в популяции—17:1000. У мужчин встречается реже (1: 6-10). Синдром гиперпролактинемии —в основном патология молодого возраста. Его частоту оценивают по меньшей мере как 1:1050—у женщин и 1:2800—у мужчин, причем более часто он диагностируется в возрасте от 20 до 40 лет, но не является редкостью и у подростков, особенно у девушек. Каждый третий случай женского бесплодия сопровождается гиперпролактинемией (Дзеранова Л.К., 1999). Гиперпролактинемия у детей и подростков с аллергическими заболеваниями обнаружена в 30 % случаев против 5 % в общей популяции (Цветкова Н.И., 2001).
При обследовании в 1986 году 10500 здоровых жителей Японии было обнаружено 5 пролактином (0,048%). Пролактинсекретирующие аденомы гипофиза составляют до 40 % всех его гормонообразую-щих опухолей. Есть сведения, что микропролактино-мы, судя по данным аутопсий случайно погибших лиц, имеются у 2-9% людей.
Этиология и патогенез. У подростков (как у юношей, так и у девушек), а также у взрослых пролактин играет важную роль в становлении и регуляции репродуктивной функции.
Пролактин — физиологический ингибитор освобождения гонадолиберина, он снижает продукцию лютеинизирующего и фолликулостимулирующего гормонов, а в больших дозах — и половых стероидов. Поэтому после родов на период грудного вскармливания у женщин с высоким уровнем пролактина в крови обеспечивается временный гипогонадизм и естественный противозачаточный эффект. Очевидно, это способствует регуляции частоты беременностей и более полноценному раннему уходу за потомством.
8
Пролактин — стимулятор роста и лактации молочной железы. При половом созревании усиленный рост железы в основном регулируется эстрогенами, затем — эстрогенами и прогестинами. Во время беременности высокий уровень эстрогенов стимулирует гиперплазию и гиперфункцию лактотрофов аде-ногипофиза у матери и у плода. Плацентарный лак-тоген и в меньшей мере пролактин готовят молочные железы матери к грудному кормлению, но высокий уровень эстрогенов пермиссивно ингибиру-ет действие пролактина на лактацию. Поэтому продукция молока наступает только после родов, на фоне быстрого снижения выработки эстрогенов. Гиперп-ролактинемия у плода и матери важна для предохранения от негативных эффектов родового стресса и им-муностимуляции.
Гормон синтезируется лактотрофами аденогипофи-за, составляющими 15-20% его массы. При беременности эта доля может возрасти до 70%!
Пролактин — это аденогипофизарный тропный гормон, периферическими мишенями которого в основном служат экзокринная молочная железа, а также, по новым данным, — макрофаги и лимфоциты.
Пролактин вырабатыватся не только в пролакто-трофах аденогипофиза. Он может секретироваться клетками иммунной системы. Как анаболический регулятор пролактин адресует своё действие и иммунной системе. Рецепторы пролактина обнаружены на макрофагах и лимфоцитах, поэтому пролактин считается активатором иммунитета. Имеются основания полагать что пролактиновый дефицит вызывает некоторое понижение иммунитета, особенно что касается продукции секреторного иммуноглобулина А. По крайней мере, накопление соответствующих лимфоцитов в лак-тирующей молочной железе и секреция IgA в молозиво и молоко, как и некоторые функции макрофагов, являются пролактинзависимыми.
Пролактин — один из регуляторов пролиферации клеток печени. Так, печень женщин отличается весьма высоким содержанием рецепторов пролактина (Смыслова B . C . с соавт., 2003). У многих животных рецепторы пролактина распространены в организме более широко. Рецепторы пролактина относятся к соматомаммотрофному типу и опосредуют своё действие через белковые внутриклеточные и аутокрин-ные посредники. Получены блокирующие и имитирующие эффекты пролактина антитела к его рецептору, что обосновывает гипотезу о возможности аутоиммунной резистентности к пролактину или аутоиммунной «псевдогиперпролактинемии».
88
Максимальная концентрация пролактина в крови появляется вскоре после засыпания. У здоровых лиц содержание пролактина начинает повышаться через 2 часа сна (Дедов И.И., Дедов В.И., 1992). Максимум его суточной секреции также приходится на период сна — она в 5-7 раз выше, чем во время бодрствования. Таким образом, сон является основной причиной повышения концентрации пролактина в крови в ночное время.
После родов при начале грудного вскармливания продукция пролактина дополнительно стимулируется при сосании груди. Во время сосания прирост продукции пролактина зависит от рефлекторно мобилизуемых серотонинергических воздействий. Гормон считается также стимулятором секреторной активности жёлтого тела, откуда его старое название —лю- теотропный гормон, лютеотропин. Эта функция про лактина имеет большое значение при беременности. Гипофизэктомия у беременных самок не приводит, однако, к прерыванию беременности, так как функции пролактина матери дублируются плацентарным лактогеном и пролактином плода.
У млекопитающих анаболические эффекты пролактина включают синергизм с соматотропином в стимуляции роста, особенно — внутренних органов, с половыми гормонами — в индукции вторичных внешних половых признаков, эритропоэтическое действие, липогенетическое действие на жировую ткань. Пролактин способствует гипергликемии и оказывает ренотропный эффект. Он стимулирует также рост волос, рост сальных желёз и их секрецию. Действие пролактина на центральную нервную систему у всех позвоночных индуцирует стереотипы материнского поведения. У нелактирующих женщин и у мужчин дефицит пролактина обнаружить трудно.
Хроническая внутричерепная гипертензия является фактором высокого риска развития патологической гиперпролактинемии в подростковом возрасте. Стойкое повышение уровня пролактина наблюдается почти у трети подростков с головными болями. Частота транзиторной гиперпролактинемии среди девушек с жалобами на частые головные боли втрое превышает таковую среди юношей с такими же жалобами (Цвет- кова Н.И. с соавт., 2001).
Многочисленные препараты, применяемые в психоневрологии (нейролептики, транквилизаторы), увеличивают секрецию пролактина, что нередко наблюдается в психиатрических стационарах как у женщин, так и у мужчин при хроническом лечении высокими дозами этих препаратов. В настоящее время в мире
 невиданными темпами нарастает частота депрессивных состояний, которые приводят к перманентному употреблению антидепрессантов и прочих психотропных препаратов, в частности, подростками. Но большинство антидепрессантов вызывают гиперпролак-тинемию, в том числе широко используемые в психоневрологической практике амитриптилин, ре-ла ниум, галоперидол и др. Известно, что опиаты, кокаин приводят к гиперсекреции пролактина (Бала-болкин М.И., 1998). Гиперпролактинемия возникает при наркозе. У подростков в происхождении гиперпро-лактинемии несомненна роль опиоидной наркомании. Опиаты потенцируют эффекты пролактина и стимулируют его секрецию. Последние ускоряют рост лактотрофов, и поэтому опиатные наркотики считаются фактором риска пролактином. Известно, что для опиатных наркоманок характерна аменорея.
невиданными темпами нарастает частота депрессивных состояний, которые приводят к перманентному употреблению антидепрессантов и прочих психотропных препаратов, в частности, подростками. Но большинство антидепрессантов вызывают гиперпролак-тинемию, в том числе широко используемые в психоневрологической практике амитриптилин, ре-ла ниум, галоперидол и др. Известно, что опиаты, кокаин приводят к гиперсекреции пролактина (Бала-болкин М.И., 1998). Гиперпролактинемия возникает при наркозе. У подростков в происхождении гиперпро-лактинемии несомненна роль опиоидной наркомании. Опиаты потенцируют эффекты пролактина и стимулируют его секрецию. Последние ускоряют рост лактотрофов, и поэтому опиатные наркотики считаются фактором риска пролактином. Известно, что для опиатных наркоманок характерна аменорея.
Так, по данным С. В. Алексеева (1998), до 1 % подростков в возрасте 15-17 лет имеют диагнозы: наркомания, токсикомания, алкоголизм. Статистические данные по Санкт-Петербургу за 1996 год свидетельствуют о том, что к выпускному школьному балу пробовали наркотики 19 % юношей и 13 % девушек, а наркозависимость выявлялась соответственно у 9 % и у 5 % выпускников. Среди юношей частота употребления так называемых «легких» наркотиков (марихуана, гашиш) составляет 52%, в б % случаев имеет место опиатная наркомания. С 1995 по 1998 гг. каждый пятый подросток-наркоман, поступивший в Мариин-скую больницу Санкт-Петербурга, умер от ангиоген-ного сепсиса, причиной которого явились «грязные» наркотики, вводимые внутривенно. При обследовании солдат-дезертиров в 35 % случаев выявлены психические болезни, в 6 % случаев — опиатная наркомания (Левина Л.И. с соавт, 1997,1998). Число наркологических расстройств среди подростков в 90-х годах XX века возросло в 3,7 раза, наркомании — в 15 раз. Реальные цифры наркомании среди подростков — в 6-10 раз выше зарегистрированных (Баранов А.А., 1999).
Повышают продукцию пролактина блокаторы кальциевых каналов, в частности, верапамил, Н -блокаторы, широко используемые в лечении язвенной болезни (циметидин, ранитидин и их аналоги). Ускоряют рост лактотрофов эстрогены, поэтому гормональные контрацептивы, содержащие много эстрогенов, также являются фактором риска гиперпролактинемии. Но максимальный пролактинстимулирующий эффект дает безобидный на первый взгляд и весьма широко используемый населением при диспепсических расстройствах церукал (метоклопропамид).
В литературе описываются случаи опоясывающего лишая, ожогов в области 4-6 межреберных нервов, которые приводили к гиперпролактинемии.
Гиперпролактинемия подразделяется на физиологическую (при беременности, лактации и у новорожденных) и патологическую.
Физиологическая гиперпролактинемия наблюдается у беременных (она постепенно нарастает, повышая у беременной либидо и достигая максимума к родам), в процессе родов, при лактации, у новорожденных, при стимуляции сосков, во время полового акта. Она присутствует при гипогликемиях, при физических нагрузках, во время еды и особенно при стрессах. Пролак-тин вообще относится к гормонам стресса. Известно, что даже факт взятия крови из вены у подростка может в качестве стресса вызывать транзиторную гипер-пролактинемию.
При хронической почечной и печёночной недостаточности гиперпролактинемия является внежелезис-той и вызвана замедлением инактивации данного гормона.
Гипоталамическая гиперпролактинемия может быть следствием разрушения дофаминергических регуляторов в подбугорье. При гиперпродукции гипота- ламического тиролиберина развивается гиперпролактинемия в сочетании со вторичным гипертирозом. Избыток тиролиберина при первичном гипотиреозе также способен вызвать усиленный пролактиногенез. При травматическом обрыве ножки гипофиза он продолжает функционировать, причем пролактогенез усиливается.
У детей и подростков синдром гиперпролактинемии изучен еще недостаточно. Нормальный уровень пролактина для возраста 12,8 ± 0,5 года — 14,1 ± 0,7 мкг/л. Дети с гиперпролактинемией чаще рождаются от медикаментозно индуцированной беременности (в 2 раза чаще, чем в контрольной группе), которая протекает с явлениями фетоплацентарной недостаточности и угрозой прерывания во второй половине. По-видимому, имеет значение острая гипоксия в родах.
Динамика концентрации пролактина в крови мальчиков и девочек до начала полового созревания существенно не отличается. Во время пубертата уровень гормона у девушек резко возрастает, в то время как у юношей в зависимости от стадий полового созревания выраженных изменений секреции пролакти на не отмечается (Скородок Л.М., Савченко О.Н., 1984).
У подростков с гиперпролактинемией постнаталь-ный период бывает отягощен гипоксически-травма-
89
 тическои энцефалопатией с гипертензивно-гидроце-фальным синдромом, нервно-рефлекторной гипервозбудимостью. В их младенчестве отмечена высокая распространенность синдрома малой мозговой дисфункции и хронической внутричерепной гипертензии. Обращает внимание высокая частота функциональных нарушений сердечно-сосудистой системы, желудочно-кишечного тракта и нейрогенной дисфункции мочевого пузыря. Таким образом, комплекс выявленных отклонений пренатального, перинатального и по-стнатального периодов определяют пестрый «пейзаж» клинических проявлений у детей и подростков с гиперпролактинемией (Цветкова Н.И., Ши-линД.Е., 2001).
тическои энцефалопатией с гипертензивно-гидроце-фальным синдромом, нервно-рефлекторной гипервозбудимостью. В их младенчестве отмечена высокая распространенность синдрома малой мозговой дисфункции и хронической внутричерепной гипертензии. Обращает внимание высокая частота функциональных нарушений сердечно-сосудистой системы, желудочно-кишечного тракта и нейрогенной дисфункции мочевого пузыря. Таким образом, комплекс выявленных отклонений пренатального, перинатального и по-стнатального периодов определяют пестрый «пейзаж» клинических проявлений у детей и подростков с гиперпролактинемией (Цветкова Н.И., Ши-линД.Е., 2001).
Более или менее перманентная гиперпролактине-мия в результате подавления ею (по принципу обратной связи) продукции гипоталамического гонадолибе-рина снижает секрецию гонадотропных гормонов гипофиза (лютеинизирующего и фолликулостиму-лирующего). На это реагируют половые железы, функция которых снижается. В результате возникает ги-погонадизм.
Следует подчеркнуть, что гиперпролактинемия и ги-перпролактинемический гипогонадизм не являются синонимами.
Синдром гипогонадизма, как известно, является составной частью гиперпролактинемического синдрома. Уровень пролактина в сыворотке, по сути, является диагностическим маркером первичного гипогонадизма (Дедов И.И., Дедов В.И., 1992).
Таким образом, гиперпролактинемия как у мужчин, так и у женщин часто служит причиной вторичного гипогонадизма, аменореи и бесплодия. Кстати, об этом упоминал еще Гиппократ — «Если небеременная женщина лактирует, у нее прекращаются менструации». По-видимому, с древних времен, наблюдая за млекопитающими домашними животными (коровы, козы, овцы), женщины уяснили, что наступление последующей беременности маловероятно, если продолжать кормление ребенка от предыдущей. Поэтому в старые времена, когда не было надежных контрацептивов, их у женщин в известной мере заменяла непрерывно продолжавшаяся лактация.
У мужчин гиперпролактинемический гипогонадизм проявляется гипоандрогенизмом. Клетки Лей-дига становятся гипофункциональными и могут даже атрофироваться. Семенные канальцы сохраняются. Пациенты теряют половое влечение, имеют гинекомастию, у них уменьшается сперматогенез. Однако
90
не более 15 % мужчин с гиперпролактинемическим гипогонадизмом имеют настолько выраженные расстройства, что обращаются к врачу. Тем не менее, до 8 % случаев импотенции и до 5 % случаев мужского бесплодия вызваны именно пролактиномами или пе-риферическими формами гиперпролактинемии. Однако в некоторых случаях синдром гиперпролактинемии может сопровождаться гиперандрогенизмом (про-лактин стимулирует продукцию дегидроэпиандро-стерона в коре надпочечников), ожирением с перла-мутровыми стриями, наклонностью к депрессивным состояниям.
Все эти проявления не обязательны и зависят oт сопутствующих гипоталамо-гипофизарных наруше-ний. Например, первое описание данного синдрома вообще сделано у женщины с галактореей и кахекси-ей («молочная сухотка»). Для гиперпролактинемии ха-рактерна склонность к депрессиям, эмоционально-личностным расстройствам и даже к суицидам, что связывают с изменением у больных уровня биоген-ных аминов.
Гораздо ярче клиника женского гиперпролактине-мического синдрома. Угнетение пролактином секре-ции лютеинизирующего гормона в середине менстру-ального цикла приводит к ановуляторным циклам и к гипоэстрогении. У женщин даже умеренная гиперпро-лактинемия может укорачивать лютеиновую фазу ова-риального цикла и вести к нерегулярным месячным и к бесплодию. При выраженной гиперпролактинемии может наблюдаться клссический синдром персис-тирующей галакторей-аменореи.
Галактореей следует называть патологическое выделение молока, а лактореей — естественное, во время нормальной лактации.
Однако галакторея как первый симптом гиперпро-лактинемии бывает только у 1/5 больных девушек. Степень галактореи—от нескольких капель при надавливании на сосок до спонтанного обильного выделения молока.
Неконтролируемая повышенная продукция про-лактина является причиной развития гипепролакти-немического синдрома и чаще всего наблюдается при продуцирующих в избытке пролактин доброкачественных аденомах — пролактиномах (реже — при соматотропиномах и адренокортикотропиномах). Свидетельством гормональной активности пролактино-мы являются нарушения менструального цикла, галакторея и бесплодие.
Пролактиномы чаще имеют небольшие размеры— не более 2-3 мм (микроаденомы), но макроаденомы могут достигать больших размеров — более 1 см.
В большинстве случаев причину пролактином выяснить не удается. Так, в этиологии макропролакти-ном могут играть роль само начало половой жизни (особенно раннее), беременность, роды, черепно-мозговые травмы, нейроинфекции, психоэмоциональное перенапряжение. Изредка пролактинома является следствием приема нейролептиков (ятрогенная).
Пролактиномы — самые распространённые гормо-нообразующие аденомы гипофиза, они составляют более трети опухолей этой подгруппы. В 90% случаев больные с микропролактиномами — женщины. Мак-ропролактиномы более редки, но у мужчин встречаются чаще.
Наконец, существуют соматотропиномы и адрено-кортикотропиномы, секретирующие пролактин наряду с основным гормоном, а также псевдопролактино-мы, клиника которых проявляется только сиптомами внутричерепной компресии. По-видимому, это можно объяснить тем, что пролактин у человека вырабатывается в различных молекулярных формах. Есть люди, у которых отмечается так называемая big-npo-лактинемия, когда вырабатывается избыток биологически неактивного гормона с большой молекулярной массой. Поэтому big-пролактинемия не считается патологической и не имеет клиники гиперпролактинемии (Мельниченко Г.А., 2000).
Опухоли, ранее квалифицировавшиеся как хромо- фобные аденомы, при современных исследованиях оказались пролактиномами. В 1968 г. в Мариинской больнице Санкт-Петербурга мы наблюдали пожи лую женщину с диагнозом «хромофобная аденома гипофиза», установленным на основании рентге нограмм турецкого седла и клиники внутричерепной гипертензии. Больная вообще никогда в жиз-'ни не имела месячных, что, впрочем, не мешало ей несколько раз быть замужем. В то время в больнице еще не было возможности определять уровень пролактина в крови. Но, по всем клиническим данным, хромофобная аденома была, по-видимому, пролактиномой.
Наступление месячных у многих девушек с пролактиномой запаздывает (14-15 лет). У каждой пятой больной месячные нерегулярные с самого начала болезни. В дальнейшем месячные нарушения всегда связаны со стрессами. Отмечено, что небольшое повышение уровня пролактина может быть причиной недостаточности желтого тела, ановуляторного цикла и бесплодия.
Клиника. Одной из самых частых жалоб при про-лактиномах является жалоба на головные боли, что
почти у половины пациентов является поводом к посещению врача. Эти головные боли обычными анальгетиками практически не снимаются. Частыми являются также жалобы на изменение веса тела, повышение артериального давления, выраженную слабость, вегетативные кризы, боли в костях, расстройства сна, нарушение зрения, изменения психики и настроения (в 1/3 случаев наблюдаются выраженные депрессии), снижение памяти.
Каждая вторая женщина с пролактиномой (чаще с макропролактиномой) жалуется как на первичное, так и на вторичное бесплодие, что служит основным предлогом обращения к гинекологу или к гинекологу-эндокринологу Именно у молодых женщин одна из основных жалоб — бесплодие. Их беспокоит гирсутизм, который выражен довольно умеренно, скорее легкий. Либидо нередко снижается, появляется фригидность, отсутствует оргазм, нарастает сухость влагалища. Нередко женщины жалуются на выкидыши — на невынашивание на раних сроках беременности.
В табл. 3 приводятся жалобы больных при микро-пролактиномах в порядке убывания их частоты.
У большинства больных с макропролактиномой наблюдается галакторея с молокоподобным характером выделений.
Расстройства менструального цикла достаточно пестрые. Могут быть отсутствие или задержка менархе, ановуляторный цикл, гипофункция желтого тела, укорочение лютеиновой фазы, олигоменорея, опсоме-норея, альгоменорея, аменорея, изредка—обильные маточные кровотечения. Аменорея чаще наблюдается именно при макропролактиномах. Первичная аменорея при пролактиноме может возникать в случаях, когда пролактинома функционирует до наступления полового созревания. В других случаях аменорея — вторичная.
Для пролактиномы характерны гипоплазия матки, отсутствие симптома «зрачка» и симптома «натяжения» слизи. Более чем у половины больных с пролактиномой наблюдается гипоплазия матки, могут выявляться миомы. У половины женщин яичники вообще не определяются, у 14 % они увеличенные и болезнен- . ные, а у 7 % они могут быть мелкокистозно измененными.
Если заболевание возникло до пубертата, то у девушек-подростков может наблюдаться гипоплазия клитора и малых половых губ. При раннем развитии гиперпролактинемического синдрома молочные железы остаются ювенильного типа с бледными плоскими или втянутыми сосками. Гигантомастия и акро-
91
мастия практически не встречаются, воспалительных изменений ареолы сосков у подростков также не наблюдается. В молочных железах в каждом третьем случае наблюдается фиброзно-кистозная мастопатия. В каждом пятом случае развивается их инволюция.
Таблица 3
Частота различных жалоб у больных
с микропролактиномами (по И.И. Дедову и В.И. Дедову,
1992)
| Частота , | |
| Жалобы | % от числа |
| больных | |
| Галакторея | 100 |
| Аменорея | 83 |
| Бесплодие | 71 |
| Ожирение | 44 |
| Головная боль | 36 |
| Слабость, утомляемость | 20 |
| Избыточный рост волос | 20 |
| Нарушение менструального цикла | 17 |
| Сексуальные расстройства | 17 |
| Кардиалгии | 14 |
| Отечность | 8 |
| Абдоминальный синдром | 5 |
| Артериальная гипертензия | 4 |
| Головокружение | 3 |
| Выпадение волос на голове | 3 |
| Нарушение зрения | 0 |
Как видно из таблицы, женщины с микропролакти-номами практически не предъявляют жалобы на нарушения зрения.
У мужчин, для которых типичны макропролакти-номы, чаще наблюдаются симптомы повышения внутричерепного давления (что проявляется как раз нарушениями зрения, снижением зрения на один глаз, головными болями), брадикардия и склонность к ги-потензии. Может развиться гидроцефалия. Из нарушений зрения чаще выявляется битемпоральная ге-мианопсия. Может быть двоение в глазах, нарастающее падение зрения на один глаз, паралич экстраокулярных мышц. Крупные пролактиномы могут приводить к судорожному синдрому, эпилепсии, а при разрушении опухолью основной кости — к назо-ликворее (Дзеранова Л.К., 1999).
Галакторея у мужчин встречается гораздо реже, так как мужские железы не подготовлены к галакто-рее предварительной эстрогенизацией. В связи с этим пролактиномы у мужчин диагностируются гораздо позже, когда появляются признаки выраженной внутричерепной гипертензии, и формируется клиника явного гипогонадизма. У юношей с пролактиномой появляются акне, гинекомастия, снижение сексуального
92
влечения, импотенция, а в дальнейшем — бесплодие из-за олигоспермии.
Медикаментозная гиперпролактинемия долгое вре-мя остается вообще бессимптомной, хотя ее проявле-ния могут варьировать от минимальных расстройся менструального цикла до типичного синдрома галак-тореи-аменореи (Мельниченко Г.А., 2000).
Классификация. Различают эссенциальную (пер-вичную) патологическую гиперпролактинемию как са-мостоятельное гипоталамо-гипофизарное заболевание и симптоматическую (вторичную) как симптом дру-гих сотояний и заболеваний. Исходя из этого, разрабо-тана этиологическая классификация гиперпролактине-мического синдрома, приводимая ниже.
I. Первичная гиперпролактинемия:
а) микропролактинома;
б) макропролактинома.
II. Гиперпролактинемия на фоне анатомических де-
фектов, опухолей и системных поражений гипо-
физа:
а) синдром «пустого» турецкого седла;
б) «псевдоопухоли» мозга (хроническая
внутричерепная гипертензия);
в) гормонально-неактивные аденомы;
г) объемные образования супраселлярной обла-
сти
(краниофарингиомы, глиомы, пинеаломы, хон-дромы);
д) гистиоцитоз X, саркоидоз;
е) аутоиммуный гипофизит; перерезка ножки ги-
пофиза.
III. Вторичная (симптоматическая) гиперпролакти-
немия на фоне различных заболеваний и приема
лекарств.
Степень галактореи оценивают по специальной шкале:
I (±) — галакторея непостоянная;
II (+) — единичные капли при сильном надавлива-нии на сосок;
III (++) — струйно или обильные капли при
несильном надавливании на сосок;
IV (+++) — спонтанное отделение молока.
Диагностика. В диагностике пролактиномы необ-
ходимо подробно анализировать анамнез жизни подро-стков с изучением приема ими каких-либо лекарств или средств (наркотики!), влияющих на выработку пролак-тина. Нужно тщательно оценивать клинические син-дромы и симптомы, проводить обследование подрост-ков офтальмологом, невропатологом, гинекологом,
исследовать, по возможности, уровни всех тропных гормонов гипофиза, включая проведение специальных тестов на их угнетение или стимуляцию, а также МРТ гипофиза (Бондарь И.А., Рогова ИЛ., 2003).
Важнейшее диагностическое значение имеет определение уровня пролактина в сыворотке крови. Но однократного обнаружения повышенного уровня про-ла ктина еще недостаточно для диагноза пролакти-номы без специальных методов инструментальной диагностики. В целях подтверждения преходящей (транзиторной) гиперпролактинемии необходимо исследовать уровень пролактина в разное время суток, а у девушек-подростков — и в разные фазы менструального цикла.
Принято считать, что диагноз пролактиномы становится достоверным при персистирующем повышении уровня пролактина в сыворотке более 200 мкг/л, причем даже в отсутствие рентгеновских изменений формы турецкого седла. У здоровых женщин уровень пролактина не превышает 20 нг/мл (600 мкЕд/л), а у мужчин— 13-15 нг/мл (450 мкЕд/л). Диагноз можно считать вероятным при спонтанном повышении уровня пролактина до 3000 мкЕд/л, когда даже однократное его определение практически патогномонично для диагноза пролактиномы (Дзеранова Л.К., 1999). Существенную помощь в диагностике пролактиномы оказывают функциональные пробы.
Чаще всего используются пробы с церукалом (ме-токлопрамидом) и тиролиберином (Балаболкин М.И. с соавт., 1990).
Проба с тиролиберином. Утром натощак у подростка производят забор венозной крови для определения пролактина, а затем внутривенно вводят 200-500 мкг тиролиберина, после чего на 15,30,60и 120-й минутах заборы крови повторяют. У здоровых подростков пик секреции пролактина после пробы наступает на 15-30-й минуте, при этом он в 4-10 раза превышает исходные его значения. При гиперпролактинемии после пробы с тиролиберином уровень пролактина сохраняется исходным или становится даже пониженным. При истинной пролактиноме ответная реакция пролактина после пробы или незначительная, или вообще отсутствует.
Проба с церукалом (метоклопрамидом). Церу-кал является антагонистом дофамина центрального действия и оказывает выраженное стимулирующее влияние на продукцию пролактина. Забор венозной крови при пробе с церукалом проводится примерно так же, как и при пробе с тиролиберином. Церукал вводится внутривенно в дозе 2 мл (10 мг).
При пероральной пробе (доза церукала при этом — 120 мг) забор крови осуществляется каждые 30 минут в течение 4 часов. В норме после церукала пик секреции пролактина повышается в 10-15 раз в сравнении с исходным. При пролактиноме после церукала продукция пролактина практически не изменяется, в то время как при функциональной пролактинемии может отмечаться дальнейшее повышение уровня пролактина, но оно несравненно ниже, чем при пролактиноме.
При подозрении на пролактиному обязательно фи-зикальное исследование молочных желез с попыткой выявить скрытую галакторею путем надавливания на соски. Необходимо определять степень увеличения молочных желез по Дж. М. Таннеру (см. Приложение 5).
Даже при незначительной гиперпролактинемии необходимо обязательно включать в обследование таких подростков цветную периметрию и осмотр глазного дна.
Обязательно ультразвуковое исследование малого таза, желательно врачом ультрасонографистом-гине-кологом.
Ренгенография гипофиза—обязательный метод исследования подростков с подозрением на гиперпролак-тинемию, но он позволяет лишь ориентировочно судить о форме гиперпролактинемии.
Использование КТ в диагностике пролактином у подростков чревато большими лучевыми нагрузками на гипоталамо-гипофизарную зону, чего следует по возможности избегать, тем более что метод КТ без специального контрастирования обладает малой разрешающей способностью в выявлении пролактином, так как их ткань по плотности мало отличается от здоровой ткани гипофиза.
Наиболее информативным методом выявления про-лактйномы служит МРТ. При этом на краниограммах выявляются косвенные признаки объемного образования в области турецкого седла: остеопороз спинки турецкого седла, ее истончение, усиление пальцевых вдавлений и пневматизации основной пазухи, иногда— обызвествление мозговых оболочек.
Использование МРТ гипоталамо-гипофизарной области с контрастированием практически во всех случаях позволяет выявлять микроаденомы, которые не видны при использовании всех прочих методов исследования.
Критерии диагноза. Основными признаками заболевания (по Г.А. Мельниченко, 2000) являются: — клиническая картина — галакторея и/или нарушение менструального цикла и бесплодие у
93
девушек, бесплодие и /или снижение потенции у юношей;
— стойкая гиперпролактинемия, сниженное выделение пролактина при стимулирующих пробах;
— исключение симптоматической гиперпролак-тинемии, прежде всего при гипотирозе;
— обнаружение тех или иных изменений (микро- и макроаденома, «пустое» турецкое седло) при КТ и МРТ головного мозга.
Пример диагноза. Первичная гиперпролактинемия. Микропролактинома гипофиза. Аменорея. Галак-торея (+). Гирсутный синдром, умеренно выраженный. Нейроциркуляторная дистония.
Дифференциальная диагностика. Гиперпролактинемия является клиническим проявлением значительного числа эндокринных и неэндокринных расстройств. Так, при хронических болезнях печени, а также более чем у половины лиц с хронической почечной недостаточн-стью, систематически подвергающихся гемодиализу, нередко выявляется гиперпролактинемия.
Ложная галакторея может быть симптомом рака молочной железы, наблюдаться при папилломатозе молочных протоков, а также у девушек, часто стимулирующих свои молочные железы.
Особенно сложна дифференциальная диагностика между стертыми и симптоматическими формами гипер-пролактинемического синдрома, а также нечетко очерченными и малоизвестными клиническими синдромами. При них галакторея может развиваться даже на фоне нормальной продукции пролактина, а ее коррекция не изменяет течения основного заболевания и не улучшает состояние больных (Мельниченко Г.А., 2000).
Причиной галактореи могут быть различные супра-селлярные опухоли (краниофарингиома, глиома и пр.), базальный туберозный менингит, саркоидоз, болезнь Хенда-Крисчена-Шюллера, травмы основания черепа с эмболией гипоталамической области, прием гормональных контрацептивов, которые содержат избыток эстрогенов (более 35 мкг этинил-эстрадиола).
Нередко гиперпролактинемия является симптомом «пустого турецкого седла». Для него характерны следующие признаки (в порядке убывания их частоты): галакторея (характерно ее непостоянство), относительная редкость вторичного бесплодия (фертильность обычно сохранена), аменорея, первичное бесплодие, головная боль, сексуальные расстройства, слабость, утомляемость, головокружения, повышение артериального давления, кардиалгии, отеки, выпадение волос, могут быть желудочно-кишечные расстройства (Дедов И.И., Дедов В.И., 1992).
94
Само исследование уровня пролактина в сыворотке крови имеет дифференциально-диагностическое значе-ние. Значительное повышение уровня пролактина в крови (более 200 мкг/л) наблюдается чаще всего при пролак-тиномах. Во всех случаях дифференциальной диагностики пролактиномы важно определять суточную секрецию про-лактина, так как повышенная его секреция при пролакти-номе в течение суток наблюдается постоянно.
Сочетание ожирения с ускоренным ростом у под-ростков служит основанием для поиска гиперпролак-тинемии. У детей и подростков с патологической триадой — «гиперпролактинемия, ожирение и/или ускоренный рост» — органические изменения гипо-физа (аденомы) выявляются в каждом шестом случае (Цветкова Н.И. с соавт., 2001).
Гиперпролактинемия нередко (до 40 %) наблюдает ся и у девушек с ожирением с розовыми стриями (Ку ликова Л.В. с соавт., 1992). Проведенное нами, совме-стно с М.Ю. Сабельниковой (2002), исследований девушек-подростков с гипоталамическим синдромом пубертатного периода также выявило у них значитель ные колебания уровня пролактина в крови — от 144 до 850 мкМе/л. Более высоким значения пролактина со-ответствовали более высокие показатели тиротропно- го гормона, свидетельствующие о гипофункции щито-видной железы. Удалось отметить, что нарушения менструальной функции у таких девушек-подростков на-блюдались не только при повышении, но и при пониже-нии уровня пролактина в крови относительно средних его значений. Однако более высоким уровням пролак- тина соответствовали более частые нарушения менст-руального цикла (Строев Ю.И. с соавт., 2003).
Во всех случаях аутоиммунного тироидита у под-ростков возникает гиперпролактинемия, обусловлен-ная закономерно наступающим гипотирозом (Цветки ва Н.И. с соавт., 2001).
Синдром поликистозных яичников сопровождается гиперпродукцией надпочечникового тестостерона, что сочетается с повышением в крови дегидроэпиан- дростерона и сопровождается гиперпролактинемией.
Изредка гиперпролактинемия с галактореей наблю-дается у лиц с первичным гипокортицизмом.
У больных с другими опухолями гипофиза, а также при опухолях гипоталамической области (краниофарин-гиомах) отсутствует ночной пик подъема уровня про- лактина в крови.
При других опухолях гипофизарно-гипоталамичес-кой области внутривенное введение тиролиберина не повышает концентрации пролактина, как в норме или у подростков с пролактиномой.
Наконец, дифференциально-диагностическое значе-ние имеет лекарственная терапия гиперпролактинемия
с помощью агонистов дофамина. Так, уменьшение размеров аденомы при лечении этими препаратами наблюдается только при пролактиноме.
Исходы заболевания и прогноз. Буквально до середины XX века пролактинома считалась неизлечимой. Моноголетние (более 5 лет) наблюдения показали, что при современных методах лечения пролактином прогноз для жизни подростков относительно благоприятный. Симптомы внутричерепной компрессии при этом развиваются редко. Обычно восстанавливается и сохраняется фертильность. Восстанавливается и суточный ритм секреции пролактина. Эффект может наступить уже через 1-1,5 месяца от начала лечения. Но регресс размеров опухоли происходит гораздо позже. Полная стабилизация патологического процесса наблюдается всего у5-10 % больных. Однако у некоторых больных эффект терапии с нормализацией продукции пролактина наступает лишь спустя годы упорного лечения.
Вследствие больших размеров пролактином мужчины с таким заболеванием лечению агонистами дофамина поддаются плохо. Поэтому их принято лечить хирургическим или лучевым методами. При макропро-лактиномах постоянно существует риск их роста с вовлечение в процесс параселлярных структур (Дзерано-ваЛ.К., 1999). Примерно в 1/5 случаев в пролактиному происходит кровоизлияние (апоплексия пролактиномы), при этом может внезапно ухудшаться зрение, так как наступает усиление симптомов внутричерепной компрессии с неврологической симптоматикой. При макро-пролактиноме вследствие недостаточности кровоснабжения ее центральной части может развится инфаркт опухоли с некрозом.
Микроаденомы менее 10 мм в диаметре иногда способны к спонтанному уменьшению. Рост их неинвазив-ный.
Самопроизвольные выкидыши наблюдаются почти у каждой пятой женщины с микропролактиномой.
При длительном гиперпролактинемическом анамнезе у мужчин и женщин может развиваться остеопо-роз с остеоалгиями.
У части больных подростков при лечении агонистами дофамина возникают тошнота, рвота, головокружение, ортостатические коллапсы, сонливость, головные боли, запоры, двигательное возбуждение, сухость во рту, дискинезия желчевыводящитх путей. Возможны аллергические кожные реакции. Изредка наблюдается синдром Рейно.
После операции — аденомэктомии — прогноз ги-перпролактинемического синдрома зависит от объема хирургического вмешательства. При макроаденомах тотальная гипофизэтомия приводит к пангипопитуита-ризму с последующей пожизненной заместительной
коррекцией наступающих гормональных расстройств тироидными гормонами, глюкокортикоидами, половыми гормонами.
При использовании современных методов микрохирургии под контролем МРТ появилась возможность более экономных операций на гипофизе, что значительно улучшает послеоперационный прогноз. Обычно после удаления микропролактиномы нормализация продукции пролактина восстанавливается у 60-90 % оперированных, а после удаление макропролактиномы — лишь у 2-40 %. У девушек через 6-8 недель может восстановиться менструальный цикл. В дальнейшем нарушения менструального цикла бывают связаны, как правило, со стрессами.
Лечение. Лечение определяется причиной гипер-пролактинемии. Цель лечения заключается в снижении и в нормализации продукции пролактина и в устранении проявлений гипогонадизма.
Необходимо стремиться к уменьшению размеров аденомы и к восстановлению функции черепно-мозговых нервов (особенно зрительного нерва).
На сегодня медикаментозное лечение синдрома агонистами дофамина является методом выбора. Используются леводопа (допар) по 0,5 г в сутки, пар- лодел (бромокриптин) по 2,5 мг 2-3 раза в сутки, ли-зурид — по 0,2-1,6 мг в сутки, лерготил — 6 мг в сутки, антагонист гистамина и серотонина — перитол (ципрогептадин) — от 6 до 10-12 мг в сутки и др.
Лучшим препаратом из перечисленных считается алкалоид спорыньи — парлодел. Однако у части больных к нему возникает резистентность.Увеличение доз парлодела приводит к нежелательным побочным эффектам — болям в животе, запорам, головным болям, возможны галлюцинации, нарушения периферического кровообращения (вазоспазм по типу синдрома Рейно).
Лечение парлоделом приводит к замедлению роста пролактиномы и к ее регрессу, в том числе при синдроме «пустого турецкого седла». В последние годы получен пролонгированный парлодел, который применяется внутримышечно по 50-200 мг 1 раз в месяц.
Опыт показывает, что парлодел может восстанавливать репродуктивную функцию даже у больным с макропролактиномами.
При непереносимости парлодела используют другие алкалоиды спорыньи — достинекс (каберголин), метэрголин, лисенил и др.
Новые селективные агонисты дофамина существенно расширили возможности консервативной терапии микропролактином (Каширина Е.П., Брызгали- на СМ., 2003).
Достинекс (каберголин) обладает выраженным и длительным гипопролактинемическим эффектом. Сниже-
95
 ние уровня пролактина после его приема начинается через 3 часа и может продолжаться в течение 7-28 дней. Поэтому его можно применять 1-2 раза в неделю или даже реже. Прием пищи не влияет на усвоение препарата. На фоне достинекса галакторея исчезает практически у всех пациентов. Значительно уменьшаются размеры пролактиномы. Устойчивое подавление продукции пролактина сохраняется на протяжении 3-6 месяцев после его отмены. Нельзя назначать достинекс одновременно с психотропными средствами, а также при послеродовых психозах. Если после лечения достинексом восстанавливается нормальный менструальный цикл, то за месяц до предполагаемого зачатия препарат не принимается. Перед назначением достинекса желательно провести тест на беременность. Если на фоне лечения достинексом возникает беременность, то лечение дос тинексом необходимо прекратить.
ние уровня пролактина после его приема начинается через 3 часа и может продолжаться в течение 7-28 дней. Поэтому его можно применять 1-2 раза в неделю или даже реже. Прием пищи не влияет на усвоение препарата. На фоне достинекса галакторея исчезает практически у всех пациентов. Значительно уменьшаются размеры пролактиномы. Устойчивое подавление продукции пролактина сохраняется на протяжении 3-6 месяцев после его отмены. Нельзя назначать достинекс одновременно с психотропными средствами, а также при послеродовых психозах. Если после лечения достинексом восстанавливается нормальный менструальный цикл, то за месяц до предполагаемого зачатия препарат не принимается. Перед назначением достинекса желательно провести тест на беременность. Если на фоне лечения достинексом возникает беременность, то лечение дос тинексом необходимо прекратить.
В России получен новый препарат — абергин, состоящий из двух изомеров бромокриптина. Он обладает более длительной способностью подавлять продукцию пролактина, а также выраженной нейро-тропной активностью. Препарат лучше переносится, чем парлодел, и почти не обладает гипотензивным действием. Он эффективен не только при изолированых пролактиномах, но и при смешанных опухолях гипофиза — соматотропиномах-пролактиномах, при склеро-кистозе яичников, при ановуляторных циклах, а также для подавления лактации и ее профилактики в целях уменьшения болей в молочных железах, которые возникают у некоторых девушек во время месячных.
В последние годы используется препарат, не имеющий отношения к алкалоидам спорыньи, который относится к дофаминовым D 2-агонистам, — норпролак. Он используется в дозах 0,05-0,175 мг в день однократно. Норпролак подавляет в основном продукцию пролактина, не оказывая особого влияния на продукцию других гормонов аденогипофиза. Но он может также нормализовать секрецию гонадотропинов.
Если гиперсекреция пролактина связана с гипоти-розом различного происхождения, то часто для нормализации его секреции бывает достаточно терапии гипо-тироза тироидными гормонами (левотироксин, эутирокс, тиреотом). Терапия тироидными гормонами гипотироза не только нормализует секрецию пролак тина, но и ликвидирует галакторею (в том случае, если пролактинемия была функциональной). Обыкновенно это приводит к нормализации продукции гонадотропинов и к восстановлению менструального цикла, а также — фертильности. При наличии пролактиномы лечение только тироидными гормонами, по нашему впечатлению, эффекта не дает. Поэтому в таких случаях приходится параллельно применять агонисты дофамина — бро- мокриптин, достинекс и др. в адекватных дозах.
96
При наступлении беременности лечение a г o ни-стами дофамина необходимо прекратить. При бе-ременности пролактиномы не отличаются выражен-ным ростом. При макропролактиномах размером 7-10 мм лечение парлоделом проводится перед плани-руемым зачатием в течение 1 года.
Если у беременных женщин с пролактиномой возни-кает нарушение зрения (хиазмальный синдром), то при по-ложительном эффекте парлодела или бромокриптина лечение ими следует продолжать до наступления родов.
При консервативном лечении синдрома гиперпролак-тинемии каждые 2-3 года на 2-3 месяца следует под кон-тролем уровня пролактина в сыворотке крови прерывать лечение для получения представления о стабилизации про-цесса и для решения вопроса о дальнейшем лечении.
Если макропролактинома разрушает турецкое седло (что доказывается рентгенологически), если при ее суп-раселлярном росте возникает компрессия на хиазму с про-грессирующим нарушением зрения, а также при неэффек-тивности консервативной терапии возникают показания к хирургическому или лучевому удалению пролактиномы. Хирургическое удаление макропролактиномы произво-дится путем транссфеноидального доступа.
В настоящее время разработаны методы хирурги-ческого лечения гиперпролактинемии даже на стадии только гиперфункции клеток-пролактотрофов адноги-пофиза.
Радиотерапия в виде протонового пучка или гам-матерапии используется при недостаточной эффектив-ности агонистов дофамина, а также в качестве до-полнительного метода после гипофизэктомии.
М.И. Балаболкин и Э.И. Кандель (1998) получа-ли эффект от деструкции пролактиномы с помощью криохирургии.
При ятрогенной гиперпролактинемии, связанной с приемом каких-либо препаратов, лечение этими пpeпa-ратами необходимо срочно прекратить. Обыкновенно при лекарственной гиперпролактинемии через 1-1,5 месяца галакторея исчезает, а нарушенный менстру-альный цикл восстанавливается.
Профилактика. Профилактика первичной идиопа-тической пролактиномы, как и других опухолей, пробле-матична. Детей и подростков необходимо оберегать от черепно-мозговых и прочих травм, в том числе от пси-хотравм (от стрессов). Следует избегать злоупотреб-ления сотовыми телефонами, воздействий ионизирую-щих излучений, СВЧ-полей.
Раннее начало у подростков половой жизни нецеле-сообразно. Важна профилактика среди подростков нар-команий, особенно опиоидных. Не желательно подрост-кам злоупотребление лекарствами, способствующими повышению продукции пролактина (транквилизато- ры, антидепрессанты, нейролептики, Н2 -блокато-
ры, блокаторы кальциевых каналов), а также гормо нальными противозачаточными средствами.
Очень важна профилактика заболеваний щитовидной железы. Раннее выявление аутоиммунного тироидита и его лечение в целях предупреждения гипотироза способствует предотвращению гипепролактинемии и ее последствий. В связи с этим во всех случаях аутоиммунного тироидита необходимо обследование подростков на содержание в сыворотке крови пролактина.
В связи с опасностью роста пролактиномы во время беременности зачатие можно допускать только после дительного (не менее года) лечения парлоделом.
Диспансерзация. Диспансерная группа — Д-3.
При пролактиноме показано постоянное наблюдение подростка эндокринологом, даже после успешного консервативного, оперативного или лучевого лечения. Кроме этого, их должны наблюдать офтальмолог (нейроофтальмолог), невропатолог и, конечно, гинеколог-эндокринолог.
С эндокринологического учета они не снимаются.
Перед каждым посещением эндокринолога необходимо, кроме пролактина, исследовать уровень других гипофизарных гормонов.
Если гиперпролактинемия обусловлена гипотирозом в исходе аутоиммунного тироидита, то в целях профилактики трансформации функциональной гиперпролактине-мии в органическую лечение синтетическими тиро- идными гормонами следует проводить пожизненно.
Вопросы экспертизы. Группа здоровья — 5.
Подростков с гиперпролактинемическим синдромом необходимо оберегать от травм и психо-эмоцио-нальных перегрузок. Поэтому их необходимо освобождать от уроков физкультуры, от массовых мероприятий. Показана лечебная физкультура.
Вопрос об освобождении от переводных и выпускных школьных экзаменов решается индивидуально, в зависимости от причины гиперпролактинемии (транзи-торная или стабильная, вследствие опухоли гипофиза — пролактиномы).
Запрещается работа с профессиональными вредностями, вибрацией, ионизирующими излучениями, с токами высокой частоты.
Так как у юношей синдром гиперпролактинемии чаще обусловлен пролактиномой, то при подтверждении диагноза пролактиномы к службе в армии они не годны. В других случаях вопрос службе в армии решается индивидуально. К приему в военно-учебные заведения такие подростки не годны.
НЕЙРОГЕННЫЕ АНОРЕКСИЯ И БУЛИМИЯ
Определение. Нейрогенная анорексия — гипотала-мическое расстройство, ведущее к нарушению пищевого
гомеостаза, патологическому пищевому поведению, к отказу от пищи и к уменьшению веса тела до состояния кахексии.
Синонимы: неврогенная анорексия, нервная анорек-сия, анорексия менталис, постпубертатное истощение, анорексия нервоза (anorexia nervosa).
По современным представлениям, нейрогенные анорексия и булимия могут быть фазами одной болезни.
В отличие от анорексии, при нейрогенной булимии вес держится в норме или слегка понижен. В отличие от других форм булимии, приступы повышенного аппетита чередуются с периодами отказа от еды и попытками «чисток».
Распространение. Нейрогенная анорексия — болезнь юных девушек и молодых женщин. 95 % больных нейрогенной анорексией — женского пола, и у 80% болезнь наступает в первые 7 лет после прихода месячных. Болеют, как правило, представительницы образованных слоев населения — в колледжах США частота недуга достигает 1 %, тогда как сред-непопуляционная встречаемость не превышает 3,27:100000.
Подростковые психологи отмечают тревожную тенденцию учащения заболевания по мере торжества в mass media нового идеала женской красоты и социальности, близкого к «типу будущего» по П. Матесу (Зайчик А.Ш., Чурилов Л.П., 1999,2001). В 80-х годах XX века за 10 лет частота нейрогенной анорексии выросла в 6,5 раза! Среди подростков анорексия наблюдается в 0,5-1 % случаев, новые случаи заболевания в возрасте 15-19 лет составляют 5-10:100000 населения (Мукоз М.Т., Аргенте Н., 2002). Заболевание свойственно девочкам-подросткам, реже—юношам. Чаще оно встречается у девушек в возрасте от 14 до 17 лет. Отношение численности больных юношей и девушек, как 1: 7-25. Частота — 1 % от девушек 16-18 лет (Т.Е. Чазова, 1991). В России нейрогенная анорексия часто встречается среди учащихся балетных школ и среди студентов высших учебных заведений.
Нейрогенная булимия встречается в несколько раз чаще, чем нейрогенная анорексия. Оба расстройства протекают у мужчин тяжелее, чем у женщин. В развитых странах не менее 10 % населения испытывали хотя бы лёгкие формы нейрогенной булимии.
Этиология. Нейрогенная (психогенная) анорексия — одно из самых загадочных заболеваний, поражающее преимущественно подростков и провоцирующее эндогенное голодание.
Это — классическое психосоматическое (иногда — первично-психическое) заболевание с тяжелым нарушением аппетита (анорексия), резким истощением и вторичной соматической и эндокринной симптоматикой.
97
Случаи нейрогенной анорексии всегда привлекали не только медицинское, но и повышенное общественное внимание. Несомненно, описанные в истории голодовки духовных подвижниц, аскетов и столпников, отказывавшихся от приема пищи, в ряде случаев представляли собой патологическое пищевое поведение больных нейрогенной анорексией.
Впервые научное описание заболевания у 18-летней пациентки дал английский врач XVII века Мортон. Много позже Уильям Галл (1874) предложил термин «anorexia nervosa».
Фотография истощённой больной с нейрогенной анорексией, впервые опубликованная в 1913 г. М. Симмон-дсом, стала одной из самых часто воспроизводимых медицинских иллюстраций (рис. 39). К несчастью, из-за редакционной ошибки, некритически воспроизведенной многими последующими руководствами, это фото фигурировало для десятков поколений студентов-медиков как пример совершенно другого заболевания—панги-попитуитаризма, при котором на деле нет истощения, если не присутствует параллельное поражение гипоталамуса.
Нередко начало заболевания связано с конфликтными ситуациями, иногда оно обусловлено повышенным весом больных, отношением его к пищи, модными поветриями. Так, известны случаи подражания эталону модной «красоты» — английской манекенщице Твиг-ги, прославившейся необычайной худобой, в результате чего медицина приобрела во всем мире сотни тысяч девушек-подростков, больных нейрогенной
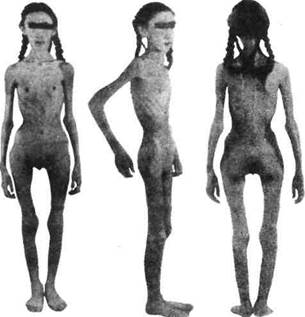
Рис. 39. Нейрогенная анорексия (по М. Симмондсу, 1913) 98
анорексией, причем в ряде случаев с летальным исхо-дом от некупирующегося истощения.
В последнее время в связи с введением в практику таких методов исследования, как КТ и МРТ головного мозга, при нервной анорексии все чаще стали выявлять органические изменения гипоталамо-гипофизарной об-ласти, в частности, микроаденомы гипофиза, «пустое турецкое седло» и др. (Строев Ю.И., Карповская Е.Б. 1998).
Обычно болеют эмоционально неустойчивые под ростки с живым интеллектом, артистическими склон-ностями. Заболевание чаще вызывается конфликтами с окружающей средой и внутрисемейными неурядица-ми. Время проявления заболевания охватывает пери-од физического созревания и не обязательно совпадав ет с психическим и социальным созреванием.
Заболевание проявляется резким снижением массы тела (не менее чем на 25 % от исходной), аменоре-ей, поведенческими нарушениями.
К нейрогенной анорексии существует полигенная наследственная предрасположенность (среди однояйце-вых близнецов индекс конкордантности в 5 раз выше) Определённый модус воспитания, вырабатывающий по-вышенное чувство долга и ориентирующий больше на соответствие определённому внешнему стандарту или примеру, чем на самоактуализацию, способствует про-явлению заболевания. Фактором риска может явиться психоэмоциональный стресс, порождённый, в частности, исходно повышенной массой тела и подростковым кри-зисом самооценки.
Патогенез. Болезнь в большинстве случаев счи-тают следствием вторичных психических и первичных эндокринно-метаболических нарушений.
Основные проявления связаны с половым и физичес-ким созреванием. В основе патогенеза нейрогенной анорексии лежат нейроэндокринные нарушения. Столь са-моуничтожающая страсть к похуданию не может возникнуть без участия гипоталамических механизмов. Ведь подбугорье — это отдел мозга, порождающий страсти. Подростки одинакового роста могут иметь разную массу тела. Массу тела можно изменять произвольно, что подвержено в значительной степени влиянию моды, У девочек во время максимального пубертатного ум корения роста прекращается отложение подкожного жира, что свойственно началу пубертата. Толщина подкожного жирового слоя в большинстве случаев является более точным показателем, чем попытка выражать дефицит массы тела в стандартных отклонениях Широкий разброс индивидуальных показателей массы тела подростков одного возраста обусловлен прежде всего неодинаковым ожидаемым ростом (зависящим от роста родителей) и различием темпов развития (особенно ко времени пубертатного ускорения роста).
Есть точка зрения, что полипептидный цитокин — интерлейкин-I, продуцируемый активированными клетками макрофагальной линии, включая элементы микро-глии, стимулирует освобождение гипоталамического кортиколиберина, который в свою очередь оказывает центральное действие на мозг, вызывая уменьшение поглощения пищи. Это позволяет представить связь между иммунной и нейроэндокринной системами и механизм, приводящий к анорексии, посредством активации иммунной системы в результате иммунологических изменений при острых инфекциях. Инфекционный индекс при ней-рогенной анорексии значительно превышает таковой в контрольной группе. Однако в ткани мозга специфических изменений при этом не обнаруживают.
В формировании пищевого поведения известно участие гипоталамуса, амигдалы и лимбических структур. Так, при разрушении амигдалы возникает исчезновение пищевых предпочтений, то есть еда теряет положительные эмоциональные корреляты (Гайтон А., 1989). В.Ю. Шанин (1996) считает, что нейрогенная анорек-сия связана с застойным возбуждением, охватывающим вентромедиальное ядро гипоталамуса. Д.А. Дроуссмэн (1987) указывает при нейрогенной анорексии на изменение метаболизма андрогенов с избыточной продукцией зтиохолоналона вместо тестостерона. Этиохолона-л он известен как активатор катаболических процессов, ответа острой фазы и метаболической мобилизации при лихорадке.
При нейрогенной анорексии снижена продукция эстро генов, что со временем вызывает остеопороз (см. стр. 260).
Обнаруживается значительное повышение уровня натриуретического гормона предсердий, так как пред-сердный натрийуретический пептид вызывает постоянную потерю натрия и, следовательно, воды, что является одной из причин снижения массы тела. А это приводит к снижению активности системы «ренин-ан-гиотензин-альдостерон», что является причиной гипотонии. Однако предсердный натрийуретический гормон приводит к повышенной экскреции кальция.
Последнее является причиной судорог, которые часто обнаруживаются у больных анорексией.
Наиболее интересной особенностью гормональной регуляции при нейрогенной анорексии считается обнаруженная у значительного числа пациенток с этим диагнозом аномально высокая концентрация в крови кахексина. Считается, что кахексии может вырабатываться мононук-леарами, адипоцитами и, возможно, опухолями глиально-го происхождения (см. клинический пример ниже).
Хотя при тяжелой нейрогенной анорексии наблюдается гиполептинемия, о роли лептина в патогенезе нейрогенной анорексии пока нет единого мнения (Черни-хова Е.А., 2000; Каландра С. с соавт., 2003).
В спинномозговой жидкости больных нейрогенной анорексией отмечается повышенная концентрация ап-петитподавляющего гормона холецистокинина. Так или иначе, но история изучения патогенеза заболевания показывает, что за психическими симптомами стоят вполне материальные патохимические механизмы, связанные преимущественно с патологией гипоталамуса.
Для нейрогенной анорексии характерна аменорея, обусловленная снижением лютеинизирющего и фол- ликулостимулирующего гормонов с утратой пульсирующего характера секреции лютеинизирующего гормона. Содержание тироксина незначительно снижено, содержание трийодтиронина резко снижено. Уровень кортизола повышен. Экскреция 17-КС снижена.
Изменения гипоталамуса при нервной анорексии вторичны по отношению к ней и к снижению массы тела. Несмотря на повышение уровня кортизола как общего, так и свободного, не бывает клиники гиперкортициз-ма. По-видимому, возникает тканевая резистентность к кортизолу. Избыток кортизола может играть роль в развитии остеопороза, при этом падает поглощение кальция и фосфатов (Коркина М.В., 1998). Повышение продукции гормона роста обусловлено резким уменьшением подвоза белков.
Повышается уровень тестостерона надпочечни-кового происхождения, что связывают с уменьшением жировой подкожной ткани, в которой происходит превращение андрогенов в эстрогены путем их ароматизации.
Стройной системы объяснения механизмов заболевания до сих пор не существует. Предполагается корти-ко-висцеральный патогенез с основным звеном участия гипоталамуса. При депрессии уровня катехоламинов (в частности, дофамина) его количество в гипоталамусе падает, из-за чего возникают функциональные нарушения гипоталамических центров с потерей аппетита. Антидепрессант амитриптилин повышает уровень норад- реналина в гипоталамусе и приводит больных с депрессией к повышению аппетита и веса.
Таким образом, причина нейрогенной анорексии— в нарушении гипоталамических центров регуляции аппетита, центров регуляции АКТГ-функции гипофиза.
Переход от убежденной сознательной редукции массы тела с помощью диеты к патологическому пубертатному истощению осуществляется незаметно. При этом определить границу, за которой начинается патологический процесс, невозможно. После того, как появляются другие характерные симптомы нейрогенной анорексии, психопатологическая ситуация настолько фиксирована, что вряд ли приходится надеяться на спонтанную ремиссию.
99
Более мягкой формой того же расстройства, что и нейрогенная анорексия, считается нейрогенная булимия. При булимии попытки сбросить вес не характеризуются той степенью самоотречения и фанатизма, как при анорексии. Поэтому через некоторое время соблюдения диеты следует эпизод «запойной еды», когда больные поглощают огромное количество пищи, причём совсем не относящейся к деликатесам. Рекордный уровень ежедневного потребления энергии при этом превышает 50 000 ккал в сутки! После такого пароксизма наступают раскаяние и попытки «очиститься», в том числе с помощью искусственной рвоты и применения слабительных средств и клизм.
Нейрогенная булимия была известна еще древнеримским авторам, оставившим нам описания симпоси-ев (в нынешнем звучании — симпозиумов), на которых объевшиеся пирующие, щекоча себе глотки павлиньими перьями, вызывали искусственную рвоту, после чего пиршество возобновлялось! Интересно, что пировавшие лежа участники симпосиев периодически укладывались на левый бок, так как уже в древности было известно, что в таком положении замедляется продукция желудочного сока, и аппетит снижается.
Среди современных завсегдатаев фуршетов и презентаций описан профессиональный синдром «социального едока», напоминающий мягкую форму булимии. Любил поесть небезызвестный шекспировский Фальстаф, в честь которого названа одна из форм мужского ожирения андроидного (яблочного) типа, которая возникает у кутил-мужчин зрелого возраста—ожирение Фальстафа.
С течением времени у больных нейрогенной булими-ей прогрессирует депрессия, при тяжелой булимии не менее 5-6 % из них предпринимают суицидальные попытки.
Развитию нейрогенной булимии способствуют наследственная предрасположенность и особенности семейного воспитания. В семьях, где существовал культ здоровой еды, а праздники содержали обильное застолье в качестве центрального момента, формируется отношение к еде как к источнику большого биологического и психического удовлетворения, как к чему-то выходящему за рамки обычного насыщения. Статистика указывает на повышение частоты булимии при таком семейном анамнезе.
Нейрогенная булимия связана с особенностями продукции эндогенных опиатов после акта еды. Указывается также на дефицит аппетитподавляющих регуляторов — серотонина и холецистокинина — в спинномозговой жидкости пациенток на высоте булими-ческого приступа. При нейрогенной булимии, в отличие от анорексии, продукция лютеинизирующего гормона в ответ на люлиберин и секреция пролактина повыше-
100
ны, половая функция более чем у половины больных cо-хранная. При нейрогенной булимии наиболее интересной особенностью гормональной регуляции может оказать-ся гиперпродукция нейропептида Y— стимулятора пи-щевого поведения (Фостер Д.У., 1994). В целом эта фор-ма расстройства пищевого поведения протекает более благоприятно, чем нейрогенная анорексия.
По-видимому, при нейрогенной анорексии пациента следуют избранной программе поведения, находясь в относительной гармонии с собой, а при нейрогенной бу-лимии — налицо конфликт поведенческих программ, порождающий психопатогенные последствия.
Клиника. Основные жалобы у больных нейрогенной анорексией — на слабость, обмороки.
Всегда присутствуют практически постоянные жа-лобы на боли в животе, зябкость. Нередко больные пред-почитают, чтобы пищу им готовил близкий родственник; Больные девушки часто страдают депрессией. Амено-рея—ведущий симптом, с которым девушки с анорек-сией чаще всего обращаются к врачу.
Симптоматика классическая: анорексия, падение массы тела, запоры, нарушения менструального цикла, рвота (обычно скрываемая). Она появляется тогда, когда масса тела снижается более чем на 25 % от исходной.
Клиника складывается из трех синдромов:
1) изменения психики с отказом от пищи;
2) изменения внутренних органов;
3) эндокринные и лабораторные изменения. Всегда налицо имеются вторичные проявления бел-
кового голодания — гипопротеинемия, анемия. Нарастает гипотермия. Злоупотребление слабительными и искусственной рвотой (втайне от окружающих!) после каждого приема пищи приводит к нарастанию истощения. Могут возникать голодные отеки, в основном — на нижних конечностях. Внешний вид таких больных представлен на рис. 40,41.
Практически всегда наблюдается желтушность кожных покровов, слизистых (кроме всегда голубых склер!), что обусловлено накоплением в организме растительных красителей — каротинов. Может наблюдаться тотальная алопеция. На теле обычно имеются пушковые волосы («лануго»).
На ЭКГ выявляется снижение амплитуды зубцов. Развивается гипотония. Нередки ортостатические коллапсы, нарушения ритма сердца, иногда при ультра-сонографии сердца обнаруживается пролапс митрального клапана, систолическая и диастолическая дисфункция желудочков. Сердечная недостаточность обусловлена в том числе дистрофией и деструкцией кар-диомиоцитов. В результате снижается толерантность к физической нагрузке, несмотря на явную внешнюю гиперреактивность.
У подавляющего большинства больных развивается анацидный гастрит, уменьшается объем желудка, поэтому прием пищи вызывает боль и чувство тяжести в животе. Практически у всех больных выявляются признаки спастического колита, проявляющегося мучительными запорами.
Повышается продукция алъдостерона, гормона роста при нормальном или даже повышенном уровне кортизола, при отсутствии нарушений со стороны оси «кортиколиберин-АКТГ-кортизол». Гипонатри-емия, гипокалиемия и гипохлоремия нарастают из-за рвоты и постоянного приема слабительных. Нередко появляется относительная гипогликемия.
Уменьшается продукция андрогенов и оволосение лобка. Значительной атрофии молочных желез не бывает.
Аменорея может быть как следствием гипотала-мических процессов, так и результатом недоедания. Гипоталамо-гипофизарные нарушения регуляции ова-риальной функции являются следствием первично-психического заболевания. Больные внешне напоминают картину вторичного гипогонадизма. Аменорея сохраняется все время, пока масса тела остается низкой. Иногда этому предшествует олигоменорея. Это сопровождается гипогонадизмом и гипогенитализ-мом. Яичники маленькие, гипотрофичные.
У юношей с нервной анорексией уменьшаются семенники.
В то же время они физически весьма активны и обычно весьма резистентны к седативным средствам.
Осложнения. На фоне значительного истощения может развиться вторичный пангипопитуитаризм. Похудание более чем на 50 % приводит к развитию кахексии. Возможен смертельный исход в коллапсе или в гипогликемии.
Внезапная смерть объясняется набуханием мозга и аритмией из-за электролитных изменений на уровне клеток. Несмотря на сокращение объема циркулирующей крови по отношению к массе тела, наступает ги-перволемия.
Всегда развиваются нарушения репродуктивности. В наших наблюдениях (Строев Ю.И. с соавт., 1997) все девушки с нервной анорексией имели аменорею.
Вместе с тем эпизоды рвоты приводят к эзофагиту, фарингиту, аспирационным бронхо-лёгочным нарушениям и даже к синдрому Маллори-Вейсса и тяжелым сердечным аритмиям, которые сами по себе могут привести к смертельному исходу.
Тотальный выраженный остеопороз может быть причиной компрессии грудных позвонков, переломов костей таза и др.
Имеется высокая подверженность острым инфекциям и даже сепсису. Инфекционный индекс при нервной анорексии составляет 4,6, а в контрольной группе—3,2.
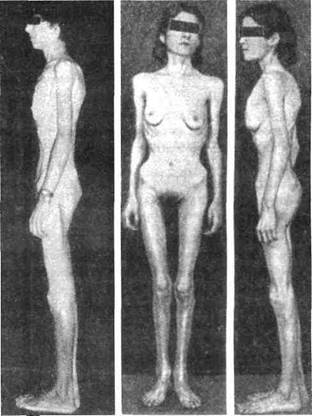
Рис.40. Нейроген- Рис. 41. Нейрогенная анорексия
ная анорексия у юноши у 18-летней девушки (по А. Гроллма-
(по А. Попову, 1968) ну, 1969)
Классификация. Выделяются следующие периоды нейрогенной анорексии: инициальный, аноректичес-кий, кахектический, реконвалесценции.
Первый период— это формирование дисморфома-нии (недовольство внешностью, стремление к коррекции недостатка). При втором периоде больные худеют на 20-50 %, что приводит их к настоящей кахексии с тяжелыми возможными последствиями. Изредка, при благоприятном исходе (выживание), наступает период реконвалесценции.
Диагностика. Основными диагностическими признаками нервной анорексии служат:
• Дизморфофобия, при которой больные воспринимают собственный вес как повышенный, собственные формы как неизящные и испытывают навязчивое стремление похудеть. Ощущение избыточной массы тела не проходит, а стремление похудеть не исчезает, несмотря на истощение.
• Аменорея (первичная или вторичная). Эндокринной основой этого симптома при нейрогенной анорексии является понижение продукции гонадотро- пинов гипофиза и инфантильная неотвечаемость аденогипофиза на гипоталамический люлиберин.
101
• Несмотря на то, что больные хотят есть, они отрицают или преуменьшают такие интерорецептивные ощущения, как голод, утомление, депрессию. Нередко это сопровождается ритуализованными упражнениями «for fitness». Характерной психологической особенностью жертв нервной анорексии является большая зависимость от мнений и оценок окружающих, а также отсутствие уверенности в себе. Внешний вид больных нередко включает проявления каротинемической ложной желтухи. На коже — пушковые волосы.
Все наблюдения отмечают значительное снижение концентрации Тз. Но при этом имеется нормальный уровень ТТГ. Реакция ТТГ на тиролиберин замедленная. В плазме крови повышен уровень холестерина, что объясняют снижением функции щитовидной железы. СТГ повышается, но симптомов гигантизма или акромегалии не бывает. Очевидно, падает продукция со-матомединов — посредников анаболического влияния СТГ, что, возможно, вызвано повышением в крови больных нейрогенной анорексией концентрации кортизола Критерии диагноза. Возникновение заболевания в периоде пубертата, достаточно высокий интеллект, демонстративный постоянный отказ от еды, выраженная потеря веса, аменорея, низкий основной обмен при отсутствии внешних признаков гипотироза или микседемы, нормальное оволосение лобка и подмышек, лануговид-ное оволосение преимущественно спины и лица являются важными признаками подкрепления диагноза.
Дифференциальный диагноз. У подростков нет ни одного первичного заболевания желез внутренней секреции, при котором истощение было бы ведущим симптомом. Поэтому, если у даже тучного подростка катастрофически падает вес, это во вех случаях следует рассматривать как довольно серьезный симптом.
Возникающие вторичные изменения гипоталамуса дают повод диагностировать несуществующую эндокринную патологию. Так, уже в дебюте нервной анорексии нормальная продукция ГЗТсопровождается значительным снижением в крови уровня трийодтиронина, что ведет к гиперлептинемии (Матарезе Дж. с соавт., 2003), повышается продукция СТГ, но без клиники гигантизма или акромегалии, нарастает продукция кортизо- ла и надпочечникового тестостерона, но без внешних признаков гиперкортицизма, что связано, по-видимому, с потерей чувствительности гормональных тканевых рецепторов к тройным гормонам.
Многие черты эндокринно-метаболической картины нейрогенной анорексии совпадают с типовыми изменениями, наблюдаемыми и при других формах голодания (в частности, нарушения тироидной и соматотропиновой регуляции). Однако при нейрогенной
102
анорексии продукция вазопрессина понижена, а не уве-личена, как при многих других формах голодания. Mо-лочные железы, даже если они атрофичные, все равно пальпаторно определяются. Нередко имеется аплас-тическая анемия.
При пангипопитуитаризме вес тела не падает так сильно, но работоспособность резко снижена, больные вялы, безынициативны. Кожа обычно алебастровой бледности, не загорает. Молочные железы пальпатор-но вообще не определяются. Нередко бывает аплас-тическая анемия.
Лица с анорексией обычно активны, оволосение при анорексии сохранено, при пангипопитуитаризме оно может исчезать. Высокая толерантность к инсулину при пангипопитуитаризме отсутствует.
При анорексии все эндокринные отклонения после восстановления веса нормализуются, а при пангипо-пититаризме требуется пожизненная заместительная гормональная терапия, отказ от которой приводит к смерти от вторичного хронического гипокортицизма.
Заболевание необходимо дифференцировать от ши-
зофрении с аноректическим синдромом, от депрес-сий, поэтому больных нейрогенной анорексией должен обязательно осматривать психиатр.
Лечение. Нейрогенная анорексия — прежде всего не только эндокринная, но и психиатрическая проблема. Поэтому при лечении таких больных целесообразно придерживаться следующих принципов:
1) изоляция в стационарных условиях с необще чием с окружающими и в особенности с родствен н инами;
2) прогрессивное увеличение пищевого режима
3) психотерапия.
Проводится комплексная терапия, направленная на нормализацию жизнедеятельности организма. Диети ческое лечение проводится крайне осторожно, на чиная с легко усвояемых продуктов, не предъявляющих к организму высоких требований при их усвоении (соки) Лечение должно проводиться психиатрами или по согла-сованию с ними. Можно добавлять седативные сред- ства, витамины, амитриптилин (с осторожностью!)] Иногда приходится кормить больных через зонд.
На первом этапе основное внимание уделяется коррекции нарушений сердечно-сосудистой системы. Особая осторожность требуется при внутривенных инфузиях, так как от дизэлектролитических нарушений может наступить летальный исход.
Вопрос о целесообразности коррекции гормональных сдвигов до сих пор не решен.
Инсулин, который традиционно, по старинке, вводи ся «для аппетита», нужно использовать крайне осторожно ввиду опасности внезапного развития у больных ней-
рогеннои анорексиеи летальной гипогликемическои комы.
Исходы заболевания и прогноз. Прогноз остается не вполне удовлетворительным.
Результаты лечения могут быть благоприятными, но они достигаются с большим трудом, в течение длительного времени и требуют от врача большого («ангельского») терпения. Не редки рецидивы, особенно у девушек-подростков после завершения периода созревания. Интересно, что при нейрогенной анорексии процент суицидальных попыток невысок (до 1%). В дальнейшем могут развиться тотальная гипофизарная недостаточность, а также шизофрения.
Длительные наблюдения показывают, что и нейро-генная анорексия, и нейрогенная булимия примерно в половине случаев упорно не поддаются терапии. Если и наступает выздоровление (у 64 % больных), то не ранее, чем через 10-12 лет после манифестации заболевания (Чазова Т.Е., 2000). Наступление и полное восстановление овуляций бывает всего у 36-84 % больных нейрогенной анорексиеи.
Число смертельных исходов колеблется от 2-3 % до 16-20 %. Причины летального исхода — сердечная и дыхательная недостаточность в результате тяжелой кахексии и дистрофии всех внутренних органов, инфекции, сепсиса, некроза кишечника, осложнений терапии. Примером может служить наше наблюдение. Больная Г., 19 лет (и/б № 2247), студентка III курса мединститута. Была обнаружена без сознания возле собственного дома. После внутривенного введения глюкозы пришла в себя и была доставлена в Мариинскую больницу Санкт-Петербурга. Больна с 11 лет. Наблюдалась с диагнозом «гипо-физарный нанизм». После нервного стресса (конфликты в семье) пропал аппетит, стала худеть. С диагнозом «нервная анорексия» в течение 2 лет лечилась в психиатрической клинике транквилизаторами, самостоятельно принимала пищу. В 17-летнем возрасте (костный возраст соответствовал 13 годам) обследовалась в эндокринологическом отделении ИАГ РАМН с диагнозом «гипофизарный нанизм», лечилась соматотропином.
Окончила школу, поступила в мединститут. Училась хорошо, охотно. На занятия ходила с трудом из-за слабости, с помощью однокурсников поднималась по лестнице, постоянно зябла (на кафедре патофизиологии ее усаживали поблизости от горячего сушильного шкафа). За 2 месяца до настоящей госпитализации вообще прекратила принимать обычную пищу, пила воду и всего полстакана сока в день.
Поступила в крайне тяжелом состоянии, заторможена. На вопросы едва отвечает, веки опущены. Выраженное истощение на грани кахексии. Кожа
бледная, умеренно влажная. Волосяной покров сохранен. Температура тела нормальная. Кожа и слизистые чистые. Явные признаки инфантилизма, но небольшие молочные железы с железистой тканью определяются. Коленные суставы несколько деформированы. Атрофия мышц. Пульс не прощупывается. АД— 60/20 мм рт.ст. Пульс — 110 уд./мин. Тоны сердца едва прослушиваются. Живот втянут, печень слегка увеличена.
Больная направлена в реанимационное отделение. Получала преднизолон, мезатон, сердечные гликозиды, витамины, аминокровин, препараты кальция. Пришла в себя, жаловалась на одышку.
В клиническом анализе крови: эр. — 4,0x10'2/л, гем. — 130 г/л, Ц.П. — 0,88, лейк. — 6,4x109/л, п. — 23 %, с. — 57%,э. — 1 %, л. ~ 15 %, м. — 4, СОЭ — 10 мм/ч. Моча — без патологии. Билирубин крови — 8,7 мМ/л, холестерин — 2,6 мМ/л, мочевина — 10, 3 мМ/л, креатинин — 66 мкМ/л, глюкоза — 2,8 мМ/л, кальций — 2,06 мМ/л, калий — 4,6 мМ/л.
В течение трех дней периодически впадала в забытье, пульс едва прощупывался. АД — 50/0 и 60/20 мм рт. ст. Состояние постепенно улучшалось, ста ла контактной. Жаловалась на головную боль, жаж ду, боли в животе. Пила кипяченую воду, разведенные виноградный и яблочный соки, затем — цельные в количестве 200-250 мл каждые 3 часа. Появились позывы на стул, который был скудным, но оформленным. Диурез — 400 мл. Заключение психиатра — не рвная анорексия как реакция на ситуацию (развод ро дителей), кахексия.
Состояние продолжало улучшаться. Обмороки исчезли. Стала активной, садится в постели. Гемодинамика стабилизировалась, но тоны сердца очень глухие, маятникообразные. Переведена в эндокринное отделение. Масса тела — 33 кг при росте 146 см (ИМТ— 1,55). На второй день пребывания в отделении внезапно потеряла сознание, появились признаки явной тетании («рука акушера», «конская стопа», «рыбий рот», напряжение брюшных мышц), которые купировались внутривенным введением 10 % кальция хлорида. В сознание не пришла. Вновь переведена в реанимационное отделение, где состояние расценено как агональное. Пульс и АД не определялись. После кардиостимуляции на ЭКГ—редкие комплексы. Несмотря на реанимационные мероприятия (ИВЛ, дефибрилляция и непрямой массаж: сердца), наступила смерть.
На аутопсии после тщательного изучения многочисленных препаратов гипофиза была выявлена опу холь, расцененная как микроаденома гипофиза, фа- рингиома. Обнаружены атрофия миокарда, печени и почек, гипоплазия матки, яичников и молочных же-
1
 лез, нерезко выраженная узелковая гиперплазия коры надпочечников при явлениях умеренного гирсутизма. По заключению патологоанатома (доц. Ю.В. Матвеев), весьма малые размеры опухоли делали диагноз микроаденомы гипофиза крайне затруднительным.
лез, нерезко выраженная узелковая гиперплазия коры надпочечников при явлениях умеренного гирсутизма. По заключению патологоанатома (доц. Ю.В. Матвеев), весьма малые размеры опухоли делали диагноз микроаденомы гипофиза крайне затруднительным.
Таким образом, у подростков с диагнозом «нервная анорексия» необходимо тщательное обследование головного мозга (КТ, МРТ), в частности, гипофиза, так как за этим диагнозом может скрываться серьезная органическая патология гипоталамо-гипофизарной области— опухоли.
Дифференциальная диагностика. Частая тщательная диссимуляция больными своего состояния, что приводит к постановке самых разных диагнозов, появление вторичных эндокринных нарушений дают повод для необоснованной терапии нейрогенной анорексии эндокринными препаратами.
Следует дифференцировать нейрогенную анорек-сию от органических причин истощения.
Гипоталамические опухоли — очень редкая причина истощения. Истощение встречается всего в 18 % случаев гипоталамических заболеваний.
Выраженной потерей массы тела могут сопровождаться болезнь Аддисона, гипертироз, гипопитуита- ризм, хронические интоксикации (фосфор, свинец, мышьях, окись углерода), хронические инфекции (туберкулез, бруцеллез, ВИЧ-инфекция), опухоли (в том числе при лечении цитостатиками), болезни желу дочно-кишечного тракта, клинические синдромы с истощением (прогерия, парциальная прогрессирующая липодистрофия, например, с исчезновением жировых комочков Бита при полной сохранности остальной клетчатки), генерализованная липодистрофия и лепреконизм (синдром Донохью или «синдром эльфа» — наследственная женская патология, характеризуется гипотрофией, маленьким лицом, увеличением молочных желез, клитора и малых половых губ, гипоплазией яичников и островкового аппарата поджелудочной железы, накоплением гликогена и железа в печени).
Нейрогенная анорексия отличается от первичного пангипопитуитаризма следующим — отсутствием преждевременного старения, сохранением вторичных половых признаков, отсутствием астении даже на этапе значительного истощения.
Зябкость, запоры, брадикардия, гипотония, бледная, сухая и холодная кожа, чувствительность к низкой температуре, потеря интереса к окружающему могут вызвать подозрение на гипотироз. Но при нейрогенной анорексии сохраняется гиперактивность (возможно, это реакция защиты против голода), какой не бывает при гипотирозе.
104
При первичном гипотирозе также не бывает потери веса, а уровень ТТГ— повышается.
При нейрогенной анорексии сохранены функциональные резервы гипофизарных гонадотропинов, чего не бывает при болезни Симмондса.
Профилактика. Если в процессе полового созревания масса подростка уменьшается, то это следует расценивать как симптом, внушающий опасение, даже если она вначале была увеличенной.
Многие полагают, что в происхождении нейрогенной анорексии важную роль играет предшествующая психогения — колкие замечания сверстников, преподавателей и родителей по поводу тучности подростков, частые разговоры окружающих взрослых о желании похудеть и пр.
Желательно оберегать подростков от вовлечения их в сомнительные компании, в религиозные секты, изнуряющие себя молитвами и постами и пр.
Нужно создавать в семье хороший моральный климат; взаимоуважение. Не следует посвящать подростка во все семейные неурядицы. Подростки тяжело переживают семейные раздоры, особенно развод родителей.
Не следует устраивать в доме культа еды и наоборот — культивировать бесконечные посты.
Диспансеризация. Диспансерная группа — Д-3.
Нейрогенная анорексия требует длительного (годами) наблюдения и лечения.
Длительная диспансеризация во многом определяется склонностью подростков с нейрогенной анорекси-ей к рецидивам, также требующим продолжительного наблюдения за больными, к тяжелым психическим заболеваниям (шизофрения), к суицидам.
Поэтому больные подростки нуждаются в постоянном наблюдении психоневрологом, психотерапевтом, эндокринологом, а также в периодических госпитализациях в эндокринологический стационар или в клинику неврозов.
Вопросы экспертизы. Группа здоровья — 4 или 5 в зависимости от состояния больного подростка и перспектив к выздоровлению.
Подростки с нейрогенной анорексией обычно сохраняют умственную и физическую работоспособность. Они интеллектуально развиты, могут выполнять привычную работу. Поэтому им показаны различные виды не тяжелого интеллектуального труда. Запрещается работа в предписанном темпе, с профессиональными вредностями, в ночную смену.
Они нуждаются в освобождении от занятий физической культурой. Показана лечебная гимнастика.
К призыву в армию юноши с такой патологией не годны. В военно-учебные заведения не принимаются,
Патофизиология надпочечных желез
Надпочечники — источник почти 60 стероидных, катехоламиновых и пептидных гормонов. Это единственные производители глюко- и минералокортико- идов, главные продуценты андрогенов в женском opгa-низме, основные источники половых стероидов перед периодом полового созревания, важнейшие эффекторы стресса—типового неспецифического нейроэндокрин-ного ответа организма на повреждение и угрозу гоме-остазу.
Они участвуют также в поставке прогестинов и эс трогенов, опиатов, в конверсии тироидных гормо нов. Вся человеческая жизнь — от появления на свет до предсмертной агонии — проходит под знаком высочайшей активности этих небольших органов, суммарный вес которых составляет всего лишь около 8 граммов. Не удивительно, что именно их гормоны нашли самое широкое клинико-фармакологическое применение.
Нарушения функций надпочечников очень распространены. Их суммарная частота превышает 1,5 % населения, а в некоторых регионах оказывается еще выше. Так, среди эскимосов Юпик одна только врожденная гиперплазия коры надпочечников, редкая у представителей других этносов, достигает частоты 1:280.
Патология надпочечников включает не только первичные приобретённые и наследственные нарушения, но и вторичные эндокринопатии вследствие расстройств регуляции роста и функций этих органов.
В данной книге подробное описание истории изучения, структуры и функции надпочечных желёз, а также спектра производимых ими гормонов, вопросы центральной регуляции функций надпочечников со стороны гипоталамо-гипофизарного нейросекретор-ного аппарата и вегетативной нервной системы, характеристика участия этих органов в стрессе — не освещаются. Они содержатся в ранее вышедшем руководстве (Зайчик А.Ш., Чурилов Л.П., 1999, 2001).
Ниже лишь кратко излагаются основные положения, существенные для клинической характеристики болезней надпочечников у подростков.
Надпочечники — органы, корковое вещество которых у взрослых состоит из клубочковой (минералокор-тикоидной), пучковой (глюкокортикоидной) и сетчатой (андрогенпродуцирующей) зон. У плода и новорожденного существует особая фетальная зона коры надпочечников, исчезающая к подростковому периоду. Моз-
говое вещество надпочечных желёз — параганглии, состоящий из катехоламин-продуцирующих хромаф-финных клеток.
Установлено, что надпочечник растёт внутрь — с центрипетальной миграцией клеток от капсулы к мозговому веществу. При этом его клетки видоизменяют свою функциональную программу и дифференцировоч-ные характеристики под действием секреторно-мито-генных стимуляторов.
Для клубочковой зоны такими основными стимуляторами служат ангиотензин //(частично возникающий в самом надпочечнике из печеночного ангио-тензиногена под влиянием местного и почечного ренина), а также АКТГ. Дополнительную роль играют калий-натриевое соотношение, липотропин, ме-ланоцитостимулирующий гормон и продукты эпифиза.
Для пучковой зоны эта роль безраздельно принадлежит АКТГ (адренокортикотропину).
Клетки сетчатой зоны находятся под сочетанным контролем АКТГ и — в более слабой степени — гона- дотропинов, пролактина и нейротензина.
Секреция мозгового вещества усиливается в ответ на симпатический нервный сигнал (от Th9-Th10) и, возможно, на некоторые нейропептиды (нейропептид У). Определённую роль играют местные ростовые ци-токины, особенно — фактор роста фибробластов (Шрейбер В. 1987).
Таким образом, главными гипоталамическими регуляторами надпочечников служат вазопрессин, кор- тиколиберин и ангиотензин, а аденогипофизарным — адренокортикотропин (АКТГ) (рис. 42).
Главный гипоталамо-гипофизарный путь стимуляции коры надпочечников предусматривает участие ад- ренокортикотропина (АКТГ), существование которого доказал П.Э. Смит (1926), а выделил в чистом виде П. Белл (1953).
Это — хорошо изученный полипептид (рис. 42). Он не имеет существенных видовых различий в своей биологически эссенциальной части (с 1 -го по 24-й аминокислотный остаток), в связи с чем.АКТГ животного происхождения действует у человека не менее, а иногда — даже более эффективно, чем гомологичный.
Все видовые различия относятся к пептиду с 25-й по 39-ю аминокислоту, который для действия на рецептор не обязателен (Панков Ю.А., 1976; Клонофф Д.К., Карам Дж.Х., 1998).
АКТГ и его взаимоотношения с ПОМК, а также биологические эффекты и основные закономерности секреции охарактеризованы во многих источниках (Зай чик А.Ш., Чурилов Л.П., 1999, 2001).
10
Секреция АКТГ стимулируется кортиколибери-ном и вазопрессином, а также ангиотензином //гипоталамуса, холинергическими и серотонинергичес-кими нейронами подбугорья, а ингибируется опиатами, ГАМК-эргическими нейронами, и— наиболее сильно — глюкокортикостероидами. Последние подавляют и продукцию кортиколиберина. Эффект отрицательной обратной связи носит двухфазный характер — процессинг и секреция АКТГ подавляется кортизолом через глюкокортикоидный рецептор I типа остро, в первые 10 минут, а затем наступает продлённая фаза подавления продукции всего ПОМК, растянутая на несколько часов и опосредованная через II тип глюкокортикоидных рецепторов.
АКТГ— короткоживущий гормон и уже через 10 ми-нут его концентрация в плазме снижается боле чем на-половину. Однако в кровь секретируется долгоживущий полипрогормон ПОМК, который может отщеплять АКТГ и другие пептиды впоследствии при его протео-лизе в надпочечниках.
Рецепторы АКТГ относятся к типичным представи-телям семейства, ассоциированого с G-белками. По Л.Д. Гаррену с соавт. (1971), немедленный пострецеп-торный механизм предусматривает активацию адени-латциклазы и спектра протеинкиназ А, фосфорилирую-щих белки — участники стероидогенеза.
Это позволяет достичь увеличения выброса и синтеза стероидных гормонов, обращаясь к трансляци-


| Ala | Алании | Leu | лейцин |
| Arg | Аргинин | Lys | Лизин |
| Asn | Аспарагин | Met | Метионин |
| Asp | Аспаргиновая к - та | Phe | Фенилаланин |
| Cys | Цистеин | Pro | Пролин |
| Gin | Глутамин | Ser | Серин |
| Glu | Глутаминовая к - та | Thr | Треонин |
| Giy | Глицин | Trp | Триптофан |
| His | Гистидин | Tyr | Тирозин |
| lie | Изолейцин | Val | Валин |
Рис. 42. Структура некоторых нсйрогормонов и нейропептидов, регулирующих функции надпочечников и других эндокринных клеток (по Ч. Наута с соавт.,1984)
106
онным и посттрансляционным механизмам в течение
нескольких минут после воздействия АКТГ на рецеп
тор.
По Р. Фариси с соавт. (1981), важным моментом служит активация фосфатидил-инозитоловых посредников и протеинкиназы С, ответственных за митоген-ное действие на клетки-мишени.
Наконец, А. Дазо с соавт. (1983) показали, что АКТГ опосредует свои отсроченные эффекты (проявляющиеся 2-4 ч спустя после рецепции) через ключевые белки стероидогенеза, дерепрессирующие транскрипцию определенных ферментов в адренокор-тикоцитах.
АКТГ очень сильно стимулирует выработку глю- кокортикоидов и андрогенов, а также умеренно стимулирует продукцию минералокортикоидов, уступая в этом первые роли ренин-ангиотензиновой систе ме.
Ангиотензин II — пептидный гормон ренин-ангио тензиновой системы — служит главным митогенным и секреторным стимулятором для клубочковой зоны коры надпочечников и выработки минералокортикоидов, Он может также стимулировать и продукцию глю-кокортикоидов, но гораздо слабее (Нассдорфер Г. Дж. с соавт. 1982).
Центральным звеном этой системы служит юкста-гло мерулярный аппарат почек (ЮГА) (рис. 43).
Ренин — гликопротеид, вырабатывается юкстагло-мерулярными клетками, лежащими вблизи плотного пятна (macula densa) в стенке афферентных и, в меньшей степени, эфферентных артериол клубочков почек (Бэкстер Дж., 1987; Рейд Я.А., 1998).
Эти клетки тесно связаны с АПУД-системой. Непосредственно они вырабатывают препроренин, который переходит в проренин, подвергающийся про-теолизу, вследствие чего в этих клетках и их паракрин-ном окружении, а также в плазме крови формируется ренин.
Переход проренина в ренин заторможен при ин-сулинозависимом сахарном диабете, что является результатом гликирования прогормона и приводит к нарушению почечного кровотока, способствующему диабетической нефропатии. Проренин продуцируется также в печени и мозге. Переход в вертикальное положение усиливает продукцию ренина. На этом основана ортостатическая проба, которая используется в дифференциальной диагностике артериальных гипертензий. Многие простагландины (в частности, Е2) усиливают секрецию ренина и ведут к гиперплазии ренинпродуцирующих клеток (синдром Бартте-
Ангиотензиноген — продуцируемый печенью гли-копротеидный препрогормон. Его синтез стимулируют глюкокортикоиды, эстрогены, тироидные гормоны и ангиотензин II . Беременность, некоторые заболевания печени, тиротоксикоз и гиперкортицизм протекают с выраженной гиперангиотензиногенемией.
Под влиянием ренина формируется ангиотензин I — прогормон, лишенный собственной биологической активности (рис. 43).
Ангиотензин I служит субстратом для фермента ди-пептидил-карбоксипептидазы, известного под условным названием «ангиотензин-конвертаза». Этот фермент эндотелиоцитов и плазмы имеется повсеместно, но наиболее активен на сосудистом ложе лёгких — важный участник протеолиза пептидных прогормонов и гормонов. Он превращает ангиотензин I в октапептидный гормон плазмы крови — ангиотензин II , первый из известных гормонов, не имеющий клетки-источника, а возникающий прямо в плазме.
Ингибиторы ангиотензинконвертазы (каптоприл и его многочисленные аналоги) вошли в широкую клиническую практику как средства против артериальной гипертензии.
Ангиотензин II— ключевой эффектор в рениновой системе.
Ангиотензин II— мощный вазоконстриктор (в десятки раз активнее нор адреналина. В почках ангиотензин II не только подавляет продукцию ренина, замыкая обратную связь, но и усиливает реабсорбцию натрия в проксимальных канальцах. Он вызывает сужение почечных сосудов. Ангиотензин II в мозге стимулирует центр жажды и является прямым дипсоге-ном — провокатором питьевого поведения. Через ангиотензинергические нейроны он усиливает продукцию вазопрессина в гипоталамусе, что способствует выработке АКТГ.
Ангиотензин II— служит тропным гормоном ми-нералокортикоидной зоны коры надпочечиков, что, как уже упоминалось, впервые доказано Г. Дж. Нассдор- фером с соавт. (1982).
Собственно ангиотензин //усиливает продукцию алъдостерона, действуя на несколько этапов: как ранних — конверсия холестерина в прегненолон, так и поздних — превращение кортикостерона в 18-гидро-ксикортикостерон (рис. 3). Кроме того, ангиотензин II способствует секреции минералокортикоидов, а для клеток клубочковой зоны он служит митогеном. В больших концентрациях он стимулирует и синтез глюкокор- тикоидов. Интересно, что и на гладкие миоциты сосудов этот гормон оказывает митогенное действие, а в кардиомиоцитах—способствует внутриклеточной гипертрофии.
107
 Рис. 43. Ренин-апгиотензин-альдостероновая система
Рис. 43. Ренин-апгиотензин-альдостероновая система
Время жизни этого гормона в кровотоке достаточно короткое — до 2 минут. При последовательном про-теолизе он дает ряд дериватов.
Среди них — продукт отщепления аспарагинового остатка аминопептидазой — гептапептид ангиотен- зин III . Он обладает слабой, сходной с предшественником, биологической активностью, также стимулируя и минералокортикоидный биосинтез, и чувство жажды. Его уровень у человека составляет до 20% от концентрации ангиотензина II .
Работа ренин-ангиотензиновой системы in vivo неотделима от регуляторных эффектов других вазоак-тивных пептидов — кининов и атриопептинов. Ки-ниновая система влияет на функции надпочечников незначительно, и ее эффект сводится к активации освобождения катехоламинов из мозгового вещества.
108
Атриопептины — важные тормозные регуляторы клубочковой зоны коры надпочечников. Они существенно влияют на минералокортикоидные реакции и поэтому нуждаются в кратком описании.
Так называемые секреторные кардиомиоциты предсердий, которые относят к нейроэндокринным клеткам, концентрируются в ушках предсердий, но присутствуют и в желудочках сердца. Эти клетки синтезируют пре-прогормон из 151 аминокислоты, из которого образуются атриопептии А (28 аминокислот) и атриопептин В (32 аминокислоты). Оба пептида имеют сходную циклическую часть (17 аминокислот), а также отходящие от нее короткую и длинную ветви (рис. 44). Атриопеп тииы убиквитарны и продуцируются также клетками АПУД-системы лёгких и нейроэндокриноцитами центральной нервной системы и вегетативных ганглиев.
В настоящее время считается (Кумар П., Кларк М.,
2002), что в предсердиях выделяется главным образом мозговой натрийуретический фактор (атриопеп тин В). Секреторные кардиомиоциты предсердий и желудочков способны также выделять предсердный натрийуретический фактор (атриопептин А) и небольшие количества атриопептина С, высокой продукцией которого отличается головной мозг.
В мозге преобладает атриопептин С (22 аминокислоты, цикл и одна нециклическая ветвь), но выделяется и атриопептин В. Тем не менее во многих источниках атриопептины рассматриваются как гормоны сердца—воплощение его давно предполагавшихся и, наконец, описанных эндокринных функций.
Атриопептины блокируют действие ренин-ан- гиотензиновой системы, увеличивают диурез, прес-сорную натрийуретическую реакцию почек и вызывают вазодилатацию, всем этим способствуя снижению нагрузки на сердце. Установлено повышение секреции атриопептинов, особенно мозгового натрийуретического фактора, при перегрузке сер-щца, главным образом, дополнительным объемом крови. Перерастяжение предсердий наиболее сильно стимулирует секреторные кардиомиоциты.
Секреция атриопептинов возрастает при гиперво-лемии, при переходе в горизонтальное положение, при физических усилиях и при солевой нагрузке. Интересно, что механизм стимуляции атриопептиногенеза растяжением миокарда не требует участия рефлексов (Нидлмен Ф., 1987).
Глюкокортикоиды, алъдостерон и вазопрессин усиливают секрецию атриопептинов. Их уровень растет также при сердечной и почечной недостаточности. Атриопептины сильно подавляют функцию ренин-ангиотензин-альдостероновой системы, уменьшая секрецию ренина и альдостерона, а также снижают продукцию АДГ. Атриопептины действуют на особые рецепторы трех типов — ANPA-С, представляющие собой трансмембранную гуанилатциклазу (см. выше). Стимуляция этого энзима повышает уровень ц-ГМФ и снижает количество кальция в цитозо-ле клеток-мишеней. Затем гормоны подвергаются эндоцитозу. В минералокортикоидной зоне коры надпочечников представлены атриопептиновые рецепторы, непосредственно угнетающие продукцию альдо стерона.
Атриопептины оказывают сосудорасширяющий и гипотензивный эффекты, снижают реабсорбцию и увеличивают фильтрацию натрия в почках. Поэтому они являются основными эффекторами при реализа-
Рис. 44. Структура атриопептинов у человека (но Я. А. Рейду. 1998)
ции важнейшего физиологического механизма — прессорного натрийуреза, предохраняющего от перехода острых гипертензий в хронические. При повышении кровяного давления, как установлено А. Гай- тоном (1989), почки усиливают экскрецию натрия и воды, что обеспечивает мощную долговременную стабилизирующую реакцию в отношении артериального кровяного давления.
Данная реакция требует одновременно усиления действия атриопептинового и ослабления влияния ренин-ан-гиотензинового звена пептидной регуляции объёма внеклеточной жидкости. На фоне высокого уровня активного ренина она осуществиться не может. Таким образом, данные гормоны предохраняют организм от перегрузки жидкостью и солью, препятствуют артериальной гипертензий и развитию застойной сердечной недостаточности.
109
Эффект атриопептинов — не только периферический. Обнаружены нейроны, чувствительные к ат риопептину, в гипоталамусе — в прилегающей ко дну III желудочка передневентральной части перивентри-кулярного ядра. Эта область гипоталамуса связана с регуляцией кровяного давления и водно-солевого го-меостаза (см. выше).
Есть указания на продукцию в наружной субкапсу-лярной части минералокортикоидной зоны коры надпочечников неидентифицированных натрийуретических стероидов антиальдостеронового действия, связанных с атриопептинами (ДеВарденер Х.Э., Кларк-сон Э.М., 1985). Ставится вопрос о существовании естественных лигандов уабаиновых и дигоксиновых рецепторов, которые обладали бы натрийуретическим действием за счет блокирования калий-натриевого насоса, либо антинаперстяночным действием (Шрайбер В., 1987). Этим гипотетическим соединениям отводят важную роль даже в сенсибилизации сосудов к прессор-ным воздействиям при недостаточном прессорном натрийурезе, что свойственно эссенциальной ги-пертензии (Нидлмен Ф., 1987). Но их строение и источник неизвестны, хотя они отождествляются некоторыми авторами с предполагаемыми антиальдо-стероновыми кортикостероидами, а другими — с уже известными минералокортикоидами. Если такие на-трийуретические вазоконстрикторные агенты будут найдены, то речь пойдет еще об одном модуляторе эффектов ренин-ангиотензин-атриопептиновых взаимодействий.
Повышение активности ренин-ангиотензин-альдо-стероновой системы и снижение эффективности ат-риопептиновых контррегуляторных механизмов считаются ключевыми в патогенезе всех видов системных отёков. Оно приводит к вторичному ги-пералъдостеронизму. Нарушениям регуляции ренин-ангиотензин-альдостероновых механизмов и связанной с ними атриопептиновой и кининовой регуляции придают большое значение в патогенезе артериальных гипертензий и сердечной недостаточности.
В дополнение к схеме стероидогенеза в надпочечниках, представленной выше, приводим краткую цитофизиологическую схему их продукции (рис. 45), отражающую локализацию и ферментативное обеспечение основных этапов биосинтеза кортикоидов.
Гормоны коры надпочечников выполняют разные, но частично перекрывающиеся биологические функции. Удаление надпочечников смертельно, однако при введении минералокортикоидов адреналэктомиро-ванным животным последние избегают острой гибели
110
и живут в условиях глубоких метаболических рас стройств и пониженной стрессоустойчивости.
Минералокортикоиды — в основном альдосте- рон и дезоксикортикостерон — важнейшие регуля-торы калий-натриевого гомеостаза и объема внеклеточной жидкости. Их действие адресовано главным образом почкам и тесно увязано с функцией ренин-ан гиотензиновой и атриопептиновой систем.
Минералокортикоиды выраженно действуют так же на желудочно-кишечный тракт, на потовые и слюн ные железы.
Во всех клетках-мишенях они адресуют свое отсроченное действие цитозольному минералокрортикоид-ному рецептору (он же — глюкокортикоидный рецептор I типа), который обеспечивает их проникновение в ядро и дерепрессию определённых генетических программ. Этот рецептор связывает альдостерон в 100 раз активнее, чем кортизол.
Под действием этих эффекторов клетки собира-тельных трубок и соединительного сегмента нефро-на начинают активно захватывать натрий и обмени-вать его на калий и водород. Следовательно, при наличии натрия в фильтрате почек пропорционально его доступности альдостерон и его аналоги будут осуществлять задержку натрия и воды, способствовать экскреции калия и подкислению мочи. Если натрия в первичной моче мало, эффективность этих процессов минимальна.
Ренин и ангиотензин, делая натрий доступным для обменного транспорта, создают условия для эффективной альдостероновой регуляции, а не просто повышают концентрации алъдостерона. Атриопептин служит неконкурентным антагонистом алъдостеро на. Потеря калия и водорода и задержка натрия происходят под влиянием гормонов также в потовых и слюнных железах, в тонком и толстом кишечнике.
Большое значение имеют эффекты минералокор- тикоидов за пределами почек. Установлено, что у этих гормонов имеются быстрые эффекты, не связанные ни с цитозольным рецептором, ни с модуляцией транскрипции. Как и предсказывает принцип Г. Рас-муссена (см. выше), ранние эффекты минералокор- тикоидов связаны с их прямым действием на плазматические мембраны клеток, их водород-натриевый противопереносчик и фосфатидил-инозитоловые посредники.
Даже минимальные концентрации алъдостерона на протяжении 1 -2 минут активируют данную транспортную систему, что ведет к задержке ионов натрия и потере протонов и ионов калия всеми исследованными клетками, даже теми, где ядерные механизмы
|
|
Рис. 45. Цитофизиологическис перемещения и биохимические превращения при биосинтезе кортикостероидов (по В. И. Кандрору, 1991)
действия минералокортикоидов неактуальны (например, лейкоцитами и миоцитами, мозгом и плацентой). Эти эффекты влияют на объём клеток, на их чувствительность к другим гормонам, на системный водно-солевой и кислотно-основной обмены, на выделение и всасывание ионов в желудочно-кишечном тракте, потовых железах, на акклиматизацию к жаре и т.д.
Расстройства секреции минералокортикоидов известны в форме гипоальдостеронизма и в форме ги- перальдостеронизма. И тот, и другой синдромы могут быть результатом надпочечниковых поражений (первичные формы) и нарушений экстранадпочечниковой регуляции (вторичные формы).
Глюкокортикоиды (у человека прежде всего кор- тизол, и в меньшей степени — кортикостерон и кор тизон) — гормоны универсального метаболического действия, основные эффекторы стресса и контринсу-лярные регуляторы, биорегуляторы, сдерживающие воспаление и иммунный ответ в рамках ортофлогоза и предупреждающие шок. В малых и средних количествах они действую на глюкокортикоидный рецептор II типа, а в больших концентрациях — через рецептор I типа — оказывают и некоторый минералокортикоид-ный эффект.
Подчеркнем, что в большинстве тканей (кроме печени) глюкокортикоиды способствуют катаболизму белков и липидов, понижают использование глюкозы в
111

тех клетках, которые имеют лишь инсулинзависимые глюкозные транспортёры. Этим определяется их дисси-миляторное действие. Одновременно в печени они стимулируют синтез глюкозы и гликогена, захват аминокислот, синтез ряда белков и использование жирных кислот. В органах с инсулиннезависимыми транспортёрами глюкозы (например, в центральной нервной системе, сердце и диафрагмальной мышце) глюкокортико иды увеличивают потребление глюкозы (рис. 46). Глюкокортикоиды — пермиссивные регуляторы экспрессии рецепторов многих других гормонов. Они влияют на скорость апоптоза в лимфоидных и других клетках. При повышении продукции глюкокортикоидов развивается гиперкортицизм. Он может быть как первичным, надпочечниковым, так и вторичным — при аномалии регуляции глюкокортикостероидогенеза. Так как АКТГ и другие регуляторы совместно активируют продукцию глюко-иминералокортикоидов, при гипер-кортицизме нередко имеются и черты гипералъдосте- ронизма. Первичная недостаточность функций коры надпочечников или отсутствие должной стимуляции со |
стороны ее регуляторов могут соответственно обусло-вить первичный или вторичный гипокортицизм.
После попадания в кровь и глюко- и минералокор-тикоиды связываются белком транскортином, а-гло-булиновым белком печёночого происхождения. Его продукция усиливается при гиперэстрогенизме, бере-менности, гипертирозе, при сахарном диабете. Существует наследственная аномалия, проявляющаяся в аутосомно-рецессивном усилении продукции транскор-тина.
Все эти состояния характеризуются повышенным свя-зыванием кортикостероидов. При подобных ситуациях происходит уменьшение фракции активного свободного кортизола, что влечёт за собой активацию продукции АКТГ. Нормокортицизм устанавливается при повышенном уровне неактивного связанного кортизола.
 Гипотироз, печёночная недостаточность и нефроти-ческий синдром ведут к понижению уровня транскор-тина. Он понижен при миеломной болезни Рустицко- го-Калера и при семейном наследственном дефиците этого глобулина. За счет действия центрального cep-вомеханизма во всех этих случаях устанавливается нормокортицизм с пониженным резервом неактивно- го кортизола в крови.
Гипотироз, печёночная недостаточность и нефроти-ческий синдром ведут к понижению уровня транскор-тина. Он понижен при миеломной болезни Рустицко- го-Калера и при семейном наследственном дефиците этого глобулина. За счет действия центрального cep-вомеханизма во всех этих случаях устанавливается нормокортицизм с пониженным резервом неактивно- го кортизола в крови.
Кортизол связывается транскортином активнее других глюкокортикоидов и имеет большее время полу выведения из плазмы крови — 1-1,51 часа, против 45 минут — у кортикостерона. Только 10% плазменных глюкокортикоидов сво-бодны и метаболически активны.
Минералокортикоиды связываются не толь-ко транскортином, но и альбумином менее актив-но, чем глюкокортикоиды. Поэтому более 30°/о общего их содержания в плазме представлено свободными гормонами. Понижение продукции альбумина и транскортина при печёночной недо-статочности и голодании, их потеря при нефро-тическом синдроме косвенно способствуют вто- ричному гиперальдостеронизму с системным отёчным синдромом.
| Рис. 46. Биологические эффекты глюкокортикоидов (по Н. А. Юдаеву, 1976) 112 |
Время полувыведения алъдостерона — 20-30 минут. Как глюкокортикоиды, так и минерал локортикоиды инактивируются в печени путём образования водорастворимых парных соедине-ний — глюкуронидов и сульфатов, а затем экск-ретируются с мочой и желчью. Свободные кор-тикостероиды составляют не более 1% суточной экскреции. Печеночная недостаточность, голода-ние, кахексия различной этиологии и гипотироз замедляют их инактивацию, что имеет значение при этих состояниях для поддержания гиперальдос- теронизма и относительного гиперкортициз- ма.
Андрогены сетчатой зоны (андростендион, де-гидроэпиандростендион и его сульфат, а также самый активный из них, хотя и секретируемый в наименьших количествах андроген — тестостерон) участвуют в регуляции половых функций, стрессе и контроле анаболических процессов. У мужчин их образование при стрессе существенно для наиболее эффективной психологической и метаболической адаптации, а также для уменьшения негативных последствий дистресса. У лиц обоего пола они влияют на формирование либидо. К тому же у женщин надпочечники — это единственный источник андрогенов, необходимых для оптимального развития клитора, что связано с возможностью испытывать оргазм. Выше уже шла речь о механизмах стимуляции их продукции. Они секретируются в свободном виде и лишь незначительно связываются с альбумином. Конверсия этих гормонов идет не только путем образования парных соединений в печени, но и в тканях-мишенях, где они метаболизируются в более активные тестостерон и дегидротестостерон. Плацента и жировая ткань, особенно локализованная в гиноидных зонах, способны превращать андрогены в эстрогены.
Нарушения секреции андрогенов могут сопровождать расстройства продукции других кортикостерои-дов (например, при тотальном гиперкортицизме, при синдроме Иценко-Кушинга). Однако возможны и изолированные нарушения их секреции, в частности, над-почечниковый гиперандрогенизм при некоторых опухолях и врождённой гиперплазии коры надпочечников. Эти нарушения известны под собирательным названием «адреногенитальные синдромы».
Катехоламины мозгового вещества — адреналин, норадреналин и дофамин — весьма существенные компоненты обеспечения острого ответа организма на повреждение. Они — участники регуляции гемодинамики. Кроме того, путем процессирования проопиомеланокортина в корковом и мозговом веществе надпочечника образуются опиатные пептиды, прежде всего энкефалины, что необходимо в фазу физиологического выхода из стресса (Зайчик А.Ш., Чу- рилов Л.П., 1999, 2001). Известны гормонообразую-щие опухоли мозгового вещества надпочечников, нарушающие баланс адреномедуллярных гормонов.
Таким образом, всё разнообразие патологии надпочечников можно условно подразделить на состояния, характеризующиеся гиперадренизмом и гипоадре-низмом. Оба синдрома могут быть тотальными, то есть предусматривающими уменьшение выработки гормонов всех функциональных частей надпочечников,
и парциальными — сводящимися к избирательной недостаточности функции какой-либо части. Термин «тотальный гиперадренизм» неупотребителен в европейских источниках, поскольку фактически этот синдром представляет собой скорее гиперкортицизм и относится к гиперфункции только коры надпочечников. Тотальный гипоадренизм, напротив, известен и в виде гипокортицизма, и в форме, затрагивающей секрецию как коркового, так и мозгового веществ (например, при апоплексии надпочечников — синдро ме Уотерхауза-Фридериксена). Отметим, что из-за универсальной роли АКТГ как стимулятора адренокор-тикоцитов всех трёх зон гиперкортицизм не является только гиперглюкокортицизмом. Тотальный гиперкор тицизм включает, как правило, более или менее выраженные симптомы как гипералъдостеронизма, так и гиперандрогенизма.
Парциальные формы гиперфункции коркового вещества надпочечников предусматривают резкое преобладание гиперсекреции и эффектов какой-либо из групп кортикостероидов. Фактически чисто парциальных форм по существу нет, так как и эффекты гормонов, и действие стимуляторов их продукции перекрываются. Выше уже шла речь о глюкостеромах, вырабатывающих избыток глюкокортикоидов. Хотя формально это вызывает, казалось бы, парциальный гиперкортицизм, у больных на практике отмечаются, как правило, и минералокортико-идные, и андрогенные эффекты.
Тем не менее можно выделить состояния с преобладанием гиперактивности тех или иных зон коры надпочечников или гиперсекреции какой-либо группы кор-тикоидов. Интерес среди них в первую очередь представляет гипералъдостеронизм.
Выделяют первичный альдостеронизм, вызванный избыточной, нерегулируемой секрецией минералокорти-коидов в коре надпочечников, а также вторичный, то есть вызванный чрезмерной ренин-ангиотензиновой стимуляцией.
Кроме истинного гипералъдостеронизма существует и ложный — псевдогипералъдостеронизм. Он развивается при употреблении в пищу избытка солодки (лакрицы), которая содержит ингибитор 11-в-гидрокси-лазы—глицирризиниевую кислоту. У лиц, жующих табак и употребляющих леденцы с лакрицей, а также у энтузиастов траволечения превращение кортизола в кортизон при передозировке солодки тормозится, и избыток первого оказывает альдостероноподобное действие. Воспроизводятся клинические признаки альдос-теронизма.
Аналогичный ферментативный дефект бывает при гипертензивной форме врожденной наследственной ги-
113
перплазии коры надпочечников, вызванной дефектом 11-в-гидроксилазы.
Псевдогипералъдостеронизм также воспроизводится при синдроме Лиддля — первичной гиперчувствительности к альдостерону, когда при нормальном уровне минералокортикоидов наступают гипокали-емия, артериальная гипертензия и гипоренинемия.
Экзогенный альдостеронизм может быть также ятрогенным результатом введения минералокортико идов, которые иногда входят в состав некоторых назальных капель и аэрозолей.
При всех формах первичного альдостеронизма и при псевдоалъдостеронизме имеет место низкая активность ренина. Продукция ренина тормозится за счет активации рецепторов растяжения избыточным объёмом внеклеточной жидкости и повышенным давлением, создающимися при превышении (адекватного уровня альдостерона.
Вторичный гиперальдостеронизм, распространенный во много раз больше, чем первичный, протекает с высоким уровнм ренина (это иногда обозначают звучным термином —ренинизм) и активной ренин-ангио-тензиновой стимуляцией минералокортикоидного стеро-идогенеза. Данная форма гиперальдостеронизма создается в нескольких ситуациях:
• При ишемии почек, вызванной атеросклерозом и артериосклерозом бассейна почечных артерий, что обычно связано с хроническими гипертензи-ями, диабетическим гломерулосклерозом (синд ром Киммельстиля-Уилсона) и т.д.
• При снижении объёма внутрисосудистой жидкости (застойная сердечная недостаточность, нефротичес-кий синдром, хроническая печёночная недостаточность, голодание, другие гипопротеинемические со-стояния,передозировкамочегонных и слабительных).
• При гипонатриемии и усиленных потерях натрия (хроническая почечная недостаточность, почечный канальцевый ацидоз).
• При первичной гиперплазии юкста-гломеруляр-ного аппарата (синдром Барттера, избыток про-стагландина Е2).
• При рениномах — опухолях, секретирующих ре-нин автономно (юкстагломерулярной и редко — овариальной локализации). Эта форма иногда обозначается как синдром первичного ренинизма (ШрайберВ., 1987).
• При беременности, так как эстрогены стиму
лируют продукцию ангиотензиногена и ренина,
а прогестины снижают эффективность действия
альдостерона («физиологический вторичный
гиперальдостеронизм»).
114
При вторичном гипералъдостеронизме в адре-ногломерулокортикоцитах наблюдаются признаки ги-персекреции и гипертрофии-гиперплазии, однако опу-холь или проявления нодулярной гиперплазии отсутствуют. Уровень альдостерона при вторичном гипералъдостеронизме выше, чем при первичном Типичны выраженная задержка натрия и воды, сис-темные отёки.
В подростковом периоде актуален первичный аль- достеронизм, который проявляется достаточно ранее Ниже приводится его подробное обсуждение.
Вопросы вторичного гиперальдостеронизма как синдрома, широко распространенного в основном у взрослых и пожилых пациентов, в данной книге зат-ронуты только в дифференциально-диагностическим целях.
Основные заболевания
надпочечников в подростковом периоде
Ниже вначале рассматриваются заболевания, харак-теризующиеся нарушениями функций коры надпочечни ков, а затем — важнейшие заболевания мозговом вещества надпочечников у подростков. При этом заболевания, протекающие с парциальной, мозаичной и тотальной гиперпродукцией соответствующих гормонов. описаны в первую, а протекающие с их гипопродукци-ей — во вторую очередь.
Дата: 2019-02-02, просмотров: 478.