Определение. Острая недостаточность надпочеч-ников — это угрожающее жизни состояние в результа-те быстро наступающих снижения или полного прекра-щения всех функций коркового и мозгового вещества надпочечников.
Синонимы: острая адреналовая недостаточность, острый гипокортицизм, острый гипоадренализм, гипоад-реналовый криз, аддисоновый криз, молниеносная пурпура (purpura fulminans), синдром Уотерхауза-Фридерик-сена.
Распространенность. Острая недостаточность надпочечников может возникать в любом возрасте, но чаще — у детей и у рожениц. Половых различий в частоте патологии нет. У подростков наблюдается редко, в основном при менингококковом или стрептококковом сепсисах.
Этиология и патогенез. Острая недостаточность надпочечников (синдром Уотерхауза-Фридериксена) чаще всего представляет собой внезапное резкое снижение функции надпочечников вследствие разрушения их коркового и мозгового веществ. Наиболее часто она возникает в ходе синдрома диссеминированного внут-рисосудистогсвёртывания-тромбообразования.
Причиной тромбозов, инфарктов и апоплексии надпочечников служит активация тромбогенных свойств их эндотелия циркулирующими цитокинами при системном действии медиаторов воспаления, характерном для сепсиса и токсико-септического шока.
Большое значение в генезе синдрома имеют генерализованные инфекции с бактериемией и вирусемией на фоне наследственных дефектов системы комплемента и других причин иммунодефицита. Наиболее часто синдром является осложнением менингококко-вого сепсиса. Отмечены его случаи также при стрептококковой инфекции, при гриппе и в дебюте тяжёлого полиомиелита, при гематогенном диссеминированном туберкулезе, а при резко сниженном иммунитете острое поражение надпочечников может вызывать генерализованная синегнойная и даже цитомегаловирусная инфекции.
Механизм поражения имеет много общего с экспериментально получаемой на животных аллергоидной (псевдоаллергической) реакцией на липополисахари-ды— феноменом Санарелли-Шварцмана.
При этих состояниях эндотоксины бактерий и ци-токины иммунной системы вызывают экспрессию дополнительных рецепторов цитокинов и молекул клеточной адгезии на поверхности эндотелия сосудов ряда органов, в том числе — надпочечников. При волнах бактериемии провоцируется активация сторожевой полисистемы плазмы, включая кинины и свёртывание, а также фибринолиз и комплемент, что и ведёт к региональному или системному ДВС-синдрому, захватывающему сосуды надпочечников. В результате надпочечники могут превращаться буквально в заполненные свернувшейся кровью мешочки.
Неифекционные факторы, способствующие синдрому —травма (в том числе, родовая), тяжелые длительные стрессы при продолжительных хирургических вмешательствах, ранениях, ожоговой болезни, родах. Синдром может осложнять геморрагические диатезы, острую и хроническую лучевую болезнь.
Проявления синдрома практически идентичны тяжёлому аддисонову кризу (см. ниже). Артериальная ги-потензия и гипогликемия бывают по обыкновению очень сильно выраженными. На клиническую картину наслаиваются симптомы тромбо-геморрагического синдрома (например, петехии и даже выраженные подкожные
кровоизлияния, что позволило назвать этот синдром молниеносной пурпурой), а также симптомы основного заболевания (например, менингеальные явления, лихорадка и др.).
Для этой формы синдрома бывает достаточно ге-моррагическо-некротических изменений даже в одном надпочечнике при частичной сохранности второго.
Острая недостаточность надпочечников, сходная с классическим синдромом Уотерхауза-Фридериксена, может наступать и в результате адреналэктомии, при острой декомпенсации хронической недостаточности коры надпочечников, при внезапной отмене продолжительной глюкокортикоидной терапии.
При этом возникает острое нарушение процессов адаптации и всех видов обмена.
Острое прекращение продукции глюко- и минера- локортикоидов приводит к внезапному снижению в крови уровней натрия, хлоридов, глюкозы, к угрожающему повышению концентрации калия, к падению артериального давления, коллапсу и шоку.
В результате развиваются ацидоз, выраженная гипогликемия, эксикоз, олигурия и анурия. Клиническая картина обычно развертывается быстро (за 1-2 часа), иногда — несколько медленнее (за сутки).
Клиника. Клиника может варьировать при различной этиологии. Возникают головная боль, боли в животе с тошнотой, рвотой, судороги.
Состояние сразу тяжелое — с интоксикацией и лихорадкой до 41,5 °С, одышкой, цианозом, возбуждением, бредом, реже — с адинамией и астенизацией. Кожа сухая, тургор ее понижен, появляются геморрагические высыпания звездчатого характера, которые обычно нарастают снизу вверх — конечности, мошонка, спина — с тенденцией к слиянию (рис. 49).
Возможны менингеальные признаки. Появляются симптомы гипогликемии. Развивается прострация, при этом артериальное давление вообще может не определяться. В результате коллапса и шока нередко наступает молниеносная смерть.
Осложнения. Течение заболевания всегда тяжелое или крайне тяжелое. При инфекционно-септической и травматической этиологии доминируют проявления системного действия медиаторов воспаления, обусловливающие шок.
Бывает кетоацидоз (при гипогликемии!). Могут развиться высочайшая гипертермия с дегидратацией, острая почечная недостаточность, необратимый коллапс, далее — смешанная по этиологии кома, что является причиной летальных исходов.
Классификация. Различают следующие клинические варианты острой недостаточности надпочечников:
135

Рис. 49. Синдром Уотерхауза-Фридериксена (по Ф. Неттеру, СIВА)
— сердечно-сосудистый (с преобладанием артериальной гипотонии, коллапса и шока);
— желудочно-кишечный (диспепсия и боли в животе);
— нервно-психический (бред, зрительные галлюцинации, астения, депрессия).
Диагностика. Отсутствие в рядовых медицинских учреждениях возможностей экстренного исследования в крови кортикостероидов существенно затрудняет диагностику острой недостаточности надпочечников. Патогномоничных симптомов заболевания, кроме звёздчатой геморрагической сыпи на коже, нет (да и геморрагии в зависимости от этиологии синдрома наблюдаются не всегда).
Всегда важен анамнез: предшествующие инфекции или контакты с инфекциями (эпидемический менингит, грипп), травмы и ушибы (особенно поясничной области), ожоги, затянувшиеся операции, облучение, хроническая недостаточность коры надпочечников (аддисо-нова болезнь). Нередко провоцирующий фактор установить невозможно.
В крови обнаруживаются умеренный нейтрофиль-ный лейкоцитоз, эозинофилия, тромбоцитопения, снижение уровней натрия и хлоридов, глюкозы, повышение
136
показателей калия, мочевины, креатинина, гематокрита
и СОЭ.
В моче появляются белок, лейкоциты, эритроциты и цилиндры, кетоновые тела (несмотря на гипоглике-мию).
ЭКГ отличается низким вольтажом, удлинением интервала QT, высокими и острыми зубцами Т. Арте-риальное давление всегда снижается в различной, но выраженной степени (вплоть до нуля), что всегда весь-ма подозрительно на острую патологию надпочечни-ков.
Критерии диагноза. Общие клинические призна-ки этой патологии — острая сердечно-сосудистая не-достаточность, коллапс, абдоминальный синдром (без симптомов раздражения брюшины), геморрагии в кожу и слизистые.
В диагностике ориентируются в основном на разви- тие коллапса и шока. Важно срочное исследование на-трия и калия в крови и определение их соотношения (величина Na/K падает до 20 и ниже), определение в крови уровня глюкозы (падает).
Наблюдается типичная для гипокортицизма эози- нофилия (более 50 в 1 мкл крови).
При наличии технических возможностей необходи-мо срочное исследование крови на содержание корти- зола и альдостерона. Даже поздние результаты ана-лизов крови на кортикостероиды очень важны для понимания причин гибели подростка при неясном ди-агнозе.
У подростков с аддисоновой болезнью в анамне-зе диагностика несравненно проще; острая недостаточ-ность надпочечников при аддисоновом кризе (гипохло- ремической коме) нарастает, к счастью, не так быстро, с клиникой прекомы, что упрощает проведение диагно- стических процедур.
Пример диагноза. Эпидемический менингит. Me- нингококковый сепсис. Кровоизлияние в надпочечни- ки. Острая недостаточность надпочечников. Коллапс. Геморрагии в области нижних конечностей, груди и живота.
Дифференциальный диагноз. Сходные симптомы возможны при системных аллергоидных реакциях, вызванных разными суперантигенами.
Поэтому исключают пищевую токсикоинфекцию, синдром стафилококкового токсического шока, токсический вариант плевропневмонии, токсико- дермии (синдром Лайелла-Стивенса-Джонсона), геморрагические диатезы (болезнь Шенляйн-Гено-ха, тяжелая цинга).
Проводят дифференциальную диагностику кома- тозных состояний.
Нужно помнить о возможности интоксикаций (наркотики, алкоголь, никотин), травм, ранений, а у девушек — криминальных абортов, обусловивших токсико-септический шок. Эти анамнестические обстоятельства подростки могут скрывать.
Для острой надпочечниковой недостаточности важно падение соотношения Na/K в крови (при сгущениях крови другого генеза оно не изменяется, и только при синдроме Конна показатель Na/K нарастает).
Исходы заболевания и прогноз. Прогноз всегда серьезный. Без лечения все больные погибают, иногда— молниеносно.
Даже в наше время смертность от острой недостаточности надпочечников достигает 50 %.
Исключительно важны своевременный ранний диагноз и начало ранней агрессивной терапии.
При болезнях, чреватых острой недостаточностью надпочечников (эпидемический менингит, аддисонова болезнь), надо проявлять соответствующую настороженность.
По выздоровлении, как правило, остаются признаки частичной или полной недостаточности надпочечников (у выживших больных возможны кальцификация и фиброз надпочечников с развитием хронического ги-покортицизма), что требует пожизненной заместительной терапии кортикостероидами.
Лечение. При подозрении на острую недостаточность надпочечников требуется немедленная транспортировка больного подростка в стационар бригадой реанимации с предварительным введением глюкокортикоидов, затем госпитализация в отделение реанимации до полного выведения из криза с последующим переводом в эндокринологическое или соматическое отделение (при наличии инфекции— изоляция). Больного согревают.
Базисная терапия во всех случаях одинаковая.
Вводят большие дозы глюкокортикоидов или их синтетических аналогов (преднизон, преднизолон) из расчета 2 мг на 1 кг массы тела.
Предпочитают гидрокортизон гемисукцинат или сукцинат внутривенно и одновременно — внутримышечно для создания «депо», так как вводимые внутривенно глюкокортикоиды быстро выводятся почками. Расчетную дозу гидрокортизона вводят внутривенно струйно или капельно в 200 мл физраствора с 5 % глюкозой. Внутримышечно вводят 100 мг препарата.
После первого внутривенного введения гидрокор тизона его вводят каждые 1-3 часа из расчета 1 мг на кг веса внутривенно или внутримышечно до нормализации кровяного давления и диуреза.
При легком кризе дают кортизон-ацетат — по 100-150 мг внутрь, затем каждые 2 часа — по 50-75 мг. Потребность в глюкокортикоидах может доходить до 1500 мг в сутки и более. Обычно для стабилизации состояния такого больного требуется 5 дней.
По достижении стабилизации состояния подростка и при снижении дозы гидрокортизона до 100 мг в сутки добавляют минералокортикоид флудрокор-тизон (кортинефф) из расчета 0,1 мг 1 раз в сутки. Введение глюкокортикоидов вообще лучше сочетать с минер алокортикоидами (если лечат предни-золоном — в особенности). Минер алокортикоид де- зоксикортикостерон-ацетат (ДОКСА) вводят внутримышечно по 5 мг 2-3 раза в сутки, далее — по 5 мг 1-2 раза в сутки. Минералокортикоиды более эффективно препятствуют нежелательному в таких случаях снижению артериального давления.
При отсутствии гидрокортизона для внутривенного введения, его вводят внутримышечно в двойной дозе (в разные мышцы для лучшего всасывания), а затем — каждые 2-4 часа до улучшения состояния.
Если отсутствует гидрокортизон, вводят предни-золон в тех же дозах.
При передозировке минералокортикоидов могут появиться отеки, а при передозировке глюкокортико идов — психозы и галлюцинации.
Регидратация достигается внутривенным введением 5 % глюкозы (2,5-3,5 литра в сутки). При рвоте вводят 10-20 мл 10 % раствора хлорида натрия.
При возможности пользуются гемодезом, полиглю- кином, плазмой, викасолом, е-аминокапроновой кислотой, большими дозами аскорбиновой кислоты.
При падении артериального давления внутривенно вводят норадреналин или мезатон.
В комплекс лечения входят антибиотики (особенно при инфекциях), у старших подростков можно использовать ципрофлоксацин (ципробай, ципринол, цип-ролет, цифран). При подозрении на туберкулёз необходимы специфические средства — туберкуло- статики (препараты ГИНК), рифампицин, этио-намид. При лечении рифампицином и его аналогами (рифадин, бенемицин) необходимо повышать дозы глюкокортикоидов, так как эти антибиотики ускоряют обмен кортикостероидов.
По показаниям осуществляются консультации инфекциониста, невропатолога, фтизиатра, хирурга, по показаниям — гинеколога.
Профилактика. В профилактике острой надпо-чечниковой недостаточности важны своевременные профилактические прививки, а при явных инфекциях — раннее введение антитоксических сывороток и антибиотиков.
137
Большую роль играют профилактика туберкулеза, ВИЧ-инфекции, сифилиса, подросткового травматизма и наркоманий.
Подросткам, получающим глюкокортикоиды, перед планируемыми стрессорными ситуациями (операции, лечение или удаление зубов), а также при любых инфекциях (даже при ОРЗ) необходимо увеличить их дозу
Прекращение лечения глюкокортикоидами при длительном их применении должно проводиться постепенно и крайне осторожно во избежание развития острого синдрома отмены.
Диспансеризация. Диспансерная группа — Д-3.
Выжившие подростки нуждаются в пожизненном наблюдении эндокринологом. С эндокринологического учета не снимаются.
При туберкулезной, а также при любой другой этиологии острой недостаточности надпочечников подростки должны встать на учет в туберкулезном диспансере, где наблюдаются (одновременно—в эндокринологическом диспансере) и получают бесплатное снабжение про тивотуберкулезными препаратами и глюкокортико идами. Лечение глюкокортикоидами, как правило, пожизненное.
Профилактические прививки проводятся им строго по показаниям, с предварительным наращиванием дозы глюкокортикоидов в 2-3 раза.
Поддерживающая доза глюкокортикоидов — индивидуальная. При лечении преднизолоном (синтетический глюкокортикоид, лишенный минералокортико-идных свойств) периодически требуется обязательное внутримышечное введение небольших доз дезоксикор- тикостерона-ацетата (ДОКСА) или флудрокорти- зона (кортинеффа), особенно при тенденции к снижению артериального давления.
В легких случаях показано санаторно-курортное лечение, обычно — в санаториях для туберкулезных больных.
Запрещается чрезмерная инсоляция (загары, посещение соляриев).
Вопросы экспертизы. После перенесенной острой недостаточности надпочечников группа здоровья — 5, реже — группа 4.
Такие подростки освобождаются от всех видов физкультуры, от разных массовых мероприятий и от экзаменов.
Практически все они считаются инвалидами.
При компенсированной функции надпочечников возможна легкая работа без нервно-психических перегрузок, стрессов, без ночных смен, командировок, профессиональных вредностей. Нежелательна работа на высоте, на транспорте, на жаре или на холоде.
138
Все переболевшие острой надпочечниковой недо-статочностью на военный учет не берутся, а после эпизода этой болезни с учета снимаются. В военные учеб-ные заведения их не принимают.
ХРОНИЧЕСКАЯ НАДПОЧЕЧНИКОВАЯ НЕДОСТАТОЧНОСТЬ
Определение. Хроническая недостаточность коры надпочечников—заболевание, обусловленное снижен-ной продукцией и/или недостаточной эффективностью действия кортикостероидных гормонов коры надпочеч-ников.
Синонимы: болезнь Аддисона, синдром Аддисона, бронзовая болезнь, аутоиммунная болезнь Аддисона, хронический гипокортицизм, хроническая меланодерми-ческая недостаточность надпочечников, хроническая надпочечниковая недостаточность.
Распространенность. Заболевание чаще возникает у старших подростков, без четких половых различий в пораженности, с частотой от 0,03 до 0,1 на 10 тыс. населения. Смертность достигает 4 на 100 тыс. населения. В явной форме болезнь наблюдается со среднепопуля-ционной частотой—приблизительно 50 случаев на 1 млн населения. Рост в последние годы заболеваемости подростков туберкулезом и особенно сифилисом можете недалеком будущем стать причиной учащения случаев аддисоновой болезни.
Этиология и патогенез. Заболевание было впервые описано Томасом Аддисоном (1855) как брон- зовая болезнь (по характерной гиперпигментации, которая может присутствовать у больных) и в настоящее время носит имя этого выдающегося английского клинициста — болезнь Аддисона.
Всего через полтора с небольшим десятилетия] (1872) клинику и развитие аддисоновой болезни у крестьянки Лукерьи классик русской литературы) И.С. Тургенев, который врачом, как известно, не был, ярко описал в рассказе «Живые мощи». Проявления данного недуга весьма характерны, и они не ускольз-нули от внимания наблюдательного писателя: «...Пе- редо мной лежало живое человеческое существо, но что это было такое? Голова совершенно высох-шая, одноцветная, бронзовая — ни дать ни взять, икона старинного письма; нос узкий, как лезет ножа; губ почти не видать — только зубы белеют и глаза, да из-под платка выбиваются на лоб жидкие пряди желтых волос. У подбородка, на складке одеяла, движутся, медленно перебирая пальцами, как палочками, две крошечных руки тоже бронзового цвета. Я вглядываюсь попристальнее: лицо не только не безобразное, даже красивое, — но страшное, необычайное...».
Хронический гипокортицизм, то есть недостаточные продукция и/или эффективность гормонов коры надпочечников, известен в общей (тотальной) и частичной (парциальной) формах.
Тотальный гипокортицизм может быть первичным (связанным с разрушением или дисфункцией собственно коры надпочечников) и вторичным (вызванным последствиями хронического введения экзогенных кортикостероидов, а также гипоталамическими и ги-пофизарными опухолями, нарушающими продукцию кортиколиберина и АКТГ). Первичный гипокорти цизм распространён намного более.
В основе первичного гипокортицизма лежит именно первичная хроническая недостаточность функций коркового вещества надпочечников, то есть аддисоно- ва болезнь.
В настоящее время известно, что этиология болез ни Аддисона более чем в 80 % случаев является ауто-аллергической. Деструкция коры надпочечников наступает в результате интенсивного аутоиммунного процесса, направленного против антигенов адренокор-тикоцитов или общих аутоантигенов коры надпочечников и гонад (антигены стероидопродуцирующих клеток).
Наиболее часто мишенью аутоиммунитета при бо лезни Аддисона служат стероидогенные ферменты. В первую очередь характерны аутоантитела к 21 -гид-роксилазе (они присутствуют почти у 60 % больных). Эти иммуноглобулины не только блокируют фермент и вызывают нарушение перехода прогестерона в дезоксикортикостерон, но и служат эффекторами ци-тотоксического процесса, разрушающего адренокорти-коциты. В надпочечниках обнаруживается иммунопатологическое воспаление — аутоиммунный адреналит. В них, наряду с деструктивными изменениями и фиброзом, развивается лимфоцитарная инфильтрация коры, так как происходит гиперчувствительность не только немедленного, но и замедленного типа.
Нередко, особенно при раннем начале болезни, обнаруживаются аутоантитела к 17-а-гидроксилазе. Так как данный фермент присутствует в изобилии также в гонадах, у больных регистрируются взаимодействия иммуноглобулинов с цитоплазмой стероидпродуциру-ющих клеток гонад и надпочечников, почему, в дополнение к клинике болезни Аддисона, может возникать гипергонадотропный гипогонадизм (Крон К. с со-авт., 1992).
Как причина болезни Аддисона описаны аутоантитела и к рецепторам АКГГ(Финк Дж., Билл Г., 1982). В этих случаях иммуноглобулины взаимодействуют не столько с цитоплазмой, сколько с плазматическими мембранами клеток коры надпочечников. Отмечают-
ся прекращение пролиферации и атрофия коры надпочечников, но без признаков адреналита.
Имеется экспериментальная модель болезни Ад-дисона, полученная у крыс индукцией аутоиммунного адреналита введением соответствующей специфической цитотоксической антисыворотки (Ирино Т., Грол- лмен А., 1968).
Еще в начале прошлого века обсуждалась возможность наследственного характера болезни Аддисона. По Мараньону, который отмечал широкое распространение заболевания в Испании, при нем большое значение имеет фактор наследственности (цит. по А.Т. Ка мерону, 1948). Так, болезнь Аддисона встречается семикратно чаще у носителей гена главного комплекса гистосовместимости DR3, который сцеплен с другими аутоиммунопатиями. Отмечается также ее учащение при гаплотипе этого комплекса, содержащем аллель B8.
Не удивительно, что её проявления чаще всего входят в структуру комбинированных аутоиммунных синдромов, поражающих и другие эндокринные железы, а также неэндокринные клетки.
Наиболее известен синдром Шмидта (сочетание аддисоновой болезни, аутоиммунного тироидита, инсу-линозависимого сахарного диабета). Это состояние характеризуется более поздним началом симптомов, сцеплением с гаплотипами главного комплекса гистосовместимости В8 и DR3. Распространена и такая комбинация: «болезнь Аддисона — гипопаратироз — хронический кожно-мышечный кандидоз». В этом случае начало болезни раннее, имеется аутосомно-ре-цессивное семейное наследование, сцепления с упомянутыми аллелями главного комплекса не обнаружено.
В общей сложности до 80 % больных с аддисоно вой болезнью имеют аутоиммунные тиропатии, 12-15% — аутоиммунный сахарный диабет, не менее 6% — аутоиммунный гипопаратироз (при частоте ауто-антител к паращитовидным железам — до 26 %).
Не менее четверти женщин, больных аддисоновой болезнью (у кого отмечены аутоантитела к стероид-продуцирующим клеткам), развивают аутоиммунный оофорит, а 5 % мужчин — орхит, который приводит к первичному гипергонадотропному гипогонадизму.
Почти в половине случаев присутствуют аутоантитела к клеткам слизистой желудка, в 9 % мишенями являются гастриновый рецептор или сам внутренний фактор Касла, что ведет к атрофическому гастриту с аутоиммунной пернициозной анемией (анемия Аддисо- на-Бирмера). Отсюда само собой напрашивается наше предположение о том, что Томасу Аддисону, по-видимому, не случайно принадлежит и честь описания
139
 «идиопатической анемии» (пернициозной, В12-дефицит-ной)—болезни, впоследствии также названной его именем. Не исключено, что хроническую недостаточность коры надпочечников и пернициозную анемию он наблюдал у своих пациентов как сочетанную патологию.
«идиопатической анемии» (пернициозной, В12-дефицит-ной)—болезни, впоследствии также названной его именем. Не исключено, что хроническую недостаточность коры надпочечников и пернициозную анемию он наблюдал у своих пациентов как сочетанную патологию.
Кстати, до сих пор не завершен спор между эндокринологами, ревматологами и дерматологами, какую болезнь описал И.С. Тургенев в «Живых мощах».
В классических трудах по эндокринологии сквозит стопроцентная уверенность в том, что героиня рассказа Лукерья страдала именно болезнью Аддисона. Непререкаемый авторитет в ревматологии академик Е.М. Тареев в классическом труде «Коллагенозы» (1965) указывает, что описание И.С. Тургенева «словно конденсирует основные черты склеродермии и может быть рекомендовано для изучения симптоматики склеродермии». А. И. Картамышев в учебнике «Кожные и венерические болезни» также уверен, что И.С. Тургенев ярко описал склеродермию. Е.М. Та реев далее обращает внимание на определенную связь склеродермии с патологией эндокринных желез, в частности, щитовидной железы и, что особенно любопытно, — с патологией надпочечников ( ! ): «клинические признаки нарушения функции коры надпочечников в виде гиперпигментации кожных покровов, адинамии, значительной потери веса... послужили причиной ошибочного диагноза адди-соновой болезни (в основном за счет бронзовой окраски кожных покровов)... В отношении щитовидной железы более обоснованно признать понижение ее функции при склеродермии ...В казуистически редких случаях развитие склеродермии связывали с недостаточностью функции коры надпочечников в результате ишемии передней доли гипофиза... Таким образом, более приемлема концепция снижения функции эндокринных желез, своеобразного малого плюригландулярного синдрома, соответствующего фиброзу различных систем организма при склеродермии».
Учитывая приведенное высказывание Е.М. Таре- ева и современные представления о полиэндокринном аутоиммунном синдроме, нам кажется, что болезнь тургеневской Лукерьи следует отнести к указанному синдрому, что может положить конец междисциплинарным дискуссиям.
По-видимому, неспроста в современной зарубежной литературе хроническая недостаточность коры надпочечников описывается как «аутоиммунная болезнь Аддисона» (Марова Е.И., 1996).
Другие аутоиммунные стигмы при аддисоновой бо лезни включают частое развитие витилиго, алопеции,
140
хронического активного гепатита, миастении, аутоим-мунной тромбоцитопенической пурпуры. Больные могут страдать идиопатическим несахарным диабетом, син-дромом множественных эндокринных опухолей, гипофи-зитом, болезнью Паркинсона, целиакией, дерматомио-зитом, не исключено развитие мальабсорбционных синдромов — с аутоантителами соответствующей спе-цифичности.
Вторая по значению и исторически первая, по опи-санию самим Томасом Аддисоном, причина болез-ни — инфекционные адреналиты, в первую очередь-в результате туберкулёза надпочечников. Эта причи-на ответственна примерно за 20 % случаев болезни.
Туберкулёзные бактерии попадают в кору надпочеч-ников при гематогенной диссеминации лёгочного, по-чечного или гастроинтестинального туберкулёза. Мно-гие отечественные фтизиатры подчёркивают значение так называемых «безлокальных» форм туберкулёза -то есть ранней и хронической туберкулёзной интокси-кации. За рубежом эти формы в классификацию и ста-тистику не входят, так как при них нет локального ту-беркулёзного очага ни в одном органе (что, между прочим, даёт существенное кажущееся улучшение эпи-демиологических показателей в этих странах).
При туберкулёзной интоксикации нет туберкулёз-ного адреналита. Однако симптомы надпочечниковой недостаточности столь очевидны, что дифференци-рование этого состояния с болезнью Аддисона нету-беркулёзной этиологии является одной из важных за-дач терапевта и фтизиатра (Король О.И. с соавт., 1997). Мы полагаем, что на ранних стадиях туберкулёза это обусловлено способностью циркулирующих цитокинов угнетать продукцию кортикостероидов. Однако эти аспекты патогенеза туберкулёзной интоксикации пока изучены недостаточно (Самарина А.В. с соавт., 2004).
Туберкулёзный адреналит протекает хронический заканчивается казеозным некрозом, а часто — и каль-цификацией как коркового, так и мозгового веществ надпочечников, что хорошо выявляется на рентгенограм-мах надпочечников и служит классическим признаком туберкулезной причины болезни Аддисона.
Кроме туберкулёза, в редких случаях хронический деструктивный адреналит вызывают другие инфекции, в первую очередь — гистоплазмоз, кокцидиоз и другие гранулёматозы (в том числе саркоидоз, для которого возбудитель пока окончательно не установлен, но все больше исследователей склоняются в пользу туберкулезного его происхождения). Для больных ВИЧ-инфекцией, а также для других иммунодефицитных состояний типичны адреналиты, вызванные обычно малопатогенной для
человека оппортунистической микрофлорой. Чаще всего этиологическим агентом являются цитомегаловирус (возможно внутриутробное поражение надпочечников плода), криптококки, Mycobacterim avium. Поражения надпочечников этими инфекциями могут быть диффузными, охватывающими 30-50 % их ткани, или процесс ограничивается их мозговым веществом (как при многих случаях цитомегаловирусной инфекции).
В прошлом отмечались случаи болезни, спровоцированные сифилисом (кстати, один из описанных То масом Аддисоном пациентов с хронической недостаточностью коры надпочечников имел сифилитическое их поражение, доказанное на аутопсии).
Таким образом, в принципе любые хронические инфекционные поражения надпочечников вызывают развитие картины аддисоновой болезни. Не только аутоал-лергия и инфекции, но и любые факторы, приводящие к постепенному разрушению коры надпочечников, могут вызывать или спровоцировать хроническую недостаточность надпочечников: амилоидоз, гемохроматоз, перенесенная острая недостаточность надпочечников (см. выше), операции на надпочечниках, различные травматические повреждения.
Любопытно, что начало болезни у своей героини Лукерьи И.С. Тургенев описывает так: «... вот раз но чью я..., знать, спросонья оступилась, так прямо с рундучка и полетела вниз — да о землю хлоп! И, ка жись, не сильно я расшиблась, потому — скоро под нялась и к себе в комнату вернулась. Только словно у меня что внутри — в утробе — порвалось... С самого того случая... стала я сохнуть, чахнуть; чернота на меня нашла; трудно мне стало ходить, а там уже — и полно ногами владеть; ни стоять, ни сидеть не могу; все бы лежала. И ни пить, ни есть не хочет ся: все хуже да хуже... И ни один лекарь даже ска зать не мог, что за болезнь у меня за такая...».
Редкие и казуистические формы тотального гипокортицизма вызываются облучением, метастатическими негормонообразующими карциномами (лёгких, грудной железы) и лимфомами надпочечников.
Многие лекарственные интоксикации вызывают гипокортицизм, блокируя ферменты стероидогенеза [метирапон, аминоглутетимид, трилостан, кето-коназол). Последний, как и некоторые другие противогрибковые средства, обладает антистероидогенной активностью для надпочечников и гонад и применяется также при ВИЧ-инфекции против микозов, что усиливает опасность ятрогенного гипокортицизма, так как СПИД-ассоциированные инфекции и сами по себе приводят к адреналиту (см. выше). Применяемое при кортикостеромах лекарство митотан как цитотоксич-
ное для адренокортикоцитов при передозировке может вызвать гипокортицизм. Функция надпочечников понижается также при действии рифампицина, опиатов, фенитоина.
Наконец, имеются наследственные и врожденные состояния с гипокортицизмом. Такова врожденная ги перплазия коры надпочечников, вызванная ферментативными дефектами стероидогенеза, когда гипокортицизм носит мозаично-парциальный характер (см. выше). Гипокортицизм своим происхождением может быть обязан также врожденной гипоплазии надпочечников, известной в двух формах — анэнцефальной, когда недоразвит и головной мозг, а также наследственной мегалоцитарной (когда недоразвиты только надпочечники, а немногие имеющиеся адренокортико-циты имеют гигантские размеры). Как причина врожденного тотального гипокортицизма представляет интерес наследственный аутосомно-рецессивный дефект фермента десмолазы (см. выше), осуществляющей отщепление боковой цепи холестерина, превращающее его в А -прегненолон.
Патогенез аддисоновой болезни связан прежде всего с дефицитом глюкокортикоидов — гипокортицизмом, в меньшей степени с дефицитом минерало-кортикоидов — гипоальдостеронизмом или половых гормонов — гипоандрогенизмом.
Типичная клиника гипокортицизма возникает при разрушении не менее 90 % ткани коры надпочечников. Болезнь развивается месяцами и нередко — годами, гораздо реже ее дебют происходит остро (например, при выживании подростков после менингококкового сепсиса с синдромом Уотерхауза-Фридериксена).
Патогенез основных проявлений болезни Аддисо- на связан не только с дефицитом различных кортико- стероидов, но и с компенсаторным избытком проопи- омеланокортина и его дериватов.
В течение длительного периода болезнь находится в латентной фазе, когда уровень кортикостероидов достаточен для спокойного функционирования в обычной обстановке, но истощенные ресурсы коры надпочечников не позволяют адекватно стимулировать их выработку при стрессе и увеличении потребности в этих гормонах.
В латентную фазу состояние больных — компенсированное, но травма, операция или сильные переживания способны спровоцировать острый надпочечниковый криз. Если этот порог перейдён, то появляются симптомы гипоалъдостеронизма (прежде всего потеря натрия и хлоридов, обезвоживание, гиперкалиемия), а также ги-покортизолизма (похудание, слабость, утомляемость, сонливость, анорексия, гипогликемии,). Начинает ком-
141
пенсаторно повышаться продукция АКТГ и его предше-ственика — прополигормона ПОМК. Это приводит к гиперпигментации кожи и слизистых за счет МСГ-подобного действия указанных регуляторов.
Гиперпигментация выражается не только в диффузном потемнении покровов тела. Обнаруживаются пигментные пятна и сгущения оттенка в складках кожи, в местах действия солнечных лучей, трения одеждой, браслетами, кольцами. Темнеют ареолярные кружки и соски, локти, колени, ногтевые ложа, перианальная и пе-ривагинальная области, наружные половые органы. Очень характерны пигментные пятна на слизистой щек, нёбе, дёснах, что считают практически патогномонич-ными для аддисоновой болезни.
Углеводный обмен характеризуется тенденцией к быстрому и стойкому понижению уровня глюкозы в крови натощак. У подростков возможны спонтанные гипогликемии, даже при своевременном приеме пищи. Характерна плоская гликемическая кривая, высокий дыхательный коэффициент натощак. В печени и мышцах резко уменьшено количество гликогена. Это вносит вклад в патогенез мышечной слабости и адинамии, весьма характерных для данного заболевания. Падение уровня гликемии может при аддисоновой болезни вызвать гипогликемическую кому, которая бывает и смертельной.
Нарушения белкового обмена определяются дефицитом глюкокортикоидов, что ведёт к снижению синтеза печёночных протеинов и к гипопротеинемии, а также нехваткой андрогенов, тормозящей анаболические процессы в мышцах. Мышечная масса уменьшается. Вместе с тем снимается катаболическое действие глюкокортикоидов на обмен белка во многих других тканях и органах, например, в лимфоидных. Для аддисоновой болезни типичны лимфоцитоз и эозино-филия, так как при гипокортицизме срок жизни этих кровяных клеток увеличивается. Ограничение распада белка и нуклеиновых кислот во многих тканях может привести к тому, что выведение азота уменьшается. Однако из-за нарушений водно-минерального метаболизма, ограничивающих скорость фильтрации (см. ниже), в крови может быть некоторая ретенцион-ная преренальная азотемия.
Нарушается и липидный обмен. При аддисоновой болезни больные сильно худеют, что связано не только с обезвоживанием и потерей мышечной массы, но и с уменьшением жировых запасов. В условиях гипогликемии под влиянием изменения глюкагон-инсулиново-го соотношения в пользу глюкагона липогенез в жировой ткани ослабевает, и усиливается липолиз. К тому же сильно снижается аппетит.
142
Водно-солевой обмен изменен по типу гипоальдос-теронизма. Многие больные испытывают неодолимую тягу к потреблению поваренной соли, фактически все они — сользависимы. Если адреналэктомированных крысам предлагают на выбор различное питье, то они предпочитают чистой воде только растворы поваренной соли. При исключении потребления соли у таких живот-ных и у больных с первичной болезнью Аддисона на-ступает смерть. Имеется гиповолемия, снижается ско-рость клубочковой фильтрации. При водной нагрузки больных усугубляется гипонатриемия, и их почки ока-зываются не в состоянии должным образом экскрети-ровать воду. К тому же имеется вызванная гипокорти-цизмом гипервазопрессинемия. Таким образом пациенты легко впадают во внутриклеточную гипергид-ратацию с набуханием клеток и «водным отравлени-ем». Нехватка хлоридов и натрия обусловливает час-тые рвоты. Имеется выраженная гиперкальциемия.
Гипоосмолярность плазмы и внутриклеточная ги-пергидратация могут провоцироваться инфузиями глю-козы. Не один больной с аддисоновой болезнью был потерян при подобных попытках коррекции гипоглике-мии без повышения осмолярности внеклеточной жид-кости. Глюкоза захватывается клетками, освобожда-ется вода, которая дополнительно разводит и без того гипонатриемичную плазму. Следует набухание клеток гипоталамуса, их неспецифическое раздражение, акти-вация термостатического центра, лихорадка, коллапс и — смерть. Набухают клетки и других органов, что может вызывать растяжение капсул брюшных внут-ренностей и симптомы «острого живота».
Кислотно-основное равновесие сдвинуто в кис-лую сторону. Ацидоз носит умеренный характер. Уро-вень бикарбоната в плазме повышен.
Важные проявления болезни Аддисона связаны с артериальной гипотензией, которая характерна для 90 % пациентов и считается обязательным признаком болезни. Кровеносные сосуды уменьшают свою чув-ствительность к катехоламинам, возможно и прямое уменьшение продукции катехоламинов в мозговом веществе надпочечников. Течение болезни характе-ризуется частыми ортостатическими коллапсами и приступами пониженного кровяного давления. Повышается проницаемость капилляров, происходит расши-рение микрососудов.
Сердечно-сосудистая система в условиях гипер-калиемии страдает от аритмий. Гипотензия и аритмии могут привести к смертельному шоку в стрессорных ситуациях. Характерно рентгенологическое уменьше-ние размеров сердца — важный рентгеновский симп-том аддисоновой болезни.
Выше уже шла речь о лимфоцитозе и эозинофи-лии в крови при этой болезни. Отмечаются также ней- тропения и моноцитоз. Вместе с тем существенного понижения противоинфекционного иммунитета не бывает. В связи с дефицитом андрогенов и глюкокор- тикоидов, стимулирующих эритропоэз, картина крови дополняется гипорегенераторной анемией, а иногда—и мегалобластической.
Гипокортицизм меняет функции центральной нервной системы и поведение больных. Характерны эмоциональная лабильность, раздражительность, отсутствие способности к длительной концентрации внимания, часто доминирует апатия. Многие пациенты необычайно чувствительны к резким запахам, звукам, вкусовым раздражителям. Если при гиперкорти-цизме ритм ЭЭГ учащен, то при аддисоновой болезни на ЭЭГ появляются волны более медленные, чем а-ритм. Психическое состояние при аддисоно вой болезни ярко описал один из пациентов французского клинициста Ж. Де ля Фуа (1887): «Я совершен но разбит, силы оставляют меня, я не способен ни на малейшее усилие...». Всякое движение внушало этому пациенту такой страх, что он ложился, чтобы не производить никаких усилий.
Механизмы и проявления вторичной недостаточности коркового вещества надпочечников несколько отличаются от классической болезни Адди сона, поэтому иногда такие состояния называют «аддисонизмом».
Этиология вторичного гипокортицизма иногда связана с разрушением кортиколипотрофов аденогипо-физа и/или кортиколибериновых нейронов гипоталамуса опухолями и аутоиммунными процессами. Примером может служить вторичный гипокортицизм при синдроме Шихена (см. выше).
Но самой частой причиной его является экзогенная — симптомы гипокортицизма становятся результатом быстрой отмены хронической глюкокортикоид-ной терапии. Применение кортикостероидов уже на протяжении 6-7 дней ведет к значительному угнетению продукции собственного АКТГ. При многонедельном лечении доктор вынужден это учитывать и в случае ожидания сильного стресса, например, — операции — повышать больному дозы экзогенных кортикостеро-идо в.
Для нормализации реактивности гипоталамо-гипо-физарного нейросекреторного аппарата после такой терапии требуется не менее 2-3 месяцев, а продукция кортизола не возвращается к норме в течение 6-9 месяцев. Поэтому дозы отменяемых кортикостеро-идов нужно снижать постепенно. При быстром их сни-
жении проявляются симптомы гипокортицизма вплоть до аддисонового криза (см. ниже) даже при нормальной концентрации глюкокортикоидов в крови, так как ткани адаптированы к их хронически более высокому уровню (Голдфин А., 1998).
В течении хронического вторичного гипокортицизма сменяются три стадии.
На I стадии базальная продукция и уровень корти зона нормальны, но ответ на стресс резко снижен, так как мала центральная стимуляция кортикостероидоге-неза.
На II стадии секреция АКТГ и КРФ еще более угнетается, начинают проявляться симптомы снижения ба-зального уровня кортизона вне стресса.
Наконец, отсутствие АКТГ по степенно ведет к вторичной атрофии коры надпочечников. Это способствует переходу в глубокую базалъную и стимулирован ную гипокортизолемию (III стадия).
При вторичных формах гипокортицизма содержание АКТГ понижено или даже нулевое. Поэтому комплекс эффектов, связанных с избытком проопиомеланокор- тина, отсутствует, а главное — нет гиперпигмента ции покровов тела. Наоборот, кожа может светлеть («белый аддисонизм»).
Вторичная надпочечниковая недостаточность часто мозаична и ограничивается в основном гипоглю-кокортикоидными проявлениями. Выраженные гипоаль- достеронизм и гипоандрогенизм при этом более редки. Это облегчает состояние больных — гиповолемия и гиперкалиемия бывают не часто. Из-за неспособности к эффективной экскреции воды наблюдается гипонатри-емия, но она не бывает столь глубокой. Менее выражены сдвиги кислотно-щелочного баланса. Не характерны выраженные азотемия и креатининемия, которые типичны для первичной болезни Аддисона. Однако гипогликемия может быть ярко выраженной, так как первичное поражение проявляется в гипопитуитаризме.
Клиника. При хронической недостаточности коры надпочечников развиваются чрезвычайная слабость, утомляемость, похудание, тошнота, полная утрата аппетита, неустойчивый стул, никтурия, звон в ушах, головокружение («в глазах все плывет»), потемнение кожи. Отдых не приносит таким больным бодрости. У больных подростков эти симптомы гораздо более выражены.
Жалобы на боли в животе — достаточно типичный и частый симптом болезни. Вначале больные ощущают чувство тяжести в подложечной области, будто съели лишнее, затем появляется тошнота, интенсивность болей нарастает, они становятся разлитыми (по всему животу), схваткообразными, режущего характера. Боли могут быть такими интенсивными, что иногда заставляют больных подростков кричать. Живот при пальпа-
143
ции чаще болезненный, гипотоничный, впалый, иногда увеличивается печень. Нередко такие больные ошибочно попадают на операционный стол с диагнозом «острый живот», при этом нередко исход оперативных вмешательств — плачевный.
Часто выявляется тяга к соленому.
Так, в Мариинской больнице в 1974 г. мы наблюдали пациента Наб-ва И.С, страдавшего аддисо-новой болезнью, который пил по утрам чай только с солью (вместо сахара), получая от этого «наслаждение» и становясь более бодрым, чем от чашки крепкого кофе. Слабость у него доходила до того, что больной не мог самостоятельно раздеться на приеме у врача, повесить свою одежду на вешалку, у него «не хватало сил шевелить языком и губами», поэтому он предпочитал отмалчиваться (Строев Ю.И., 1976).
У больных постепенно темнеет кожа, блондины могут превратиться в брюнетов. Оттенки пигментации — от желтоватой до цвета старой бронзы («бронзовая болезнь»), иногда такую кожу образно называют «цыганской» или «креольской». Подростки выглядят чрезмерно загорелыми. Кожа у них темнеет в основном на открытых местах и в местах трения кожи одеждой (под резинками от трусиков, под брючным ремнем, под бретельками, украшениями, например, — под кольцами, что некоторыми расценивается как «дурная примета»). Пигментируются также ареолы сосков, локти, колени, половые органы и область заднего прохода, ладонные складки (как у африканцев), послеоперационные рубцы, ссадины и царапины. Кожа приобретает «грязный» вид. Попытки отмыть кажущуюся «грязь» приводят к еще большей пигментации («симптом грязных локтей, тыла пальцев рук, коленок»).
J5 эндокринологическом отделении Мариинской больницы в 1969 мы наблюдали пациента Ф-ва В.Б., 23 лет (и/б № 3096), который был освобожден от военной службы спустя несколько месяцев после призыва в армию в связи с развившейся аддисоно-вой болезнью. Смуглым был с отрочества. В легких находили очаги Гона. Заболевание началось у него со слабости, которая не нравилась сержанту, считавшему рядового симулянтом (на кроссах прибегал последним в роте). Поэтому заболевший солдат умышленно подвергался дополнительным физическим нагрузкам (бег, отжимание на руках, подтягивание на турнике и пр.), которые ему были, конечно, не под силу, что вызывало еще большую ярость сержанта и новые, более изощренные, физические испытания, доводившие новобранца до полной прострации. Похудел на 17 кг. Была тяга к соленому, с его слов, постоянно «клянчил у повара
144
селедку». Затем у него стала особенно сильно тем неть кожа, за что он быстро получил от других но вобранцев прозвище «копченый». Плачевный юмор ситуации заключался в том, что у этого заболев- шего солдата новобранцы в бане всей ротой пыта лись отмыть его воображаемую «грязь» на шее, спине, локтях, усердно драя его мочалками и даже пемзой, что, естественно, только усиливало пигментацию в местах интенсивного трения. Больной поступил в эндокринологическое отделение в тя желом состоянии, резко истощенным, смуглым как индус, с АД 90/40 мм рт. ст.
Декомпенсация первичной недостаточности надпо-чечников всегда сопровождается нарастанием пигмен-тации, что является грозным симптомом и требует сроч-ной госпитализации больного в эндокринное отделение
Интересно, что у больных на коже практически все-гда можно обнаружить разные по площади участки пол-ной депигментации (витилиго аутоиммунной природы
При вторичной недостаточности надпочечников пол-ное отсутствие продукции МСГв аденогипофизе может привести к общей неестественно «алебастровой» де-пигментации (чаще это бывает после осложненных pо-дов при синдроме Шихена и сопровождается наруше-ниями месячных и лактации).
Как уже подчеркивалось выше, только для первич-ной аддисоновой болезни характерны темные пятна на слизистых: на кайме губ, на слизистых щек, также на всем протяжении желудочно-кишечного тракта, осо-бенно при декомпенсации болезни. Подобная пигмен-тация слизистых обычно не наблюдается у здоровых лиц европейского происхождения, что позволяет счи-тать этот симптом весьма характерным для аддисо- новой болезни.
Больные обязательно теряют вес (один из важнейших симптомов болезни!) в результате дегид-ратации, но жалкого впечатления такое похудание не производит. Они как бы равномерно «усыхают», что придает им вид изящных, как будто выточенных из эбе-нового дерева, статуэток восточных божков. В осо-бых редких случаях вес может не падать.
Так, мы наблюдали одного молодого больного который занимался профессиональным спортом почему тщательно старался «сбрасывать вес чтобы не попасть в другую весовую категорию Заболев аддисоновой болезнью, он стал неожиданно прибавлять в весе, что противоречило логике болезни и вызвало определенные диагностические затруднения. В дальнейшем выяснилось что этот больной из-за нарастающей слабости полностью прекратил занятия спортом и попыт-ки худеть. Последнее, очевидно, и явилось причи-
ной нарастания массы тела, несмотря на наличие выраженного гипокортицизма.
Сердце обычно маленьких размеров, что подтверждается при ренгеновских исследованиях. Тоны сердца глухие, иногда выслушивается ритм галопа. Артериальное давление всегда падает, даже если до заболевания была артериальная гипертензия. Но по достижении компенсации болезни артериальная гипертензия может вернуться.
Из-за дефицита андрогенов у больных подростков уменьшается оволосение лобка. У девушек могут нарушаться месячные вплоть до аменореи. У юношей появляется резкое понижение половой функции вплоть до безразличия к сексу.
Осложнения. Самое грозное осложнение болезни—хронической надпочечниковой недостаточности— аддисонов криз или гипохлоремическая (гипо- натриемическая) кома, т.е. острая надпочечниковая недостаточность на фоне хронической. Острый адди сонов криз является наивысшим проявлением, кульминацией гипокортицизма (как первичного, так и вторичного).
Это экстремальное состояние, вызванное резким несоответствием между потребностью в кортикостеро-идах и их поставкой. Оно провоцируется стрессорами. Так как хроническая надпочечниковая недостаточность имеет длительную латентную фазу, аддисонов криз может быть у больных хроническим гипокорти-цизмом даже дебютным проявлением заболевания, которое до этого было своевременно не распознанным — например, в ответ на травмы или медицинские вмешательства, проведённые без учёта особенностей надпочечниковой функции.
Неадекватная реакция больных хронической недостаточностью надпочечников на любые стрессы вызывает внезапные обострения (даже испуг, суровый окрик могут стать роковыми), поэтому угроза кризов существует у них постоянно.
В 1968 г. в эндокринологическое отделение Ма-риинской больницы скорой помощью прямо с работы был доставлен в состоянии коллапса инженер, которого мы знали ранее по неоднократным госпитализациям по поводу болезни Аддисона. Оказалось, что за 1 час до настоящей госпитализации он был приглашен в кабинет своего руководителя для нелицеприятной беседы. Для большего эффекта нотаций начальник сильно ударил кулаком по столу, в результате чего больной тут же оказался в коллапсе из-за остро развившегося аддисонова криза.
Первично острое течение надпочечниковой недостаточности при септическом синдроме Уотерхау- за-Фридериксена, апоплексии гипофиза, при кро-
воизлиянии в надпочечники также даёт картину, подобную аддисонову кризу, но отличающуюся отсутствием предвестников.
Криз характеризуется быстрым развитием на фоне прогрессирующей гипогликемии глубоких гипонатри-емии и гипохлоремии, внеклеточного обезвоживания, гиповолемии, но в присутствии гиперкалиемии и гипер-кальциемии.
В то же время клетки мозга и других органов набухают. Возникают симптомы «водного отравления».
Аддисонов криз проявляется высокой лихорадкой, болями в суставах и мышцах, прострацией, тошнотой, рвотой и поносом, усугубляющими потери натрия и хлоридов. Растяжение капсул абдоминальных органов почти всегда присутствует при этом осложнении и провоцирует такие боли, что наблюдается картина «острого живота», и больной может ошибочно трактоваться как хирургический. Кома, аритмия и артериальная гипотензия, резистентная к катехоламинам, могут привести к смертельному нарушению кровообращения и дыхания. Картина гипохлоремичес- кой комы с выраженными желудочно-кишечными проявлениями в финальных стадиях трудноотличима от одного из вариантов кетоацидотической комы, что может быть поводом к ошибочной попытке лечения таких больных инсулином и привести к гипогликемичес-кой коме, из которой их очень трудно вывести.
У больных подростков со временем может развиваться задержка роста, пубертата, сексуальные нарушения, психозы, пирамидные расстройства с гемипарезами из-за лейкодистрофии и дегенерации клеток мозга.
При заместительной терапии глюкокортикоидами также могут возникать психозы, которые являются нередким поводом для госпитализации больных болезнью Аддисона в психоневрологические стационары. Психоневрологическая симптоматика вообще типична для этих больных. В. Фальта (1913) описывает это так: «Сперва болезнь почти всегда проявляется в легкой утомляемости, неохоте работать, апатии. Временами к этому присоединяются головные боли, плохой сон, иногда — упорная бессонница, плохое настроение, угнетенное состояние. Часто — ненормальная возбудимость, потеря памяти, шум в ушах, головокружение и частые обмороки, зевота, икота, ревматические боли в крестце, конечностях, иногда — эпилептиформные судороги. В позднейших стадиях могут наблюдаться очень бурные явления со стороны нервной системы: частый бред, острое помешательство, судороги, сильное угнетение и кома».
145
Классификация. Существуют первичная хроническая недостаточность надпочечников (классический вариант) и вторичная (при первичной патологии гипоталамуса или гипофиза) с течением легкой, средней и тяжелой степеней. Может (у девушек — чаще) наблюдаться синдром Шмидта (аутоиммунное поражение сразу нескольких эндокринных желез). Диагностика. В анализах крови наблюдается гипо-или нормохромная анемия (особенно — при гипопиту-итарном, вторичном аддисонизме), эозинофилия с лим-фоцитозом, увеличение СОЭ (особенно при активном туберкулезе). Вследствие сгущения крови нарастает гематокрит.
Всегда выявляются гипонатриемия и гиперкалиемия (величина Na/K—не более 20 и ниже). Возникает тенденция к гипогликемии. Уровни кортизола и кортикос- терона в крови падают, содержание I 7- OKC в моче снижается, но при первичной надпочечниковой недостаточности в крови возрастает (в 5-10 раз!) уровень АКТГ, вплоть до развития крайней степени гиперплазии корти-колипотрофов гипофиза—адренокортикотропиномы. В крови падает также уровень минералокортикоидов. Гипонатриемия и гипохлоремия определяют развитие гипоацидного и даже анацидного гастрита с инфицированием желчных путей (нередко развивается лямблиоз). Сердце при рентгеноскопии маленькое (почти пато-гномоничный признак болезни). На ЭКГ—низкий вольтаж, депрессия сегмента S-T, уплощенный или отрицательный Т, укорочение сегмента Q-T, комлекс ORS может сливаться с зубцом Т («синус-стоп»-феномен), имеются синусовая брадикардия, экстрасистолия и даже идиовентрикулярный ритм. Из-за бурой атрофии и очаговых некрозов миокарда развивается фазовый синдром гиподинамии (Левина Л.И., 1989).
Падение минутного объема и гиповолемия всегда приводят к падению артериального давления при небольшом снижении периферического сосудистого сопротивления.
На ЭЭГ регистрируются медленные волны дезорганизации а-ритма.
В легких можно выявить петрификаты, которые иногда выявляют и в надпочечниках, и в головном мозге как отражение туберкулезной инфекции.
Критерии диагноза. Для хронической недостаточности надпочечников типична триада из трех «гипо-»: «гипотония — гипонатриемия — гипогликемия». При характерной «грязной» пигментации кожи, похудании, резкой общей слабости эта триада в высокой степени определяет диагноз.
Все ослабленные и худые подростки подозрительны на гипокортицизм.
146
Падение уровня кортизола и альдостерона в кро-ви с нарушением циркадного ритма, снижение экскре-ции 17-ОКС с мочой, падение показателей натрия в кро-ви с соотношением Na/K ниже 20 уточняют диагноз.
Проводят пробу Торна (у здоровых после введения АКТГ в дозе 25 ME абсолютное число эозинофилов кро-ви падает в 2 и более раза, а при болезни Аддисона этот феномен отсутствует). Можно провести аналогичную пробу с определением уровня кортизола до и после вве-дения АКТГ: при аддисоновой болезни уровень корти-зола повышается не более, чем на 50 % от исходногою Отрицательная проба с метирапоном в сочетании с положительной пробой с АКТГ говорят о вторичной недостаточности надпочечников.
Обнаружение аутоантител к коре надпочечников или стероид-продуцирующим органам (например, реакции ей непрямой иммунофлюоресценции) уточняет этиоло-гию болезни.
В диагностику должны включаться УЗИ, КТ- и МРТ-методы исследования надпочечников и гипота-ламо-гипофизарной области.
Каждый случай заболевания требует тщательно-го сртизиатричсского исследования вплоть до иммуно-логической диагностики туберкулеза, что важно для выработки оптимальной комплексной терапии.
Пример диагноза. Хроническая надпочечниковая недостаточность туберкулезной этиологии. Тяжелое течение. Стадия декомпенсации. Аддисонов криз от числа. Хронический гипоацидный гастрит. Лямблиоз Туберкулез верхушки правого легкого в фазе уплотне-ния.
Дифференциальный диагноз. Заболевание диффе-ренцируют с различными пигментозами, с болезня-ми, протекающими с истощением, артериальной гипотонией, а при кризе — с другими комами и ины-ми причинами «острого живота». Гиперпигментация наблюдается при:
• естественной и искусственной гиперинсоляция (слизистые не вовлечены, защищенные участки кожи не загорают!);
• синдроме Пейтц-Эгерса (множественный поли-поз желудочно-кишечного тракта с инвагинация ми и кровотечениями; наследуется);
• гемохроматозе Реклингхаузена-Труссо — пигментный цирроз печени с высоким уровнем сыво-роточного железа, часто — сахарный диабет (Kid лесникова Л.Я., Строев Ю.И., 1968);
• пеллагре (в анамнезе — бродяжничество, голо-дание; характерны дерматит, деменция, диарея)
• нейрофиброматозе Реклингхаузена (пигмента-ция кожи над невриномами);
• профессиональных интоксикациях вследствие работы с цветными металлами (профессиональный анамнез);
• педикулезе (расчесы, обнаружение паразитов);
• неспецифическом язвенном колите (подтверждается колоноскопией);
• при порфириях (гиперпорфиринурия).
При спонтанной потере веса у подростков исключают сахарный диабет, особенно диабет 1 типа, тироток- сикоз, нервную анорексию, глистные инвазии (особен но инвазия широкого лентеца — дифиллоботриоз!).
Важно исключить или подтвердить наличие тубер кулеза.
В последнюю очередь подразумевают возможность онкологической патологии (чаще — метастазы в надпочечники), амилоидоза внутренних органов.
Следует иметь в виду, что в годы распада советского и кризиса постсоветского общества в нашей стране прогрессивно нарастало количество подростков с тро- фологической недостаточностью, которая обусловлена разными причинами, в частности, недоеданием (Строев Ю.И. с соавт., 2003).
Низкое артериальное давление может быть при ней- роциркуляторной дистонии, при хронической симпа- тоадреналовой недостаточности {«гипотоничес кой болезни», синдромах Шая-Дрегера и Райли-Дэя), при врожденных и приобретенных пороках сердца и сосудов, миокардитах, язвенной болезни, при ак тивных занятиях спортом, тяжелых интоксикациях и инфекциях, передозировке наркотиков и нейролептиков, при неврастении и анорексии.
Уточняет патологию исследование уровней корти- костероидов и электролитов крови.
СП. Боткин говорил, что врач не ставит диагнозов тех болезней, о существовании которых не знает или забыл.
С этой точки зрения, не будет лишним напомнить в данном разделе о существовании у человека псевдоги- покортицизма {синдром Виндерхёдса-Крусоса), связанного с пониженной чувствительностью тканевых рецепторов к кортизолу. Синдром характеризуется высоким уровнем общего, свободного кортизола крови, АКТГ в крови и дериватов кортизола в моче при клинике умеренного гипокортицизма или же без клинических признаков. Могут быть умеренная артериальная гипертензия и гипокалиемический алкалоз, так как АКТГ повышает уровень кортизола и дезоксикорти- костерона. Полная резистентность тканей к корти золу летальна (Шрейбер В., 1987).
Исходы заболевания и прогноз. В большинстве случаев хроническая недостаточность надпочечников неизлечима.
Прогноз зависит от ранней диагностики.
При активном лечении туберкулеза может наступить выздоровление.
Все больные нуждаются в пожизненном лечении кортикостероидами.
Исходы аддисонова криза в каждом случае непредсказуемы с летальностью до 50 %. Криз развивается постепенно (чаще—ранней весной и поздней осенью), начиная с предвестников — с ортостатичес-ких обмороков, болей в животе («солнечные кризы»), бессонницы.
Внезапное бурное усиление пигментации кожи и слизистых, похудание с нарастающей слабостью, диспепсия (тошнота, рвота, поносы) с болями в животе—грозные признаки начинающегося аддисонова криза.
Прогноз в высокой степени зависит от возникающих интеркуррентных инфекционных заболеваний, от вредных привычек (алкоголь, наркотики, токсикомании), от оперативных вмешательств, даже от случайных событий, например, от удаления зубов (стрессорные ситуации, которые тяжело переносятся больными).
Лечение. Больным запрещаются продукты с избыточным содержанием калия (курага, финики, чернослив, изюм), ограничиваются мясо, картофель, капуста, бобовые. При легкой форме болезни бывает достаточной добавка к диете поваренной соли при ограничении источников калия.
Лечение заключается в заместительной терапии кортикостероидами (на первом месте — глюкокор-тикоиды, на втором —минералокортикоиды).
Больным предпочтительнее назначать кортизон- ацетат (12,5-50 мг в сутки в 2 приема), который обладает как глюкокортикоидным, так и минералокор-тикоидным действием. Дозы гормонов — всегда индивидуальные, и их необходимо подбирать в условиях стационара. В соответствии с циркадным ритмом целесообразно больным утром давать 2/3, а вечером — 1/3 суточной дозы. Максимальная поддерживающая доза редко превышает 62 мг (2,5 таблетки кортизона.) В начале лечения — дозы большие.
Двухсторонняя адреналэктомия требует ежедневного приема 50-62 мг кортизона-ацетата в сутки. При признаках дефицита минералокортикоидов или при систематической терапии только синтетическими глю- кокортикоидами, не обладающими минералокортико-идными эффектами {преднизон, преднизолон), нужно периодически вводить внутримышечно по 5-10 мг де- зоксикортикостерона ацетата (ДОКСА). При вторичной надпочечниковой недостаточности компенсации ми-нералокортикоидами обычно не требуется.
Повышение потребности в глюкокортикои-дах — признак возможного развития аддисонова
147
 криза, что требует срочного направления больного подростка в эндокринологический стационар. При лечении только глюкокортикоидами дополнительно дают 8-10 г поваренной соли в день.
криза, что требует срочного направления больного подростка в эндокринологический стационар. При лечении только глюкокортикоидами дополнительно дают 8-10 г поваренной соли в день.
Показаны витамин С (200-500 мг в сутки), анти- гипоксанты (рибоксин, инозин, цитохром-С), поливитамины, а при половых нарушениях — анаболичес кие стероиды, особенно у девушек, у которых надпочечники — единственный их источник.
Больным противопоказаны гипотензивные, наркотические и снотворные средства, транквилизаторы (они их плохо переносят).
Весьма рискованно применять инсулин, что иногда практикуют у истощенных подростков («для аппетита»).
Нежелательны слабительные (обезвоживание!). При доказанной туберкулезной этиологии заболевания проводят активную терапию туберкулеза. Практика показывает, что противотуберкулезные препараты у больных с хроническим гипокортицизмом всегда улучшают их общее состояние, даже при недоказанном туберкулезе. В таких случаях чаще пользуются фтивазидом в средних дозах. При выявлении сифилиса проводят соответствующее его лечение.
Неотложная помощь при аддисоновом кризе оказывается по принципам терапий острой надпо-чечниковой недостаточности (см. выше — Острая надпочечниковая недостаточность).
Критерием эффективности лечения являются прибавка веса, устранение слабости и пигментации, стабилизация нормального уровня артериального давления. Профилактика. У подростков необходимо своевременно выявлять и лечить любые формы туберкулеза и сифилиса.
Важна профилактика алкоголизма, наркомании, токсикомании и ВИЧ-инфекции.
Скрупулезное лечение глюкокортикоидами существенно для профилактики острой недостаточности надпочечников (самовольное снижение доз глюкокор- тикоидов или их неразумная отмена смертельно опасны).
Перед любыми стрессорными ситуациями: при инфекциях, перед операциями, перед экстракцией и лечением зубов доза глюкокортикоидов должна увеличиваться в 2-3 раза.
При хроническом гипокортицизме запрещено загорать на солнце и в соляриях (обостряются возможный туберкулез и гипокортицизм!).
Диспансеризация. Диспансерная группа — Д-3. Наблюдение эндокринологом и фтизиатром — постоянные, а другими специалистами — по показани-
148
ям. С диспансерного учета у эндокринолога и фтизи-атра больные практически никогда не снимаются. Неукоснителен принцип систематического активного наблюдения.
Наблюдение противотуберкулёзным диспансером дает в России право больным с хронической недоста-точностью надпочечников на бесплатность всех видов медицинской помощи.
Все случаи впервые выявленного заболевания, а также его обострений требуют немедленной госпитализации в эндокринологическое или реанимационное (по показаниям) отделения.
Показано систематическое направление в санато-рии туберкулезного профиля.
Все больные с такой патологией рассматриваются как инвалиды с пониженной приспособляемостью, жи-вущие на грани безопасности. Им подходит легкая pa-бота, желательно — на дому, где подростки с хроничес-кой недостаточностью надпочечников также требуют неусыпного наблюдения.
Однако скрупулезная рациональная комплексная терапия и постоянная подчеркнутая забота медиков и ок-ружающих о больном аддисоновой болезнью может позволить ему заниматься ответственной мыслитель-ной деятельностью. Примером может быть Джон Кен-неди, который страдал первичной недостаточностью коры надпочечников. На протяжении последних лет жизни, получая пероральные глюкокортикоиды и те- стостерон в инъекциях, он стал прославленным пре-зидентом США, ведя при этом активную личную жизнь с частыми зарубежными визитами и подвергаясь ко-лоссальным нервно-психическим и умственным пере-грузкам.
Вопросы экспертизы. Группа здоровья — 5.
Подростки с хроническим гипокортицизмом осво бождаются от всех видов физкультуры и от экза менов.
Профилактические прививки проводятся лишь при крайней в них нуждаемости и с предварительным повышением доз принимаемых больным подростком глю-кокортикоидов в 2-3 раза.
Больные должны постоянно носить с собой специальную личную карточку (бирку), как и боль-ные сахарным диабетом, с указанием диагноза заболевания и получаемой дозы глюкокортикоидов. Это помогает в диагностике и в оказании помощи при ад-дисоновых кризах с коматозными состояниями, ког-да анамнез собрать бывает невозможно.
Призыву в армию они не подлежат, а заболев, с военного учета снимаются. Поступление в военные учебные заведения при всех формах гипокортицизма абсолютно противопоказано.
ФЕОХРОМОЦИТОМА
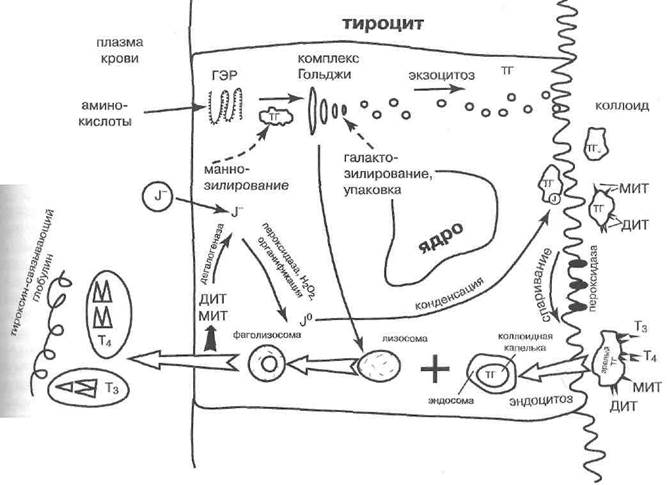
Определение. Феохромоцитома — неопластическое заболевание, обусловленное избыточной секрецией катехоламинов опухолью мозгового вещества надпочечников или вненадпочечниковой локализации.
Синонимы: хромаффинома (доброкачественная или злокачественная), феохромобластома (при злокачественном характере опухоли), параганглиома.
Распространенность. Частота феохромоцитомы достигает 0,3-3 % от общей заболеваемости среди больных с артериальной гипертензией, делая эту опухоль важной причиной вторичной гипертензии. Феохромоцитома имеет среднепопуляционную частоту не менее 2:1000000 населения и наиболее типична для лиц зрелого возраста (30-50 лет), хотя нередка и у подростков. Дети и подростки среди больных с феохромоци-томой составляют около 10 %. Впервые в мировой практике заболевание описано именно у подростка — у 18-летней девушки (Френкель, 1886). Так как они зачастую могут оставаться при жизни нераспознанными, некоторые авторы оценивают их частоту намного выше — до 20 на 1 млн населения (Казеев К.Н., Ан тонов А.Н., 1991).
Этиология и патогенез. Хромаффинома — собирательный термин, которым называют как доброкачественные, так и злокачественные опухоли мозгового вещества надпочечников, параганглиев или симпатических ганглиев. Доброкачественная хромаффинома (90 % случаев) именуется феохромо-цитомой, а злокачественная (остальные 10% случаев) — феохромобластомой.Следует иметь в виду возможность гиперпродукции катехоламинов и в ганглионевромах. Нефункционирующие образования того же генеза в параганглиях иногда называют хемо- дектомами.
Первым в России прижизненно распознал феохро- моцитому выдающийся отечественный кардиолог Г.Ф. Ланг, а подтвердил этот исторический диагноз на операции не менее выдающийся отечественный хирург СИ. Спасокукоцкий. С развитием современных лабораторных методов определения катехоламинов и способов прижизненной визуализации опухолей качество диагностики хромаффином улучшилось.
Мозговое вещество составляет около 10% веса надпочечников. Оно заключено в голове и теле каждого надпочечника и отсутствует в его хвостовой части.
Мозговое вещество надпочечников представлено хромаффинной тканью, названной Н. Вюльпианом (1856) по способности окрашиваться в зеленовато-коричневый цвет солями железа. Хромаффинные клет-
ки так названы за своё сродство и к солям хрома, обусловленное присутствием катехоламинов.
Хромаффинная ткань — часть функционально единой и эмбриогенетически родственной симпатохромаф-финной системы организма, включающей, помимо неё, симпатическую нервную систему (КрайерФ.Э., 1987). Симпатохромаффинная система участвует в патогенезе многих заболеваний и синдромов у человека (гипертонической болезни, некоторых вторичных гипертензий, гипо- и гипергликемий, аритмий, ортостатического коллапса и так называемой «гипотонической болезни»). Ряд этих заболеваний и синдромов поражают лиц подросткового возраста.
Хромаффинная ткань мозгового вещества организована в балки и гнездоподобные скопления вокруг богатой сосудистой сети, анастомозирующей с сосудами коры надпочечников.
По этим сосудам часть артериальной крови, поступающей от ветвей почечных и диафрагмальных артерий и аорты в капилляры коркового вещества, переходит затем в мозговое, но большая её доля проходит по перфорирующим сосудам от капсулы надпочечника — прямо в мозговое вещество. Побывав в его синусоидах и приняв продукты секреции мозгового вещества, часть венозной крови может поступать обратно в синусоиды коркового вещества через анастомозы.
Предполагается, что это создает дополнительные возможности для координации продукции катехолами нов и кортикостероидов, а градиент гормональных начал, аутокоидов и цитокинов, создаваемый в сосудах, участвует в дифференцировке зон коры надпочечника (Хорнсби П., Кривелло А., 1983).
Кроме мозгового слоя надпочечников, хромаффи-ноциты содержатся у человека и в других параганглиях.
Параганглии — небольшие органы, происходящие из нервного гребня и расположенные паравертебраль-но — от основания черепа до крестца, а также в стенках мочевого пузыря. Они находятся вблизи симпатических стволов и в стенке крупных сосудов (примерами являются крупнейшие из них — каротидные тельца, подключичные тельца, яремные клубочки и аорто-лёгочные тельца). В виде отдельных клеток хромаффиноциты лежат по ходу вегетативных нервов и в автономных ганглиях. Хромаффинная ткань на протяжении раннего по-стнатального периода подвергается бурным онтогенетическим изменениям. У плода и детей первых 3-4 месяцев жизни хромаффинная ткань особенно развита и образует самые крупные парааортальные ганглии —
149
органы Цукеркандля, локализованные в буром жире близ места ответвления нижней брыжеечной артерии.
Секреторные функции хромаффинной ткани надпочечников характеризуются следующим.
За пределами мозгового вещества надпочечников синаптическими передатчиками симпатических нейронов служат норадреналин (норэпинефрин) и дофамин. Мозговое вещество надпочечников способно их вырабатывать, особенно у плода, у которого норадреналин — основной катехоламин стресса. Но резко преобладающим катехоламином в секрете этого отдела надпочечных железу взрослых является адреналин, он же — эпинефрин (фон Эйлер У.С., 1946).
У новорожденных крыс адреналиновые клетки в мозговом веществе надпочечников составляют 75%. Это происходит из-за большой активности в мозговом веществе надпочечников (но не в других параганглиях) фермента фенилэтаноламин-N-метилтрансфе-разы, превращающей норадреналин в адреналин. Пути биосинтеза и деградации катехоламинов в хромаффиноцитах надпочечников представлены на рис. 50.
Ключевым ферментом при продукции катехолами нов является тирозингидроксилаза. Интересно, что обнаружены антитела против этого энзима, значительно активирующие его функцию (Хэйкок Дж., Уэймур Дж.,
1982). Это позволяет ставить вопрос о возможности возникновения аутоиммунной гиперфункции хромаффино-цитов.
Мозговое вещество надпочечников продуцирует не только катехоламины, но и нейропептиды — нейро- тензин, мет-энкефалин и $-эндорфин (Ливетт Б. с соавт., 1981). Проопиомеланокортин экспрессирует-ся в самих хромаффинных клетках и может поступать сюда из гипофиза для протеолитической обработки. В хромаффинных клетках можно выявить также присутствие нонапептидов, вещества Р, нейропепти-да Y , динорфина, вазоактивного интестиналъного полипептида и бомбезина.
Регуляция деятельности мозгового вещества надпочечников (в отличие от коркового) главным образом нервная, и опосредована она холинергическим симпатическим сигналом. Нервный путь, активирующий хромаффиноциты, начинается в гипоталамусе и проходит через ретикулярную формацию, спинной мозг, солнечное сплетение. Секреторные ветви малого чревного нерва иннервируют хромаффиноциты и стимулируют их секрецию, причём доходящие до мозгового вещества волокна являются постганглионар-ными, так как само мозговое вещество — не симпатический ганглий, как неверно указано в некоторых старых источниках, а именно параганглий, Нейроны второго порядка в этом симпатическом пути
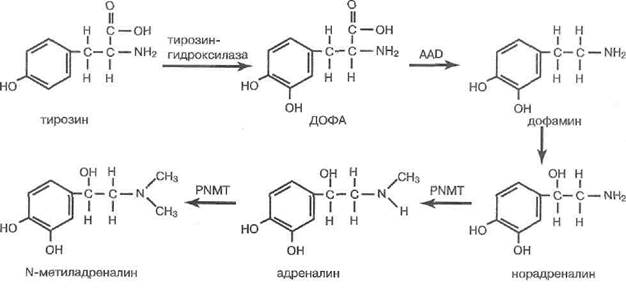
Рис. 50. Биосинтез катехоламинов в мозговом веществе надпочечников. AAD — декарбоксилаза ароматических аминокислот, PNMT-фенил-этаноламин-М-трансфераза
150
не сконцентрированы в отдельном узле, а согласно направлению их эмбриональной миграции, рассеяны по всей его протяжённости — от пограничного ствола и до самого мозгового вещества (Ильина В.И., 1946).
Достигающие надпочечников парасимпатические ветви блуждающего и диафрагмального нервов передают, по-видимому, вазомоторные импульсы и не являются секреторными. Гуморальные факторы имеют для секреции катехоламинов вспомогательное значение.
Кортикостероиды при их длительно повышенном уровне в оттекающей от коры надпочечников крови могут усиливать синтез фермента тирозингидроксилазы и тем самым стимулировать продукцию катехоламинов. Стимулирующим действием на катехоламиноге-нез обладает и пептид нейротензин, выделяемый в мозговое вещество надпочечников нервными окончаниями.
До момента секреции адреналин хранится в особых гранулах вместе с упаковочным белком хромограни-ном и АТФ. Ацетилхолиновый сигнал обусловливает входной ток кальция в цитоплазму хромаффиноцитов, активацию сократительных белков цитоскелета и эк-зоцитоз содержимого гранул в кровь.
Открытые в мозговом веществе надпочечников К.Эронке (1960) адреналинпродуцирующие и норад-реналинпродуцирующие клетки различаются диаметром гранул. У последних диаметр гранул меньше, плотность их выше, и они могут быть отдифференцированы при окраске йодатом (положительная — у норадрено-цитов) и по флюоресценции (положительная—у норад- реналина). Эти два клеточных типа получают раздельную иннервацию, что создает основу для раздельной секреции разных катехоламинов (Шрейбер В., 1987). Отдельных дофаминоцитов в мозговом веществе не найдено.
Во время сна секреция катехоламинов надпочечниками минимальна. Содержание их в крови невелико и при обычной жизнедеятельности. Однако любая активация симпатической нервной системы, особенно при стрессе (травмы, опасность, гипоксия, гипогликемия, боль, физическая нагрузка, гипертермия), ведет к массированному катехоламиновому секреторному ответу.
При сильном стрессе уровень катехоламинов в крови возрастает в 4-5 раз. Родовой стресс приводит к абсолютно максимальным значениям концентрации ка техоламинов. При максимальной стимуляции в условиях тяжёлого стресса в крови зарегистрированы концентрации адреналина в 50, а норадреналина — в 20 раз выше нормы (Хокер Ф., 1988).
Катаболизм гормонов происходит в основном в ходе их окисления и метилирования при обратном захвате хромаффинными клетками, а также путем образования парных соединений в печени. С мочой выводится только 5 % дериватов катехоламинов. Время полувыведения катехоламинов из крови — 1-2 мин. Основными продуктами распада этих гормонов вне центральной нервной системы являются ванилил-миндальная и го- мованилиновая кислоты.
В клетках-мишенях имеется 3 подтипа в-адренало-вых рецепторов и 2 подтипа — а-адренорецепторов (последние, в свою очередь, представлены семью разновидностями). Ни одно природное вещество не действует строго избирательно на какой-либо один вид ад-ренорецепторов (Шрейбер В., 1987). Рассмотрение вопросов адренорецепции выходит за рамки данной книги и представлено в современных фармакологических руководствах (см. Хоффман Б.Б., 1998).
Ниже приводятся лишь данные, необходимые для понимания контролируемых гормонами мозгового вещества надпочечников эффектов и симптомов соответствующих болезней.
Адреналин — главный агонист в2-адренергических рецепторов, а норадреналин влияет в основном на в1-адренорецепторы, которые, впрочем, примерно с равной силой стимулируются и адреналином.
На а-адренорецепторы влияют оба главных кате- холамина, причём норадреналин — чуть сильнее адреналина — на а1-рецептор, а адреналин — заметно активнее норадреналина — на а2-рецептор (Шрейбер В., 1987). В связи с этим действие главных продуктов хромаффинных клеток на органы и ткани не идентично (табл.5). Катехоламины действуют на типичные G-протеин-ассоциированные рецепторы. В передаче их эффектов в клетках большую роль играют в случае в-рецепторов — аденилатциклазно-протеинкиназный посредник, а в случае а-рецепто-ров — фосфатидил-инозитоловый мессенджер. В последнем случае активность аденилатциклазных механизмов не стимулируется, а тормозится. Каль-модулин-кальциевые модуляторы участвуют в передаче сигнала от обоих типов рецепторов.
Дофамин влияет на D-рецепторы, которых обнаружено не менее 4 подтипов (D1, D2, D4, D5). Эти рецепторы — из того же семейства, что и адренорецепторы. Стимуляция D1-рецепторов усиливает, a D2-peцeпто-ров — ослабляет работу аденилатциклазы и соответствующих протеинкиназ А. Более слабо этот катехо-ламин действует на р-адренорецепторы, а еще слабее — на а-адренорецепторы.
151
Таблица 5
Распределение и результаты стимуляции основных подтипов катехоламиновых рецепторов
| Под тип | Ткани и органы | Эффекты |
| а1 | Гладкие мышцы иннервируемых сосудов Мышцы мочеполового тракта Дилататор зрачка Пиломоторные мышцы Сердце Желудочно-кишечный тракт Слюнные и потовые апокринные аксиллярные, ладонные и подошвенные железы | Сокращение Вазоконстрикция (в коже -норадреналин) Эякуляция, сокращение матки и мочевого пузыря Сокращение, дилатация, адаптация к зрению вдаль Пилоэрекция Положительный инотропный, хронотропный Увеличение тонуса сфинктеров Торможение перистальтики Секреция амилазы Экскреция пота |
| а2 | Гладкие мышцы желудочно-кишечного тракта Постсинаптические в центральной нервной системе Тромбоциты Лимфоциты Адренергические и холинергические нервные окончания Гладкие мышцы некоторых сосудов Липоциты Эндокриноциты | Расслабление Различные, в зависимости от отдела Бодрость, тревога, страх Агрегация Хоуминг Подавление освобождения медиаторов Сокращение, вазоконстрикция Подавление липолиза (в буром жире - липолиз, калоригенез) Подавление секреции инсулина, глюкагона, ренина, стимуляция соматостатина |
| в1 | Сердце Эндокриноциты Липоциты | Положительный инотропный, дромотропный, хронотропный, аритмогенный Снижение продукции ренина Липолиз |
| в 2 | Гладкие мышцы дыхательных путей, матки, мочевого пузыря, сосудов Скелетные мышцы Печень Эндокриноциты Гладкие мышцы желудочно-кишечного тракта | Расслабление, бронхо-и вазодилатация (в том числе -здоровых коронаров-адреналин) Усиление захвата К+ и гликогенолиза. Увеличение производства лактата, вазодилатация Стимуляция гликогенолиза, глюконеогенеза, выхода в кровь катионов калия Активация секреции ренина, инсулина, глюкагона, соматостатина, эритропоэтина Расслабление |
| Под тип | Ткани и органы | Эффекты |
| в 3 | Липоциты | Стимуляция липолиза, калоригенез |
| Гладкие мышцы | Расширение сосудов почек и брыжейки, вазоконстрикция других бассейнов |
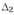
| Нервные окончания | Модуляция освобождения медиаторов. В ЦНС - про-лактостатический эффект |
Следует обратить внимание на то, что адреналин повышает работу сердца и расширяет артериолы сердца, мозга и мышц, сужая сосуды кожи и кишок. Нор-адреналин незначительно влияет на сердце, но выра-женно повышает общее периферическое сопротивление за счет общего вазоконстрикторного эффекта. Таким образом, оба гормона способствуют систолической, а норадреналин - еще и диастолической артериальной ги-пертензии (подробнее - см.: В. Шрейбер, 1987).
Регуляция выделения катехоламинов мозгового вещества надпочечников и их биологические эффекты как основа проявлений патологии их мозгового ве-щества представлены на рис. 51.
У подростков возможна и гипофункция мозгового вещества надпочечников, для которой типичны прежде всего гипотензивный синдром и так называемая «автономная нейропатия».
Но спектр нарушений функций мозгового вещества надпочечников включает прежде всего состояние гиперфункции этого нейроэндокринного органа.
Среди них выделяются рассматриваемые в данном разделе подробно гормонообразующие опухоли — фео-хромоцитома и другие, приводящие к злокачественной гипертензии и к тяжелому нарушению обмена веществ.
Этиология феохромоцитомы в конкретных случаях часто не известна. Но поскольку это заболевание неопластическое, то не подлежит сомнению причинная роль мутагенов и соматических, а нередко — и генеративных мутаций. Не менее 1/10 случаев являются наследственно-семейными, аутосомно-доминантными.
По образному выражению Р. Де Лилли (1989), «фе- охромоцитома — зверюшка общительная и любит компанию».
Дело в том, что феохромоцитома входит в структуру пяти разных наследственных плюригландулярных синдромов — по 40 % всех семейных случаев относятся к синдромам MEN 11а и MEN 11 b (см. выше), а 1 % приходится на болезнь фон Реклингхаузена {семейный нейрофиброматоз с феохромоцитомой). Остальные наблюдаются в структуре следующих заболеваний: — синдрома фон Гиппеля-Линдау (частота 1:36000), аутосомно-рецессивный дефект—в хро-
152
 мосоме 3. Проявления — гемангиобластома центральной нервной системы (чаще—мозжечка), фе-охромоцитома, ангиомы сетчатки, карцинома почки, кисты поджелудочной железы и почек, цистаденомы придатка яичка; - синдрома Штруге-Краббе-Вебера (частота — 1:10000), носит спорадический характер, генети-
мосоме 3. Проявления — гемангиобластома центральной нервной системы (чаще—мозжечка), фе-охромоцитома, ангиомы сетчатки, карцинома почки, кисты поджелудочной железы и почек, цистаденомы придатка яичка; - синдрома Штруге-Краббе-Вебера (частота — 1:10000), носит спорадический характер, генети-
ческий дефект неизвестен. Проявления — ангио-матоз мозговых оболочек и кожи — в области иннервации VII черепно-мозгового нерва, кальцификация участков мозга, задержка умственного развития, судороги, хромаффиномы. В случае MEN-синдромов этиология опухоли связана с экспрессией мутаций протоонкогена RET,
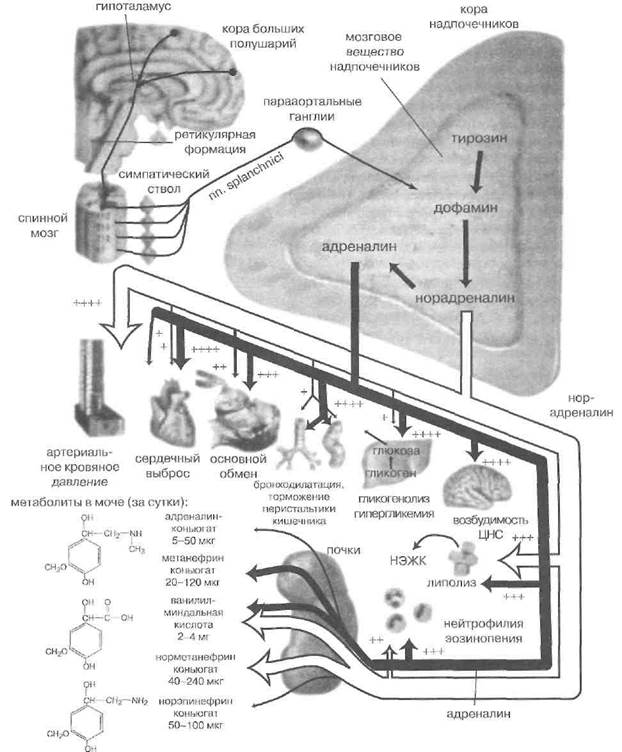
Рис. 51. Регуляция адреномедуллярной секреции и биологические эффекты катехоламинов (по Ф. Неттеру, США)
153
 локализованного в хромосоме 10qll.2 и кодирующего рецептор-ассоциированную тирозинкиназу. Мутации бывают различными — либо мутирует экстрацел-люлярный цистеинсодержащий домен белка RET (при синдроме MEN На), либо меняется треонин на мети-онин во внутриклеточном домене того же белка (при MEN 11b). Изредка при этом наблюдается не опухоль, а лишь диффузная гиперплазия мозгового слоя надпочечников.
локализованного в хромосоме 10qll.2 и кодирующего рецептор-ассоциированную тирозинкиназу. Мутации бывают различными — либо мутирует экстрацел-люлярный цистеинсодержащий домен белка RET (при синдроме MEN На), либо меняется треонин на мети-онин во внутриклеточном домене того же белка (при MEN 11b). Изредка при этом наблюдается не опухоль, а лишь диффузная гиперплазия мозгового слоя надпочечников.
Остальные случаи хромаффином — спорадические. С. Дж. МакФи (1997) остроумно называет хро-маффиному «десятичной» опухолью, имея в виду, что 1/10 случаев имеет вненадпочечниковую природу (эктопические феохромоцитомы чаще находят около почек, но они могут быть и в грудной клетке, и даже в головном мозге — рис. 52). Десятичный принцип простирается и на другие особенности феохромоцитомы: 1/10 — расположена вне брюшной полости, в 1/10 наблюдений — опухоль множественная, в 1/10—имеет двусторонний характер, и в довершение к этому — по 10 % случаев возникают у детей или подростков, 10% не сопровождаются гипертензией, 10 % — злокачественные.
Доброкачественные феохромоцитомы чаще всего невелики по размерам — весом до 300 г, но злокачественные феохромобластомы могут достигать громадной величины (более 2 кг). Описан вес и в 3,6 кг!
Феохромоцитомы, особенно в наследственных случаях, как правило, одиночные, с типичным размером — от 1 до 5 см. На разрезе они красно-кофейного цвета (рис. 53). Они не прорастают в ткани. Тип строения феохромоцитом ближе к ткани мозгового вещества надпочечников и может быть трабекулярным или альвеолярным. У некоторых феохромоцитом и многих феохромобластом он — хаотический.
В отличие от феохромоцитом, феохромобластомы прорастают в окружающие ткани и метастази-руют в региональные лимфоузлы, лёгкие, печень и кости. Злокачественность не мешает феохромоб-ластоме вырабатывать гормоны, как зрелой ткани. Это — яркое свидетельство того, что ни в коем случае не правомочно отождествлять в онкологии понятия «злокачественность» и «дедифференцировка» (Зайчик А.Ш., Чурилов Л.П., 2002).
Большинство хромаффином секретируют в основном норадреналин. Экстраадреналовые опухоли адре налина вообще не вырабатывают. Некоторые адрена-ловые образуют поровну адреналин и норадреналин: Реже (обыкновенно при MEN-синдромах) встречается
154
Рис. 52. Типичная и возможные эктопические локализации хро-маффином (по С. Зографски, 1973)
чисто адреналиновая секреция. Редкие злокачественные хромаффинобластомы способны вырабатывать преимущественно дофамин, что сопровождается экскрецией больших количеств гомованилиновой кисло- ты. Как апудоцитарные клетки хромаффиноциты способны и к продукции других гормонов. Опухоли-хро- маффиномы могут вырабатывать существенные коли-чества энкефалинов, АКТГ, ВИП, серотонина, эрит- ропоэтина, интерлейкина-6 — это вносит вклад в патогенез и симптоматику. Маркерами хромаффином служат хромогранин и нейронспецифическая енолаза, Именно последнее обстоятельство позволяет отнести их к апудомам.
Кроме хромаффином, в мозговом веществе надпочечников и в параганглиях нередко бывают ней- робластомы. Это — весьма злокачественные опухоли из нейробластов нервного гребня. Они являются самыми частыми солидными экстракраниальными опухолями у детей до 5 лет, а у подростков практически не встречаются. Причиной опухоли служит амплификация онкогена N-myc. Этот онкоген в норме представлен одной копией в коротком плече хромосомы 2. В результате его амплификации появляется множество копий данного онкогена, которые могут располагаться в ядрах клеток опухоли экстрахромосомно в виде характерных сателлитов — малых двойных хро-матиновых телец. Копии гена переносятся и в хромо-
сому 13, где выглядят как гомогенно окрашиваемый регион длинного плеча.
Часто в опухолевом клоне имеется и аномалия хромосомы 1 (частичная моносомия 1 из-за делеции части короткого плеча этой хромосомы). Все эти характерные признаки важны для цитогенетической диагностики нейробластом. В структуре опухоли характерны розетки Гомера-Райта — скопления примитивных нейробластов вокруг центрально расположенной гомогенной массы эозинофильных нервных волокон.
Эти опухоли могут вызвать некоторое увеличение уровня циркулирующих катехоламинов и содержат нейронспецифическую енолазу. Но, в отличие от хро- маффином, они не обусловливают столь значительного избытка катехоламинов и не выделяют хромограни-на. Нейробластомы характеризуются инфильтратив-ным агрессивным ростом, метастазируют в кости черепа (метастазы Гетчинсона), обусловливая, в частности, небазедов экзофтальм, а также в печень (метастазы Пеппера) и в костный мозг.
Неметастазирующие доброкачественные гангли- оневромы тех же локализаций и происхождения также могут повышать уровень катехоламинов в крови, но не образуют хромогранина. Их маркером служит белок S100. Эти опухоли поражают и детей, и взрослых.
По некоторым данным, возможно одоброкачест-вление нейробластом, при котором их клетки спонтанно созревают и превращаются в шванноциты и многоядерные гигантские ганглиоциты. Нейроблас- тома с признаками созревания считается переходной и квалифицируется как ганглионейробластома. В конечном итоге, после полного созревания, возможна её трансформация в ганглионеврому, что является чуть ли не единственым примером подобного рода в онкологии.
Патогенез феохромоцитомы определяется выс вобождением из опухолей гормонов и реакцией тканей на их сигналы.
Более чем у половины больных феохромоцитомы проявляются частыми (от нескольких раз в неделю до 25 раз в сутки) катехоламиновыми кризами. В значительном проценте случаев (из-за меньшей секреторной активности опухоли и десенсибилизации тканей к катехоламинам) имеется хроническое течение с редкими кризами. Наконец, опухоль может быть бессимптомной («немой»).
При феохромоцитоме гиперсекреция адреналина проявляется большими вегетативно-обменными

Рис. 53. Макропрепарат феохромоцитомы, внешний вид и на разрезе (по С. Зографски, 1973)
нарушениями, а избыток норадреиалина в первую очередь — стойкой артериальной гипертензией.
Артериальная гипертензия может быть постоянной и кризовой и объясняется усилением насосной деятельности сердца и повышением периферического сопротивления. Гиперренинемия может затруднять работу прессорного натрийуретического разгрузочного механизма. Еще большую роль играют прессорные центральные эффекты катехоламинов. У больных — бледное лицо и холодное влажное рукопожатие (за счет периферического вазоконстрикторного действия, опосредованного через ос-рецепторы). Характерны обмороки и ортостатическая гипотензия, так как снижение объема плазмы из-за периферической вазокон-стрикции ведет к уменьшению возможностей компенсации уровня системного артериального кровяного давления при постуральных изменениях.
Основной обмен повышен. Кислотно-основное равновесие сдвинуто в сторону метаболического ацидоза, имеется гиперлактацидемия. В крови — избыток жирных кислот и гиперкалиемия.
Толерантность к глюкозе уменьшается. При малых функциональных ресурсах В-клеток панкреатических островков может быть вторичный сахарный диабет.
До 28 % случаев протекают с лихорадкой на фоне кризов. В развитии лихорадки велика роль не только повышенного под действием катехоламинов калориге-неза, но и гиперпродукции интерлейкина-6—эндогенного пирогена. Больные плохо переносят жару, как и лица, страдающие гипертирозом.
Избыток энкефалинов создаёт симптоматику так называемых «вагальных кризов» — с падением дав-
155
ления и другими симптомами, имитирующими действие парасимпатической вегетативной нервной системы (10%). Продукция вазоактивного интести- налъного полипептида дополняет картину болезни диареей (6 %). Выработка паратпрокринина или ас-социированых с ним пептидов ведет к гиперкальцие-мии (4 %). При секреции хромаффиномой АКТГ формируется картина синдрома эктопической продукции адренокортикотропина (см. выше). При этом, в частности, наблюдается не ацидоз, а гипокалиемический алкалоз.
Клиника. Клиника доброкачественной и злокачественной феохромоцитомы практически одинакова.
Подростки жалуются на сердцебиения, головокружения, головные боли. Вследствие расстройств церебрального кровообращения при одновременной продукции опухолью серотонина особенно характерны головные боли.
Нередко ощущаются боли в животе без четкой их локализации и связи с приемом пищи. При легкой форме заболевания подростки зачастую годами лечатся «от живота». Такие боли иногда служат-поводом к операции, приводящей к катастрофическим последствиям. Бывают тошнота и рвота.
Вес подростков обычно понижен. Под кожей по ходу нервных стволов могут обнаруживаться единичные или множественные невриномы — нейро-фиброматоз фон Реклингхаузена, который у детей и подростков особенно часто сочетается с феохромо-цитомой.
Все указанные симптомы протекают на фоне эпизодических или стойких повышений артериального давления.
Артериальная гипертензия — основной симптом болезни. При дофаминовой феохромоцитоме артериальное давление может вообще не повышаться.
Феохромоцитома течет циклически, с постоянно учащающимися пароксизмальными кризами, которые возникают от 1-2 раз в месяц до десятков раз в сутки и которые прогрессируют и встречаются чем дальше, тем чаще. Продолжительность таких катехоламино-вых атак — от 5 минут до суток и более.
Их провоцируют механические воздействия на опухоль — повышение внутрибрюшного давления при акте дефекации, при физических усилиях (например, подтягивание на турнике, подъем штанги), при физи-кальном исследовании брюшной полости (глубокая и грубая пальпация живота), при стрессе, при приеме ингибиторов МАО и ряда адренергических лекарств.
156
При локализации опухоли в стенке мочевого пузыря описаны необычные кризы в процессе мочеиспуска-ния.
Пароксизмы выражаются в приступах гипертен-зии (систолическое давление — до 320 мм рт. ст.!)с потемнением в глазах, головокружением, мигренепо-добной головной болью, сердцебиениями, тахиарит-мией, дрожью в теле, жаром, а затем — проливным холодным потом. Появляются давление в груди, боли в сердце, пояснице и животе, онемение или оцепене-ние конечностей, жажда, слюнотечение, рвота, час-тые позывы на мочеиспускание (поллакиурия).
Это может сопровождаться тревожным состояв нием и неподдельным страхом (эффект избытка ад- реналина — «гормона тревоги»). Бывают эмоцио-нальная лабильность, слуховые и зрительные галлюцинации, психическая дезориентация, дизартрия и даже эпилептиформные судороги. Зрачки расшире-ны. Возможны диплопия и временное ухудшение зре-ния из-за нарушения аккомодации и ишемии сетчат-ки. Лицо может быть мертвенно-бледным. Кожа -мокрая, «гусиная».
При феохромоцитомных кризах практически все-гда отмечается гипергликемия, обусловленная кон-тринсулярным эффектом катехол аминов. После криза в моче может обнаруживаться глюкоза.
Избыток катехоламинов повышает потребность миокарда в кислороде, создаёт тенденцию к относи-тельной коронарной недостаточности, что может выз-вать симптомы грудной жабы. Формируется миокар- диодистрофия, может быстро развиться застойная сердечная недостаточность.
Для функции желудочно-кишечного тракта харак-терны запоры. Могут возникать атония кишечника и кишечная непроходимость. Больные худеют, теряя жировые запасы, причем избыток свободных жирных кислот в крови дополнительно усиливает риск аритмий и калоригенных эффектов.
Из-за спазма шейки мочевого пузыря может возни-кать задержка мочеиспускания.
Характерны (особенно — на высоте криза) эрит-роцитоз (он крайне выражен в случае продукции опухолью и эритропоэтина), лимфоцитоз, эозинопения, лейкоцитоз, увеличенная СОЭ (особенно при гиперпродукции интерлейкина-6). Повышается свёртываемость крови.
Симпатоадреналовый криз обычно заканчивается фазой, когда доминируют явления «противорегуля-ции» — падает артериальное давление, краснеет лицо, замедляется пульс. Пациент испытывает тошноту,
рвоту, гиперсаливацию, отделяется большое количество мочи, как после приступа пароксизмальной тахикардии.
Продукция различных гормонов при хромаффино-мах может отклонять картину пароксизмов от описанной—наиболее типичной.
к Так, хромаффиномы нор адреналинового типа отличаются приступами гипертензии и красной, тёплой кожей из-за периферической вазодилатации. При подобных опухолях тип течения болезни может быть интер-миттирующим, кризовым, с нормализацией давления между приступами. Адреналиновые хромаффиномы характеризуются более кратковременными кризами. В то же время метаболические сдвиги при высокой продукции адреналина могут быть более выраженными, чем в случаях, когда опухоль вырабатывает только но- радреналин.
Между кризами обычны общая слабость, утомляемость, малоподвижность, худоба при хорошем аппетите, ухудшение зрения, реже — судороги и параличи, неустойчивый стул и даже — мелена. При осмотре обращает на себя внимание бледность подростка. Конечности могут быть «ледяными», а преходящий цвет тыла стоп, кистей и голеней — багро-во-цианотичный. У подростков феохромоцитома протекает с более выраженными изменениями сердца и сосудов, чем у взрослых (Левина Л.И., 1989). У них более выражена тахикардия, и выше поднимается артериальное давление.
Между приступами самочувствие может быть вполне нормальным, нередко — даже при наличии артериальной гипертензии.
У больных подростков часто выявляют увеличе ние щитовидной железы, экзофтальм, гипертрихоз.
Осложнения. Срок жизни больных хромаффино- мой укорочен из-за ее осложнений, даже если сама опухоль и доброкачественная.
Среди осложнений болезни наиболее опасны ка- техоламиновые кризы.
Криз может быть спровоцирован физическим и нервным перенапряжением, ушибом живота, обильной пищей, тряской ездой, введением в десну перед удалением зуба адреналинсодержащих обезболивающих (новокаина или лидокаина), приемом продуктов, богатых предшественником катехоламинов— тирамином (тирозином) — шоколад, сыр в больших количествах, красное вино, в частности, кьянти.
В момент хирургического удаления феохромоци- томы также реально возникновение тялселого гипер-
теизивиого криза, а после операции — острой недостаточности надпочечников.
Гиперпродукция адреналина может вызвать внезапный гиперадренергический синдром с кровоизлияниями в сетчатку или в мозг. Часто отмечаются проявления лейкоцитокластического васкулита, тромбоэмболи- ческой болезни и ДВС-синдрома. Может развиться синдром Рейно.
Наиболее типичные и тяжелые осложнения включают фибрилляцию желудочков, отек лёгких в связи с левожелудочковой недостаточностью, инфаркт миокарда или почек, но особенно часто — инсульт. Может развиться полная блокада сердца с синдромом Морганъи-Эдамса-Стокса. В миокарде могут возникать некрозы. Терминальное состояние больных феохромоцитомой с преобладанием клиники острого расстройства гемодинамики известно как «катехоламиновый шок».
Возможно развитие острой кишечной непроходи мости и картины «острого живота», провоцирующего опасное для больных хирургическое вмешательство. В желудке могут возникать острые кровоточащие язвы.
На высоте криза бывают случаи острой почечной недостаточности. Развиваются кетоацидоз и лактат-ацидоз. Может обостряться латентный гипертироз.
Классификация. Различают пароксизмальную, постоянную и смешанную формы феохромоцито-мы.
Выделяют также доброкачественную феохромо-цитому, феохромобластому и микроаденоматоз мозгового вещества надпочечников.
По преимущественной продукции катехоламинов различают адреналиновую, нор адреналиновую, дофаминовую и смешанную феохромоцитому.
Диагностика. Классическая триада феохромоци-томы — «тахикардия — потливость — головная боль».
Более вероятна феохромоцитома у худощавых подростков с холодными конечностями и багрово-красными тыльными сторонами кистей, стоп, голеней и коленей, с выраженной потливостью и кризовым течением артериальной гипертензии.
При феохромоцитомных катехоламиновых кри зах выявляют нейтрофильный лейкоцитоз до 30x109/л, часто — гипергликемию, полицитемию. При пробе на толерантность к глюкозе нередко выявляется диа бетический тип гликемической кривой.
Артериальная гипертензия обычно упорная, с обменными нарушениями. На ЭКГ—часты ишемия
157
и метаболические изменения, экстрасистолии, блокады, иногда — узловой ритм, отрицательные зубцы Т. Офтальмолог находит гипертоническую ангиопа-тию сетчатки.
Основной обмен увеличивается до +75 %, часто повышается температура тела. При фиброгастроско-пии обнаруживают острые гастралъные и дуоденальные язвы, патогенез которых сродни острым стрессорным язвам Т. Курлинга (1842), развивающихся при ожоговой болезни. От язв при язвенной болезни они отличаются отсутствием перифокального воспаления и индурации (Курыгин А.А., Скрябин О.Н., 1996).
После феохромоцитомного криза обычно отделяется много светлой «спастической» мочи с протеинурией и гематурией. При диагностике гормонообразующих хромаффином большое значение имеет выявление гиперэкскреции с мочой продуктов деградации катехола- минов, которая не подавляется клонидином (клофели- ном, минипрессом, гемитоном) и имеет, следовательно, автономный источник.
Поэтому одним из самых точных методов диагностики феохромоцитомы считается определение сразу после криза в крови и в суточной моче уровней кате- холаминов и их метаболитов (ванилил-миндалъной кислоты—ВМК), которые могут повышаться в десятки и сотни раз.
Кризы можно провоцировать гистамином, реджи- тином, тропафеном, фентоламином, клофелином и глюкагоном (последнее — менее опасно).
Опасность всех подобных проб — в непредсказуемости подъема уровня артериального давления, почему пробы проводятся только в стационаре при исходном систолическом давлении крови — не выше 150 мм рт.ст., а также при нормальном уровне катехоламинов в крови и в моче. Наготове должны быть в-адреноблокаторы, гипотензивные средства и реанимационное оборудование.
При любой артериальной гипертензии введение указанных провокаторов повышает систолическое давление на 40-45, а диастолическое — на 30 мм рт.ст. При феохромоцитоме цифры давления крови могут удваиваться — с катастрофическими последствиями.
В норме глюкагон кровяное давление не повышает, но при феохромоцитоме под влиянием этого гормона оно резко возрастает.
Перед исследованием катехоламинов в крови и в моче нельзя употреблять в пищу содержащие ванилин продукты (торты, другие выпечные изде-
158
лия, мороженое, шоколад), бананы, цитрусовые так как они могут повышать уровень ванилилми бальной кислоты и привести к ложноположи-тельным результатам. Нельзя также применять анальгин.
Источник повышенной продукции катехоламина выявляют с помощью УЗИ, КТГ и МРТ-метода. Ис-следования касаются брюшной полости и прицельно-надпочечников. Желательно сканирование надпочеч-ников и других областей тела с 13 l J -м em ил-й o д-6 e нзил гуанидином.
При рентгеновской урографии по отклонению тени левого мочеточника судят о возможности хромаффи- номы органа Цукеркандля. Иногда используют пнев-моретроперитонеум.
Критерии диагноза. Кризовое течение артериаль-ной гипертензии с обилием нервно-вегетативной сим-птоматики, тахикардией, потливостью, отсутствием эффекта от обычных гипотензивных средств, похуда-нием, бледностью, повышенным содержанием при кризах лейкоцитов, глюкозы и катсхоламинов в крови или продуктов деградации последних (В M К) в моче -типичны для феохромоцитомы. В сомнительных случаях показаны провокационные пробы.
Подозрение доказывается обнаружением опухоле-вого образования мозгового вещества надпочечни-ков при инструментальных методах диагностики. Пример диагноза. Феохромоцитома левого надпо-чечника, преимущественно — норадреналиновая. Па-роксизмальная форма. Гипертензивный криз от... чис-ла. Кровоизлияние в сетчатку правого глаза. Скрытый сахарный диабет.
Дифференциальный диагноз. Феохромоцито-ма — многоликое заболевание.
Наличие у подростка артериальной гипертен-зии требует исключения десятков ее возможных при чин.
Чаще всего феохромоцитому дифференцируют с гипертонической болезнью, встечающейся у подро-стков редко и протекающей без кризов.
При нейроциркуляторной дистонии кровяное давление не достигает феохромоцитомных цифр, про-текает это расстройство со слабостью, без потливос-ти и повышения уровня катехоламинов в крови и в моче.
Тиротоксикоз при типичной клинике с тахикарди-ей и повышенным уровнем Т3 и Т4 распознать не слож-но.
Медуллярный рак щитовидной железы с арте-риальной гипертензией и диареей требует поиска
MEN -синдрома Сиппла (в крови повышены уровни тирокальцитонина и серотонина).
Трудно распознать дофаминовую феохромоци-тому, протекающую без артериальной гипертензии. Но в её клинической картине также имеют место похудание, боли в сердце, животе, субфебрильная температура, лейкоцитоз при нормальной СОЭ, гипергликемия и глюкозурия.
Исходы заболевания и прогноз. Прогноз при фе- охромоцитоме обусловливается развитием артериальной гипертензии. В целом прогноз неблагоприят ный. Эффект от операции бывает в 90 % случаев, но у 10 % оперированных подростков возможны рецидивы.
Болезнь развивается медленно — в течение 8-10 лет. Четкая клиника развертывается через 2-3 года.
В 6-10 % случаев феохромоцитома проявляет зло качественную природу и может метастазировать в печень, легкие, кости, лимфоузлы, плевру и мозг.
Вследствие высокого артериального давления и гиперкатехоламинемии могут развиться гипертрофическая кардиомиопатия и фиброэластоз эндокарда, дистрофия миокарда, микротромбозы сосудов легких с васкулярным легочным сердцем. Прогноз определяется также развитием вторично-сморщенной почки.
Наблюдаются тяжкие последствия феохромоцитом-ных кризов: инсульты, нарушения психики, геморрагии из острых язв желудка и кишечника, катехоламиновые инфаркты миокарда, почечные и панкреатические осложнения, сахарный диабет.
Кровоизлияние в опухоль дает картину острой не достаточности надпочечников.
Беременность при феохромоцитоме протекает весьма драматично. Возникает спазм сосудов плаценты, что в 70 % случаев дает гибель плода. Поэтому при выявлении феохромоцитомы в первой половине беременности ее нужно прервать, а через 3-4 недели — оперировать феохромоцитому. Во второй половине беременности нужно применять в-адреноблокаторы, а если они не дают пользы, то для спасения ребенка прибегают к кесареву сечению.
Лечение. Установление диагноза феохромоцито мы является абсолютным показанием к операции, так как консервативной терапией получить полную блокаду адренергических структур организма не удается.
В диете исключаются богатые тирамином продукты: сыры, шоколад, какао, красные вина, особенно у тех
больных, которые получают антидепрессанты — ингибиторы МАО, иначе можно спровоцировать гипертен-зивный криз («сырная болезнь»).
Подбирают оптимальные препараты для профилактики феохромоцитомных кризов и их лечения.
При постоянной форме феохромоцитомы используют фентоламин, а при кризах — тропафен, которые вводят при необходимости внутривенно (0,1 мг на кг веса). Синтез катехоламинов тормозит в-метил-тирозин.
В легких случаях феохромоцитомы пользуются Р-адреноблокаторами (обзидан, анаприлин, ате-нолол, соталол, эгилок и др.), но при лечении а-ад-реноблокаторами (празозин, пратсиол, клонидин, гемитон, клофелин, катапрессан и др.) возможны ортостатические коллапсы.
Профилактика. Профилактика феохромоцитомы, как и других гормонопродуцирующих опухолей, пока не разработана и не известна.
Ранняя ее диагностика возможна у подростков в семьях больных синдромом Сиппла, которые рекомендуются поголовно диспансеризировать как группу риска по медуллярному раку щитовидной железы. У членов таких семей часто развивается феохромоцитома.
Все подростки с признаками нейрофиброматоза фон Реклингхаузена должны быть обследованы на возможное наличие феохромоцитомы, особенно при повышениях у них артериального давления.
Диспансеризация. Диспансерная группа — Д-3. Подростки, оперированные по поводу феохромоцито мы, наблюдаются постоянно до полного выздоровления и снятия с учета.
Не оперированные подростки при стабильном течении феохромоцитомы должны осматриваться эндокринологом, невропатологом и окулистом не реже 1 раза в месяц.
Вопросы экспертизы. Подростков с феохромо-цитомой относят к 5-й, реже — к 4-й группам здоровья.
Они должны освобождаться от физкультуры в любых ее формах. Им запрещены физические и психические перегрузки (экзамены), ночная работа, работа в горячих цехах, работа, требующая острого зрения, командировок.
Они подлежат снятию с военного учета. При удачной операции с выздоровлением вопрос о призыве на военную службу решается индивидуально (в мирное время к призыву в армию не годны). В военные учебные заведения они не принимаются.
Клиническая патофизиология щитовидной железы
Щитовидная железа легко подвергается воздействиям неблагоприятных экологических факторов, как из-за своей поверхностной локализации, так и в связи с присущими этому органу метаболическими особенностями (кумуляция йода и других микроэлементов, интенсивное перекисное окисление).
Особая роль среди этих неблагоприятных факторов отводится ионизирующим излучениям и потенциально токсичным компонентам диеты. Немаловажную роль играет и высокая чувствительность данного органа к им-муностимуляции. Вследствие всего этого в среднем не менее 5,5-6 % населения имеют те или иные расстройства тироидной функции, и их число быстро растёт. Чтобы представить себе важность тироидной патологии для здравоохранения, достаточно привести данные о 17-кратном увеличении числа лиц, госпитализированных в эндокринное отделение Мариинской больницы Санкт-Петербурга за последние 10 лет с диагнозом «аутоиммунный тироидит» (Ю.И. Строев с соавт.,1998).
Главным регулятором функции щитовидной железы является аденогипофиз, секретирующий тиро-тропный гормон — тиротропин.
Тиротропин (ТТГ) вырабатывается базофильны-ми тиротропами аденогипофиза. Структура ТТГ сложна, и его продукция вне аденогипофиза маловероятна, но имеются данные (Дольва А. с соавт., 1983) о возможности эктопической продукцим ТТГ в островках Лангерганса, особенно в неонатальном периоде.
Как обнаружено в 1971 г. Т. Ляо и Дж. Пирсом, ТТГ—это гликопротеид, состоящий из двух нековален-тно связанных субъединиц — а (2 углеводных остатка, кодируется в 6-й хромосоме) и (3 (1 углеводный остаток, кодируется в хромосоме 1).
Выработка ТТГв аденогипофизе находится под позитивным контролем гипоталамического тиролибе-рина и негативным — соматостатина (рис. 42, стр. 106). И гипоталамическое, и гипофизарное звенья регуляции тироидной функции чувствительно к обратному контролю сервомеханизма, основанного на понижении продукции ТТГ при избытке тироидных гормонов и самого ТТГ. При этом тироксин и особенно три-йодтиронин, в который тироксин активно превращается в тиротропах гипофиза, действуют на ядерные рецепторы тиротропов, блокируя генетические программы биосинтеза ТТГ
Дополнительными ингибиторами базальной и стимулированной секреции ТТГ служат дофамин и глюкокор- тикоиды, в связи с чем еще классик эндокринологии Н. Пенде (1937) говорил об антагонизме питуитарно-
160
тироидной и питуитарно-супраренальной «осей». Суточ-ный ритм продукции ТТГ предусматривает понижения его уровня после полуночи. При сохранности гипотала-мо-гипофизарной связи острое и хроническое переохлаж-дение вызывает усиление продукции ТТГ, особенно у но-ворожденных, а стресс и тепло понижают продукцию этого гормона.
В связи с сильным влиянием обратных связей на продукцию ТТГ, концентрации ТТГ и тироидных гор- монов при практической интерпретации результатов ла-бораторных обследований должны всегда сопостав-ляться друг с другом. Одни и те же абсолютные цифры в контексте разных сочетаний могут означать присут-ствие различных синдромов.
При первичном гипотирозе низкая продукция ти-роидных гормонов вызывает гипертрофию и гиперфун-кцию гипофизарных тиротропов. Концентрации ТТГ в крови растут, причём, как правило, — еще до развития гипотироза. Выработка тиролиберина увеличена, а тиростатических факторов — снижена. Гипофиз так увеличивается, что может возникать ошибочное подо-зрение на его опухоль. Параллельно активируется про-дукция близких по структуре к ТТГ гонадотропинов, снижается выработка СТГ и АКТГ, и может возникать гиперпролактинемия, так как выработка в гипотала-мусе тиропролактостатического медиатора — дофа- мина — бывает понижена. В тяжелых случаях первич-ного гипотироза вследствие этого компенсаторного гипофизарного ответа отмечаются даже нарушение полей зрения, лакторея и ускорение полового созрева-ния. Однако при нормализации тироидной функции все эти явления в силу их обратимости исчезают.
При вторичном гипотирозе речь идет о недостаточной стимуляции исходно нормальной щитовидной железы со стороны гипоталамуса или гипофиза. В типич-ном случае концентрации ТТГснижены или нормальны, хотя низкий уровень тироидных гормонов требует их повышения. Многие пациенты, однако, демонстрируют более сложную картину. У них при низком содержании тироидных гормонов концентрация ТТГ повышена, как и при первичном гипотирозе. Причиной этого явления (наблюдаемого при так называемом «синдроме болезненного эутироза») служит продукция в гипофизе недостаточно активного ТТГ, в частности, не подвергшегося адекватному гликозилированию. Высокий уровень иммунореактивного ТТГ при этом не означает усиления тиротропной стимуляции щитовидной железы. Введение тиролиберина активизирует гликозилирование ТТГ и повышает его биологическую активность.
Гипертироз чаще всего не является результатом гипоталамических или гипофизарных нарушений, а происходит из-за наличия не гипофизарных иммуно-
логических стимуляторов щитовидной железы, либо автономных от гипофизарного контроля источников продукции тироидных гормонов (при болезни фон Б азедова — Гревса и токсических аденомах щитовидной железы). Соответственно уровень продукции ТТГ и тиролиберина при подобных формах гиперти-роза, как правило, снижен. Однако примерно в 5 % случаев гипертироз можно считать центральным.
Причины вторичного гипертироза следующие.
Автономные от периферического и гипоталамичес-кого контроля опухоли из тиротрофов аденогипо- физа могут насыщать организм ТТГ и вызывать гипертироз. Как правило, это —макроаденомы. Они могут параллельно продуцировать СТГ. В опухолевых клетках изготавливается наряду с нормальной дефектная а-субъединица ТТГ, не вступающая в комплекс с в-субъединицей. Присутствие таких а-субъединиц в крови является диагностическим признаком mupom - ропином аденогипофиз а.
У некоторых больных с центральным гипертиро-зом в гипофизе нет аденом, но их тиротропы резис тентны к ингибирующему действию тироидных гормонов. Поэтому секреция ТТГ происходит на повышенном уровне, и весь тиростат стабилизируется при состоянии гипертироза.
Биологическое действие ТТГ, время полужизни которого в крови около 1 часа, основано на комплементарном связывании этого гормона с поверхностным клеточным рецептором, который является белково-ганглиозидным комплексом и принадлежит к семейству рецепторов, ассоциированных с G-белками (см. выше). Пострецепторные эффекты данного транслятора предусматривают активацию аденилатциклазы и цАМФ-протеинкиназных механизмов в клетках-мишенях, а также участие фосфатидил-инозитоловых и кальций-кальмодулиновых посредников.
ТТГрасполагает рецепторами и вне тироидных клеток. Экстратироидные эффекты этого гормона включают, в частности, усиление липолиза в жировой ткани.
Однако главное метаболическое действие ТТГ практически исключительно опосредовано через щитовидную железу. Для щитовидной железы ТТГ служит не только стимулятором захвата йода, синтеза тироидных гормонов и их освобождения в кровь. Доказано, что при исключении влияния ТТГ яз. тироциты у млекопитающих щитовидная железа инволюцирует, её фолликулярный эпителий уплощается и перестает обновляться. Эмбриональное развитие железы требует действия ТТГ, при его отсутствии может развиться врождённый атироз.
Таким образом, ТТГ— еще и митогенный, и морфо-генетический гормон для тироцитов. Осуществляя эти
функции параллельно, ТТГ действует через неодинаковые механизмы. Имеются данные, что функция тиро-цитов стимулируется с участием ганглиозидной части рецептора ТТГ и протеинкиназы А, а их рост—с участием белковой части этого рецептора, протеинкиназы С и, возможно, липидных посредников и процессов, зависящих от интернализации комплекса ТТГ и его рецептора.
Все это при патологии может приводить к диссоциированным и мозаично-сочетанным нарушениям функций щитовидной железы и ее роста. Таким образом, щитовидная железа — главная мишень ТТГ.
В середине XIX века была сформулирована гипотеза о йоддефицитном происхождении зоба. Т. Кохером была показана эффективность йода при микседеме (1895), а усилиями Э. Бауманна (1896) было установлено, что йод входит в состав приготовленного им концентрата специфического гормонального начала железы — йодотирина. А. Освальд (1899) выделил из коллоида йодсодержащий белок тироглобулин. Значимость йодно-щитовидной темы в медицине начала столетия подтвердил Нобелевский комитет, удостоивший Т. Кохера премии по медицине за 1909 г. Позже Э. Кен- далл (1919) получил йодсодержащий гормон щитовидной железы в кристаллической форме, назвав его тироксином, а К.Р. Хэрингтон с соавт. (1926,1927) установили его строение и синтезировали. Затем М. Гросс показал, что в железе синтезируется и трийодтиронин, гормональная активность которого примерно в 50 раз выше ти роксина.
Щитовидная железа возникает на 4-й неделе эмбрионального развития из выпячивания вентральной стенки глотки между I и II жаберными карманами. Из эндо-дермального эпителия этого зачатка формируются фолликулярные тироциты—А-клетки щитовидной железы, а также близкие к ним клетки Аскенази (В-клет- ки).А и В клетки трансформируются друг в друга и, вероятно, имеют общие функции — синтез тироксина и трийодтиронина. В-клетки несколько крупнее и содержат биогенные амины, в частности, серотонин.
Предполагается, что метаплазия В-клеток при тироидите Хасимото и других тиропатиях приводит к появлению оксифильных клеток Хюртля, характерных для этих поражений. Помимо этого, щитовидная железа имеет и третий клеточный тип, который происходит из производных V пары жаберных карманов — ультимобранхиальных телец, врастающих в эмбриональную железу. Это — парафолликулярные С-клетки, источники тирокалъцитонина и кокаль-цигенина (старое название — полипептид, ассоциированный с геном кальцитонина). Нарушения ти-рокальцитониновой регуляции рассмотрены в разделе, посвященном патологии паратироидно-тирокальцито-
161
 ниновой регуляции кальций-фосфорного обмена. О ко- кальцигенине известно, что при системном действии он вызывает гипотензию и тахикардию.
ниновой регуляции кальций-фосфорного обмена. О ко- кальцигенине известно, что при системном действии он вызывает гипотензию и тахикардию.
Это—убиквитарный пептид, синтезируемый многими нейроэндокриноцитами разной локализации. В бронхах он участвует в спазме гладких мышц, в центральной нервной системе считается активатором симпатических центров гипоталамуса, подавляет пищевое поведение и повышает кровяное давление (РейдЯ.А., 1998).
В тироидной патологии значение С-клеток определяется тем, что это — источники медуллярного рака щитовидной железы. Они относятся к АПУД-системе. При нарушении миграции эмбриональных клеток щитовидной железы они остаются по пути миграции или перемещаются в средостение. По ходу трахеи, под языком и в грудной клетке возможно образование эктопической ти-
роидной ткани и С-клеток, которые могут инфицироваться, озлокачествляться или подвергаться гиперплазии, давая загрудинный или язычный зоб.
В зрелой щитовидной железе паренхима имеея псевдодольчатое строение и разделена неполными перегородками, берущими начало от ее капсулы. Псевдодольки состоят из фолликулов, в центре которых расположен коллоид — концентрат секретируемого тироцитами тетрамерного гликопротеида тироглобу- лина, уникального тироидного белка, богатого тирозином и йодом и используемого для синтеза и хранения гормонов щитовидной железы. Фолликулы окружены базальной мембраной с проживающими на ней А-клетками. Фолликулярный эпителий производит биосинтез гормонов, причём цилиндрическая, кубическая или уплощённая формы клеток отражают их более или менее активную функцию.
Рис. 54. Биосинтез тироидных гормонов и их предшественников 162
|
|
Рис. 55. Цитофизиологические механизмы синтеза и секреции тироидных гормонов (ТГ— тироглобулин, МИТ — монойодтирозин, ДИТ - дийодтирозин, ГЭР — гладкий эндоилазматический ретикулум)
Биосинтез требует постоянного поглощения йода из крови, продукции и секреции тироглобулина, его эн-доцитоза и отщепления от него йодированных тирози-нопроизводных. В железе более 30 млн фолликулов, соединенных через отверстия в базальной мембране и формирующих оплетённую капиллярами сеть. Между фолликулами имеются интерфолликулярные островки, которые содержат фолликулярные и парафолликуляр-ные клетки и участвуют в регенерации фолликулов.
Синтез тироидных гормонов определяется основными процессами, представленными схематически на рис. 54-55. Характеризуя их этапы, мы упомянем и некоторые их первичные нарушения.
Клетки фолликулярного эпителия постоянно синтезируют на рибосомах шероховатого эндоплазматическо-го ритикулюма, гликозилируют в нем (маннозилирование) и комплексе Гольджи (галактозилирование), пакуют в секреторные пузырьки и выделяют в коллоид тирогло булин.
Для образования гормонов щитовидной железы необходим йод, содержащийся, в основном, в морепродук-
тах, особенно много его в морской капусте — ламина рии. Значительные территории, удалённые от морей, относятся к геохимическим провинциям, где потребность в йоде обеспечивается с известным напряжением. В таких регионах гиперплазия щитовидной железы и гипотироз встречаются чаще. Эту зону населяет до 250 млн человек, и в нее преимущественно входят высокогорные районы (Альпы, Анды, Гималаи, Нагорный Дагестан, Саяны, Папуа) и внутриконтинентальные территории (район Великих Озёр в США, Полесье в Беларуси, часть Сибири, Средней Азии). В разных регионах фактическое суточное поступление йода в организм колеблется от 20 до 700 мкг. Оптимальное обеспечение йодом требует его поставки на уровне 150-300 мкг/сутки. Суточное потребление йода на уровне менее 80 мкг опасно, так как не позволяет поддержать эутироидное состояние без ТТГ-стимуляции железы и формирования её гиперплазии.
Пищевой йод в форме J- всасывается в желудке и в верхней части кишечника всего за полчаса. Тироциты захватывают йод из плазмы крови и концентрируют
его в 25-50 раз, а при необходимости — и в несколько сот раз! Работает энергозависимый йодный насос, позволяющий поглощать йод против градиента концентраций. Происходит противоперенос йодида и натрия с участием специального транспортного белка, а калий/ натрий-АТФаза нормализует натрий-калиевое соотношение, затрачивая АТФ. В сутки щитовидная железа поглощает не менее 120 мкг йода. Так как эта система не строго специфична, многие ионы служат конкурентными антагонистами транспорта йода.
Транспорт йода блокируют тиоцианаты, тиооксизо-лидоны ироданиды, содержащиеся в некоторых продуктах, обладающих антитироидным действием, или «стру-могенных» (здесь не только экзотические для нас кассава, тапиока, маниока, арахис, но и привычные для европейцев крестоцветные и кабачковые—репа, цветная и краснокочанная капуста, брюква, турнепс, бобовые, горчица). Диета, перенасыщенная этими ингредин-тами (в том числе молоко вскармливавшихся ими коров), способствует гипотирозу. Массовый гипотироз на почве струмогенной диеты и содержания углеводистых стру-могенов в воде отмечен во многих регионах Африки (Центральная Африка, Мозамбик), Америки (Колумбия, Чили), а также в других местах планеты. При наличии струмогенов формированию гиперплазии способствуют высокое содержание в воде фтора и ее жесткость.
В этом смысле реформы Петра Великого, после которых в России с её громадными пространствами, принадлежащими к йоддефицитным зонам, репа — один из основных продуктов питания тогдашнего населения России — уступила место не содержащей струмогенов картошке, еще предстоит оценить потомкам с точки зрения невольной заботы великого реформатора об эндокринологическом здоровье российских народов!
Пертехнат, содержащий радиоактивный технеций, также захватывается железой, но не задерживается в коллоиде. Это позволяет использовать его при сцин-тилляционном радионуклидном сканировании щитовидной железы.
Ежедневно не менее 80 мкг йода ежедневно расходуется на синтез тироидных гормонов. Йод, не абсорбированный тироцитами, а также попадающий обратно в кровь вследствие утечки из железы (которая в норме достигает 40-100 мкг/сут и может повышаться при патологии), частично утилизируется макрофагами и нейтрофилами, которые оказывают бактерицидное действие на объекты фагоцитоза с помощью йодидов и оксийодидов. Выведение йода из организма осуществляется желудочно-кишечным трактом и почками, причём в желудочно-кишечном тракте йод подвергается полной реабсорбции.
164
Следующий этап функционирования тироцитов-органификация йода, то есть его окисление — превра-щение из йодид-аниона в связанную с тироглобулином форму. Этот процесс происходит на щёточной кай-ме тироцитов и катализируется тироидной перок- сидазой.
Мембраносвязанная гемсодержащая пероксидаза щитовидной железы бывает объектом аутоиммуните-та, а титр антитиропероксидазных аутоантител кор-релирует с тяжестью аутоиммунного тироидита. Под ее воздействием йод связыватся с остатками тирозина в тироглобулине коллоида.
До четверти всех тирозинов йодируются. Органи-фикация приводит к образованию как монойодти- ырозина (МИТ), так и дийодтирозина (ДИТ Последующий этап — спаривание или конденсация йодтирозиновых остатков с образованием тирониновых структур — ведет к образованию на тироглобулиновой молекуле связанных с ней тироксина (3,5,3,5-тетрай- одтиронин) и трийодтиронина (3,5,3-трийодтиро- нин). Первый формируется путем конденсации двух ос-татков ДИТ, а второй — из МИТ и ДИТ. Уникальная третичная структура и конформация тироглобулина могут быть ключевыми в этом процессе. Аутоанти- тела к тироглобулину при различных тиропатиях ча-сто присутствуют в высоких титрах. Некоторые из них, по-видимому, служат лишь свидетелями иммунопатологических процессов, но относительно других имеется предположение, что они способны нарушать сложный конформационно-зависимый процесс конденсации, идущий на тироглобулиновой матрице. Так как конденсация тоже катализируется пероксидазным комплексом, блокаторы пероксидазы (в частности, тиомоче-вина) служат мощными ингибиторами функции щитовидной железы, действие которых не снимается избытком йода в отличие от перхлората и тиоцианатов. В патофизиологии существует тиомочевиная модель острого гипотироза и гипотироидной комы на грызунах (Зайчик А. Ш., Чурилов Л. П., Утехин В. Н. с со-авт).
Практически важно, что очень высокое поступ ление йода в железу ингибирует органификацию и спаривание йод-тирониновых остатков тироглобу-лина (эффект Вольфа — Чайкова). Поэтому приме нение больших доз йода в течение длительного времени может вызвать гипотироз и зоб («йодная микседема»). В последнее время, на эксприменталь-ной модели — мышах NOD , получавших йодирован ную воду, доказано, что избыток йода может провоцировать аутоиммунный тироидит (Роуз Н.Р. с соавт., 1999), исходом которого, как известно, явля ется гипотироз.
При проведении йодной профилактики эндемического зоба у населения йод дефицитных районов наблюдаются вспышки гипертироза. Увеличение частоты гипертироза наблюдалось при осуществлении программ йодирования соли или перорально-го йодированного масла в Испании и Заире. Через 2 года в Заире после профилактики зоба йодированной солью у 14 % лиц содержание ТТГ снизилось до неопределимого уровня (Бурда P . P . с соавт., 1966). Со держащие большое количество йода лекарства (на пример, амиодарон или кордарон) могут вызывать как гипотироз, так и тиротоксикоз, которые разви ваются либо вследствие действия избытка йода, либо из-за вызываемого самим амидароном тирои-дита (Роти Э., Браверман Л.И., 2000). Показано, что прием беременными женщинами избытка йода со- провождается транзиторным повышением ТТГ в пуповинной крови (Новаес М. с соавт., 1994).
Особенно чувствительны к струмогенному действию йода плод и лица с гипертирозом, леченные радиоактивным йодом. Так как йод у предрасположен ных к аутоиммунным тиропатиям лиц может провоцировать и болезнь фон Базедова, и гипотироз, ясно, что применение йодосодержащих препаратов (амиодарон, кордарон, йодид калия, витаминно-минеральные композиции с йодом, например, поливитамины «Матерна», предназначенные, по иронии судьбы, беременным женщинам) должно контролироваться и противопоказано определённому кругу лиц.
Следует считаться с авторитетным мнением патриарха эндокринологии, выдающегося канадского ученого Р. Вольпе (2000) о том, что «возросшее потребле ние йода за последние десятилетия почти наверняка играет основную роль в увеличении частоты аутоиммунного тироидита».
На 1 моль тироглобулина приходится в норме 6-7 остатков МИТ, 4-5 молекул ДИТ, 4 моля тироксина и 0,2-0,3 моля — трийодтиронина. Чем хуже щитовидная железа обеспечена йодом, тем выше доля МИТ и трийодтиронина, что считается компенсаторным явлением.
Под влиянием секреторных стимулов тироциты захватывают обратно порции йодированного тирог лобулина. Это осуществляется путём пиноцитоза. При этом коллоидная капелька сливается с лизосомой. В фаголизосоме происходит протеолиз тироглобулина, освобождаются тироксин и трийодтиронин, и имеет место частичное дейодирование тироксина в трийодтиронин, повышающее в секрете железы долю высокоактивного трийодтиронина. Отщепление гормонов от тироглобулина подавляется большими дозами йода, а также препаратами лития,
применяемыми при психических заболеваниях. Дега- логеназа, требующая НАДФ, освобождает йод из оставшихся непревращенными в гормоны ДИТ и МИТ для повторного использования.
ТТГ способен активизировать захват и транспорт йода железой, синтез тироглобулина и его йодированных производных, пиноцитоз коллоида и освобождение в кровь трийодтиронина и тироксина.
Помимо эндемического дефицита йода и токсических воздействий химических струмогенов пищевого и лекарственного происхождения, имеются наследственные дефекты ответственных за функции тиро-цитов белков, которые тоже могут приводить к первичному гипотирозу и к зобу. В этих случаях гипотироз носит врождённый, часто — семейный характер. В эпидемиологическом и медико-географическом отношениях важно различать эндемические формы гипо-тироза и зоба, связанные с региональной особенностью экологии человека (геохимический дефицит йода, традиционное употребление струмогенов), и спо радические формы гипофункции и гиперплазии железы вследствие действия индивидуальных причинных факторов и условий.
Районы, где зоб встречается более чем у 10 % населения, считаются эндемическими.
В настоящее время даже экологическое состоя ние конкретного региона оценивают по состоянию щитовидной железы у жителей этого региона.
Что же касается спорадического гипотироидного или эутироидного зоба, то вполне возможно его возникновение на почве наследственных дефектов тиро-цитов. При близкородственных браках в малых популяциях и изолятах возможно накопление дефектных генов и учащение встречаемости подобных нарушений. Такой семейный, спорадический по своей сути, синдром может ложно казаться эндемическим.
Четыре главных наследственных тиропатии, все — аутосомно-рецессивного типа, включают:
• При дефекте мембранного белка-транспортёра возникает системная неспособность желудка, слюнных желёз и тироцитов улавливать и концентрировать йодид и ряд других неорганических анионов. Тест с захватом пертехната — отрицательный.
• Отсутствие или дефицит тироидной пероксида- зы ведет к невозможности для йодида отдать электрон, превратиться в свободный йод и органифи-цироваться. При этом часто имеется врожденная тугоухость (синдром Пендреда).
• Дефицит дегалогеназы приводит к нарушению реутилизации йода, остающегося в МИТ и ДИТ.
165
 Это повышает потребность в йоде и делает синтез тироидных гормонов малоэффективным. • Синдром, при котором не происходит конденсация остатков МИТ и ДИТ в тироглобулин-связанные ТЗ и Т4, ранее характеризовавшийся условно, как «де фицит конденсазы», оказался гетерогенной группой по меньшей мере из трёх разных наследственных нарушений (аномальный тироглобулин, нарушение протеолиза тироглобулина и нарушение взаимодействия йода с тирозином). Все эти нарушения в зависимости от экспрессии генов и условий среды могут вызвать различной тяжести функциональные расстройства щитовидной железы. Следовательно, зоб, который может возникать при каждом из этих нарушений, может быть эутироидным (с компенсированной функцией) или, наоборот—ярко ги-потироидным (с развитием кретинизма), когда малая функциональная активность тироцитов, даже стимулированных ТТГ, не может быть компенсирована их числом.
Это повышает потребность в йоде и делает синтез тироидных гормонов малоэффективным. • Синдром, при котором не происходит конденсация остатков МИТ и ДИТ в тироглобулин-связанные ТЗ и Т4, ранее характеризовавшийся условно, как «де фицит конденсазы», оказался гетерогенной группой по меньшей мере из трёх разных наследственных нарушений (аномальный тироглобулин, нарушение протеолиза тироглобулина и нарушение взаимодействия йода с тирозином). Все эти нарушения в зависимости от экспрессии генов и условий среды могут вызвать различной тяжести функциональные расстройства щитовидной железы. Следовательно, зоб, который может возникать при каждом из этих нарушений, может быть эутироидным (с компенсированной функцией) или, наоборот—ярко ги-потироидным (с развитием кретинизма), когда малая функциональная активность тироцитов, даже стимулированных ТТГ, не может быть компенсирована их числом.
После секреции в плазму большая часть тироидных гормонов переходит в белково-связанную, неактивную, форму, уравновешиваясь с малой активной свободной фракцией. На 75 % тироидные гормоны связываются с тироид-связывающим глобулином (из фракции а-глобулинов). Большая часть остального пула связана с транстиретином, мигрирующим на электро-фореграммах, как преальбумин. Наконец, небольшая его часть связывается с сывороточным альбумином. Уменьшение связывания способствует более выраженному действию гормонов и наоборот. Тироид-связыва- ющий глобулин комплексирует тироксин намного более активно, чем трийодтиронин, а транстиретин вообще связывается только с тироксином. Поэтому лишь 0,02 % тироксина и целых 0,3% трийодтиро-нина остаётся свободными. Соответственно время полужизни тироксина — около 7 дней, а трийодтиро- нина — только 30 часов.
Все белки, связывающие тироидные гормоны, вырабатываются в печени. Поэтому плазменное связывание тироидных гормонов снижается при печёночной недостаточности, при голодании. Андрогены и большие дозы глюкокортикоидов подавляют продукцию тироид-связывающего глобулина, а эстрогены, клофибрат, тамоксифен, перфеназин, наркотики (героин и метадон), а также, вероятно, эндогенные порфирины при перемежающейся порфирии—повышают. При нефротическом синдроме связывающие эквиваленты теряются из плазмы, аспарагиназа разрушает тироид-свзывающий глобулин, салицилаты,
166
фуросемид и фенитоин конкурентно вытесняют тиро- идные гормоны из комплексов с белками. При бере-менности экспрессия тироид-связывающего глобу- лина растёт, а при акромегалии-гигантизме -снижается.
Наконец, имеются наследственные дефициты ти-| роид-связывающего глобулина и транстиретина, а также наследственный избыточный синтез первого из этих транспортёров тироидных гормонов. При па-тологии щитовидной железы в плазме обнаруживают-ся аутоантитела к тироксину. Однако они суще-ственно не влияют на гормонозависимые функции органа.
Свободные гормоны, достигая клеток-мишеней, вза-имодействуют с их поверхностными и ядерными рецеп-торами. В клетках тироксин практически нацело переходит в трийодтиронин в результате дейодиро-вания. Монодейодинация, катализируемая тканевой дейодиназой,—важнейший этап метаболизма тироид-ных гормонов, поскольку, по современным представле-ниям, его можно приравнять к переходу прогормона {тироксина) в наиболее активный гормон (трийодти- ронин), биологическое действие которого более чем в 3 раза сильнее. Этот процесс регулируется в адаптив-ных целях. Только 13% циркулирующего трийодти-ронина выделяется непосредственно тироцитами, ос-тальной гормон возникает путём периферического дейодирования тироксина. Отщепление йода от на-ружного кольца, в положении 5' приводит к появлению высокоактивного изомера трийодтиронина. Дейоди-рование внутреннего кольца в положении 5 порождает малоактивный обратный или реверсивный трийодти- ронин. В норме этим путём метаболизируется около 40 % тироксина.
Тироксин-5 '-дейодиназы—микросомальные суль-фгидрильные ферменты печени и почек, коры надпо-чечников и гонад (I тип), а также ЦНС, гипофиза, буро-го жира и плаценты (II тип). В этих органах в основном и формируется трийодтиронин. В буром жире акти-вация II типа дейодиназы происходит рефлекторно,в ответ на симпатическую стимуляцию липоцитов при холодовой адаптации.
Описана активация тироксин-5'-дейодиназы II подтипа при гипотирозе, сопровождающем, в частно-сти, аутоиммунный тироидит, когда это считается компенсаторным явлением. Дейодиназа I типа, в от-личие от II типа этого энзима, ингибируется пропил-тиоурацилом и реагирует на гипотироз понижением активности.
При голодании и тяжелых болезнях образуется повышенное количество реверсивного трийодтиро-
нина. Конверсия тироксина в трийодтиронин ослаблена у плодов, новорожденных и престарелых. Она понижается при голодании, тяжелом стрессе и под действием некоторых медикаментов (йопагност, верог- рафин и другие йодоконтрастные препараты, ймиодарон, пропранолол, дексаметазон). Как полагают, в основе этого лежит торможение активности дейодиназы I типа, а для йодсодержащих лекарств— обоих типов. Дальнейший катаболизм тироидных гормонов предусматривает их последовательное дейодирование, окисление углеродного скелета, а также глюкуронидизацию и сульфатирование. Метаболиты выводятся с желчью в желудочно-кишечный тракт и частично реабсорбируются.
Некоторые эффекты тироидных гормонов (ускорение захвата аминокислот, активация калий-натриевой АТФ-азы) детерминированы поверхностной рецепцией гормонов. Часть их зависит от внутрими-тохондриального действия, но большинство определяются влиянием на специфические ядерные рецепторы тироидно-стероидного семейства, гомологи онкобелка с-erbA, воспринимающие исключительно трийодтиронин.
Имеется два типа тироидных внутриклеточных рецепторов — TR-рецепторы (подтипы al и а2), кодируемые 17-й хромосомой и преобладающие в мозге, а также TRp-рецепторы (подтипы в1- и в2), закодированные в хромосоме 3 и преобладающие в печени и почках. Сердце в равной мере содержит оба типа TR-рецепторов. При наследственном дефекте трийодтиронин-связывающего домена TRвl -рецепторов формируется аутосомно-рецессивный синдром Рефетова — системная резистентность к действию тироидных гормонов.
Спектр биологических эффектов тироидных гор монов широк, так как их рецепторы имеются у всех клеток (наименьшую чувствительность к тироидным гормонам проявляют спленоциты и семенники).
Часть эффектов опосредована через регуляцию транскрипции генов. Некоторые зависят от влияния гормонов на судьбу долгоживущих РНК и трансляцию, а отдельные осуществляются на посттрансляционном уровне. Различным путём тироидные гормоны активируют более 100 клеточных ферментов.
Некоторые эффекты тироидных гормонов на клеточном уровне перечислены в табл. 6.
С точки зрения физиологии органов и систем и клинических критериев оценки их функции, уместно указать основные физиологические эффекты тироидных гормонов (табл. 7).
Таблица 6
Цитологические и биохимические эффекты тироидных гормонов
| Мишени | Эффекты |
| Клеточная мембрана | Усиление поглощения аминокислот, глюкозы, калия; усиление выведения натрия, кальция, фосфора |
| K+/Na+-АТФаза | Активация, увеличение хеми-осмотических градиентов, прирост основного обмена Ускорение генерации биопотенциалов и реполяризации |
| Рибосома | Стимуляция связывания амино-ацил-тРНК, пептидил-синтетазной и транслоказной реакций |
| Митохондрия | Увеличение аэробного окисления, в токсических, фармакологических дозах (но не в физиологических!) разобщают окисление и фосфорилирование |
| Метаболизм углеводов | Ускорение всасывания и окисления глюкозы и распада гликогена, контринсулярное действие |
| Метаболизм липидов | Стимуляция липолиза, окисления жирных кислот, уменьшение стероидогенеза, индукция рецепторов ЛПНП |
| Метаболизм белков | Усиление синтеза мочевины, отрицательный азотистый баланс, активация биосинтеза дифференцировочных протеинов в ЦНС, скелете, гонадах и других тканях Индукция синтеза миозина в миокарде |
| Метаболизм нуклеиновых кислот | Синтез цАМФ, активация начальных этапов синтеза пуринов и пиримидинов, дифференцировочная активация синтеза ДНК и РНК. Синтез короткоживущих РНК Индукция метаморфоза у головастиков |
| Взаимоотношения с другими гормонами | Стимуляция освобождения инсулина, глю-кагона, соматостатина, повышение печеночного распада стероидов и кортикостероидогенеза, снижение синтеза катехоламинов в мозговом веществе надпочечников, тимотропное действие на гормонообразование в вилочковой железе, подавление секреции тиролиберина и ТТГ |
| Пермиссив-ное действие на эффекты кате-холаминов | Стимуляция транскрипции и экспрессии в-адренорецепторов ТТГ усиливает экспрессию а1-адренорецепторов на самих тироцитах |
| Витаминный обмен | Повышение потребности в большинстве витаминов |
167
 Таблица 7
Таблица 7
Дата: 2019-02-02, просмотров: 492.