Механизмы действия гормонов обладают некоторыми общими чертами. Гормоны действуют целена правленно, специфично и высокоэффективно. Эффективность — свойство гормонов, в отличие от рефлексов, действовать, по сути, без порогов, то есть даже в ничтожно малых концентрациях.
Целенаправленность — это воздействие на конкретные, снабжённые комплементарными приёмниками гормонального сигнала—рецепторами — тар-гетные клетки или органы («мишени»). Специфичность действия гормонов может быть анатомически относительно избирательной (так, глюкагон действует прежде всего на печень) или очень многоцелевой (тироидные гормоны располагают рецепторами во всех клетках).
Специфичность не означает абсолютной уникальности и независимости действия разных гормонов на процессы обмена. Отдельные гормоны в разных концентрациях и на различном контекстном фоне дополняют и даже взаимозамещают друг друга. На последнем обстоятельстве основано получение синтетических аналогов гормонов (преднизолон, декса-метазон, контрацептивы и др.), а также антигормонов (спиронолактоны, альдактон, верошпирон).
Наиболее важный принцип, на котором основано современное понимание механизмов влияния гормонов на клетки, — принцип пермиссивного взаимодействия гормонов. Образ гормона как пальца, нажимающего на клавишу пишущей машинки, устарел. Еще в первой половине XX века бытовало представление о том, что роль гормонов сводится к независимому запуску определенного стандартного набора клеточных ответов через чувствительный к данному гормону рецептор.
Однако ряд авторов и, прежде всего, первооткрыватель липидной природы гормонов коры надпочечников А.А. Богомолец (1908) справедливо указывали на теоретическую недостаточность таких построений, подчёркивая, что близость или противоположность
20
того или иного конкретного эффекта двух гормонов еще не равнозначна синергизму либо антагонизму взаимных влияний соответствующих желёз. А.А. Богомолец прозорливо указывал на множественность и неоднозначность эффектов гормонов.
Особое значение он придавал полученным его учеником Л.Р. Перельманом данным о пермиссивном действии гормонов. Будучи еще очень молодым ученым, помощник прозектора из г. Саратова Л.Р. Пе-рельман (1924) показал, что предварительная кастрация у котов и самцов собак снимает судорожный синдром, вызванный удалением паращитовидных желёз, несмотря на то, что уровень кальция в крови кастрированных паратиропривных животных остаётся низким. Таким образом, «конечный результат опыта определяется физиологическим состоянием периферического органа... Состояние периферии оказывается решающим моментом в реакции её на гормональные и нервные влияния» (А.А. Богомолец, 1937). Ныне представление о пермиссивном действии одного гормона (биорегулятора) на эффекты другого — один из краеугольных камней эндокринологии. Эффект одного биорегулятора может меняться под действием другого на пострецепторном уровне, на эффекторном уровне или путём влияния одних гормонов на экспрессию рецепторов других. Нарушения пермиссивного действия гормонов способны приводить к патологии. Так, глюкокортикоиды контролируют экспрессию катехоламинового рецептора и пермиссивно влияют на концентрации ц-АМФ в клетках, облегчая действие катехолами-нов и на пострецепторном уровне. Поэтому в условиях гипокортицизма адреналин не оказывает должного гликогенолитического действия, и болезнь Аддисона протекает с тенденцией к гипогликемии. В то же время гиперкортицизм усиливает гипертен-зивное действие катехоламинов, что имеет значение в патогенезе многих форм повышения артериального давления. Это особенно актуально для подростков, у которых даже относительно повышенная активность коры надпочечников может способствовать дебюту артериальной гипертензии (например, при гипоталамическом синдроме пубертатного периода или ожирении с розовыми стриями).
Пермиссивностъ означает, что в общей эндокринной оркестровке, кроме суммации, прямого антагонизма или синергизма, имеет место важнейшее явление, когда гормон действует не просто в качестве компле ментарного рецептору сигнала-триггера, но и вы-
 полняет роль символа, включающего пакет плеиотроп-ных эффектов, создающих сцену или контекст для интерпретации других сигналов.
полняет роль символа, включающего пакет плеиотроп-ных эффектов, создающих сцену или контекст для интерпретации других сигналов.
Один и тот же гормональный сигнал имеет для одной и той же клетки разное значение и вызывает неодинаковые последствия в зависимости от того, каково метаболическое состояние организма и данной клетки, каков контекстный фон, какие действуют иные регуляторы и каков этап онтогенеза.
Именно данное объективное обстоятельство, помимо прочего, вызывает необходимость в создании специального руководства по эндокринологии подросткового периода.
Логика нервного регулятора бинарна и дискретна, но «химический компьютер» эндокринной системы оперирует более многозначными символами, чем просто «ноль и единица» — то есть сигнал и его отсутствие! В области доминирования нервной регуляции «работают» усредняющие формы контроля и применимы широкие, ступенчатые регуляторные характеристики типа «симпатический тонус» и «парасимпатический тонус». Но эндокринная регуляция индивидуализирует своё воздействие на конкретную мишень в определенный момент ее онтогенеза и достигает поэтому большой многогранности.
Наряду с пермиссивностъю второй важнейшей предпосылкой эндокринологической логики служит принцип сервоконтроля или теория обратных и прямых связей в эндокринной системе.
Еще М.М. Завадовский (1933) выдвигал концепцию «плюс-минус взаимодействий», то есть отрицательных обратных связей как основы взаимоотношений эндокринных желёз. Развивая эти поиски, А. Минз (1943)создал представления о «гипофизар-но-тироидной оси», объединяющей эти железы. Однако явственно теория обратных связей как форма взаимодействия гипоталамо-гипофизарного нейросек-реторного аппарата и периферических эндокринных желез, подконтрольных гипофизу, оформилась только после создания и популяризации основ кибернетики (Винер Н., 1948). Практически немедленно после выхода в свет винеровской книги «Кибернетика: наука об управлении в животном и машине» Р. Хоскинз (1949) объединил идеи обратной связи и «гипофи-зарно-тироидной оси» в своей концепции «тиро-стата», а позже Г. фон Эйлер и Б. Хольмгрен (1957) экспериментально доказали реальность тирок- синового игибирования секреции аденогипофизар-ного ТТГ.
В дальнейшем представления о сервоконтроле гормональных функций стали одной из аксиом эндокринологии. В настоящее время твёрдо установлено, что принцип обратной связи, когда регулируемый параметр оказывает обратное влияние на продукцию гормонального регулирующего сигнала, служит повсеместной основой самоуправления в эндокринной системе.
Регулируемым параметром может быть концентрация гормона в крови. Повышение уровня гормона периферической эндокринной железы может понижать секрецию тропного гормона аденогипофиза или его гипоталамического либерина (длинная петля обрат ной связи). Возможны подобные соотношения между концентрациями тропного гормона и рилизинг-фак-тора {короткая петля обратной связи). Наконец, сам тропный гормон или его либерин понижают собственную продукцию {ультракороткая петля обратной связи).
В роли регулируемого показателя может выступать и содержание какого-либо метаболита, подавляющее по принципу сервомеханизма продукцию гормона, повышающего такой показатель. Пример — взаимоотношения концентрации кальция и секреции паратгор- мона, уровня глюкозы и гормонов островков Лангерганса, калий-натриевого соотношения в плазме и секреции альдостерона, осмолярности внеклеточной жидкости и продукции вазопрессина. Наряду с отрицательными обратными связями в отдельных случаях во взаимоотношениях центральных и периферических эндокринных образований были обнаружены проявления положительной обратной связи. Так, при овуляции эстрогены, синтезируемые под влиянием гонадотропинов, способствуют пиковому повышению концентрации ЛГ и ФСГ.
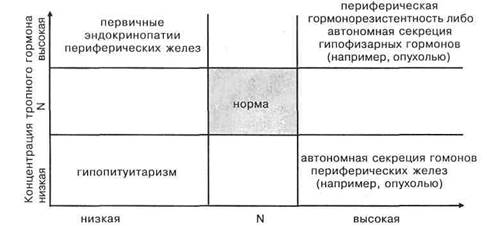
Представления об обратных связях в ауторегуляции эндокринной системы имеют большое значение для диагностики и лечения эндокринопатий. В соответствии с ними эндокринные заболевания можно разделить на первичные эндокринопатий и вторичные эндокри нопатий.
При первичных эндокринопатиях патологический процесс, вызвавший нарушения гормональной регуляции (аутоиммунное повреждение, воспаление, опухоль, генетический дефект), локализован в самой эндокринной железе. При вторичных эндокринопатиях начальное поражение (которое также может принадлежать к одной из перечисленных выше категорий) находится в пределах гипоталамо-гипофизарного нейросекреторного аппарата, а дисфункция перифери-
21
|
|
| концентрация гормона периферической железы Рис. 5. Роль принципа обратной связи в распознавании первичных и вторичных эндокринопатий 22 |
ческой эндокринной железы является следствием этого процесса.
Принцип обратной связи накладывает отпечаток и на основные подходы к лечению эндокринных болезней, и на их диагностику. В области лечения приходится считаться с тем, что более или менее длительное назначение экзогенного гормона периферической железы подавляет продукцию гипофизарных и гипоталамических стимуляторов её деятельности. Поэтому резкое прекращение заместительной терапии всегда провоцирует син дром отмены (например, отмена кортикостероидов при гипокортицизме). Более того, назначение гормонального регулятора вызывает ответ, понижающий в той или иной мере чувствительность к нему организма (пример — вторичная инсулинорезистентностъ в практике диабетологии). Первым сформулировал это в виде «принципа обратной чувствительности» Дж. Б. Коллип (1934) — «индивидуальная чувствительность к вводимым гормональным препаратам обратно пропорциональна содержанию или продукции гормона в собственной железе».
Еще более важные последствия диктует феномен обратной связи в дифференциальной диагностике эн-докринопатий. Очевидно, что первичные и вторичные эндокринопатии очень часто могут быть разграничены по противоположным изменениям концентраций тропных гормонов (или иногда—гипоталамических факторов) в крови. Так, при первичном гипотирозе, вызванном йодной недостаточностью, гипоталамо-гипофизарный аппарат, повинуясь принципу обратной связи отвечает на низкое содержание
тироксина и трийодтиронина в крови повышением продукции ТТГ. В то же время вторичный гипо-тироз, вызванный гипопитуитаризмом, протекает при низкой концентрации как тироидных, так и ти-ротропного гормона.
При базедовой болезни (первичный гипертироз и гиперплазия щитовидной железы аутоиммунного происхождения) содержание ТТГ в крови понижено, в то время как при вторичном базедовизме, спровоцированном опухолями гипоталамо-гипофизарной локализации, которые вырабатывают стимуляторы тироид-ной функции, повышены и уровень ТТГ, и уровень тироидных гормонов. Классическая болезнь Адди-сона — первичная хроническая недостаточность коры надпочечников — вызвана инфекционным (чаще — туберкулез), либо аутоиммунным адрена-литом, а изредка — атрофией коры надпочечников аутоиммунного генеза. Поэтому продукция проопи-омеланокортина — прогормона, содержащего центральный стимулятор адренокортикоцитов, АКТГ, — компенсаторно возрастает. Так как продуктом проте-олиза проопиомеланокортина является и мелано-цитостимулирующий гормон {МСГ), кожа больных приобретает бронзовый оттенок и наблюдается характерный «симптом грязных локтей».
Если гипокортицизм имеет центральное происхождение и относится к вторичным эндокринопатиям, то в силу первичного гипопитуитаризма продукция проопиомеланокортина и его дериватов, наоборот, понижается, и гиперпигментации кожи не наблюдается. Напротив, возможен даже обратный процесс («белый аддисонизм»). Легко заметить, что это создает возможность для точной дифренциаль-ной диагностики, если эндокринолог располагает прецизионными данными о концентрациях гормонов в крови (рис. 5).
Как впервые было экспериментально доказано У. Э. Нок-сом (1951), гормоны опосредуют действие на физиологические процессы через активность энзимов. Позднее из работ Б. О'Мэл-ли и Р. Т. Шимке с соавт. (1965, 1972) стало ясно, что под влиянием гормонального сигнала меняется не только активность, но и количество молекул ферментов.
Но как гормональный сигнал доходит до эффекторов?
Судьба гормонального сигнала в клетке
Гормонорецепторные взаимодействия — ключевое звено метаболизма гормонов и эндокринной регуляции. Достигая клеток-мишеней, гормоны связываются с распознающими молекулами. Основные процессы, определяющие биоэффекты гормонов, представляются в настоящее время следующим образом.
Первым этапом служит комплементарное взаимодействие гормона с внутриклеточным или мембранным поверхностным гормональным рецептором. Специфичность этих рецепторов высока, но не абсолютна. Так, кортизол взаимодействует не только с глюкокортико-идным, но и с минералокортикоидным рецептором, и, наоборот, алъдостерон способен действовать на.ре-цепторы глюкокортикоидов.
Инсулин часть своих эффектов опосредует не через инсулиновый рецептор, а через рецепторы инсули-ноподобных ростовых факторов.
До последней четверти XX столетия казалось устоявшимся представление о том, что белковые и катехо-ламиновые биорегуляторы действуют на клетки-мишени исключительно с поверхности клеток — не проникая внутрь их, а стероидные и тироидные — только через внутриклеточные рецепторы (Юдаев А.Н. с соавт., 1976).
Хотя подобное разграничение и имеет известный смысл, оно не должно более восприниматься как абсолютное или как диктуемое исключительно гидрофильным или гидрофобным характером молекул биорегуляторов.
Еще в 80-х годах прошлого века было твёрдо установлено, что белковым регуляторам не может приписываться только дистантный механизм действия. Доказано, что многие белковые гормоны (и даже такие биорегуляторы, как антитела!) после их рецепции на плазматической мембране таргетных клеток подвергаются адсорбтивному эндоцитозу и таким путём оказываются внутри клеток, а далее могут транспортироваться в органоиды, включая ядро (Зайчик А.Ш., 1973;Аларкон-Сеговия Д., 1973;Расмуссен Г., 1982; Чурилов Л.П., 1986; Зайчик А.Ш. с соавт., 1988). Схема процесса показана на рис. 6.
Это позволяет гормонам иметь «раннюю волну» эффектов, наблюдаемых на протяжении первых минут после взаимодействия с клеткой, опосредованную мембранным рецептором и пострецепторными посредниками, а также «позднюю волну», наступающую в сроки 2-4 часа и позже, связанную с внутриклеточным и внутриядерным переносом белковых регуляторов и адресованную непосредственно генам. Доказан, напри-
мер, внутриядерный перенос инсулина (Голдфайн А. с соавт, 1982), хорионического гонадотропина (Яс-келяйнен К. с соавт, 1983), люлиберина (Шлессин-гер Ю. с соавт, 1983), многих других пептидных гормонов, а также антител (Зайчик А.Ш., 1973; Алар- кон-Сеговия Д., 1973).
В «позднюю волну» эффектов белковых гормонов входят, в частности, такие результаты их действия, как морфогенетическое влияние гормонов, регуляция пролиферации клеток-мишеней, индукция синтеза ключевых белков, контролирующих каскады внутриклеточных событий, например, ключевых протеинов стероидогенеза (Дазо А., 1983).
У стероидных и тироидных гормонов тоже имеется не только вутриклеточный набор отсроченных эффектов, но и определенные эпигенетические ранние эффекты, связанные с их действием на мембраны и с мобилизацией внутриклеточных посредников того же типа, что и у белковых гормонов (Фауси А., 1982).
Так, например, тироидные гормоны именно через поверхностные рецепторы опосредуют свой усиливающий эффект на захват клетками аминокислот и глюкозы, а также прямо активируют мембранную АТФ-азу плазмалеммы (Катцунг Б.Г., 1998).
Таким образом, дистантный и внутриклеточный механизмы — не альтернативные виды действия белковых, либо тироидных и стероидных гормонов, а со трудничающие способы передачи соответственно
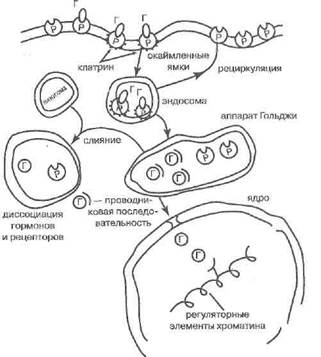
Рис. 6. Перенос гормонов в клетку и в ядро посредством ре-пепторного эидоцитоза (Г - гормон, Р - рецептор)
23
 раннего и отсроченного гормональных эффектов (Бэкстер Дж., 1987). Учение о внутриклеточном действии гормональных сигналов получило название «эн- доэндокринологии».
раннего и отсроченного гормональных эффектов (Бэкстер Дж., 1987). Учение о внутриклеточном действии гормональных сигналов получило название «эн- доэндокринологии».
Механизмы внутриклеточного опосредования эффекта гормонов на поверхностные рецепторы разнообразны и представлены на рис. 6-9. В качестве комментария заметим, что различные, обнаруженные за последние 35 лет внутриклеточные посредники действия гормонов (циклонуклеотиды ц-АМФ и ц-ГМФ, кальций и связывающие его белки, фосфатидилинозит и его производные, эйкозаноиды, пептиды) — это в большинстве случаев не альтернативные мессенд-жеры, как полагали изначально, а взаимодействую щие части целостной системы. Тот или иной гормон, оперируя с разными типами рецепторов, может в разной степени затрагивать различные части этой системы. Но целостный ансамбль эффектов, вызываемых гормоном, всегда требует участия нескольких интра-целлюлярных посредников.
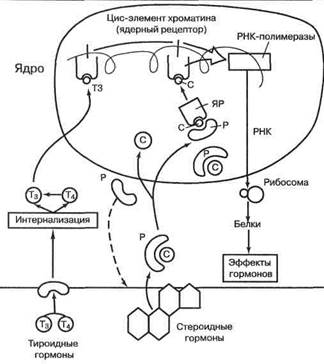
Механизмы действия гормонов на внутриклеточные рецепторы представлены на рис. 7. Гормон связывается с цитоплазматическим рецепторным белком, чтобы попасть в ядро. До прихода гормона цитоплазмати-ческий рецептор блокирован белком-инактиватором. Для глюкокортикоидных рецепторов таким инактива-тором служит белок теплового шока (БТШ-90). Белки теплового шока используются в этом качестве
Рис. 7. Механизмы действия стероидных (С) и тироидных (Т) гормонов. Р — рецептор, ЯР — ядерный рецептор
24
и другими цитоплазматическими гормональными рецепторами.
В клеточном ядре гормон взаимодействует с цис-регуляторными элементами хроматина, формируемыми комплексами ДНК и негистоновых белков, которые условно и называют «ядерными рецепторами». Тироидные гормоны располагают и митохондриаль-ными рецепторами, поскольку митохондрии также содержат ДНК и ассоциированные с нею протеины. Изменения конформации цис-регуляторного элемента хроматина способствуют ассоциации гена с ДНК-зависимой РНК-полимеразой, а также его экспрессии. Как сказано выше, и тироидные, и стероидные гормоны имеют, кроме этого, эпигенетические механизмы действия, опосредованные через звенья, аналогичные мес-сенджерам белковых гормонов. Внутриклеточные рецепторы тироидных и стероидных гормонов вместе с рецепторами витамина А принадлежат к классу белков-регуляторов транскрипции и гомологичны онкобел-ку—продукту онкогена е rb А. Один гормон может иметь несколько разновидностей erbA -подобных рецепторов (например, тироксин).
Минералокортикоиды, глюкокортикоиды, эстрогены, андрогены, кальциферол и прогестины имеют разные подтипы подобных рецепторов. Лиганды (сигнальные молекулы) некоторых аналогичных рецепторов всё еще не найдены, что вселяет надежду на обнаружение новых стероидных гормонов. По некоторым данным (Уайт А. с соавт, 1981; Шрай-бер В., 1982), неохарактеризованные гипотетические гормоны-стероиды вырабатывают тимус (тимостерин), а также, возможно, субкапсуляр-ный слой минералокортикоидной зоны коры надпочечников (кардиотропные или натрийурети- ческие стероиды — антиминералокортикоидного действия, возможно, аналоги уабаина или сердечных гликозидов).
Клонирование и секвенирование новых рецепторов стероидного типа может привести в дальнейшем к повтору ситуации с эндогенными опиатами, когда рецепторы в организме животных были открыты ранее своих естественных лигандов.
Рецепторы гормонов на плазматической мембране характеризуются известным разнообразием (рис. 8, 9). Они принадлежат по меньшей мере к пяти типам, использующим посреднико-вые механизмы по-разному.
Крупнейшая группа поверхностных гормональных рецепторов принадлежит к семейству ассоциированных с G -белками (ГТФ-связывающими белками). Прояснение механизмов их функциониро-
вания было начато первооткрывателем циклонукле-отидных вторичных посредников лауреатом Нобелевской премии по медицине 1971 г. Э.У. Сазерлендом (младшим). Современная концепция функционирования G-белков сложилась благодаря работам А. Г. Гилмэна и М. Родбелла, также удостоенных Нобе-левскрй премии за 1994 г. Подробная характеристика системы G -белков и нарушений, связанных с ними, содержится в ряде руководств (Катцунг Б.Г., 1998; Зайчик А.Ш., Чурилов Л.П., 2001). Рецепторы рассматриваемой группы имеют внеклеточный домен, связывающий гормон или иной биорегулятор, а также внутримембранную часть, пронизывающую плазма-лемму несколько раз (откуда второе название группы —серпантинные рецепторы), и, наконец, внутриклеточный домен, способный связывать клеточный адаптер — G -белок. Ассоциация лиганда и рецептора ведёт к связыванию и гидролизу G -белком ГТФ, что позволяет запустить цепи из нескольких внутриклеточных посредников, параллельно обеспечивающих ансамбль ранних метаболических изменений, диктуемых гормоном.
Одновременно активируется аденилатциклаза, причём образованная ц-АМФ обеспечивает активацию ряда протеинкиназ класса А, фосфорилирующих энзимы и распознающие белки клетки (рис. 8). Данный цик-лонуклеотид также напрямую способствует открытию натриевых ионных каналов мембраны.
Другая, параллельно развивающаяся линия эффектов, запускаемая G -белком, включает активацию ферментов инозитол-фосфатаз, известных под условным именем «фосфолипаза С». Эти энзимы прямо из инозитол-фосфатидов мембраны изготовляют фос-фатидил-инозитол-4,5-дифосфат, переходящий в три-фосфоинозит (ИТФ) и диацил глицерин (ДАГ). ДАГ активирует протеинкиназы класса С, фосфорилирующие в свою очередь ряд функциональных белков клетки (рис. 9).
Третья линия событий, спровоцированных активацией рецептора из данного семейства, заключается в генерации из материала мембраны арахидоновой кислоты и эйкозаноидов (в чём участвуют фосфолипазы С и А2 и ДАГ-липаза). Эйкозаноиды дополняют веер гормонозависимых эффектов, опосредованных G -бел- ками.
Наконец, под влиянием ИТФ из внутриклеточных резервуаров освобождается еще один важный участник ансамбля посредников гормонального эффекта—каль ций. Кальций входит в стимулированную гормоном клетку и извне, чему способствует открытие (при участии аденилатциклазных механизмов) ионных каналов.
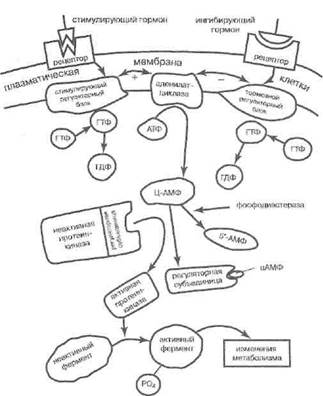
Рис. 8. Циклонуклсотид — протеинкиназная часть опосредующего механизма гормонального сигнала
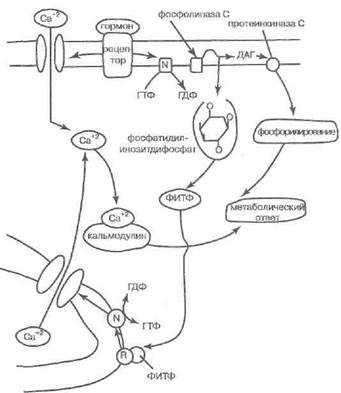
Рис. 9. Роль кальция и инозитфосфатидов в опосредовании гормонального сигнала. N — гуанилатсвязывающий белок, ДАГ — диа-цилглицерин, ФИТФ — фосфатидилинозитолтрифосфат, ГДФ — гу-анозинтрифосфат, R — рецепторная единица
25

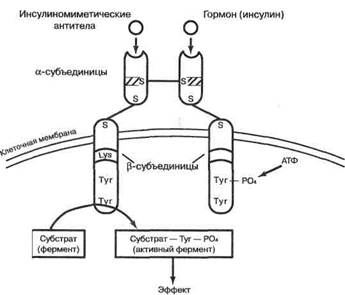
гормона Рис. 10. Рецептор инсулина — пример гормонального рецептора тирозинкиназного типа
Кальций (см. стр. 227) не представляет собой альтернативного независимого посредника гормонального действия в клетке, но взаимодействует с вышеназванными мессенджерами. Он распознаётся внутриклеточным рецепторным белком калъмодулином и некоторыми протеинами цитоскелета. Цитоскелет под влиянием кальция обеспечивает движение органоидов или клетки, что вносит вклад в ансамбль гормонально-зависимых эффектов. Калъмодулин в одних системах включает фосфодиэстеразу и снижает эффективность аденилатциклазной передачи (например, именно так катехоламины вызывают расслабление гладких мышц, сокращающихся под влиянием ацетилхолина). Но в других системах и, что особенно важно, при действии тройных гормонов на периферические железы внутренней секреции кальмодулиновый и аденилатциклазный механизмы выступают синерги-стами. К данной группе гормональных рецепторов принадлежат рецепторы ЛГ, ФСГ, ТТГ, АКТГ, вазопрес- сина, глюкагона, катехоламинов, паратгормона, соматостатина, калъцитонина, бомбезина, опи-атных пептидов, серотонина, мускариновый рецептор ацетилхолина и рецепторы многих других биорегуляторов. Здесь же — обонятельные и зрительные рецепторы. При этом АКТГ, адреналин, кальци-тонин, ФСГ, глюкагон, ЛГ, паратгормон повышают уровень ц-АМФ в клетках-мишенях, так же как и ускоряют кругооборот инозит-фосфатидов. АКТГ, ва- зопрессин, ТТГ и ЛГ к тому же заметно повышают
26
цитоплазматическую концентрацию ионизированного кальция. В то же время соматостатин, оперируя через G-белки, снижает уровень ц-АМФ в таргетной клетке. Это свидетельствует о том, что разные биорегуляторы в различных клетках используют вышеописанный комплекс посредников неодинаково. Зарегистрированы при патологии и получены в эксперименте антитела к рецепторам этого класса, имитирующие и блокирующие действие соответствующих гормонов (ТТГ, АКТГ, гонадотропинов).
Другая группа гормональных рецепторов представляет собой тирозиновые протеинкиназы. Эти рецепторы не оперируют с G -белками, как бы сокращая вышеописанную посредниковую цепь событий (рис. 10). Каждый такой рецептор — мембранный гликопротеин из пары а-субъединиц снаружи и двух Р-субъединиц, пронизывающих мембрану. Наружные субъединицы связывают гормон, а внутренние — гидролизуют АТФ и фосфорилируют себя и внутриклеточные функциональные белки, вызывающие гормонозависимый ответ клетки. Показанный на рис. 10 рецептор — инсулино-вый. Помимо важнейшего гормона инсулина, к этой группе принадлежат рецепторы инсулиноподобных ростовых факторов I и II , фактора роста эпидермиса, тромбоцитарных ростовых факторов и, возможно, фактора роста нервов. Как видно из этого перечня, данный тип рецепции очень важен в эндокринной регуляции ростовых и анаболических процессов. По некоторым данным, подобные двухвалентные рецепторы при активации должны попарно сшиваться гормоном или антителом. При действии инсулина и ростовых факторов уровень ц-АМФ снижается. Вместе с тем подобная рецепция не исключает участия компонентов посредниковой системы, на которой основывается адаптерная роль G -белков. Так, эпи-дермальный ростовой фактор сочетает тирозин-протеинкиназный механизм активации клетки-мишени с повышением уровня цитоплазматического кальция и с активацией инозит-фосфатидов, как и гормоны, влияющие через G -белки. Тирозиновые протеинкиназы кодируются многими онкогенами. Получены в эксперименте и зарегистрированы при патологии антитела к рецепторам данного класса как имитирующие действие гормона, так и блокирующие его (в частности, к инсулиновому рецептору и к рецептору эпидер-мального ростового фактора).
Меньше известно о механизмах опосредования внутриклеточных эффектов пролактина, плацетар-ного лактогена и гормона роста. Эти гормоны (а с ними — ряд цитокинов и фактор роста нервов) имеют рецепторы в виде трансмембранной молекулы из од-
ной субъединицы гомологичного строения, которая не является протеинкиназой и не использует G -белки.
Имеются данные Л. М. Удебин (1982) о том, что эти рецепторы опосредуют своё действие в цитоплазме через пептидные мессенджеры. По данным Д. Тёркингтона с соавт. (1973), эти посредники приводят в ядре к увеличению экспрессии генов проте-инкиназ. Известно, что ряд эффектов СТТ опосредован вторичной продукцией в тканях инсулиноподобных ростовых факторов, рецептируемых тирозиновыми протеинкиназами. В пренатальном периоде тканевым посредником действия СТГ служит ИФР-П (со-матомедин А), а после года в большинстве тканей (кроме зубных зачатков) — ИФР- I (соматомедин С). Вероятно, их можно рассматривать как внутриклеточные и паракринные тканевые вторичные посредники, зависящие от действия СТГ на его рецептор. Мутации рецептора СТГ нарушают продукцию сома- томединов (дефицит ответа на соматомедин С при синдроме карликовости Ларона). Есть сведения, что рецепторы этого класса мобилизуют внутри клетки также эйкозаноиды. Получены антитела к рецепторам пролактина, имитирующие его эффекты, и зарегистрированы аутоантитела к рецептору СТГ, тормозящие рост подростков (Миракян Д. с соавт., 1983).
Уникальный характер носят рецепторы атриопеп- тинов (натрийуретических факторов). Эти гормональные рецепторы сами являются трансмембранно расположенными гуанилатциклазами. Взаимодействие атриопептина с рецептором ведёт к накоплению ц-ГМФ в клетке-мишени. Ц-ГМФ способствует активации внутриклеточных сериновых и треонино-вых протеинкиназ, фосфорилирующих ансамбль белков-эффекторов. Не известны антитела, которые бы влияли на данный рецептор стимулирующим, либо блокирующим образом. Однако при застойной сердечной недостаточности отмечена резистентность атриопеп-тиновых рецепторов к действию данного сердечного гормона, не дающая возможности облегчить отёчный синдром с помощью атриопептина. В последнее время обнаружено, что N0 — липофильный газообразный медиатор — также активирует гуанилатцик-лазу в клетках-мишенях (Катцунг Б.Г., 1998).
Взаимодействие биорегулятора с рецептором может приводить непосредственно к открытию ионных каналов в мембране: хлоридных (ГАМК, глицин и другие возбуждающие аминокислоты), натриевых и калиевых (ацетилхолин при действии на никотин-холинер-гический рецептор). Так как агонисты рецепторов канального типа формально не относятся к гормонам, в данной книге этот вид рецепции не рассматривается.
И в рецепторной, и в гормональной эндокринологии сохраняют свою актуальность единые основные принципы: обратной связи и пермиссивного эффекта, так как гормоно-рецепторное взаимодействие — двустороннее. В течение первой половины XX столетия внимание эндокринологов было приковано к изменениям количества гормонов как причине заболеваний. Но уже в 1942 г. Ф. Олбрайт описал псевдогипопаратироз, связанный с неотвечаемостью тканей на паратгор-мон, вырабатываемый в более чем достаточных количествах. Таким образом, был заложен первый камень в основание «эндоэндокринологии» или учения о цитофизиологических закономерностях рецепции гормонов и патологических последствиях рецепторных и пострецепторных дефектов клеток-мишеней.
Впоследствии были открыты рецепторные и пост-рецепторные формы тканевой резистентности практически ко всем известным гормонам. Развитие представлений о рецепторах гормонов позволило распространить принцип сервоконтроля и на гормоно-рецепторные взаимоотношения. Так, при гиперинсу-линизме, вызванном перееданием, по механизму сервоконтроля подавляется экспрессия инсулиновых рецепторов, и могут формироваться инсулинорезис-тентность и сахарный диабет тучных лиц.
Количество большинства гормональных рецепторов на клеточной поверхности и в цитозоле понижается при избытке гомологичного гормона. Сродство многих рецепторов, особенно тирозин-протеокиназного типа, к их гормонам уменьшается после связывания гормона. Одни гормоны гетерологично влияют на экс-пресию и аффинность рецепторов других гормонов. Так, эстрогены повышают экспрессию прогестиновых рецепторов.
Распределение гормональных рецепторов в организме неравномерно. Выше уже говорилось, что ти-роидными рецепторами располагает каждая клетка. Глюкокортикоиды и катехоламины действуют также на очень широкий круг органов и тканей. Но рецепторы глюкагона, повторим, сосредоточены исключительно в печени. Альдостерон также имеет очень узкий круг мишеней (почки, желудочно-кишечный тракт, слюнные и потовые железы). Проникновение глюкозы во многие жизненно важные органы (центральная нервная система, диафрагмальная мышца, сердце, ткани глаза, почка, надпочечник, гонады) — не зависит от инсулина и т.д.
Спектр эффектов гормонов может ограничиваться не только распространенностью его рецепторов, но и анатомо-гистологическими особенностями эффекторов, а также нюансами транспорта гормонов. Из-за существования портальных циркуляторных систем
27
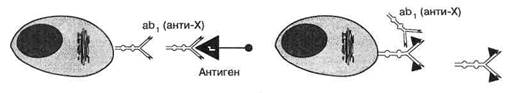
Идиотип-продуцирующая Антиидиотип- ab2в (анти-
В-клетка продуцирующая В-клетка анти-Х)
Рис. 11. Антиидиотипическис антитела как внутренние иммунологические отображения структуры антигенных эпитопов
 многие гормоны практически не попадают за пределы определённых зон. Некоторые биорегуляторы действуют только паракринно (например, мюллеров ин-гибирующий полипептид).
многие гормоны практически не попадают за пределы определённых зон. Некоторые биорегуляторы действуют только паракринно (например, мюллеров ин-гибирующий полипептид).
В организме ответ нейроэндокринной системы всегда бывает плюригландулярным и вызывает разные влияния нескольких гормонов на разные клетки. Примером может служить интегральный ответ на гипогликемию: глюкагон и адреналин побуждают печень к гликогено-лизу и тормозят гликогеногенез, а также (вместе с кор-тизолом) усиливают в этом органе глюконеогенез. Параллельно в липоцитах СТГ, кортизол и адреналин стимулируют липолиз, причём печень будет превращать глицерин в глюкозу, а жирные кислоты послужат альтернативным источником энергии. Однако захват глюкозы липоцитами эти гормоны останавливают. Адреналин способствует распаду мышечного гликогена. Коршизол ингибирует потребление глюкозы в инсулинозависимых
|
|
тканях, а в ряде органов (например, в лимфоидных) сдви-
гает баланс распада и синтеза белка в катаболическую сторону, поставляя субстраты для глюконеогенеза.
Данная реакция известна как метаболический ком понент стрессорного ответа и ответа острой фа зы, причем в последнем случае она координируется с действием цитокинов острой фазы, не позволяющим упомянутым гормональным воздействиям метаболически «обокрасть» иммунную систему и кроветворные органы.
Приведенные примеры свидетельствуют о большой пластичности и об интегрированном ансамблевом характере деятельности эндокринной системы. Концепция гормональных рецепторов имеет важное общемедицинское значение. С одной стороны, по П. Эрлиху (1901), «антитела есть оторвавшиеся от клеточной поверхности рецепторы». Это вводит иммунную систему и физиологический аутоиммунитет в круг участников эндокринной регуляции (Зайчик А.Ш., Чури- ловЛ.П.,2002).
Генерируя антитела к гормональным рецепторам, а затем — аутоантиидиотипические антитела против антирецепторных иммуноглобулинов (рис. 11), иммунная система в принципе способна изготавливать более или менее точные иммунологические копии (об-
28
разы) различных гормонов, которые взаимодействуют с гормональными рецепторами, блокируют их либо стимулируют (Блэчер М. 1984; Линденманн Ж., 1979; Зайчик А.Ш. с соавт., 1988;ФаридН.,Линтикам Д.,
1988). Для многих, причем не только белковых, но и ами нокислотных гормонов такая возможность и реальное существование этого явления уже доказаны. Более того, наличие в организме рецепторов к лекарствам растительного или синтетического происхождения ставит вопрос о существовании еще не найденных, но действующих в нашем теле эндогенных гормонов, для которых природа эти рецепторы предназначила. В. Шрайбер (1987) приводит данные о наличии пока не идентифицированных эндогенных гормонов с проти-вотревожным бензодиазепиновым действием, антими-нералокортикоидным эффектом, антидепрессивным влиянием и пр.
Дата: 2019-02-02, просмотров: 386.