В комплексонометрии используют несколько методов титрования: прямое и обратное титрование, алкалиметрическое титрование и титрование заместителя.
1. Прямое титрование используется, когда известен индикатор с четким переходом окраски в конечной точке. Так, например, катионы магния, бария, стронция, кальция, цинка и др. могут быть определены трилоном Б в присутствии индикатора мурексида. С этой целью анализируемый раствор разбавляют в колбе дистиллированной водой до метки, тщательно перемешивают. Титрование проводят в щелочной среде (рН 10), используя аммонийную буферную смесь.
2. Обратное титрование проводят в том случае, когда для определения катиона металла неизвестен индикатор с четким переходом окраски в эквивалентной точке. В этом случае избыток комплексона титруют раствором соли магния, цинка или другой соли. К анализируемому раствору прибавляют известный объем (избыток) стандартного раствора трилона Б, раствор нагревают для завершения реакция и после охлаждения титруют избыток трилона Б раствором соли магния. Эквивалентную точку определяют индикатором на ионы магния. Этим способом широко пользуются при определении стронция и галлия, а также в тех случаях, когда вследствие гидролиза определяемый катион не может быть удержан в растворе при рН титрования.
 |
3. Алкалиметрическое титрование также возможно использовать, так как при взаимодействии трилона Б с определяемыми катионами выделяется эквивалентное количество ионов водорода. Выделившиеся ионы водорода титруют раствором щелочи в присутствии фенолфталеина.
4. Титрование заместителя основано на способности ионов магния образовывать с трилоном Б менее устойчивый комплекс, чем другие катионы. Поэтому, если смешивать магниевый комплекс с катионами определяемого металла (например, кальция), произойдет сдвиг равновесия вправо:
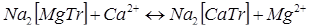
Выделившиеся ионы Мg 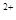 оттитровывают трилоном Б в присутствии хромогена черного.
оттитровывают трилоном Б в присутствии хромогена черного.
Комплексонометрическое титрование прямым способом применяется для определения жесткости воды
Жесткость воды характеризуют молярной концентрацией эквивалентов кальция и магния и выражают в ммоль/дм3.
Индикатором служит обычно хромоген черный. Анализируемую воду подщелачивают до рН 10, прибавляя аммонийную буферную смесь, и титруют раствором трилона Б:


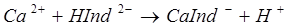


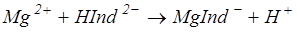
К 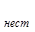 [CaInd]
[CaInd]  =3,9 ×10
=3,9 ×10 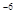 ; К
; К 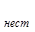 [CaTr]
[CaTr] 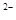 =2,7 ×10
=2,7 ×10 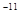 ;
;
K 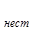 [MgInd]
[MgInd]  =1 ×10
=1 ×10 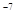 ; K
; K 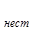 [MgTr]
[MgTr] 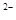 = 2×10
= 2×10 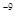 .
.
Учитывая, что константы нестойкости комплексов Са 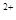 и Mg
и Mg 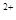 с трилоном Б гораздо меньше, чем соответствующие комплексы с индикаторами, последние разрушаются.
с трилоном Б гораздо меньше, чем соответствующие комплексы с индикаторами, последние разрушаются.

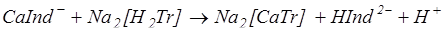



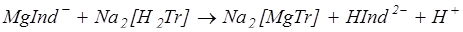
Появление синей окраски раствора укажет на окончание реакции. Общую жесткость воды вычисляют по формуле:
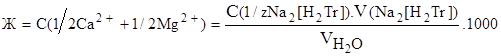
где С(1/zNa2[H2Tr]) - нормальная концентрация раствора трилона Б,
V(Na2[H2Tr]) - объем рабочего раствора трилона Б, затраченного на титрование (в см3),
V( 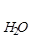 ) - объем анализируемой воды, взятой для титрования (см3).
) - объем анализируемой воды, взятой для титрования (см3).
Пример. На титрование 100 см3 анализируемой воды пошло в среднем 6,5 см3 0,09820 н раствора трилона Б. Рассчитайте общую жесткость воды.
Решение. По формуле, которая приведена выше для расчета жесткости воды, получаем следующие данные. Вода, в которой молярная концентрация эквивалента солей кальция и магния имеет значение до 7 ммоль/дм3 считается мягкой, а выше 7 – жесткой. 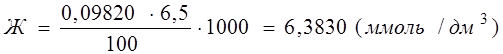
Перечень заданий контрольной работы (раздел 4.4)
127. В чём состоит сущность метода комплексонометрии?
128. Что такое комплексоны? К какому классу соединений они относятся и каковы их свойства?
129. Назовите рабочие растворы, индикаторы метода комплексонометрии.
130. Как приготовить раствор трилона Б и установить его нормальность?
131. Какие ионы (катионы и анионы) можно определить комплексонометрическим методом? Напишите схему реакции взаимодействия Са2+ с Na2[H2Tr].
132. Какие типы титрования можно использовать в комплексонометрическом методе? Опишите способ прямого титрования. Какие компоненты должны быть в колбе для титрования, что наливается в бюретку? Напишите формулу, по которой расчитывают концентрацию определяемого компонента.
133. Какие типы титрования можно использовать в комплексонометрическом методе? Опишите обратное титрование для данного метода. Напишите схемы реакций, лежащих в основе такого титрования (например, для Ме2+) и формулы, по которым можно вычислить массу Ме 2+ .
134. Какие типы титрования можно использовать в комплексонометрическом методе? Опишите титрование по замещению. Почему в данном титровании применяют раствор [MgTr]2- в качестве вспомогательного раствора? Напишите схемы реакций и формулы для определения Ме2+.
135. Почему возможно использование фенолфталеина в качестве индикатора? Опишите алкалиметрическое титрование в этом методе? К какому способу титрования можно отнести данное титрование? Какие компоненты должны быть в колбе для титрования; что наливается в бюретку? Напишите формулы, по которым можно вычислить массу определяемого катиона Ме2+.
136. Почему общую жёсткость воды можно определять комплексонометрическим методом? Опишите выполнение данной работы. Вычислить жесткость воды, если на титрование 100 см3 ее израсходовано 27,6 см3 0,05н раствора трилона Б.
137. Что такое жёсткость воды? Расчитайте общую жёсткость воды, если на титрование 50 см3 воды израсходовано 12,35 см3 0,0493н раствора трилона Б. Является ли вода в данном случае мягкой? Почему?
138. К 10 мл анализируемого раствора, содержащего ионы железа (III), добавили 20 см3 0,1н раствора трилона Б. На титрование избыточного количества трилона Б, которое не прореагировало с Fe3+ пошло 6,9 см3 0,0991н раствора сульфата магния. Определите массу Fe3+ в 200 см3 анализируемого раствора. Напишите схемы соответствующих реакций.
139. Вычислить массу Мg2+ в 20 см3 раствора, на титрование которого израсходовано 9,8 см3 0,1н раствора трилона Б. Напишите уравнение реакции.
140. Когда в комплексонометрическом методе точка эквивалентности определяется переходом цвета с винно-красного в сине-фиолетовый и наоборот? Почему?
Рекомендуемая литература
1. Логинов Н.Н., Воскресенский А.Г., Солодкин И.С. Аналитическая химия. – М.: Просвещение, 1979 – 450с.
2. Алексеев В.Н. Количественный анализ. – М.: Химия, 1972.
3. Пономарев В.Д. Аналитическая химия ( в двух частях).- М. Высшая школа, 1982 – 288с.
4.Алексеев В.Н. Курс качественного химического полумикро анализа. – М.: Химия, 1972.
5.Ярославцев А.А. Сборник задач и упражнений по аналитической химии. – М.: Высшая школа, 1979.
6.Основы аналитической химии. Общие вопросы. Методы разделения (книга 1). Под редакцией акад. Ю.А.Золотова. – М.: Высшая школа, 2002.
7.Основы аналитической химии. Методы химического анализа (книга 2). Под редакцией акад. Ю.А.Золотова. – М.: Высшая школа, 2002.
Содержание
| Введение Перечень тем контрольной работы Выбор вопросов контрольной работы Раздел 1. Основы качественного анализа Раздел 2. Основы гравиметрического (весового) анализа 2.1. Методы выделения и отгонки 2.2. Метод осаждения Раздел 3. Определение молярных масс эквивалентов сложных веществ в аналитических исследованиях Раздел 4. Основы титриметрического (объемного) анализа 4.1. Метод кислотно-основного титрования 4.2. Метод перманганатометрии 4.3. Метод йодометрии 4.4. Метод комплексонометрии Литература | 3 4 5 6 13 18 22 25 31 40 43 47 51 60 |
Дуленко Люция Викторовна – кандидат химических наук, доцент,
Пикула Любовь Федоровна – кандидат технических наук, ст. преподаватель
Горяйнова Юлия Артуровна – ст. преподаватель
Кафедра химии
АНАЛИТИЧЕСКАЯ ХИМИЯ
Методические указания
для самостоятельного изучения и
Дата: 2019-02-02, просмотров: 538.