Данная группа методов основана на окислительно-восстановительных реакциях, которые протекают между рабочим раствором и веществом, которое определяется. К этой группе относятся:
· перманганатометрия – рабочий раствор КMnO4 – окислитель, с помощью которого определяют восстановители;
· йодометрия, где как окислитель используют І2, а как восстановитель І- ;
· хроматометрия – как окислитель применяют рабочий раствор дихромата калия;
· а также броматометрия, ванадатометрия, цериметрия.
В перманганатометрии используется окислительная способность раствора KMnО4 в кислой среде. Данным методом при непосредственном титровании рабочим титрованным раствором KMnО4 можно определить восстановители.
Перманганатометрия - безиндикаторный метод, так как точку эквивалентности можно зафиксировать на основе преобразования ионов MnО4- розового цвета в бесцветные ионы Mn2+.
Метод перманганатометрии применяют для определения железа (II), перекиси водорода, нитратов-ионов, хрома, кальция, марганца.
В кондитерских изделиях методом перманганатометрии можно определить количество сахара, азотистых веществ, щавелевой кислоты и др.
Установить титр перманганата калия по точной его навеске невозможно, так как он легко изменяется под влиянием восстановителей, например, аммиака, органических веществ, которые попадают в воду с пылью, и др. Вследствие этого концентрация раствора KMnО4 в первое время после приготовления несколько уменьшается. Титр его устанавливают через 7-10 дней после приготовления раствора. За это время окисление присутствующих в растворе примесей восстановителей успевает закончиться и концентрация KMnО4 перестает изменяться.
Отсюда следует, что брать точную навеску KMnО4 не имеет смысла, а титр его следует устанавливать по какому-то первичному стандарту, который имеет восстановительные свойства. Титр и концентрацию раствора перманганата калия KMnО4 устанавливают по безводному оксалату натрия Na2C2O4 или дигидрату щавелевой кислоты H2C2O4×2H2O. В основе процесса стандартизации раствора KMnО4 по щавелевой кислоте лежит реакция окисления иона C2O42- ионами MnО4- в кислой среде (к раствору, который титруют, прибавляют серную кислоту). Реакция катализируется ионами Mn2+.
5H2C2O4 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 10CO2 + K2SO4 + 8H2O

 MnO4- +8H+ + 5e- = Mn2+ + 4H2O 2
MnO4- +8H+ + 5e- = Mn2+ + 4H2O 2
10
C2O42- - 2e- = 2CO2 5
В данной реакции молярная масса эквивалента перманганата калия равняется 1/5 М(KMnО4 ), т.к. одна молекула его принимает 5 электронов:
М(KMnО4 ) 158,04
М(1/5 KMnО4 ) = _________________ = ___________________ = 31,61 г/моль
5 5
Фактор эквивалентности щавелевой кислоты равняется - 1/2, поэтому молярная масса эквивалента дигидрата щавелевой кислоты равняется:
126,06
М(1/2 H2C2O4 ×2H2O) = __________ = 63,03 г/моль
2
Пример. Рассчитать количество железа в 250 см3 раствора, если на титрование 25 см3 его в присутствии серной кислоты затрачено в среднем 23,80 см3 0,05081н раствора перманганата калия.
Решение. Запишем уравнение реакции, чтобы иметь представление об эквивалентной массе реагирующих веществ.
10 FeSO4 + 2KMnO4 + 8H2SO4 = 2MnSO4 + 5 Fe2(SO4)3 + K2SO4 + 8H2O

 MnO4- +8H+ + 5e- = Mn2+ + 4H2O 2
MnO4- +8H+ + 5e- = Mn2+ + 4H2O 2
10
2 Fe2+ - 2e- = 2Fe3+ 5
М(1/zFe2+ ) = М (Fe2+ ) = 55,85 г/моль
Рассчитаем титр перманганата калия по железу, т.е. узнаем, сколько граммов ионов Fe2+ взаимодействует с 1 см3 данного раствора.
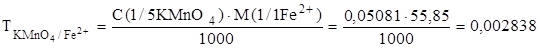 г/см3
г/см3
В нашем случае затрачено 23,8 см3 раствора перманганата калия, значит в аликвотной части находилось (0,002838×23,8) г железа. Чтобы узнать сколько железа в 250 см3 раствора нужно данное количество разделить на объём пипетки и умножить на общий объем:
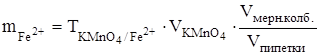
 0,0022838× 23,80× 10 = 0,6754 г
0,0022838× 23,80× 10 = 0,6754 г
Перечень заданий контрольной работы (раздел 4.2.)
99. Как можно приготовить титрованный раствор перманганата калия (для титрования в кислой среде)?
100. Опишите работу по определению железа в соли Мора по методу перманганатометрии. Как провести расчеты?
Как определяют точку эквивалентности в методе перманганатометрии?
102. Почему титрование перманганатом калия проводят предпочтительно в кислой среде? Приведите примеры, напишите уравнения реакций.
103. На титрование навески 0,2070 г щавелевой кислоты 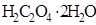 расходуется 40,0 см3 раствора
расходуется 40,0 см3 раствора 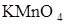 . Рассчитайте титр и нормальность раствора перманганата калия.
. Рассчитайте титр и нормальность раствора перманганата калия.
104. Вычислите весовое содержание 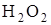 в 100 мл раствора, если на титрование 25 см3 этого раствора пошло 21,5 см3 0,050 н раствора
в 100 мл раствора, если на титрование 25 см3 этого раствора пошло 21,5 см3 0,050 н раствора 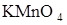 .
.
105. На титрование 25 см3 раствора 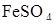 , взятого из мерной колбы на 200 см3, пошло 23,5 см3 0,050н раствора
, взятого из мерной колбы на 200 см3, пошло 23,5 см3 0,050н раствора 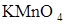 . Определить весовое содержание железа в исследуемом растворе и титр раствора
. Определить весовое содержание железа в исследуемом растворе и титр раствора 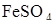 .
.
106. Сколько см3 перманганата калия 0,05 н пойдет на титрование 20 см3 задачи, если в 100 см3 задачи находится 0,42 г перекиси водорода?
107. На титрование 20 см3 раствора щавелевой кислоты, содержащей 5г 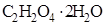 в 500 см3 раствора, израсходовано 25 см3 раствора
в 500 см3 раствора, израсходовано 25 см3 раствора 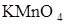 . Определить молярную концентрацию эквивалента раствора
. Определить молярную концентрацию эквивалента раствора 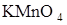 .
.
108. На титрование 0,1085 г Na2C2O4 в кислой среде израсходовано 20,5 см3 раствора КMnО4. Вычислить молярную концентрацию и нормальность раствора КMnО4.
109. Вычислить массу соли Мора (NH4)2Fe(SO4)2×6H2O, если на её титрование в кислой среде израсходовано12,8 см3 0,1н раствора КMnО4.
Вычислить молярную концентрацию и нормальность раствора КNO2, если на титрование 10 см3 его израсходовано15,6 см3 0,05н раствора KMnO4. Напишите схему реакции.
111. Вычислить объем 0,2н KMnO4, необходимый для титрования 0,25г FeSO4×7H2O в кислой среде. Напишите уравнение реакции.
Как стандартизируют рабочий раствор KMnO4?
Раздел 4.3.Метод йодометрии
Йодометрия является одним из методов окисления-восстановления объемного анализа.
В основе метода йодометрии лежат следующие окислительно-восстановительные реакции:
I2 + 2е = 2 I¯ (1)
2I¯ – 2е = I2 (2)
Первая реакция протекает в присутствии таких восстановителей, которые могут быть окислены свободным йодом, т.е. имеют окислительно-восстановительный потенциал меньший, чем у системы I2/2I¯ (+ 0,54 В), например, Na2S2O3 ´ 5H20, H2SO3, H2S и др.
Вторая реакция протекает в присутствии окислителей, которые могут быть восстановлены ионами йода, т.е. те, у которых окислительно-восстановительный потенциал больше +0,54 В, например : KMnO4, K2Cr2O7, Cl2, Br2 и др. Следовательно, методом йодометрии могут быть определены как окислители, так и восстановители.
В качестве рабочих титрованных растворов в этом методе применяются два: титрованный раствор йода (окислитель) и титрованный раствор тиосульфата натрия Na2S2O3 ´ 5H20 (восстановитель).
Определение восстановителей производят или непосредственным титрованием раствором йода, или способом обратного титрования. Для этой цели к определенному объему восстановителя добавляют в избытке определенный объем титрованного раствора йода, а затем избыток титруют вторым рабочим раствором — тиосульфатом натрия.
Определение окислителей не производят непосредственным титрованием рабочим раствором тиосульфата натрия, так как реакция между окислителем и тиосульфатом натрия проходит сложно и трудно определить точку эквивалентности. Определение окислителей производят методом замещения. Для этого к раствору окислителя добавляют избыток растворов KJ и H2SO4 . При этом окислитель выделяет эквивалентное количество йода из йодида калия, который затем титруют рабочим раствором тиосульфата натрия, например:
а) K2Cr2O7 + 6KJ + 7H2SO4 = 3J2 + Cr2(SO4)3 + 4K2SO4 + 7H2O


 Cr207 2- + 6е + 14Н+ = 2Cr3++ 7 Н2О 1
Cr207 2- + 6е + 14Н+ = 2Cr3++ 7 Н2О 1
2J-1 - 2ē = J2 6 3

Cr207 2- + 6J-1 + 14Н+ = 2Cr3+ + 3 J2 + 7 Н2О
б) 2Na2S2O3 + J2 + 2NaJ + Na2S4O6
 тетратионат натрия
тетратионат натрия
2S2O32- - 2ē = S4O62-
J2 + 2ē = 2J-1

2 S2O32- + J2 = S4O62- + 2J-1
Зная объем титрованного раствора тиосульфата натрия, который израсходован на титрование йода, выделенного в эквивалентном количестве определенным объемом окислителя, вычисляют молярную концентрацию эквивалента раствора окислителя.
Эквивалентная точка в йодометрии определяется с помощью индикатора — раствора крахмала.
Пример 1. Навеску химически чистого дихромата калия массой 0,1180 г обработали в кислой среде избытком раствора йодида калия и оттитровали выделившийся йод раствором тиосульфата натрия, которого израсходовано 23,80 см3. Определите молярную концентрацию эквивалента и титр раствора тиосульфата натрия.
Решение. Составим уравнения реакций и определим молярную массу эквивалентов окислителя и восстановителя:

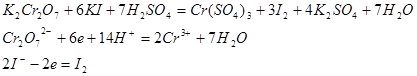
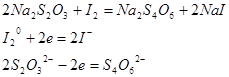
Следовательно,
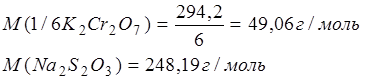
Во взятой навеске дихромата калия содержалось количества вещества эквивалентов:
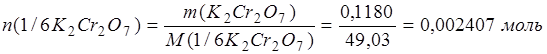
Поскольку вещества реагируют в эквивалентных количествах, то в израсходованном объеме раствора тиосульфата натрия содержится такое же количество эквивалентов Na2S2O3 (0,002407моль).
Определяем молярную концентрацию эквивалента раствора тиосульфата натрия:
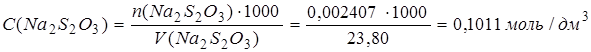
Определяем титр раствора тиосульфата натрия:
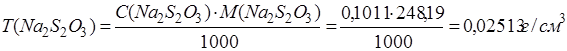
Дата: 2019-02-02, просмотров: 792.