Сколько процентов влаги и золы содержит каменный уголь, если его навеска массой 1,0836 г после высушивания составила 0,8214 г, а после прокаливания - 0,1662?
При сжигании навески 4,3020 г некоторого органического вещества получено 13,2000 г оксида углерода (IV). Определите процентное содержание углерода в данном веществе.
Сахар-песок массой 1000 кг, который хранился на складе, поглотил влагу массой 14 кг. Сделайте вывод, годен ли сахар к реализации, если стандарт предусматривает массовую долю влаги не больше 0,14%.
32. Рассчитать влажность пшеничной муки 1-го сорта, если навеска образца массой 9,7651 г после высушивания и взвешивание составляла 8,0020 г. Стандартом предусмотрено содержание влаги не больше 15%. Сделайте вывод, отвечает ли этот образец стандарту?
33. Для печенья, изготовленного из муки высшего сорта, стандартом предусмотрено содержание влаги от 3 до 8,5%. Сделайте вывод о качестве печенья, если навеска образца 9,9725 г после высушивания в сушильном шкафу встала 8,5110 г.
34. Определить процентный состав криталлизационной воды в кристалогидратах: Na 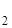 SO
SO 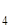 .10H
.10H 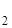 O; BaCI
O; BaCI 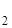 .2H
.2H 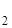 O.
O.
35. Сколько глауберовой соли Na 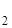 SO
SO 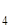 .2H
.2H 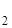 O можно получить из 300г 10% раствора сернокислого натрия?
O можно получить из 300г 10% раствора сернокислого натрия?
36. Сколько воды выделяется при прокаливании 20г кристаллогидрата MgSO 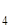 . 7H
. 7H 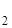 O?
O?
37. Вычислите число молекул воды в молекуле кристаллогидрата сульфата марганца, если из его навески 0,3240 г получили 0,2031 г MnSO4.
38. Сколько молекул воды в молекуле кристаллогидрата хлорида кальция, если из его навески 1,0000 г получили 0,5068 г CaCI2.
39. Вычислите число молекул воды в молекуле кристаллогидрата сульфата хрома, если из его навески 0,8500 г получили 0,4654 г Cr2(SO4)3.
40. Вычислите число молекул воды в молекуле кристаллогидрата хлорида бария, если из его навески 0,3245 г получили 0,3100 г BaSO4.
41. Для определения содержания гигроскопической влаги в пробе хлорида натрия, во взвешенный тигель была взята навеска, которую подвергли высушиванию до постоянного веса. Вычислить процентное содержание гигроскопической влаги по таким данным (в г):
вес тигля …………………………………… 9,0005.
вес тигля с навеской ……………………… 9,4211.
вес тигля с навеской после высушивания ……9,4143.
42. Вычислить процент потери от прокаливания пробы цемента по таким данным (в г):
вес тигля …………………………………………… .9,0646
вес тигля с навеской абсолютно сухой пробы цемента .9,9461
вес тигля с навеской после прокаливания………… … 9,9376
Раздел 2.2. Метод осаждения
В методах осаждения определяемый компонент количественно осаждают химическими способами в виде малорастворимого химического соединения строго определенного состава. Выделившийся осадок промывают, высушивают и прокаливают. При этом осадок большей частью превращается в новое вещество точно известного состава, которое и взвешивают на аналитических весах. В весовом анализе различают: осаждаемую форму, т.е. форму, в виде которой осаждают определяемое вещество, и весовую форму, т.е. форму, в виде которой определяемое вещество взвешивают. Весовая форма может иметь ту же формулу, что и форма осаждения. Например, при определении сульфат-ионов весовым методом, путем осаждения их ионами бария, формула осаждаемой формы (осадка) и формула весовой формы при соблюдении всех требуемых условий анализа одна и та же. Схема такого определения представляется следующим образом:
Ba2+ t
SO42- → BaSO4 → BaSO4
определяемое осаждаемая весовая
вещество форма форма
В некоторых весовых методах определения путем осаждения формула весовой формы отличается от формулы осадка. Например, содержание Сa2+ в солях можно определить методом осаждения, используя в качестве реактива оксалат аммония:
СаСІ2 + (NH4)2C2O4 → CaC2O4 + 2NH4CI
осаждаемая
форма
Осадок СaС2О4 промывают, высушивают и прокаливают. При этом оксалат кальция переходит в оксид кальция
CaC2O4 → CaO + CО2
весовая
форма
Образовавшийся оксид кальция взвешивают и по его количеству рассчитывают содержание кальция в анализируемом веществе.
Расчет результатов определения при анализе по методу осаждения.
Содержание определяемого вещества обычно вычисляют или в граммах или в процентах.
Расчет массы определяемого вещества. Массу определяемого вещества (gA) в граммах находят по формуле:
gA = аА·FВ,
где аА – масса весовой формы определяемого вещества, г;
FВ – аналитический множитель (фактор) весового анализа.
Величину FВ находят из соотношения:

где - MA – молекулярная масса определяемого вещества;
MA1 – молярная масса весовой формы определяемого вещества;
m, n – коэффициенты.
Дата: 2019-02-02, просмотров: 652.