Буквы алфавита
Первые четыре
Буквы фамилии
Первые три буквы имени
Первые три буквы отчества
Кислотно-щелочная классификация катионов
На аналитические группы
Для удобства проведения анализа катионы разделяют на отдельные аналитические группы.
Аналитическая группа — это группа катионов, которая с определенным реактивом (при определенных условиях) дает подобные аналитические реакции. Известны две классификации: сульфидная и кислотно-щелочная.
Сульфидная классификация основывается на неодинаковой растворимости карбонатов и сульфидов металлов.
Согласно кислотно-щелочной классификации катионы распределяются на группы согласно их отношению к серной, соляной кислотам, едким щелочам и к аммиаку (табл.2).
Анализ катионов с применением сероводорода (в сульфидной классификации) имеет ряд недостатков, главным из которых является работа с сероводородом, что вредно для здоровья; работу надо выполнять в лаборатории, оборудованной сильной вытяжной системой. Исходя из этого, лучше анализ катионов проводить, используя кислотно-щелочную классификацию.
Первая группа катионов (К+, Nа+, NН4+) не имеет группового реагента; катионы этой группы не осаждаются ни минеральными кислотами, ни щелочами.
Катионы второй группы (Аg+, Рb2+, [Нg2]2+) осаждаются соляной кислотой.
Катионы третьей группы (Ва2+, Sr2+, Са2+) осаждаются серной кислотой.
Таблица 2
Кислотно-щелочная классификация катионов
| Группа | Кат и оны | Групповой реактив | Вещества, которые образуются | Групповая характеристика |
| 1 | К+, Na+,NН4+ | Нет | Хлориды, сульфаты и гидроксиды растворяются в воде | |
| 2 | Аg+, Рb2+, [Нg2]2+ | 2 н раствор НСl | Осадки АgСl, РbС12, Нg2С12 | Хлориды нерастворимы в воде |
| 3 | Ва2+, Sг2+, Са2+ | 2 н раствор Н2SО4 | Осадки ВаSО4, SrSО4, СаSО4 | Сульфаты нерастворимы (или плохо растворимы) в воде и в кислотах |
| 4 | Zn2+, Al3+ , Сr+3, Sn2+, Sn(ІV), Аs(ІП), Аs(V) | Избыток 4 н раствора NaОН или КОН | Раствор ZnO22–, AlO2‾, CrO2‾, SnO22– SnO32–, AsO33–, AsO43– | Гидроксиды растворимы в избытке растворов NaОН или КОН |
| 5 | Fе2+, Fе3+, Мn2+, Мg2+, Ві3+ , Sb(ІІІ), Sb(V) | Избыток 25%-ного раствора NН3 | Осадки Мg(ОН)2, Мn(ОН)2, Ві(ОН)3, Fе(ОН)2, Fе(ОН)3, Sb(ОН)3, Н[Sb(ОН)6] | Гидроксиды нерастворимы в избытке раствора NaОН |
| 6 | Нg2+, Сu2+, Сd2+, Со2+, Nі2+ | Избыток 25 %-ного раствора NН3 | [Сu(NН3)4]2+ [Cd(NН3)4]2+ [Nі(NН3)6]2+ [Hg(NH3)4]2+ [Co(NH3)4]2+ | Гидроксиды растворимы в избытке раствора аммиака с образованием аммиакатов |
Четвертую группу образуют катионы (Zn2+, Al3+ , Сr+3, Sn2+, Sn(ІV), Аs(ІП), Аs(V)), которые не выпадают в осадок при добавлении избытка раствора щелочи.
Катионы пятой группы (Fе2+, Fе3+, Мn2+, Мg2+, Ві3+ , Sb(ІІІ), Sb(V)) осаждаются раствором щелочи.
В шестую группу входят катионы (Нg2+, Сu2+, Сd2+, Со2+, Nі2+), которые образуют гидроксиды, растворимые в избытке 25 % -ного раствора аммиака (получаются аммиакаты).
Раздел 2.2. Метод осаждения
В методах осаждения определяемый компонент количественно осаждают химическими способами в виде малорастворимого химического соединения строго определенного состава. Выделившийся осадок промывают, высушивают и прокаливают. При этом осадок большей частью превращается в новое вещество точно известного состава, которое и взвешивают на аналитических весах. В весовом анализе различают: осаждаемую форму, т.е. форму, в виде которой осаждают определяемое вещество, и весовую форму, т.е. форму, в виде которой определяемое вещество взвешивают. Весовая форма может иметь ту же формулу, что и форма осаждения. Например, при определении сульфат-ионов весовым методом, путем осаждения их ионами бария, формула осаждаемой формы (осадка) и формула весовой формы при соблюдении всех требуемых условий анализа одна и та же. Схема такого определения представляется следующим образом:
Ba2+ t
SO42- → BaSO4 → BaSO4
определяемое осаждаемая весовая
вещество форма форма
В некоторых весовых методах определения путем осаждения формула весовой формы отличается от формулы осадка. Например, содержание Сa2+ в солях можно определить методом осаждения, используя в качестве реактива оксалат аммония:
СаСІ2 + (NH4)2C2O4 → CaC2O4 + 2NH4CI
осаждаемая
форма
Осадок СaС2О4 промывают, высушивают и прокаливают. При этом оксалат кальция переходит в оксид кальция
CaC2O4 → CaO + CО2
весовая
форма
Образовавшийся оксид кальция взвешивают и по его количеству рассчитывают содержание кальция в анализируемом веществе.
Расчет результатов определения при анализе по методу осаждения.
Содержание определяемого вещества обычно вычисляют или в граммах или в процентах.
Расчет массы определяемого вещества. Массу определяемого вещества (gA) в граммах находят по формуле:
gA = аА·FВ,
где аА – масса весовой формы определяемого вещества, г;
FВ – аналитический множитель (фактор) весового анализа.
Величину FВ находят из соотношения:

где - MA – молекулярная масса определяемого вещества;
MA1 – молярная масса весовой формы определяемого вещества;
m, n – коэффициенты.
Решение.
M(1/6 К2Сr2O7) =1/6 M(K2Cr2O7) = 1/6×294,20 = 49,03 г/моль
M(1/5 КМn04 ) =1/5 M(КМn04) = 1/5×158,04 = 31,61 г/моль.
В реакции FeCI3 + 2KI = I2 + FeCI2 + KCI
Fе3+ + 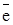 = Fе2+
= Fе2+
I - -  = I0
= I0
молярные массы эквивалента окислителя и восстановителя будут совпадать с молярными массами, т.к. в реакции окисления и восстановления принимает участие только один электрон.
Методические указания
для самостоятельного изучения и
Л.В. Дуленко, Л.Ф. Пикула, Ю.А. Горяйнова
АНАЛИТИЧЕСКАЯ ХИМИЯ
методические указания
для самостоятельного изучения и
выполнения контрольных работ
Утверждено
на заседании кафедры химии.
Протокол № 1 от 29.08.03.
Одобрено
учебно-методическим
советом ДонГУЭТ.
Протокол № 1 от 25.09.03.
Донецк – 2003
«Аналитическая химия. Методические указания для самостоятельного изучения и выполнения контрольных работ». Данная работа рекомендована для студентов заочного отделения факультета питания и оборудования специальности «Технология питания». Сост.: Л.В. Дуленко, Л.Ф. Пикула, Ю.А. Горяйнова – Донецк. ДонГУЭТ, 2003. - 62с.
В данных методических указаниях даны краткие теоретические положения по основным темам курса «Аналитическая химия», приведены примеры решения расчетных задач, дан перечень вариантов контрольных заданий, рекомендована литература.
Рецензенти: докт. хим. наук, профессор кафедры химии
ДонГУЭТ им. М. Туган-Барановского
Дмитрук А.Ф.,
д.х.н., профессор кафедры аналитической
химии Донецкого национального
университета
Алемасова А.С.
Донецкий государственный университет
экономики и торговли
им. М. Туган-Барановского, 2003
| ВВЕДЕНИЕ |
Аналитическая химия является одной из фундаментальных естественных наук. Курс аналитической химии является теоретической базой для последующего изучения студентами дисциплин, предусмотренных учебным планом специальности «Технология питания».
При изучении курса аналитической химии студенты должны:
знать основы качественного анализа и основные методы количественного анализа, их преимущества и недостатки, ошибки количественных определений и их влияние на результаты определения; вычисления в количественном анализе;
уметь выполнять операции качественного анализа, гравиметрического и титриметрического анализа, осуществлять расчеты, связанные с определением концентрации веществ, массовой доли веществ в определяемых объектах.
Изучение курса должно обязательно сопровождаться выполнением заданий и решением задач.
После усвоения теоретического материала студент должен приступить к выполнению контрольной работы.
Контрольная работа выполняется в отдельной ученической тетради. Она должна быть аккуратно оформлена. На обложке тетради студент должен указать свою фамилию, имя и отчество, факультет, курс, номер группы. Номера и условия задач переписываются студентом в том порядке, который указан в контрольной работе. В конце контрольной работы приводится перечень литературы, которой пользовался студент. Работа подписывается студентом, ставится дата ее выполнения.
Перечень тем контрольной работы:
Основы качественного анализа.
Основы гравиметрического (весового) анализа
Методы выделения и отгонки
Метод осаждения
Определение молярных масс эквивалентов сложных веществ в аналитических исследованиях
Основы титриметрического (объемного) анализа
Метод кислотно-основного титрования
Метод перманганатометрии
Метод йодометрии
Метод комплексонометрии
Выбор вопросов контрольной работы
Выбор вопросов контрольной работы осуществляется по первым четырем буквам фамилии, первым трем буквам имени, первым трем буквам отчества студента (табл 1.).
Исходя из первых четырех букв фамилии выбирают первые четыре задания контрольной работы (колонки цифр №№1 , 2, 3, 4 табл.1). Исходя из первых трех букв имени выбирают следующие за ними три задания контрольной работы (колонки цифр №№ 5, 6, 7 табл.1). Исходя из первых трех букв отчества выбирают следующие за ними три задания контрольной работы (колонки цифр №№ 8, 9, 10 табл.1). Например:
П а р а монова И р и на С е р геевна
1, 15, 30, 43, 65, 72, 93, 101, 118, 128
Если фамилия содержит меньше четырех букв, то сосответсвующие вопросы следует выбирать по первым буквам имени. Если имя содержит меньше трех букв, то соответствующие вопросы следует выбирать по первым буквам отчества.
Таблица 1.
Номера вопросов контрольной работы
Буквы алфавита
Первые четыре
Буквы фамилии
Первые три буквы имени
Первые три буквы отчества
Дата: 2019-02-02, просмотров: 416.