Титриметрическим называется метод количественного анализа, основанный на измерении объема раствора точно известной концентрации, вступившего в реакцию с определяемым веществом или его раствором.
Основная операция данного метода анализа – титрование.
Титрованием называют процесс приливания стандартного (рабочего) раствора к исследуемому раствору до наступления момента эквивалентности, т.е. такого момента, когда количество добавленного вещества становится химически эквивалентным количеству определяемого вещества.
Любой количественный анализ, и титриметрический в частности, основывается на основных законах химии: законе постоянства состава вещества, законе эквивалентов. Поскольку в момент окончания реакции количество эквивалентов прореагировавших веществ равно:
n 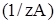 = n(1/zB),
= n(1/zB),
можно вывести основную формулу, применяющуюся при расчётах в титриметрическом анализе, выразив количество эквивалентов веществ через молярную концентрацию эквивалентов (нормальную концентрацию, см. ниже):
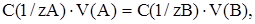
где C(1/zA) и C(1/zB) –молярные концентрации эквивалентов веществ А и В;
V(A) и V(B) –объемы растворов данных веществ, вступивших в реакцию.
Объем стандартного раствора, пошедшего на титрование в тот момент, когда зафиксирована точка эквивалентности, используют для расчета количества определяемого вещества.
Исходя из последнего выражения, самым удобным способом выражения концентрации растворов при решении задач является молярная концентрация эквивалента вещества, но при этом также пользуются и другими видами концентрации.
Способы выражения концентраций растворов в титриметрическом анализе
1. Молярная концентрация – С(А) - это отношение количества растворенного вещества А к объему его раствора:
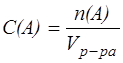 , моль/дм3
, моль/дм3
Основной единицей молярной концентрации является моль/дм3.
Растворы с молярной концентрацией атомов, молекул, ионов называют молярными.
Например, если в 1 литре раствора хлороводородной кислоты содержится 1 моль HCI, то он называется молярным, если 0,1 моль - децимолярным, 0,01 моль - сантимолярным и т.д.
2. Молярная концентрация эквивалента вещества (нормальная концентрация) – С( 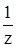 А) - это отношение количества эквивалентов вещества А в растворе к объему раствора:
А) - это отношение количества эквивалентов вещества А в растворе к объему раствора:
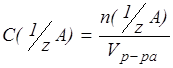 , моль/дм3.
, моль/дм3.
Растворы с молярной концентрацией эквивалента называют нормальными. Например, если в 1 литре раствора серной кислоты содержится 1 моль эквивалентов Н2S04, то он называется нормальным, если 0,1 моль эквивалентов - децинормальным, 0,01 моль - сантинормальным и т.д.
Применяют следующие формы записи:
С(Н2SO4) = 0,2 моль/ дм3 или 0,2 М H2S04;
C(1/2 H2S04) = 0,1 моль/ дм3 или 0,1н Н2S04
(сокращение "н" относится к слову "нормальный").
Не следует писать С(Н2SO4) = 0,2 М или C(1/2 Н2S04) = 0,1н.
Не следует пользоваться устаревшей формой записи Н2S04=0,1 г- экв/ дм3.
Отношение молярной концентрации к молярной концентрации эквивалента вещества А равно фактору эквивалентности - f экв:
 А)
А)
Молярную и нормальную концентрации можно вычислить по навеске вещества А, растворенной в известном объеме раствора:
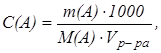 моль/дм3
моль/дм3
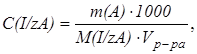 моль/дм3
моль/дм3
где m (А) - масса (навеска) вещества, г;
М(А) -молярная масса вещества, г/моль;
М(I/zА) -молярная масса эквивалента, г/моль;
V(A) -объем раствора, дм3.
Пример 1. 4,9 г безводной серной кислоты растворили в мерной колбе на 500 см3. Определить молярную и нормальную концентрации полученного раствора, найти их отношение.
1). Определяем молярную концентрацию полученного раствора:

2). Определим нормальную концентрацию раствора:
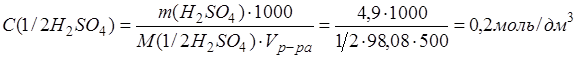
3).Найдем отношение молярной и нормальной концентраций приготовленного раствора серной кислоты:
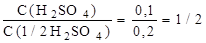 (f экв. (H2SO4) = ½)
(f экв. (H2SO4) = ½)
Если f экв.(А) = I, то величины молярной и нормальной концентраций раствора совпадают, и тогда применяют только молярную концентрацию.
3. Концентрация, выраженная через титр – Т(А) – это отношение массы растворенного вещества А к объему его раствора:
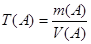 , г/см3
, г/см3
Если массовую концентрацию измеряют в граммах на кубический сантиметр (г/см3), то в этом случае ее принято называть титром. Если известен титр раствора, то известно число граммов растворенного вещества в каждом миллилитре его раствора. Например, титр раствора хлороводородной кислоты Т(HCI)=0,03604 г/мл, это означает, что каждый миллилитр данного раствора содержит 0,03604 г HCI.
Титр раствора можно рассчитать через молярную или нормальную концентрации, используя соотношение:
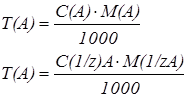
Пример 2. Рассчитать титр 0,2 н раствора серной кислоты.
1) Молярная масса эквивалента 
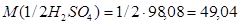 г/моль
г/моль
2) Молярная концентрация эквивалента или нормальная концентрация раствора серной кислоты по условию равна
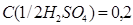 моль/дм3
моль/дм3
3) Определяем титр данного раствора серной кислоты по формуле:
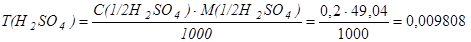 г/ см3
г/ см3
4. Массовая доля вещества  (A ) – это отношение массы вещества (А) к общей массе раствора:
(A ) – это отношение массы вещества (А) к общей массе раствора:
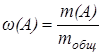
В количественном анализе массовую долю, как правило, измеряют в процентах. Она характеризует содержание компонента А в твердом веществе или растворе:
 %
%
5.Титр по определяемому веществу Т(А/В) – это отношение массы определяемого вещества m(В) к эквивалентному объему рабочего раствора V(A):
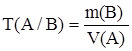
Титр по определяемому веществу показывает, какая масса этого вещества реагирует с 1 мл стандартного раствора вещества А. Такой способ выражения массовой концентрации обычно используют для расчета массы определяемого вещества в серийных анализах:

Если известна молярная концентрация эквивалента вещества А в растворе, титр по определяемому веществу можно вычислить по формуле:

где С(1/zA) – молярная концентрация эквивалента вещества А в растворе;
M(1/zB) – молярная масса эквивалента вещества B (определяемого вещества).
Пример 3. Рассчитайте молярную концентрацию эквивалента щавелевой кислоты в растворе, его титр и титр по NaOH для раствора, приготовленного растворением 3,1220 г щавелевой кислоты 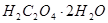 в мерной колбе на 250 см3.
в мерной колбе на 250 см3.
1.Определяем молярную концентрацию эквивалента щавелевой кислоты в растворе
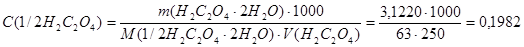 моль/дм3
моль/дм3
2.Определяем титр приготовленного раствора щавелевой кислоты
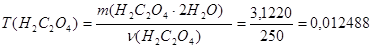 г/см3
г/см3

3.Определяем титр раствора щавелевой кислоты по гидроксиду натрия:
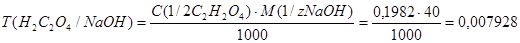 г/ см3
г/ см3
Химические реакции в объемном анализе должны отвечать определенным требованиям:
· реакции должны происходить стехиометрично, то есть в соответствии с уравнением протекающей реакции;
· рабочий раствор должен реагировать только с веществом, которое определяют, то есть не должно происходить побочных реакций;
· реакции между рабочим раствором и раствором вещества, которое определяют, должны происходить быстро, практически моментально;
· реакция должна быть практически необратимой;
- хорошо заметным должен быть момент окончания реакции (точка эквивалентности).
Для определения момента (точки) эквивалентности применяют титрование в присутствии индикатора и без индикатора (в том случае, если одно из веществ окрашено и его окраска изменяется в точке эквивалентности); титрование, сопровождающееся изменением какого-либо физического свойства раствора.
В титриметрическом анализе применяют 1) рабочие растворы и 2) растворы анализируемого вещества.
Рабочим (стандартным, титрованным) раствором, или титрантом называется раствор, концентрация которого известна с точностью до четвертой значащей цифры. Они бывают с приготовленным титром и с установленным титром.
Приготовленные стандартные растворы готовят растворением навески химически чистого вещества, взятой с точностью 0,0002г, в мерной колбе с известной вместимостью. Титр раствора можно легко определить по формуле:
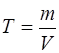 , г/дм3
, г/дм3
Вещества, использующиеся для этого, называются стандартными или установочными.
Они должны удовлетворять таким требованиям:
· вещества должны быть химически чистыми, их состав должен строго отвечать химической формуле;
· они должны быть стойкими в растворе и при сохранении в твердом состоянии;
· для повышения точности концентрации раствора величина их молярной массы эквивалента должна быть как можно наибольшей.
К таким веществам относят тетраборат натрия Nа2В4О7×10Н2О, карбонат натрия, щавелевую кислоту Н2С2О4×2Н2О, оксалат натрия, хлорид калия, хлорид натрия и т.п.
Многие растворы, используемые в качестве рабочих, приготовить этим способом нельзя из-за неустойчивости реактива или раствора в процессе приготовления. Гидроксид калия, хлороводород и др. непригодны для приготовления таких растворов, так как в процессе взвешивания и приготовления их концентрация будет меняться – гидроксид калия будет вступать в реакцию с оксидом углерода (IV) и парами воды, которые находятся в воздухе, хлороводород улетучивается и т.п.
В этом случае готовят раствор примерной концентрации.
Массу навески m вещества А, необходимую для получения определенного объема раствора V нужной концентрации C(1/z), рассчитывают по формуле:
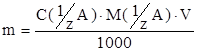 , г
, г
где M(1/z A) – молярная масса эквивалента вещества А.
Затем точную концентрацию устанавливают титрованием этим раствором навески стандартного вещества или известного объема другого стандартного раствора. Такие стандартные растворы называют установленными или растворами с установленным титром. Так готовят, например, рабочие титрованные растворы щелочей, соляной, серной кислот.
Для приготовления стандартных растворов можно использовать стандарт-титры. Стандарт-титры представляют собой запаянную ампулу, в которую помещена навеска стандартного вещества. Для приготовления стандартного раствора содержимое ампулы переводят в мерную колбу соответствующей вместимости – чаще всего 1литр. Подобные растворы, концентрация которых выражается целочисленными цифрами, часто рекомендуются ГОСТами при анализе технических и пищевых продуктов. Если при выполнении стандартной методики ГОСТа используется стандартный раствор, концентрация которого отличается от целочисленной, то в расчетную формулу вводят поправочный коэффициент.
Например, для анализа нужен 0,05000н раствор, а используется 0,04900н раствор. Поправочный коэффициент находится следующим образом:
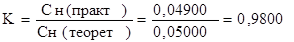
Титрование в объёмном методе анализа проводят двумя способами:
1. способ отдельных навесок, при котором берут несколько (2-3) близких по величине навесок исходного вещества, помещают каждую в отдельную колбу для титрования, растворяют в небольшом количестве дистиллированной воды и полученные растворы титруют;
2 ) способ пипетирования – в этом способе навеску вещества, которое анализируется, переносят в мерную колбу, растворяют в дистиллированной воде, доводят раствор до метки и тщательно перемешивают. Потом пипеткой берут определенную (аликвотную) часть раствора и титруют ее. Титрование повторяют 3-4 раза.
В зависимости от типа химической реакции, которая лежит в основе определения выделяют четыре метода титриметрического анализа:
- метод нейтрализации (кислотно-основной);
· редоксиметрии (окислительно–восстановительный);
· метод комплексонометрии;
· метод осаждения.
Приступая к изучению данных методов, обратите внимание на тип реакции, лежащей в основе метода, на используемые стандартные растворы, способы их приготовления, условия применения и хранения, на выбор индикаторов, на примеры применения метода.
Дата: 2019-02-02, просмотров: 432.