Методы выделения. В методах выделения определяемый компонент количественно выделяют в свободном состоянии из анализируемого вещества и взвешивают на аналитических весах.
Примером такого определения является определение процентного содержания золы в твердом топливе, основанное на сжигании и прокаливании до постоянной массы навески топлива в предварительно взвешенном тигле. Оставшуюся в тигле золу взвешивают. По массе золы вычисляют её процентное содержание (х) в данном образце твердого топлива.
Расчет результатов определения при анализе по методу выделения:

где gа – масса определяемого компонента, г; a – навеска образца анализируемого вещества, г.
Методы отгонки. В методах отгонки определяемый компонент количественно отгоняют в виде летучего соединения. Отделение определяемой части осуществляют путем нагревания анализируемого вещества или действием соответствующих реагентов, сопровождающимся выделением летучих продуктов. Методы отгонки бывают прямые и косвенные.
Прямые методы отгонки. Определяемый компонент поглощают специфическим поглотителем и по увеличению массы последнего вычисляют количество определяемого компонента.
Примером прямого весового определения летучего вещества является определение СО2 в карбонатных породах, основанное на разложении карбонатов кислотами:
t
CaCO3 + 2H+ → CO2↑+ Ca2+ + H2O
CO2 + 2NaOH → NaOH + H2O
Образец карбоната разлагают в специальных приборах, позволяющих улавливать выделяющийся CO2. Содержание CO2 вычисляют по увеличению массы поглотительной трубки, наполненной натронной известью (CaO + NaOH).
Расчет результатов анализа при прямом весовом определении по методу отгонки.
При прямых определениях летучие продукты обычно выделяют в форме соединений определенного состава. Кристаллогидраты разлагаются с выделением воды, карбонаты – с выделением СО2 и т.п. Поэтому количество определяемого вещества вычисляют по увеличению массы поглотительного прибора. В общем виде при расчете процентного содержания определяемого вещества прямым определением по методу отгонки пользуются формулой:
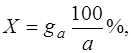
где gA – масса вещества, определяемого по увеличению массы поглотительного прибора, г; a – навеска образца анализируемого вещества, г.
Косвенные методы отгонки. В косвенных методах определения узнают массу остатка вещества после полного удаления определяемого вещества. Разность в массе до и после отгонки определяемого вещества дает возможность вычислить количество определяемого компонента. Схема этого определения:
t
BaCI2·2Н2О → BaCI2 + 2Н2О
Косвенные способы весовых определений применяют при определении влажности материалов, кристаллизационной воды в кристаллогидратах, потерь при прокаливании и т.д.
Расчет результатов анализа при косвенном весовом определении по методу отгонки.
При косвенном способе определения летучие продукты удаляют нагреванием или прокаливанием анализируемого образца. Процентное содержание летучего компонента при косвенном определении по методу отгонки вычисляют по формуле:
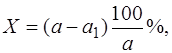
где а – навеска образца анализируемого вещества, г; а1 – масса высушенного или прокаленного анализируемого вещества после удаления летучих определяемых компонентов, г.
Во всех случаях для установления количественного содержания влаги пользуются взвешиванием. Для этого сначала взвешивают и просушивают посуду (чашку, тигель и т.п.) при температуре не ниже, чем та, при которой предусмотрено просушивать вещество. При этом через определенные промежутки времени (20-40 мин) нагревания посуду охлаждают в эксикаторе и взвешивают. Нагревание, охлаждение и взвешивание повторяют до тех пор, пока не будет достигнута постоянноя масса посуды. Потом в высушенную посуду помещают вещество, взвешивают его с посудой и просушивают до постоянной массы. На основании полученных результатов взвешивания можно вычислить массовую долю сухого вещества и влаги в исследуемом веществе.
При растворении веществ в воде, в том числе и солей, наблюдается процесс электролитической диссоциации, которая приводит к образованию в растворе гидратированных ионов (гидратов): H  .H
.H  O (H
O (H  O+); Cu
O+); Cu 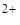 .nН
.nН 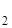 O и др. Иногда катионы электролита настолько крепко связываются с полярными молекулами воды, что частички, которые получаются, можно рассматривать как аквакомплексы: [Cr(H
O и др. Иногда катионы электролита настолько крепко связываются с полярными молекулами воды, что частички, которые получаются, можно рассматривать как аквакомплексы: [Cr(H 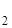 O)
O) 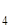 ]
]  ; [Cu(H
; [Cu(H 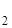 O)
O) 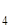 ]
] 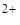 ; [Fe(H
; [Fe(H 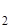 O)
O)  ]
]  и др.
и др.
В процессе кристаллизации соответствующих солей из растворов молекулы воды, которые выступают как лиганды, входят в структуру кристаллов солей. Некоторые вещества при кристаллизации могут удерживать и кристаллизационную воду, которая не входит во внутреннюю сферу комплексов, например: [Fe(H 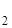 O)
O)  ]SO
]SO 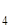 .7H
.7H 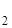 O; [Cr(H
O; [Cr(H 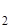 O)
O) 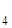 Cl
Cl 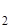 ]CI . 2 H
]CI . 2 H 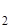 O.
O.
Напоминаем, что вещества, в структуру кристаллов которых входит вода, называют кристаллогидратами. Состав кристаллогидратов обозначается определенными химическими формулами, например: FeSO 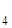 . 7H
. 7H 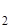 O, BaCl
O, BaCl 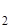 .2 H
.2 H 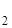 O, CrCІ
O, CrCІ 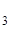 .6 H
.6 H 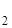 O, Na
O, Na 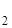 SO
SO 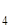 .10H
.10H 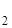 O.
O.
Определение содержимого соли в кристаллогидратах проводится по разнице в весе соли до и после прокаливания, во время которого вода полностью улетучивается и кристаллогидрат превращается в безводную соль. При этом преобразовании часто происходит изменение цвета вещества. Следует иметь в виду, что вода, которая не входит во внутреннюю сферу комплекса, связана менее крепко, чем координированная, и легче теряется при нагревании.
Дата: 2019-02-02, просмотров: 530.