Анионы разделяют на аналитические группы. Групповые реагенты используются не для отделения групп анионов, а для того, чтобы сделать вывод: следует ли дальше проводить реакции для выявления каждого из ионов данной группы.
В основу классификации анионов положена разная растворимость солей бария и серебра. Все анионы можно разделить на три аналитические группы (табл.3).
Таблица 3
Распределение анионов на аналитические группы
| Груп-па | Анионы | Групповой реагент | Характеристика группы |
| 1 | SO 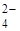 , CO , CO 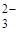 , PO , PO 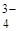 ,
SO32-, SiO32-, CrO42-, MnO4- и др. ,
SO32-, SiO32-, CrO42-, MnO4- и др.
| Хлорид бария в нейтральной или слабощелочной среде | Соли бария, которые мало растворяются в воде |
| 2 |
CI 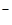 , Вr , Вr 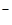 , I , I 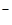 , S2-, SCN-
и др. , S2-, SCN-
и др.
| Нитрат серебра в присутствии азотной кислоты | Соли серебра, которые не растворяются в воде и разбавленной азотной кислоте |
| 3 |
NO 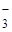 , CH , CH  COO COO 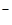 , NO2- , NO2-
| Группового реагента нет | Соли бария и серебра растворимы в воде |
К первой аналитической группе анионов относятся анионы: SO 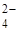 , CO
, CO  , PO
, PO 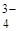 , SO32-, SiО32-, CrО42-, MnО4- и т.п. Эти анионы образуют с катионом Ва
, SO32-, SiО32-, CrО42-, MnО4- и т.п. Эти анионы образуют с катионом Ва 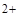 соли, которые мало растворяются в воде, но за исключением сульфата бария, хорошо растворяются в разбавленных минеральных кислотах. Поэтому выделять анионы этой группы в виде осадков групповым реагентом – хлоридом бария – можно только в нейтральной или слабощелочной среде. Анионы первой аналитической группы образуют с катионами серебра соли, которые растворяются в разбавленной азотной кислоте, а сульфат серебра растворяется даже в воде.
соли, которые мало растворяются в воде, но за исключением сульфата бария, хорошо растворяются в разбавленных минеральных кислотах. Поэтому выделять анионы этой группы в виде осадков групповым реагентом – хлоридом бария – можно только в нейтральной или слабощелочной среде. Анионы первой аналитической группы образуют с катионами серебра соли, которые растворяются в разбавленной азотной кислоте, а сульфат серебра растворяется даже в воде.
Ко второй аналитической группе анионов относятся ионы: CI 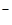 , Вr
, Вr 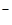 , I
, I 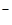 , S2-, SCN- и т.п. Эти анионы образуют с катионами Ag
, S2-, SCN- и т.п. Эти анионы образуют с катионами Ag 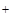 соли, которые не растворяются в воде и разбавленной азотной кислоте. Групповым реагентом второй группы анионов есть нитрат серебра в присутствии азотной кислоты (в этих условиях анионы первой группы не дают осадка с анионами Ag
соли, которые не растворяются в воде и разбавленной азотной кислоте. Групповым реагентом второй группы анионов есть нитрат серебра в присутствии азотной кислоты (в этих условиях анионы первой группы не дают осадка с анионами Ag 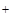 ). Хлорид бария с анионами второй группы осадков не дает.
). Хлорид бария с анионами второй группы осадков не дает.
К третьей группе анионов относятся ионы: NO 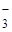 , CH
, CH  COO
COO 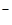 , NO2- и т.п. Катионы Ba
, NO2- и т.п. Катионы Ba 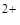 и Ag
и Ag 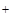 с анионами данной группы не образуют осадков, группового реагента на ионы третьей группы нет.
с анионами данной группы не образуют осадков, группового реагента на ионы третьей группы нет.
Перечень заданий контрольной работы (раздел 1)
47.На чем основан принцип аналитической классификации катионов? Сколько и каких аналитических групп катионов существуют в кислотно-щелочной классификации?
2. Разделите катионы Fe2+, Cu2+, Ba2+, Zn2+, Pb2+ на аналитические группы, укажите групповые реагенты, составьте соответствующие уравнения реакций.
3. Что называют групповым реагентом? Какие реакции являются общими, а какие специфическими? Приведите примеры.
4. Распределите катионы Mn2+, Al3+, Ag+, Ba2+, Cu2+ на аналитические группы, укажите групповые реагенты, составьте соответствующие уравнения реакций.
5. Какую реакцию называют аналитической (качественной)? Какие требования к ней предъявляются? Что такое чувствительность реакции?
6. По какому признаку катионы Ag+, Pb2+ образуют отдельную аналитическую группу? Какова растворимость их хлоридов в воде и как это используется в анализе?
7. Разделите катионы Ni2+, Mn2+, Cr3+, Ca2+, Pb2+ на аналитические группы, укажите групповые реагенты, составьте соответствующие уравнения реакций.
8. На чем основан принцип аналитической классификации анионов? Какие вы знаете аналитические группы анионов?
9. Распределите катионы Cr3+, Ca2+, Ni2+, Pb2+, Mn2+ на аналитические группы, укажите групповые реагенты, составьте соответствующие уравнения реакций.
Какое значение для аналитических исследований сырья и материалов имеет определение рН? Определите рН раствора, концентрация ионов Н+ которого равна 1·10-3моль/дм3.
Разделите катионы Fe3+, Ag+, Al3+, Co2+ на аналитические группы, укажите групповые реагенты, составьте соответствующие уравнения реакций.
Какое значение имеют процессы гидролиза солей в качественном анализе?
13. Какое значение для аналитических исследований имеют процессы комплексообразования? Приведите примеры.
14. Напишите уравнения реакций, при помощи которых можно подтвердить наличие в растворе следующих анионов: PO  , CH
, CH  COO
COO  , CO
, CO  .
.
Раздел 2.Основы гравиметрического анализа
Гравиметрическим (весовым) называют метод количественного анализа, основанный, но точном измерении массы определяемого вещества,
выделенного в химически чистом виде или в виде малорастворимого соединения точно известного постоянного состава.
Гравиметрические методы основаны на законах сохранения массы вещества и постоянства состава веществ. Гравиметрический анализ отличается высокой точностью (до 0,2%) и хорошей воспроизводимостью.
Все многочисленные весовые определения можно разделить на три большие группы методов, а именно: методы выделения, отгонки и осаждения.
При изучении темы уясните основные требования, предъявляемые к осадкам, и способы получения возможно чистых осадков, особое внимание обратите на то, как влияют условия осаждения аморфных и кристаллических осадков, условия получения крупнокристаллических осадков. Изучите устройство весов (технохимических и аналитических), технику и правила взвешивания на них, обратите внимание на точность взвешивания и запись результатов. Ознакомьтесь с основными приемами гравиметрического
анализа и его основными операциями (взятие навески вещества, перевод ее в раствор, осаждение, фильтрование и промывание осадка, высушивание и взвешивание).
Обратите внимание на требования, предъявляемые к осаждаемой и весовой форме.
Требования, предъявляемые к осаждаемой форме:
малая растворимость – не более 1×10-7 – 10-8 моль/дм3;
осадок должен быть крупнокристаллическим;
необходимо, чтобы осаждаемая форма достаточно легко и полно превращалась в весовую форму.
Учтите, что осаждаемая форма по своему составу на всегда совпадает с весовой формой.
Требования, предъявляемые к весовой форме:
точное соответствие химической формуле;
достаточная химическая устойчивость; она не должна поглощать оксид углерода (IV) воздуха, водяные пары, не окисляться кислородом воздуха, не разлагаться при высоких температурах;
содержание определяемого элемента в весовой форме должно быть как можно меньшим, так как в этом случае погрешности взвешивания менее скажутся на результатах анализа.
Обратите внимание, что количество осадителя в первую очередь будет определяться содержанием определяемого элемента в исследуемом веществе, а это в свою очередь зависит от величины навески анализируемого вещества.
Величина навески исследуемого вещества влияет на точность проведенного анализа. Чем больше величина навески, тем выше точность проведенного анализа. Однако не выгодно иметь слишком большое количество осадка, так как последний было бы трудно отмыть от примесей, возрастает время, необходимое для анализа. В то же время применение слишком малых навесок может явиться причиной значительных относительных ошибок. Например, если общая масса осадка 0,5 г, а потери его 0,0005 г, то ошибка составит 0,1%. При массе осадка в 0,05 г при тех же потерях ошибка возрастает в 10 раз и будет равна 1%.
Таким образом, при уменьшении навески возрастает относительная ошибка анализа. Практикой установлено, что величина осадка в случае кристаллических осадков должна составлять около 0,5 г, а в случае аморфных осадков – около 0,2-0,3 г. Исходя из этого, можно рассчитать оптимальную величину навески и количество осадителя. Для полноты осаждения берут полуторный избыток рассчитанного количества осадителя.
Осадки бывают аморфные и кристаллические. Обратите внимание на условия образования таких осадков: концентрация раствора, температура растворов, скорость приливания осадителя и перемешивание. Так, например, осаждение из концентрированных растворов приводит к образованию аморфных осадков, поэтому для получения крупнокристаллических осадков осаждение ведут из относительно разбавленных горячих растворов при медленном приливании осадителя и при перемешивании.
Серьезное внимание обратите на расчеты, уясните понятие о факторе пересчета (аналитическом множителе).
Расчеты в количественном анализе основаны на стехиометрии уравнений реакций. Например, в реакции
AgNO3 + NaCl= AgCl + NaNO3
соотношение между числом прореагировавших молекул нитрата серебра и хлорида натрия одинаково и не зависит от их исходных количеств. При избытке одного из веществ избыточное количество его остается без изменения. 
Пример. В результате анализа руды на содержание железа получено 0,4956 г оксида железа (ІІІ). Определить массовую долю железа в руде, если для ее анализа была взята навеска массой 1,2140 г
Решение. Расчет следует вести, исходя из реакций:
Fe3+ + 3 NH4OH = Fe(OH)3 + 3NH4+
осаждаемая
форма
t
2Fe(OH)3 = Fe2O3 + 3H2O
весовая
форма
xг 0,4956г
2Fe3+ = 2Fe(OH)3 = Fe2O3
2×55,85г 159,7г
Исходя из данного стехиометрического соотношения, определяем неизвестное – массу железа в руде:

Здесь величина 0,6994 является постоянным числом для данного анализа и называется фактором пересчета, или аналитическим множителем. Фактор пересчета показывает, сколько
граммов определяемого компонента содержит 1г полученного осадка.
Для вычисления массы определяемого компонента нужно фактор пересчета умножить на массу осадка.
Определяем массовую долю железа в руде: 

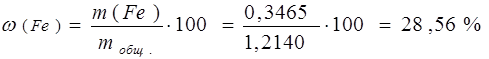

Перечень заданий контрольной работы (раздел 2)
15. В чём заключается сущность гравиметрического (весового) анализа? Перечислите основные операции, применяемые в методе осаждения.
16. Каким требованиям должны удовлетворять химические реакции, используемые в гравиметрическом анализе?
17. Что называется осаждаемой формой. Какие требования предъявляются к осаждаемой форме?
18. Что называется весовой формой? Каким требованиям должна удовлетворять весовая форма?
Какие требования предъявляются к осадкам? Какая из следующих солей кальция наиболее пригодна в качестве осаждаемой формы: СаSO4 (ПР = 2,37. 10-5), СаСО3 (ПР = 4,8. 10-9), СаС2О4 (ПР = 2,3. 10-9)?
Пригодны ли в качестве весовой формы такие соединения, как гидроксид алюминия или гидроксид меди (II)? Почему их необходимо прокалить в ходе анализа?
Осадок СаС2О4. Н2О при прокаливании превращается в безводный оксид кальция. Как это вещество относится к углекислому газу и водяным парам? Удобны ли эти свойства для анализа?
Обоснуйте условия образования кристаллических осадков (влияние концентрации растворов, температуры, скорости приливания осадителя). Какие процессы происходят при созревании осадков?
Обоснуйте условия образования амфорных осадков (влияние концентрации растворов, температуры, скорости приливания осадителя).
Какие цели преследует промывание осадка? Какими соображениями руководствуются при выборе промывной жидкости?
Вычислите аналитические множители (факторы пересчёта):
а) для определения хлора, если весовая форма AgCl;
б) для определения железа, если весовая форма Fe2O3.
Вычислите аналитические множители (факторы пересчёта):
а) для определения магния, если весовая форма Mg2P2O7;
б) для определения серы, если весовая форма ВаSO4.
Вычислите аналитические множители (факторы пересчёта):
а) для определения алюминия, если весовая форма Al2O3;
б) для определения кальция, если весовая форма СаСО3.
Какие типи промывных вод существуют? Чем необходимо промывать осадки BaSO 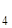 ; Fe(ОН)
; Fe(ОН) 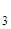 ?
?
Дата: 2019-02-02, просмотров: 964.