Определите массовую долю хлора в образце технического хлорида натрия, если при смешивании 2,0000 г его раствора с избытком раствора нитрата серебра получено 4,6880 г хлорида серебра.
44. Определите массовую долю железа в техническом магнитном железняке, если из 0,5 г его получено 0,4110 г оксида железа (III).
45. Сколько граммов осадка образуется из 0,5072 г ацетата свинца (II) при действии на него небольшого избытка серной кислоты?
46. Какой объём 1М раствора аммиака потребуется для полного осаждения ионов железа из раствора, содержащего 0,3256 г хлорида железа (III)?
Кусочек серебряной монеты массой 0,2000 г после растворения в азотной кислоте даёт с избытком хлорида натрия осадок массой 0,2393. Каково процентное содержание серебра в монете?
48. Сколько граммов Н2SO4 содержится в 1 дм3 раствора серной кислоты, если при действии на 50 см3 его раствором хлорида бария получено 0,2126 г сульфата бария?
49. Какой объём раствора нитрата серебра, содержащего 17 г соли в 1 литре, потребуется для полного осаждения ионов хлора из 1 г BaCl2.2H2O?
50. Образец сплава серебра массой 0,4000 г был растворён в азотной кислоте. Из полученного раствора всё содержащееся в нём серебро осаждено избытком соляной кислоты. Масса высушенного осадка хлорида серебра равна 0,4228 г. Определите процентное содержание серебра в сплаве.
51. При анализе 0,8105 г сплава получен осадок оксида алюминия, масса которого равна 0,5008 г. Вычислите процентное содержание алюминия в сплаве.
52. Сколько миллилитров 0,25М раствора (NH4)2C2O4 потребуется для осаждения ионов кальция из раствора, полученного при растворении 0,7 г СаСО3 в соляной кислоте?
53. Какова масса железа в образце карбоната железа FeСО3, если после его растворения, окисления, осаждения и прокаливания получено 1,0900 г оксида железа (III)?
54. Какой объём 0,5М раствора серной кислоты потребуется для полного осаждения ионов бария из 0,5234 г соли BaCl2 . 2Н2О?
55.Определите массовую долю хлора в образце технического хлорида натрия, если при смешении 2,0000 г его раствора с избытком раствора нитрата серебра получено 4,6880 г хлорида серебра.
56. Сколько граммов осадка образуется из 0,5072 г ацетата свинца (II) при действии на него небольшого избытка серной кислоты?
Раздел 3. Определение молярных масс эквивалентов сложных веществ в аналитических исследованиях
Эквивалент – реальная или условная часть атома, молекулы, иона, (например, 1/2 Zn, 1/2 Cl2, 1/6 Ca3(PO4)2, 1/3 Al3+), которая равноценна по химическому действию одному атому водорода в данной реакции, одному иону водорода (Н+) в кислотно-основной реакции, одному электрону (е) в окислительно-восстановительной реакции.
Все указанные частицы эквивалентны (равноценны), т.к. все они, как и атом водорода в реакциях могут принять или отдать только один электрон.
Эквивалент элемента Х имеет символ 1/ z Х, где z- степень окисления данного элемента в каком-то соединении (или заряд его иона).
Например, эквивалент цинка обозначается – 1/2 Zn,
эквивалент алюминия – 1/3 AI,
эквивалент сульфат-иона – 1/2 SO42- и т.п.
В системе СИ основной единицей количества вещества является моль. Моль относится к любым видам элементарных частиц, из которых построено вещество. Поскольку эквивалент является реальной или условной частицей, то единицей его количества также является моль. Для указания количества молей эквивалентов используется символ n. Например, n(1/2 Zn) = 0,1 моль, n(1/3 AI3+) =0,05 моль и т.д.
Эквивалентное количество вещества – это такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях, численно совпадает с эквивалентом.
Например, с 1 молем Н взаимодействует 0,5 молей атомов
Zn , 1/3 моля атомов Al, 0,5 молей ионов SO42- .
Молярная масса эквивалента вещества М(1/ z Х) - масса одного моля эквивалентов вещества Х, выраженная в граммах.
Для простого вещества
М(1/z Х) = Аr(X) / z [ г/моль],
где А – атомная масса элемента Х,
z – его степень окисления в каком-то соединении (или заряд для иона).
Таким образом, количество эквивалентов измеряется в молях, а молярная масса эквивалентов – в г/моль.
Так, например, масса моля эквивалентов цинка равна 32,68 г, т.е.
М(1/2 Zn) = 65,36/2 = 32,68 г/моль,
масса моля эквивалентов алюминия – 9 г, т.е.
М(1/3AI) = 27/3 = 9 г/моль и т.п.
Молярная масса сложного вещества может иметь разные значения и зависит от того, в какую реакциию вступает это вещество.
Молярная масса эквивалента кислоты М(1/ z Н z An) равна молярной массе кислоты, делённой на её основность в данной реакции, т.е. на количество атомов водорода (z), прореагировавших в данной реакции
М(1/z НzAn) = 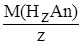
Для реакции H2SO4 + Са(ОН)2 = CaSO4 + 2H2O
М(1/zH2SO4) = 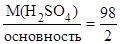 = 49 г/моль, z=2.
= 49 г/моль, z=2.
Молярная масса эквивалента основания M(1/ z Me( OH) z) равна молярной массе основания, делённой на её кислотность (z), т.е. количество групп ОН, прореагировавших в данной реакции
M(1/z Me(OH)z) = 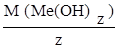 ,
,
Например, для предыдущей реакции
М(1/z  ) =
) =  =
= 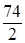 = 37 г/моль, z =2.
= 37 г/моль, z =2.
А для реакции HCl + Ca(OH)2 = Ca(OH)Cl + H2O
кислотность щёлочи-1, т.к. здесь кислоты взято недостаточно и пререагировала только одна группа ОН, по реакции также видно, что одному иону Н+ эквивалентна одна молекула Ca(OH)2, значит
М(1/z  ) =
) = 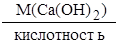 =
= 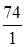 = 74 г/моль, z =1.
= 74 г/моль, z =1.
Молярная масса эквивалента соли М(1/ z Me n Anm)  равна молярной массе соли, делённой на произведение числа ионов (либо металла, либо аниона) и его заряд по модулю.
равна молярной массе соли, делённой на произведение числа ионов (либо металла, либо аниона) и его заряд по модулю.
М(1/z MenАnm) = 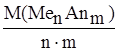 , где z = n. m
, где z = n. m
М(1/z Cr2(SO4)3) = 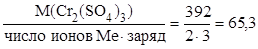 г/моль, z = 6.
г/моль, z = 6.
Молярная масса эквивалента оксида М(1/z Me n Om) равна молярной массе оксида, делённой на удвоенное число атомов кислорода в данном соединении, например:
М(1/zMenOm) = 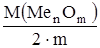 , где z = 2. m
, где z = 2. m
М(1/zСuО) = 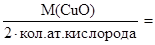
 г/моль, z =2.
г/моль, z =2.
При рассмотрении окислительно-восстановительных реакций эквивалентом называют такую часть атома, молекулы или иона, на которую в данной реакции приходится один отдаваемый или принимаемый электрон (е).
Молярная масса эквивалента окислителя (восстановителя) М(1/zХ) равна молярной массе этого окислителя Х (восстановителя), делённой на количество присоединенных (или отданных) электронов молекулой данного вещества в соответствующей окислительно-восстановительной реакции.
Пример. Рассчитать молярные массы эквивалентов окислителей и восстановителей в реакциях:
Сr2072-+14 Н++6 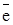 = 2Сr3++7 Н20
= 2Сr3++7 Н20
Мn04-+ 8Н+ + 5 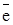 = Мn2+ + 4Н20
= Мn2+ + 4Н20
Решение.
M(1/6 К2Сr2O7) =1/6 M(K2Cr2O7) = 1/6×294,20 = 49,03 г/моль
M(1/5 КМn04 ) =1/5 M(КМn04) = 1/5×158,04 = 31,61 г/моль.
В реакции FeCI3 + 2KI = I2 + FeCI2 + KCI
Fе3+ + 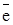 = Fе2+
= Fе2+
I - -  = I0
= I0
молярные массы эквивалента окислителя и восстановителя будут совпадать с молярными массами, т.к. в реакции окисления и восстановления принимает участие только один электрон.
Дата: 2019-02-02, просмотров: 535.