В основе этого метода лежат такие реакции:
Н+ + ОН- → Н2О; Н3О+ + ОН-→ 2Н2О
В качестве стандартного раствора обычно используют 0,1 н растворы NaOH, КОН и HCl, Н2S04.
Если стандартным раствором является щелочь, то метод называется алкалиметрией (алкали - щёлочь). С помощью метода алкалиметрии можно определить количество кислот и солей, растворы которых имеют кислую среду.
В методе ацидометрии (ацидум - кислота) стандартным раствором является кислота. Методом ацидометрии определяют количество щелочей и солей, растворы которых имеют щелочную среду.
Как первичный стандарт в методе алкалиметрии для установления титра щелочей используют титрованный раствор дигидрата щавелевой кислоты H2C2O4×2H2O, янтарной кислоты Н6С4О4. А в методе ацидометрии – раствор соды или тетрабората натрия 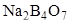 (буры).
(буры).
При использовании методов кислотно-основного титрования точка эквивалентности определяется при помощи индикаторов, которые изменяют свой цвет в зависимости от реакции среды (величины рН).
Пример 1. Для установки титра раствора серной кислоты использовали стандартный раствор буры. На титрование 20 см3 0,1 н раствора буры израсходовано 19,20 см3 раствора серной кислоты.
Определите молярную концентрацию эквивалента серной кислоты в растворе, поправочный коэффициент (К) и титр раствора серной кислоты.
Решение. Определяем молярную концентрацию эквивалента серной кислоты в растворе:
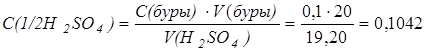 моль/дм3
моль/дм3
Находим поправочный коэффициент по отношению к 0,1н раствору:
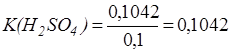
Определяем титр раствора серной кислоты:
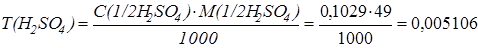 г/см3.
г/см3.
Пример 2. На титрование раствора, полученного растворением 3,1580г технического едкого калия, расходуется 27,45 см3 НСІ
(Т(HCI/NaOH) = 0,07862г/ см3). Определите массовую долю гидроксида калия в образце технического продукта.
Решение. Определим нормальную концентрацию раствора соляной кислоты, используя формулу:
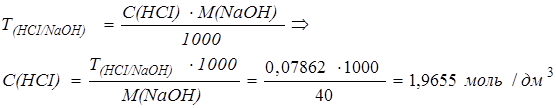
Определим титр соляной кислоты по гидроксиду калия:
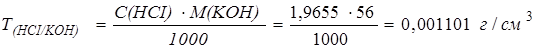
Определим массу гидроксида калия в образце:
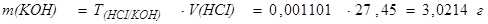
Определим массовую долю гидроксида калия в образце:
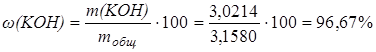
Перечень заданий контрольной работы (раздел 4.1)
85. Сколько 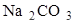 находилось в 250 см3 раствора, если на титрование 25 см3 этого раствора ушло 30 см3 0,1 н раствора НС1?
находилось в 250 см3 раствора, если на титрование 25 см3 этого раствора ушло 30 см3 0,1 н раствора НС1?
86. Сколько граммов химически чистой щавельной кислоты Н2С2О4.2Н2О требуется для приготовления 2000 см3 0,1н раствора?
87. Сколько миллилитров раствора серной кислоты с массовой долей 50% и плотностью 1,4 г/см3 нужно добавить к воде, чтобы получить 2 литра 0,25 н раствора кислоты?
88. Сколько миллилитров раствора гидроксида калия с массовой долей 40% и плотностью 1,41 г/см3 требуется для приготовления 2 литров 0,1 н раствора?
89. До какого объема нужно разбавить 50 см3 раствора серной кислоты с массовой долей 38% и плотностью 1,29 г/см3, чтобы получить 0,5 н раствор по отношению к реакции полной нейтрализации?
90. Сколько литров 5 н раствора гидроксида натрия можно приготовить из 4 литров 50%-ного раствора плотностью 1,52 г/см3?
91. Как приготовить 500 см3 0,1 н раствора соляной кислоты из 30%-ного раствора плотностью 1,15 г/см3?
92. Сколько миллилитров раствора фосфорной кислоты с массовой долей 40% и плотностью 1,25 г/см3 требуется для приготовления 2,5 дм3 0,5 н раствора по отношению к реакции полной нейтрализации?
93. В мерной колбе на 200 см3 приготовлен раствор из 1,4200 г кристаллического оксалата аммония 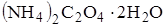 . Вычислите молярную концентрацию эквивалента раствора и его титр.
. Вычислите молярную концентрацию эквивалента раствора и его титр.
94. На титрование 0,3451г H2C2O4 израсходовано 20,00 см3 раствора NaOH. Вычислить молярную концентрацию эквивалента раствора и титр.
95. Имеется 0,1046н НCl. Определить молярную концентрацию, ТHCl , ТHCl /Ca(OH)2.
96. На титрование раствора, полученного растворением 3,1580 г технического КОН, расходуется 27,45 см3 НСl (ТНСl/NaOH = 0,07862 г/см3). Определите массовую долю гидроксида калия в образце технического продукта.
97. На титрование навески 0,1907 г тетрабората натрия 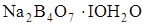 расходуется 10 см3 раствора HCl. Рассчитайте титр и молярную концентрацию эквивалента раствора.
расходуется 10 см3 раствора HCl. Рассчитайте титр и молярную концентрацию эквивалента раствора.
98. На титрование навески 0,2584 г безводной соды 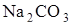 расходуется 27,3 см3 раствора серной кислоты. Рассчитайте титр и молярную концентрацию эквивалента серной кислоты в растворе.
расходуется 27,3 см3 раствора серной кислоты. Рассчитайте титр и молярную концентрацию эквивалента серной кислоты в растворе.
Дата: 2019-02-02, просмотров: 543.