Продукты комплемента СЗа и С5а, как и многие химические вещества и токсины насекомых, способны вызывать дегрануляцию тучных клеток без участия IgE. Реакции такого типа называют анафилактоидными.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ
Первоначально термин «атопия» относили только к сенной лихорадке и астме, вызываемым аллергенами животных и растений — находящимися в воздухе пыльцой, грибами, клещами и др. До сих пор точно не установлено, все ли формы бронхиальной астмы вызываются аллергией. Сходные аллергены могут вызывать также кожные реакции (крапивница) посредством прямого контакта или после абсорбции. Крапивница, появляющаяся после употребления в пищу моллюсков, клубники, коровьего молока и других продуктов, наглядно демонстрирует способность IgE прикрепляться к тучным клеткам не только в месте проникновения антигена, но практически в любой части организма. Накапливается всё больше данных о том, что мигрени и другие соматические и неврологические заболевания неясной этиологии вызываются аллергией на пищу.
73
34. ИММУННЫЕ КОМПЛЕКСЫ, КОМПЛЕМЕНТ И ЗАБОЛЕВАНИЯ
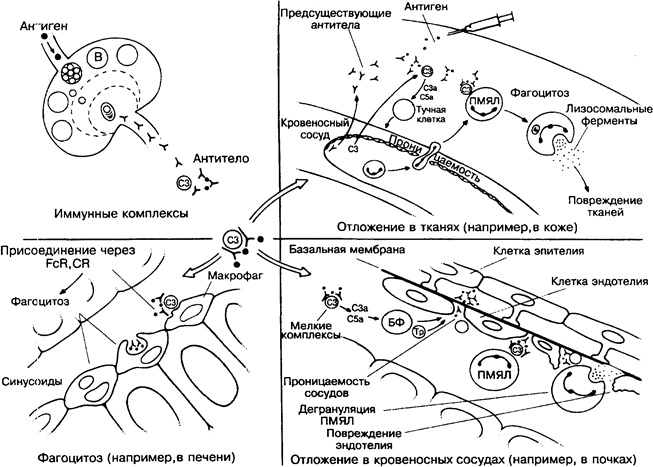
Все полезные функции антител зависят от их способности взаимодействовать с соответствующим антигеном, чтобы образовывать иммунные комплексы (ИК; рис. 19). В норме эти комплексы подвергаются фагоцитозу, который значительно усиливается, если комплемент входит в состав ИК (на рисунке внизу слева) Таким образом, образование ИК — существенный этап в удалении антигена из организма. Однако в этом процессе наблюдаются отклонения, особенно если образуются мелкие комплексы, например, при соотношении между антигеном и антителом 2:1 или 3:2. Такие комплексы формируются при избытке антигена (персистирующая инфекция, аутоиммунные заболевания), при очень низкой аффинности антител или из-за дефектов системы комплемента и фагоцитарных клеток. В зависимости от места формирования медленно фагоцитируе-
мые комплексы способны вызывать серьёзные воспалительные процессы в тканях (вверху справа) или в стенках небольших кровеносных сосудов (внизу справа). В обоих случаях имеются активация комплемента и высвобождение ферментов нейтрофилами, вызывающими повреждение. Капилляры клубочков почек особенно уязвимы для иммунных комплексов. Иммуно-комплексная патология является основной причиной хронического гломерулонефрита, ведущего к почечной недостаточности.
Повышенная проницаемость сосудов способствует как отложению на их стенках комплексов, так и проникновению комплемента и нейтрофилов в ткани. Это подчеркивает тесную связь между гиперчувствительностью I и III типов. В некоторых случаях гломерулонефрит, вызванный антителами к базальной мембране, сходен с поражениями при гиперчувствительности II типа.
74
Иммунные комплексы. Мелкие иммунные комплексы формируются при избытке антигена. Это может происходить на ранней стадии иммунного ответа, вызванного большой дозой антигена, или при продолжительном воздействии лекарствами, возбудителями хронических инфекций (стрептококки, возбудители гепатита, малярии), или в ассоциации с аутоантителами.
Макрофаги, выстилающие синусоиды печени (клетки Купфе-ра) или селезёнки, очищают кровь от частиц, в том числе и от крупных комплексов.
ПМЯЛ (полиморфно-ядерный лейкоцит) — основная фагоцитарная клетка крови. В гранулах (лизосомах) лейкоцита содержатся многочисленные бактерицидные ферменты, освобождение которых часто приводит к повреждению близлежащих клеток. Чаще всего это случается при фагоцитировании комплексов, фиксированных в тканях.
СЗ — ключевой компонент комплемента из группы сывороточных белков, участвующих в воспалении и антибактериальном иммунитете. Присоединение к комплексу С1, С4 и С2 приводит к расщеплению СЗ на малый (СЗа) и большой (СЗb) фрагменты. Фрагмент СЗа (анафилатоксин) активирует базофилы и тучные клетки, СЗb (опсонин) присоединяется к рецепторам нейтрофилов и макрофагов. При дальнейшей активации комплемента образуются хемотаксические факторы, привлекающие нейтрофилы в очаг воспаления. Под действием липополисаха-ридов и других бактериальных продуктов активация комплемента может начинаться сразу с компонента СЗ (альтернативный путь активации). Комплемент также предотвращает формирование крупных преципитатов и растворяет уже образовавшиеся (рис. 5).
Тучные клетки, базофилы и тромбоциты выделяют гиста-мин, повышающий проницаемость сосудов (рис. 33).
Базальная мембрана клубочков вместе с эндотелиальными клетками и внешними эпителиальными подоцитами отделяет кровь от мочи. Антитела, специфичные к базальной мембране клубочков (например, при аутоиммунном синдроме Гудпасчера), фиксируются на внутренней поверхности мембраны. Мелкие комплексы проникают через базальную мембрану и накапливаются на её внешней стороне. Мезангиальные клетки могут про-лиферировать в субэндотелиальном пространстве, вероятно, для удаления комплексов. Пролиферация клеток эндотелия ведёт к утолщению клубочков и снижению их функции.
БОЛЕЗНИ ИММУННЫХ КОМПЛЕКСОВ
Классические болезни иммунных комплексов — это реакция (феномен) Артюса и сывороточная болезнь. При реакции Артюса (справа вверху) внутрикожное введение антигена животному, имеющему высокий уровень антител, вызывает местный некроз тканей. Сывороточная болезнь развивается после введения чужеродной сыворотки, например, лошадиной антисыворотки. Образующиеся на ранней стадии иммунного ответа малые иммунные комплексы откладываются на стенках кровеносных сосудов, примерно через неделю вызывают лихорадку, кожные высыпания, суставные боли. В настоящее время классические реакции встречаются редко. Некоторые заболевания представляют данный тип патологических реакций.
Системная красная волчанка — заболевание неясной этиологии (возможно, вирусной). Аутоантитела к ДНК и РНК совместно с комплементом откладываются в почках, коже, суставах, мозге и других органах. Лечение — иммуносупрессивные препараты или (в тяжёлых случаях) обменное переливание плазмы с целью удаления аутоантител.
Узелковый полиартериит — поражение мелких артерий многих органов. Некоторые случаи могут быть обусловлены комплексами антигена гепатита В, антител и комплемента.
Ревматоидный артрит характеризуется как местным (по типу реакции Артюса) повреждением суставных поверхностей, так и системным васкулитом. Причина заболевания неизвестна, но обнаруживаются аутоантитела к IgG (ревматоидный фактор).
Альвеолиты, обусловленные Aclinomyces и другими грибами (рис. 28). Могут быть следствием реакции Артюса в лёгких.
Тиреоидиты и, возможно, другие аутоиммунные заболевания вызываются повреждением органа иммунными комплексами (ауто-антигены + аутоантитела). С развитием методов регистрации иммунных комплексов (сейчас их более 20; рис. 19) список подобных аутоиммунных заболеваний, очевидно, пополнится.
Инфекционные заболевания. Реакции гиперчувствительности III типа могут быть причиной кожных высыпаний и нарушения функции почек при некоторых инфекциях. Кроме того, септический шок, вызванный липополисахаридами грамотрицательных бактерий, и геморрагический шок вирусной природы (например, вирус Денге) могут привести к массивной активации комплемента. Важную роль в этих процессах играет фактор некроза опухоли. Комплемент, нейтрофилы и цитокины вовлекаются в развитие сосудистой недостаточности в лёгких при дыхательном дистресс-синдроме взрослых после тяжёлой травмы.
75
35. ХРОНИЧЕСКОЕ И КЛЕТОЧНО ОПОСРЕДОВАННОЕ ВОСПАЛЕНИЕ
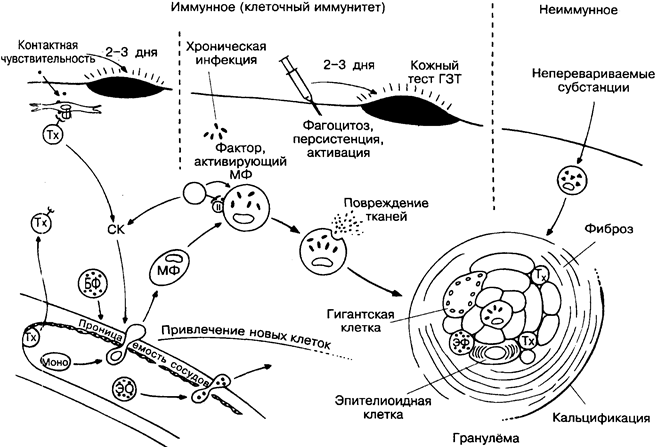
После начальной стадии воспалительного процесса, характеризующейся изменениями проницаемости сосудов, активацией комплемента и притоком гранулоцитов, в очаг поражения мигрируют мононуклеарные клетки — лимфоциты и моноциты (на рисунке внизу слева). Лимфоциты реагируют специфически, и их деструктивные возможности ограничены. Однако моноциты и макрофаги с большим набором ферментных систем, необходимых для удаления погибших клеток, в том числе гранулоцитов, могут вызвать повреждение здоровых клеток, включая другие макрофаги. При продолжительной стимуляции плотно сгруппировавшиеся макрофаги образуют гранулёмы — характерный признак хронического воспаления (внизу справа). Эти изменения могут происходить без специфического иммунного ответа (например, на чужеродные частицы; вверху справа), но усиливаются активированными специфическими Т-лимфоцита-ми, которые, секретируя цитокины, привлекают моноциты и сти
мулируют их вместе с макрофагами. Если эти процессы приводят к благоприятному исходу (например, закрытая форма туберкулёза), принято говорить о клеточном иммунитете. Если исход неблагоприятный (контактная гиперчувствительность, шистосомный цирроз и др.), то речь идёт о гиперчувствительности IV типа (рис. 20). Прямой киллинг цитотоксическими Т-клетками также обозначается как клеточный иммунитет, но их действие направлено главным образом против «своих» клеток, содержащих вирусы. Возможно, в этих случаях подошёл бы термин «клеточно опосредованный аутоиммунитет» или (в ситуации с трансплантацией органов) «клеточно опосредованное отторжение трансплантата». Как бы то ни было, все иммунные механизмы взаимосвязаны общими биохимическими путями, межклеточными взаимодействиями и др., и трудно найти пример, чтобы какой-либо тип повреждения тканей происходил изолированно.
76
КЛЕТОЧНЫЙ ИММУНИТЕТ
Рециркулирующие Т-лимфоциты, контактируя с антигеном, выделяют цитокины, которые вызывают хемотаксис и активацию моноцитов и других миелоидных клеток (рис. 20). Хроническое воспаление наиболее вероятно при персистирующих внутриклеточных инфекциях,таких как туберкулёз, лепра, бруцеллёз, лейшманиоз, шистосомоз (инкапсуляция яиц), трихинеллёз, гистоплазмоз.
Дата: 2018-12-28, просмотров: 380.