Симпатические нервы (Симп.), выделяя норадреналин (эпи-нефрин), возбуждают функции, необходимые для немедленных действий: минутный сердечный выброс, дыхание, сознание, уровень сахара в крови, потоотделение и т.д.
Парасимпатические нервы (на рисунке — Парасимп.), многие из которых проходят в составе Х-пары черепно-мозговых нервов (блуждающий нерв), выделяют ацетилхолин и управляют более спокойными действиями, такими, как пищеварение и ближнее зрение. Деятельность большинства внутренних органов регулируется симпатическими и парасимпатическими нервами. Обширная симпатическая активация (включая мозговое вещество надпочечников; см. ниже), вызванная страхом, яростью и другими причинами, становясь хронической, переходит в стресс.
ЭНДОКРИННАЯ СИСТЕМА
Мозговое вещество надпочечников в ответ на стимуляцию симпатическими нервами освобождает адреналин, действующий подобно норадреналину, но более длительно.
Кора надпочечников в ответ на стимуляцию кортикотропи-ном (АКТГ) из передней доли гипофиза начинает выделять альдостероа, гидрокортизон (кортизол) и другие гормоны, регулирующие водно-солевой баланс, а также белковый и углеводный обмен. Кроме того, гидрокортизон и его синтетические производные оказывают мощное противовоспалительное действие.
Щитовидная железа, стимулированная тиреотропином (ТСГ) из передней доли гипофиза, освобождает йодсодержащие тире-оидные гормоны ТЗ и Т4 (тироксин), которые регулируют многие процессы клеточного метаболизма.
Гормон роста (ГР) регулирует рост костей и мягких тканей.
Половые железы. Фолликулостимулирующий гормон (ФСГ) и лютеинизирующий гормон (ЛГ), выделяемые передней долей гипофиза, регулируют развитие яичек и яичников, половозре-лость и секрецию половых гормонов.
Задняя доля гипофиза. Главным продуктом её деятельности является антидиуретический гормон (АДГ), который регулирует всасывание жидкости почками в зависимости от сигнала осморецепторов гипоталамуса.
Поджелудочная и паращитовидная железы функционируют более или менее автономно, регулируя соответственно уровни глюкозы и кальция. Поджелудочная железа отвечает также на сигналы вегетативной нервной системы.
ИММУННАЯ СИСТЕМА
Все представленные на рисунке элементы иммунной системы подробно рассмотрены в других разделах. Здесь выделены только особенности, связанные с нервной и эндокринной системами.
Цитокины. Наиболее наглядно связь между иммунной и нервной системами иллюстрируется тем, что ФНО, ИЛ-1, ИФ вызывают лихорадку. Большие дозы многих цитокинов также вызывают сонливость и общее недомогание. Цитокины, особенно ИЛ-2 и ИЛ-6, обнаружены в мозге. ФНО и ИЛ-1 индуцируют секрецию АКТГ гипофизом, возможно, через гипоталамус.
Лимфоидные органы. Нейроны, заканчивающиеся в тимусе и лимфатических узлах, прослеживаются по симпатическим нервам до спинного мозга.
Лимфоциты. Установлено, что лимфоциты несут рецепторы к эндорфинам, энкефалинам, веществу Р, а также сами секретируют эндорфины и гормоны, например АКТГ.
Иммунный ответ ингибируется гидрокортизоном и гормонами половых желез и при стрессовых, особенно неизбежных, ситуациях (экзамены, тяжёлые переживания и т.д.). Известно, что гипноз снижает немедленные и замедленные реакции кожной гиперчувствительности. Действительно ли эти случаи объясняются действием кортикостероидов, пока остаётся спорным.
Аутоиммунитет. Очень многие аутоиммунные заболевания (см. рис. 36) поражают эндокринные органы. Особенно сильно поражается щитовидная железа, в которой аутоантитела могут как мимикрировать, так и блокировать стимулирующее действие ТСГ.
55
25. АНТИМИКРОБНЫЙ ИММУНИТЕТ. ОБЩАЯ СХЕМА
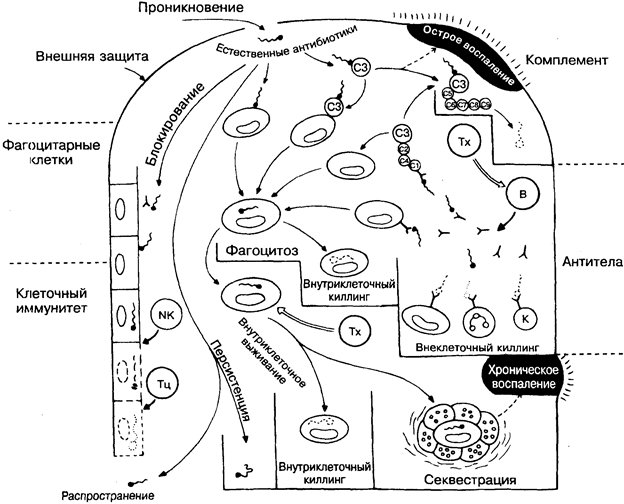
Следует подчеркнуть, что иммунная система высокоэффективна в распознавании чужеродных субстанций, но совершенно беспомощна в определении степени опасности, которую они могут представлять для организма. Кроме того, могут быть нежелательные побочные эффекты, например сильный иммунный ответ против чужеродной, но непатогенной структуры, такой, как пыльца злаковых и др. (рис 33).
Предполагаемые патогенные микроорганизмы, которые преодолевают кожные или слизистые барьеры, встречаются с 4 главными распознающими системами: комплементом (на рисунке вверху справа), фагоцитарными клетками (слева), антителами (справа) и клеточным иммунитетом (слева внизу) и вместе с их часто взаимодействующими эффекторными механизмами. Если отсутствует предварительный контакт с соответствующим антигеном, то антительный и клеточный иммун-
ный ответ начинает действовать через несколько дней после проникновения микроорганизма, тогда как фагоцитарные клетки и комплемент, постоянно присутствующие в организме, — уже через несколько минут. Существуют специализированные естественные факторы (вверху в центре), такие, как лизоцим, интерферон и др., которые действуют более или менее неспецифично и почти как антибиотики (естественные антибиотики).
В общем, комплемент и антитела наиболее активны против микроорганизмов, свободно находящихся в крови или тканях, а клеточный иммунный ответ имеет дело с микроорганизмами, проникшими в клетки. Какой из механизмов окажется эффективным, во многом зависит от поведения микроорганизма. В следующих 5 разделах речь пойдёт о микроорганизмах, которые уклоняются от иммунных механизмов, подавляют их или становятся устойчивыми к ним.
56
Проникновение. Значительная часть микроорганизмов проникает в организм через раны, укусы. Микроорганизмы, обычно обитающие на коже или слизистых оболочках кишечника, дыхательного тракта и других тканях, по сути дела находятся вне организма.
Поверхностные барьеры. Кожа и слизистые оболочки защищены кислой рН, ферментами, слизью и другими антимикробными секретами, а также антителами класса IgA (см. ниже).
Естественные антибиотики. Выделяемые главным образом макрофагами антибактериальный фермент лизоцин (рис. 27) и противовирусные интерфероны (рис. 23, 26) составляют важное звено естественного иммунитета. Без них инфекционных заболеваний было бы значительно больше. Очевидно, что многие другие естественные антибиотики ждут своего открытия. Этот тип защиты явно ограничен в масштабах во избежание повреждений «своих» тканей.
СЗ. Многие микроорганизмы непосредственно активируют СЗ-компонент комплемента по альтернативному пути, что в итоге приводит к их лизису или захвату фагоцитами. Тот же эффект наблюдается при активации СЗ антителами по классическому пути (рис. 5).
Т-хелперы обычно отвечают на несущую детерминанту антигена и стимулируют В-лимфоциты к синтезу антител. Установлено, что бактерии, вирусы, простейшие и гельминты выполняют функцию сильных носителей, хотя существует небольшое количество микроорганизмов, антительный ответ на которые является Т-независимым.
В-клетки. Образование антител В-лимфоцитами является почти универсальной характеристикой инфекции. Они имеют огромное диагностическое значение. Как правило, в иммунном ответе первыми появляются антитела класса IgM, затем — IgG и остальные. Высокий уровень IgM в сыворотке почти всегда указывает на начальную стадию заболевания. В слизистых оболочках наиболее эффективны антитела IgA (рис. 16).
Блокирование. Антитела могут не допустить проникновения микроорганизмов или токсинов в клетку, блокируя их участки, ответственные за связывание с клеткой, как это происходит, например, со столбнячной палочкой и большинством вирусов. IgA действует главным образом по этому механизму в кишечнике.
Фагоцитоз. Значительная часть микроорганизмов фагоцитиру-ется макрофагами или полиморфно-ядерными лейкоцитами. Процесс значительно ускоряется, если микроб, предварительно опсо-низированный СЗ или антителом, присоединяется к фагоцитарной клетке соответственно через СЗ- или Fc-рецепторы (рис. 8).
Внутриклеточное разрушение захваченных фагоцитами микроорганизмов осуществляется лизосомальными ферментами. В определённых случаях активация макрофагов Т-клетками не
обходима для запуска процесса киллинга микроорганизмов (рис. 20).
Внеклеточное разрушение. Моноциты, нейтрофилы и другие киллерные (К) клетки убивают покрытые антителами клетки in vitro без фагоцитоза, но неясно, насколько эта активность развита in vivo.
NK — естественные киллеры. Эти клетки способны быстро убивать многие инфицированные вирусом клетки, но без специфичности, характерной для Т-лимфоцитов.
Внутриклеточная выживаемость. Некоторые вирусы, бактерии и простейшие могут выживать внутри макрофагов, где они устойчивы к киллерным механизмам. Другие микроорганизмы выживают в клетках мышц, печени, мозга и других органов, где они недоступны для антител и могут быть уничтожены только в результате клеточного иммунного ответа.
Тц — цитотоксический Т-лимфоцит. Вызывает лизис «своих» клеток, изменённых вирусом и другими антигенами, а также ал-логенных, например трансплантированных, клеток (рис. 20).
Тх — Т-хелпер замедленной гиперчувствительности, который через секретируемые цитокины привлекает и активирует моноциты, эозинофилы и другие клетки (рис. 20, 23). Центральная роль Т-хелперов при большинстве инфекций подтверждается тяжёлыми последствиями повреждения их, например, при СПИДе (рис. 40).
Секвестрация. Микроорганизмы, которые не могут быть убиты, например, некоторые микобактерии и недеградируемые вещества, в том числе оболочки стрептококков, участвуют в образовании гранулём макрофагами, часто при помощи реакций кле-точно опосредованного иммунного ответа (рис. 20).
Распространение. Выжившие микроорганизмы должны покинуть один организм и инфицировать другой, что происходит чаще всего при кашле, чихании, укусах насекомых, через фекалии и т.д.
Персистенция. Некоторые микроорганизмы выработали защитные механизмы, позволяющие избегать разрушающего действия иммунных факторов. Они способны длительно находиться в организме носителя, вызывая хронические и трудноизлечимые инфекционные заболевания.
Воспаление. Некоторые микроорганизмы (например, цитопа-тические вирусы), а также токсины способны разрушать ткани, но это несравнимо с теми повреждениями, которые наносит себе сам организм хозяина в ходе иммунного ответа на инфекцию. Острые и хронические воспаления подробно рассмотрены в других главах (рис. 6, 35). Здесь важно то, что инфекция ставит иммунную систему хозяина перед выбором: уничтожить микроорганизм любой ценой или, позволив ему жить, сберечь свои ткани. Решение этой дилеммы остается за естественным отбором.
57
26. ПРОТИВОВИРУСНЫЙ ИММУНИТЕТ
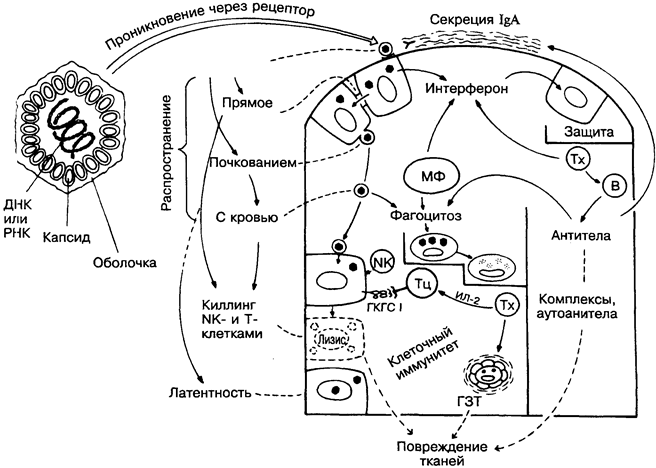
Отличительные черты вирусов — отсутствие оболочки (у части вирусов), очень малые размеры (рис. 42) и неспособность к независимому метаболизму, т.е. к репликации вне клеток хозяина. Таким образам, основа вирусной инфекции — это внутриклеточное размножение вируса со всеми, вплоть до гибели инфицированных клеток, последствиями. На рисунке вирус изображён в виде шестиугольника; в природе форма и размеры вирусов крайне разнообразны.
При вирусных инфекциях интерферон, а при бактериальных лизоцим выполняют функции естественных антибиотиков (вверху справа). Проникновение некоторых вирусов и их распространение с кровью блокируются антителами (справа). Другие вирусы, распространяющиеся из клетки в клетку (слева), уничтожа-ются цитотоксическими Т-лимфоцитами, которые распознают изменённые «свои» молекулы ГКГС класса I, или NK-клетками, действующими быстрее, чем Т-киллеры, и эффективнее, когда на инфицированных клетках-мишенях мало или отсутствуют моле
кулы ГКГС класса I. Макрофага выполняют ряд противовирусных функций, продуцируя интерферон и осуществляя фагоцитоз. На изменённое «своё» реагируют не только Т-, но и В-лимфоциты, часто продуцируя аутоантитела (см. Аутоиммунитет, рис. 36).
Обычно инфекция сопровождается повреждением тканей, вызванным как самим вирусом, так и иммунным ответом на него. Вирусы жизнеспособны только в организме хозяина и обычно быстро адаптируются, снижая свою вирулентность. Но вирусы, которые хорошо адаптированы в организме животного, могут быть высоковирулентными для человека, как это случается при зоонозах (например, при инфицировании человека вирусом бешенства от собак или вирусом Марбурга от обезьян).
Переходную ступень между бактериями и вирусами представляют облигатные внутриклеточные организмы, имеющие клеточную оболочку ( Rickettsia, Trachoma) или без неё, но способные к внеклеточной репликации ( Mycoplasma). С точки зрения иммунологии, первые ближе к вирусам, вторые — к бактериям.
58
Рецепторы. Вирусы проникают в клетку после соединения со специфическим рецептором на её поверхности. На сегодня известно лишь несколько таких рецепторов, например, CR2-pe-цептор комплемента для вируса Эпстайна-Барр, ацетилхоли-новый рецептор нейронов для вируса бешенства, СD4-молеку-ла на Т-клетках для вируса иммунодефицита человека.
Интерфероны — группа белков (рис. 23), продуцируемых в ответ на вирусную инфекцию, а также под влиянием липополи-сахарида и др. Продуцируются макрофагами (ИФ-альфа), фибробластами (ИФ-бетта) и Т-клетками (ИФ-гамма). Интерфероны стимулируют клетки к выделению белков, блокирующих транскрипцию информационной РНК вируса. Интерфероны влияют на деление нормальных клеток. Полученные методами генной инженерии интерфезоны могут оказаться полезными противовирусными и, возможно, противоопухолевыми лечебными средствами.
Клеточный иммунный ответ, Т-киллер, NK. Как показано в разделах 13,17, 20, цитотоксические Т-лимфоциты обучены распознавать молекулы ГКГС класса I и реагировать на сочетание вирусного антигена и молекулы ГКГС класса I. Поскольку практически любой тип клеток может быть инфицирован вирусом, молекулу класса I, в отличие от молекул класса II, экспрессиро-ваны на большинстве клеток. Интересно, что роль ГКГС в клеточном иммунном ответе обнаружена при изучении именно противовирусного иммунитета у мышей. Роль ГЗТ при вирусной инфекции противоречива. Теоретически активированные макрофаги могут разрушать инфицированные вирусом клетки и вызывать повреждение тканей, но на практике трудно разделить активности Т-клеток-киллеров и Т-клеток-хелперов даже при использовании клонируемых Т-клеток. NK-клетки могут разрушать некоторые инфицированные клетки, но без ограничения по ГКГС.
ВИРУСЫ
Общепринятая классификация вирусов ещё не разработана. Их различают по размерам, форме, природе генома (ДНК или РНК), способу распространения (почкованием, при цитолизе клеток хозяина, непосредственно; см. рисунок). Крайне важный показатель — уничтожается вирус в результате иммунного ответа или уклоняется от него. Ниже даны характеристики некоторых наиболее распространённых вирусов.
Вирусы оспы (натуральная оспа, коровья оспа). Большой ДНК-вирус; распространяется с лейкоцитами крови или локально, недоступен для антител, экспрессирует антигены на поверхности инфицированных клеток, стимулирует клеточный иммунный ответ. Тяжёлый Т-клеточный иммунодефицит (рис. 39) часто характеризуется как прогрессирующее неизлечимое заболевание при полной неспособности контролировать вирус осповакцины. Перекрёстное антигенное реагирование легло в основу применения вируса коровьей оспы для защиты людей от натуральной оспы (метод, тысячелетиями известный в странах Востока, а в Европе в 1796 г. его впервые применил Э.Дженнер). Благодаря вакцинации натуральная оспа стала первым инфекционным заболеванием, полностью исчезнувшим с лица земли.
Вирусы герпеса (простого герпеса, ветряной оспы, Эпстайна-Барр, цитомегалии). Средние ДНК-вирусы, способны перси-стировать и при реактивации вызывать различные симптомы. Вирус ветряной оспы вызывает опоясывающий лишай; вирус Эпстайна-Барр (вирус инфекционного мононуклеоза) может вызвать опухоль (лимфома Беркитта; рис. 31). Вирус цитомегалии становится наиболее важным возбудителем оппортунис-тической инфекции при иммуносупрессии. Аденовярусы (инфекции глаз и горла). Средние ДНК-вирусы. Многочисленные антигенно различающиеся типы делают иммунитет неэффективным, а вакцинацию проблематичной.
Миксовирусы (вирусы гриппа, эпидемического паротита, кори). Большие РНК-вирусы, распространяются почкованием. Вирус гриппа — классический пример присоединения специфическим рецептором (гемагглютинин) и антигенного разнообразия. Адаптивный иммунитет к гриппу относительно неэффективен. Вирус эпидемического паротита поражает яички и может вызвать аутоиммунные повреждения. Вирус кори, инфицируя лимфоциты, неспецифически подавляет клеточный иммунный ответ. Способен персистировать и вызывать подострый склерози-рующий панэнцефалит. Некоторые исследователи полагают, что рассеянный склероз тоже может быть заболеванием такого типа.
Вирус краснухи («германская корь»). Средний РНК-вирус. Главную опасность представляет способность вируса поражать плод в первые 4 мес беременности. Ослабленные вакцины дают выраженный иммунитет.
Вирус бешенства. Большой РНК-вирус. Распространяясь по периферическим нервам, поражает ЦНС. Обычно инфекция передаётся вследствие укуса собаки. Для сохранения жизни требуется немедленная пассивная иммунизация.
Арбовирусы (вирус жёлтой лихорадки). Небольшие ДНК-вирусы, переносятся членистоногими. Попадая в печень, вызывают желтуху. Выраженный иммунитет и защита в ответ на вакцинацию.
Энтеровирусы (вирус полиомиелита). Небольшие РНК-вирусы. Иммунная система способна различать их только на стадии проникновения (через кишечник) и после лизиса клеток. Чувствительны к антителам, включая IgA, но не к клеточному иммунному ответу.
Риновирусы (вирусы обычной простуды). Небольшие РНК-вирусы. Как и в случае с аденовирусами, иммунитет неэффективен из-за слишком большого количества серотипов.
Вирусы гепатита. По крайней мере 3 типа вирусов могут вызвать гепатит: А (инфекционный гепатит; РНК-вирус), В (сывороточный гепатит; ДНК-вирус) и С (ранее известный как ни А ни В; РНК-вирус). При гепатите В в сыворотке обнаруживаются аутоантитела и иммунные комплексы. Возможно вирусоно-сительство, особенно в тропических странах, где имеется связь с циррозом и раком печени. Длительное применение ИФ-альфа значительно улучшает состояние носителей.
Аренавирусы (вирус лихорадки Ласса). Средний РНК-вирус. Лихорадка Ласса — болезнь крыс, часто фатальная у человека. Относится к зоонозам. Отчасти сходное заболевание — болезнь Марбурга у обезьян.
Ретровирусы (опухоли). РНК-вирусы, содержат обратную транскриптазу, позволяющую встраиваться в ДНК клетки, инфицированной вирусом. К ретровирусам относятся вирусы лейкоза Т-лимфоцитов человека (HTLV) и вирус иммунодефицита человека, вызывающего СПИД, который проникает в клетки через CD4-молекулу и поражает главным образом Т-хелперы (рис. 40).
Трахома. Вызывает болезнь из группы пситтакозов (инфекционное заболевание птиц, особенно попугаев). Возбудитель — Chlamidia. Чрезмерный клеточный иммунный ответ оставляет рубцы на конъюнктиве.
Риккетсии — возбудители тифа и других заболеваний, способны выживать в макрофагах, как и туберкулёзные палочки.
Куру — крайний вариант медленного вируса. Передаётся только при каннибализме и вызывает прогрессирующее поражение мозга. Как выяснилось, это происходит из-за очень мелких молекул (прионов), которые нарушают процесс полимеризации молекул хозяина.
59
27. ИММУНИТЕТ К БАКТЕРИЯМ
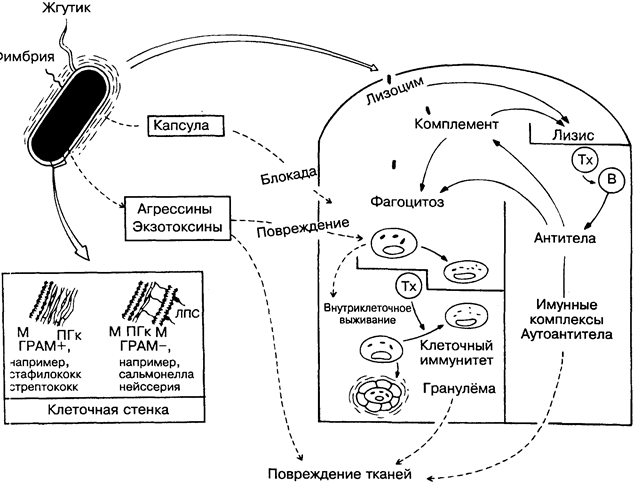
В отличие от вирусов, бактерии — клеточные организмы, вполне способные к независимому метаболизму. Тем не менее многие из них предпочитают временно или постоянно паразитировать В экономически развивающихся странах подавляющее боль-шин:тво инфекционных заболеваний вызывается бактериями и вирусами.
Большая часть бактерий уничтожается в организме в результате фагоцитоза. Основные защитные механизмы бактерий (на рисунке слева внизу), помогающие им выжить, связаны с капсулой (предупреждение прилипания), клеточной стенкой или оболочкой (предупреждение переваривания) и освобождением экзотоксинов (повреждение фагоцитов и других клеток). К счастью, большинство капсул и токсинов высокоантигенны, и антитела преодолевают многие их эффекты, что положено в основу большинства антибактериальных вакцин. На рисунке процессы, благоприятные для бактерий и опасные для хозяина, показаны пунктирными линиями.
Бактерии, в отличие от более высокоорганизованных организмов (от грибов до человека), являются прокариотами, поэто
му их молекулы чужеродны для человека в большей степени, чем молекулы эукариотов (грибы, простейшие, гельминты). Возможно, поэтому иммунной системе человека проще специфически реагировать на бактерии, чем на более развитые ядросо-держащие паразиты. Пожалуй, самое совершенное вещество, действующее на бактерии и безвредное для клеток хозяина, — естественный антибиотик лизоцим (по крайней мере, он был им до наступления эры антибиотиков, которые, как и лизоцим, открыл А. Флеминг).
Как и в случае с вирусами, наиболее вирулентные и устойчивые бактериальные инфекции имеют зоонозную природу, например чума (крысы) и бруцеллёз (крупный рогатый скот). Клеточный иммунный ответ на бактерии, способные выживать в макрофагах, например на туберкулёзные палочки, обычно приводит к серьёзным повреждениям тканей (рис. 35). Не случайно кожная реакция замедленной гиперчувствительности, характеризующая Т-клеточный иммунитет, долгое время называлась бактериальной аллергией.
60
Клеточная стенка (оболочка). На поверхности плазмати-ческой мембраны (на рисунке — М) бактерии имеют оболочку (клеточная стенка) из мукопептида пептидогликана (ПГк). Ли-зоцим, действуя на стенку бактерии, прерывает связи N-ацетил-мурамовой кислоты с N-ацетилглюкозамином. Кроме этого, гра-мотрицательные бактерии имеют вторую мембрану с липопо-лисах:)ридами (ЛПС, называемый также эндотоксином).
Жгутики — главное средство передвижения бактерии. Содержат высокоантигенные белки (например, Н-антигены возбудителей брюшного тифа), активно стимулирующие синтез антител.
Фимбрии используются бактериями для прикрепления к клеткам. Присоединение может быть блокировано антителами (например IgA против гонококков).
Капсула. Многие бактерии вирулентны именно из-за капсул, которые защищают их от контакта с фагоцитами. Большинство капсул состоит из больших разветвлённых полисахарид-ных молекул, но некоторые — из белков. Интересно, что многие полисахариды капсулы и некоторые белки жгутиков являются Т-независимыми антигенами (рис. 17). Поскольку считается, что Т-независимые антитела были первыми антителами, появившимися в процессе эволюции (рис. 3), это ещё раз подтверждает, что бактерии были главным стимулом для развития антите-лообразующей системы. Примеры инкапсулированных бактерий — пневмококки, менингококки, гемофильные бактерии.
Экзотоксины отличаются от эндотоксинов (ЛПС), находящихся в клеточных стенках. Грамположительные (ГРАМ+) бактерии часто секретируют белки с деструктивными свойствами против фагоцитов, локальных тканей, ЦНС и т.д. Часто экзотоксины становятся причиной летального исхода инфекции. Кроме того, существуют белки, известные как агрессины. Разрушая ткани хозяина, они способствуют распространению бактерий.
БАКТЕРИИ
На рисунке бактерии приведены не в соответствии с классификацией, а в связи с их распространённостью. Некоторые виды бактерий приведены ниже.
Стрептококки обычно классифицируются либо по гемолита-ческиу экзотоксинам (альфа, бетта, гамма), либо по антигенам клеточных стенок (группы A-Q). Наиболее патогенны бетта-гемолитические стрептококки группы А. Они несут капсулы (М-белок) для прикрепления к слизистым мембранам, устойчивы к фагоцитозу, выделяют многочисленные экзотоксины (например, вызывающие симптоматику скарлатины), неперевариваемость оболочки вызывает сильный клеточный иммунный ответ, имеют антигены, перекрёстно реагирующие с сердечной мышцей (ревматическая лихорадка). Иммунные комплексы, включающие их, участвуют в поражении почек.
Стафилококки — крайне разрушительные микроорганизмы, вызывающие абсцессы. Секретируют множество токсинов, в том числе антифагоцитарные факторы, включая фермент коагулазу и белок А, который блокирует опсонизацию, присоединяясь к Fc-фрагменту IgG.
Пневмококки, менингококки классифицируются по антигенной структуре капсулы. Особенно вирулентны в тропических странах. Применение вакцин из полисахаридов капсулы оказывается высокоэффективным в предотвращении эпидемий. Этим инфекциям особенно подвержены больные с дефицитом антителообразования (рис. 39).
Гонококки. Присоединение гонококков к слизистым оболочкам может блокироваться антителами класса IgA. В свою очередь гонококки выделяют протеазы, разрушающие IgA. Инфекция редко излечивается полностью и чаще приводит к бак-терионосительству. Кроме того, гонококки — единственные бактерии, в отношении которых установлено литическое действие комплемента.
Микобактерии туберкулёза и лепры имеют высокоустойчивые клеточные стенки, богатые липидами, успешно противостоящие действию лизосомальных ферментов и препятствующие слиянию фагосомы и лизосомы в фагоцитах. Клеточный иммунный ответ, переходя в хроническую стадию, вызывает многочисленные повреждения тканей и рубцевание. При лепре локализация или распространение возбудителей зависит от преобладания соответственно клеточной и антительной форм иммунного ответа.
Шигеллы и возбудители холеры обитают только в кишечнике. Патогенное действие обусловлено выделением экзотоксинов. Антитоксические вакцины создают иммунитет гораздо менее эффективно, чем естественная инфекция. Ведутся работы по созданию ослабленных штаммов методами генной инженерии (рис. 41).
Сальмонеллы (например. Salmonella typhi) инфицируют кишечник. Способны выживать и развиваться в макрофагах.
Столбнячная палочка выделяет экзотоксины, быстро поражающие ЦНС. Антитела (антитоксины) высокоэффективно блокируют действие токсинов. Пример того, что т требуется участия макрофагов и комплемента.
Дифтерийная палочка также выделяет мощные нейроток-сины, но смерть при инфекции может произойти в результате локального повреждения тканей гортани.
Бледная трепонема (возбудитель сифилиса) — бактерия, которая выдерживает все формы иммунной атаки, не укрываясь в клетках хозяина. В реакции Вассермана используются аутоан-титела к митохондриальному кардиолипину. Очевидно, перекрёстные реакции такого рода происходят вследствие мимикрии бактерий под антигены хозяина, которые таким образом избегают реакций со стороны иммунной системы. Продуцируемые аутоантитела способны вызвать повреждение тканей хозяина (рис. 36).
Боррелии — другой вариант спирохет; обладают свойством, выявленным у некоторых вирусов и простейших, варьировать своими поверхностными антигенами, что сильно затрудняет антительный иммунный ответ. В результате инфекционное заболевание характеризуется периодическими приступами (возвратная лихорадка).
61
28. ИММУНИТЕТ К ГРИБАМ
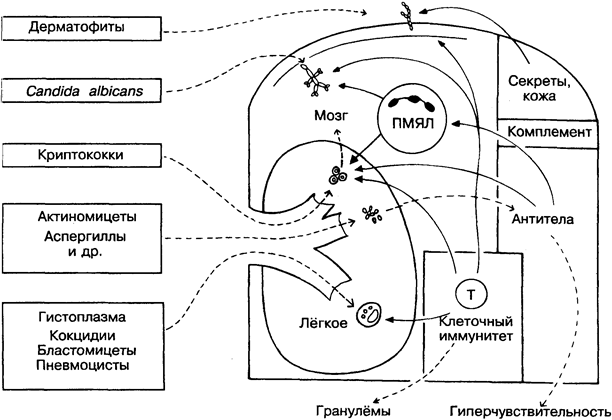
Подавляющее большинство грибов — свободноживущие организмы, и лишь немногие из них способны вызывать заболевания животных и человека. Чаще всего для этого необходим длительный контакт (например, у сельскохозяйственных рабочих) или ослабленная иммунная система (например, при СПИДе).
В основном грибковые инфекции довольно безобидны (например, парша). Однако некоторые грибы, обычно в виде спор проникающие через лёгкие (на рисунке в центре), могут вызы-вать серьёзные системные заболевания. В зависимости от степени и типа иммунного ответа развивается интенсивная реакция гиперчувствительности и происходит быстрое фатальное распространение гриба по всему организму хозяина или заболевание ограничивается поражением лёгких.
Защитные механизмы грибов мало отличаются от таковых у бактерий и включают капсулу, предохраняющую грибы от фагоцитоза (например, у криптококков), резистентость к перева
риванию в макрофагах (например, у гистоплазм) и способность к разрушению ПМЯЛ (например, у кокцидий). Некоторые дрожжевые клетки активируют комплемент по альтернативному пути, но неизвестно, как это сказывается на их выживаемости.
С точки зрения иммунологии, из грибов наиболее интересен Candida albicans (на рисунке вверху слева) — безобидный и частый обитатель кожи и слизистых оболочек, который быстро реагирует на ослабление иммунной системы. Для его проникновения достаточно, чтобы организм был просто переутомлён, не говоря уже о дефектах ПМЯЛ и Т-клеток, старости, недоедании, иммуносупрессии, алкоголизме, диабете, недостатке железа и прочих причинах ослабления иммунитета (рис 39). Микроорганизмы, успешная жизнедеятельность которых возможна только при иммунодефиците у хозяина, называются оппортунистическими. К ним относятся не только грибы, но и некоторые вирусы (вирус цитомегалии), бактерии (синегнойная палочка), простейшие (токсоплазма), черви (нематоды).
62
ПМЯЛ — полиморфно-ядерный лейкоцит (нейтрофил). Одна из важнейших фагоцитарных клеток. Любые нарушения в функции или количестве ПМЯЛ, вызванные генетическими причинами или индуцируемые лекарствами (стероидами, антибиотиками), создают основу для рецидивирующих грибковых и бактериальных инфекций. К функциональным дефектам относятся нарушения хемотаксиса (синдром «ленивых лейкоцитов»), неспособность к формированию нормальных фаголизосом (синдром Чедиака-Хигаси), нарушение продукции метаболитов кислорода (хронический гранулёматоз), дефицит миелопироксида-зы и других ферментов. Фагоцитарная активность нейтрофилов ослабляется также в результате дефицита комплемента или антител (рис. 39).
Т-клетка. Иммунодефицит по Т-лимфоцитам часто сопровождается грибковыми заболеваниями кожи, слизистых оболочек ( Candida) и лёгких ( Pneumocystis). Т-лимфоциты играют важную роль в защите от грибов, но механизмы их действия ещё не установлены. Известно, что некоторые грибы уничтожаются NK-клетками (см. ниже).
Гиперчувствительность. Многие грибковые заболевания, особенно связанные с лёгкими, сопровождаются реакциями гиперчувствительности (обычно I или IV типа; рис. 33).
Дерматофиты — нитевидные грибы, метаболизирующие кератин, который берут из волос, ногтей, кожи (дерматомикоз). Подвержены действию факторов сальных секретов и, вероятно, клеточного иммунитета.
Candida albicans ( Monilia) — дрожжеподобный гриб. Вызывает тяжёлые распространённые инфекции кожи, слизистой оболочки полости рта и других тканей у больных с иммунодефицитом, особенно с дефектами Т-клеток. Точная роль Т-клеток в подавлении инфекции не установлена. Значительного клинического улучшения и восстановления положительной кожной реакции замедленной гиперчувствительности удаётся добиться
с помощью фактора переноса — экстракта из нормальных лейкоцитов. Первоначально считалось, что фактор переноса передаёт специфическую Т-клеточную отвечаемость. Теперь известно, что его эффективность не связана со специфичностью в отношении антигена.
Криптококки (инкапсулированные дрожжи) имеют оболочку, успешно противостоящую фагоцитозу, если нет опсонизации антителами и/или комплементом (сравните пневмококки и др.). При иммунодефиците распространяются в мозг и мозговые оболочки, вызывая серьёзные осложнения. In vitro криптококки могут разрушаться NK-клетками.
Актиномицеты и другие спорообразующие грибы из прелого сена, соломы и др. способны достигать лёгочных альвеол и стимулировать синтез антител (классов IgG и IgE) с последующей индукцией острой гиперчувствительности («лёгкое фермера»). Аспергиллы обычно поражают больных туберкулёзом.
Гистоплазма (гистоплазмоз), кокцидии (кокцидиоз), блас-томицеи (бластомикоз) наиболее распространены в Америке. Вызывают похожие заболевания лёгких, которые в зависимости от иммунного статуса больного могут спонтанно разрешаться или приводить к хроническому гранулёматозу и фиброзу. Сходство этих инфекций с туберкулёзом и лепрой подтверждает тот факт, что течение инфекционного заболевания больше зависит от реализуемых микроорганизмом защитных механизмов (в данном случае резистентность к перевариванию макрофагами), чем от вида самого паразита.
Пневмоцисты ( Pneumocystis carinii). Исследования РНК показали, что эти микроорганизмы всё-таки ближе к грибам, чем к простейшим. Пневмоцистная пневмония стала одним из опаснейших осложнений при СПИДе (рис. 40), что предполагает наличие в норме супрессорного влияния Т-лимфоцитов на размножение паразита, хотя механизм этого влияния ещё неизвестен.
63
29. ИММУНИТЕТ К ПРОСТЕЙШИМ
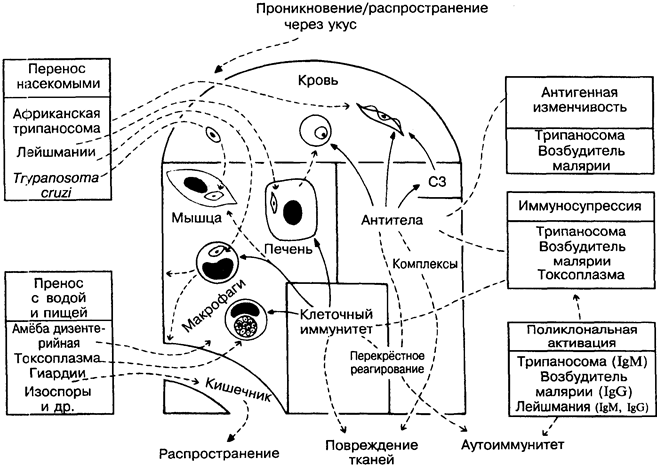
Относительно немногие (менее 20) простейшие инвазиру-ют человека, но среди них 4 паразита представляют наибольшую опасность для него, вызывая тяжёлые заболевания: возбудители малярии, африканская и американская трипаносомы, лей-шмании (на рисунке слева вверху). Простейшие используют те же защитные механизмы, что и бактерии и вирусы, но делают их более совершенными. Они распространяются на большие расстояния насекомыми-переносчиками (для сравнения — чума, тиф, жёлтая лихорадка), паразитируют внутриклеточно (для сравнения — туберкулёзная палочка, вирусы), отличаются вариабельностью антигенов (для сравнения — грипп) и обладают иммуносупрессивными свойствами (для сравнения — ВИЧ). В результате полноценный иммунитет к ним очень редок, а роль
иммунной системы сводится к ограничению численности паразитов (нестерильный иммунитет) и сохранению жизни организма хозяина (а значит, и паразитов). Рациональность вакцинации соответственно низка с учётом того, что некоторые симптомы заболевания развиваются в результате иммунных повреждений, а не воздействия паразита как такового.
Напротив, простейшие, поражающие кишечник (на рисунке внизу слева), вызывают достаточно лёгкие заболевания (при условии нормального функционирования иммунной системы). Однако какими бы лёгкими эти болезни ни казались, в сочетании с паразитирующими в кишечнике червями, о которых пойдёт речь в следующем разделе, они составляют серьёзную дополнительную нагрузку на здоровье в тропических странах.
64
Африканские трипаносомы. Trypanosoma gambiense и T. rho- desiense, разносимые мухой цеце, вызывают сонную болезнь и распространены в Восточной и Западной Африке. Циркулирующие в крови формы чувствительны к антителам и комплементу, но выживают в результате антигенной вариабельности поверхностного гликопротеина, контролируемого антигенпереключаю-щим геном. Число возможных вариантов неизвестно, но велико (вероятно, около тысячи). Наряду с подавленным антительным ответом на другие антигены (в частности, вакцинальные), в организме больного присутствуют в большом количестве неспецифические IgM, в том числе и аутоантитела. Вероятно, это следствие поликлональной активации В-лимфоцитов паразитарными продуктами (для сравнения — бактериальные липополисахари-ды). Организм человека устойчив к трипаносомам грызунов, так как содержит нормальный сывороточный фактор — липопроте-ин высокой плотности, который агглютинирует их. Это хороший пример защитной роли естественного иммунитета.
Плазмодии малярии. Plasmodium falciparum (наиболее опасна), Р. malaria, P. vivax и Р. ovale переносятся комарами. При заражении проникают сначала в печень. На этой стадии вакци-нация эффективна, вероятно, благодаря цитотоксическим Т-лим-фоцитам. Тканевая стадия очень непродолжительна, и вслед за ней возбудители начинают циклически проникать в эритроциты. На этой стадии антитела менее эффективны вследствие вариабельности антигенов возбудителя и поликлональной продукции IgG. На некоторых экспериментальных моделях вакцинация защищает организм на эритроцитарной стадии развития и гамет. Получены обнадёживающие результаты в опытах по созданию вакцины против P. falciparum у человека. Эритроциты человека, не имеющие антигенов групп крови Даффи или содержащие фетальный гемоглобин, естественным образом ре-зистентны к Р. vivax и Р. falciparum. P. malaria вызывают отложение иммунных комплексов в почках. В тяжёлых случаях малярии наблюдается повышенный уровень фактора некроза опухоли (рис. 23) в результате чрезмерной активации макро-фагов продуктами паразита. Сходная патология наблюдается при грамотрицательной бактериальной септицемии.
Бабезии, или пироплазмы, — паразиты крупного рогатого скота, сходные с возбудителями малярии. Разносятся клещами и способны заражать человека. Вероятность заражения возрастает после удаления селезёнки и при иммуносупрессивной терапии. Применение ослабленной вакцины для лечения собак и крупного рогатого скота даёт превосходные результаты.
Тейлерии (лихорадка восточного побережья) — инфекция крупного рогатого скота. Сходна с малярией, но внутриклеточная стадия развития возбудителя проходит не в печени,'а в лимфоцитах. Необычность заболевания состоит ещё в том, что возбудитель разрушается цитотоксическими Т-клетками, т.е. ведёт себя как вирус.
Лейшмании — многочисленные паразиты, разносимые песчаными москитами и песчаными мухами. Встречаются в основном в тропических странах, где вызывают множества заболеваний. Паразитируют внутриклеточно в макрофагах. Патология с поражением кожи или внутренних органов во многом зависит от силы клеточного иммунного ответа и/или его баланса с антителами (для сравнения — лепра). Африканский кожный лейш-маниоз необычен тем, что стимулирует самоисцеление с последующей резистентностью к возбудителю. Этот вид защиты многие столетия был известен на Ближнем Востоке (лейшма-низация). Эксперименты на мышах показывают, что Th1-лимфоциты опосредуют резистентность к лейшманиям, а Th2-лим-фоциты ослабляют её. Окись азота может быть основным про-тивопаразитарным киллерным агентом (рис. 8).
Trypanosoma cruzi вызывает американский трипаносомоз, или болезнь Чагаса. Источник инфекции — дикие млекопитающие, переносчики — насекомые. Трипаносомы инфицируют множество клеток, в значительной степени мышцу сердца и ганглии вегетативной нервной системы. Предполагается, что клеточно опосредованный аутоиммунный ответ против антигенов мышцы сердца может быть причиной хронической сердечной недостаточности. Аналогична ситуация с нервной системой. Существует сходство между антигенами нервной системы и паразита. Антитела и эозинофилы убивают микроорганизмы in vitro, но перспективной представляется вакцинация только против паразита, циркулирующего в крови. Лучшим решением проблемы является преодоление нищеты, с которой обычно связано обилие переносчиков болезни.
Токсоплазмы. Т. gondii особенно вирулентна для плода и больных с ослабленной иммунной системой, поражает главным образом глаза и мозг. Способна выживать в макрофагах, препятствуя образованию фаголизосом (для сравнения — туберкулёз), но клеточные иммунные реакции могут действовать на паразита в этой стадии. Токсоплазма стимулирует макрофаги и подавляет Т-лимфоциты, влияя на резистентность к другим возбудителям инфекции.
Entamoeba histolytica обычно является причиной заболевания толстой кишки (амёбная дизентерия), но может попасть с кровью в печень и другие органы и вызвать абсцессы в результате прямого лизиса клеток хозяина. Некоторые животные и, возможно, человек способны вырабатывать иммунитет определённой степени к паразиту на тканевой стадии развития, но не на стадии развития в кишечнике.
Giardia, Balantidium, Cryptosporidium, Isospora и др. обычно локализуются в кишечнике, вызывая дизентерию и расстройства всасывания. При СПИДе могут вызывать серьёзные осложнения (рис.40).
65
30. ИММУНИТЕТ К ГЕЛЬМИНТАМ
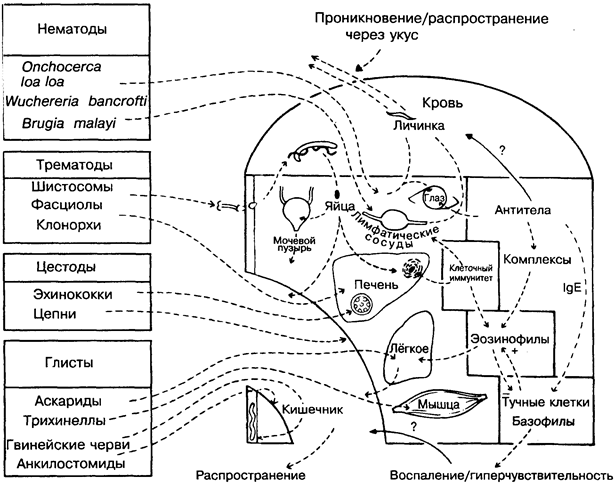
Паразитирующие черви всех 3-х классов (трематоды, цесто-ды и нематоды) вызывают у человека множество заболеваний, наиболее неприятные из которых (на рисунке слева вверху) онхоцеркоз, слоновость и шистосомоз. Эти болезни распространены в тропических странах и переносятся насекомыми, моллюсками и др. Другие болезни (на рисунке слева внизу) распространены повсеместно и передаются с пищей, заражённой яйцами, личинками или цистами паразитов. Черви характеризуются сложным жизненным циклом и круговой миграцией, во время которой часто заселяют определённые органы.
Особенность иммунного ответа на червей характеризуется определяющей ролью эозинофилов и IgE. В соответствии с этим заболевания обычно сопровождаются реакциями гиперчувстви-тельности в коже, лёгких и других органах, причём протектив-ная эффективность этих реакций противоречива. Поскольку в
организме человека черви не воспроизводятся (в отличие от простейших, бактерий и вирусов), каждая отдельная особь защищена от действия иммунных факторов. Как и в случае с наиболее адаптированными простейшими (плазмодии малярии), действие иммунитета состоит скорее в ограничении численности червей, чем в их уничтожении. Возможность вакцинации человека представляется маловероятной, хотя для некоторых животных (собаки, крупный рогатый скот) вакцинация оказывается на удивление эффективной.
Интересно, что некоторые препараты, действующие на червей (ниридазол, левамизол, гетразан), как выяснилось, стимулируют или супрессируют Т-лимфоциты человека, воспалительные процессы и т.д. Возможно, черви имеют общие с хозяином структуры и метаболические характеристики.
66
Эозинофилы могут выполнять 3 функции при гельминтозах, включая фагоцитоз многочисленных комплексов антиген-антитело, модуляцию гиперчувствительности и киллинг некоторых червей с помощью IgG-антител (по крайней мере in vitro). Эозинофилия развивается частично под влиянием тучных клеток и факторов хемотаксиса, выделяемых Т-клетками. Стимуляция выхода эозинофилов из костного мозга осуществляется Т-клетками через ИЛ-5 (рис. 23).
IgE. Экстракты некоторых червей и сами черви стимулируют синтез как специфических, так и неспецифических IgE-антител. Возможно, опосредуемая IgE воспалительная реакция (например, в кишечнике) препятствует проникновению или фиксации червей. С другой стороны, IgE в больших количествах способны блокировать тучные клетки, предотвращая аллергию, например, к пыльце растений. Синтез антител класса IgE означает активность Т-хелперов типа Th2,
НЕМАТОДЫ (круглые черви)
Нематоды подразделяются на филярии, у которых личинки I стадии (микрофилярии) могут развиваться лишь в насекомых, а для человека инфекционна только III их стадия, и кишечные глисты, у которых весь цикл развития может проходить у человека.
Филярии. Onchocerca volvulus — возбудитель онхоцеркоза, или «речной слепоты», распространяется мошками Simulium, которые откладывают и концентрируют личинки в коже человека. Микрофилярии, обитающие в области глаза, вызывают прогрессирующую слепоту, которая в основном связана с иммунным ответом. На Ближнем Востоке патология связана преимущественно с поражением кожи. Не совсем ясно, с чем связаны особенности заболевания — с паразитами или иммуноло-гическими особенностями (сравните — лепра). Loa loa вызывает сходное заболевание (лоаоз), но в более лёгкой форме. Wuchereria bancrofti и Brugia malayi распространяются комарами, которые всасывают микрофилярии с кровью больного. Личинки заселяют лимфатические сосуды и лимфатические узлы и вызывают слоновость, частично блокируя и частично стимулируя клеточный иммунитет. Возможно, какую-то роль в этом играют элементы почвы, например силикаты. На некоторых экспериментальных моделях микрофиляремия контролируется антителами.
Глисты кишечника — Ascaris, Strongiloides, Toxocara. При прохождении через лёгкие могут вызвать астму и другие заболевания лёгких, связанные с эозинофилией. Личинки Trichinella spimlis инкапсулируются в мышцах. На некоторых экспериментальных моделях черви этого типа стимулируют стойкий защитный иммунитет. Strongiloides часто вызывают заболевание у людей с иммуносупрессией. Toxocara — болезнь кошек и собак; переда
ваясь людям, вызывает заболевание детей младшего возраста (ток-сокароз) и поражения глаз в более позднем возрасте.
Гвинейские черви ( Dracunculus) обитают под кожей, достигая в длину до 120 см. Анкилостомиды ( Ancylostoma, Necator) проникают через кожу и живут в тонкой кишке, вызывая тяжёлые анемии. Ни один из этих червей не стимулирует защитный иммунитет.
ТРЕМАТОДЫ (сосальщики)
Часть жизненного цикла трематоды проходят в моллюске. Выходящий из него церкарий способен инфицировать человека через кожу (шистосомы) или попадает в организм с пищей (фас-циолы, клонорхи). В последнем случае трематоды заселяют печень (печёночные сосальщики), но не стимулируют защитный иммунитет.
Шистосомы (кровяные сосальщики) обитают и спариваются в венозной крови ( Schistosoma mansoni, S. japonicum — в брыжейке; S. haematobium — в мочевом пузыре). Безвредны до тех пор, пока их яйца не попадут в печень или мочевой пузырь. После этого опосредованные Т-клетками гранулёматозные реакции могут вызвать фиброз в печени, а иногда рак мочевого пузыря. Для защиты от иммунных факторов поверхность взрослых червей покрыта антигенами, происходящими из клеток хозяина. В то же время стимулируемые антитела могут поражать молодые формы на последующих стадиях развития. В этих реакциях участвуют IgE-, lgG-антитела, эозинофилы и макрофаги. Шистосомы выделяют множество молекул, разрушающих антитела и подавляющих макрофаги, что делает взрослую особь практически неуязвимой. Таким образом, организм хозяина, оставаясь заражённым шистосомой, становится устойчивым к реинвазиям (сопутствующий иммунитет).
Фасциолы представляют опасность в основном для сельскохозяйственных животных, у которых они паразитируют в желчном протоке. В этих случаях иммунный ответ может вызвать повреждение печени. Вакцины неэффективны.
Клонорхи сходны с фасциолами, но инфицируют человека и могут вызывать рак желчного протока.
ЦЕСТОДЫ (ленточные черви)
Паразитирование цестод в кишечнике может быть для хозяина сравнительно безвредным (например, цепни), но иногда они попадают в мозг, где погибают (цистицеркоз) или образуют колонии в печени (например, пузыревидные личинки эхинококка), в которой черви защищены от действия антител. Антигены эхинококка (например, освобождаемые при хирургическом вмешательстве) могут вызвать тяжёлую гиперчувствительность немедленного типа (рис.33).
67
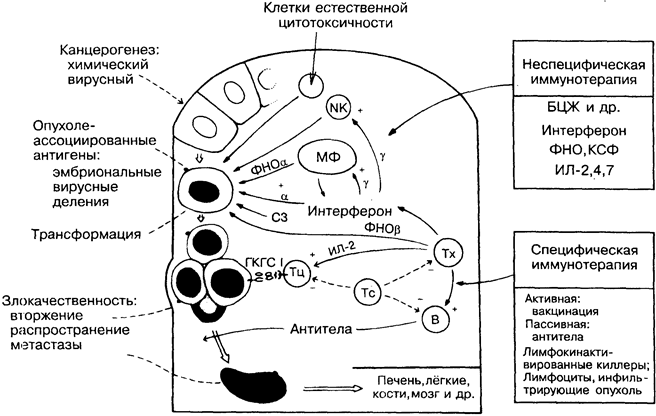
31. ПРОТИВООПУХОЛЕВЫЙ ИММУНИТЕТ
Считалось, что в первых рядах покорителей рака непременно будут иммунологи. К сожалению, в свете последних событий приходится признать, что вряд ли они там окажутся. Во взаимоотношении с хозяином опухолевую клетку можно сравнить с паразитом, но при наличии дополнительных защитных механизмов, таких, как слабая антигенность, множественные перекрёстные реакции с антигенами хозяина, выделение растворимых антигенов, иммуносупрессия, образование иммунных комплексов и антигенная изменчивость. В отличие от паразитов, спонтанные опухоли индивидуальны и уникальны; происхождение их обычно неизвестно. Опухоль лишена чувства самосохранения, заставляющего хорошо адаптировавшихся паразитов не подвергать опасности жизнь хозяина. В этом отношении опухоль более походит на вирулентные зоонозы. Более того, кроме некоторых опухолей у детей, рак часто наблюдается в позднем возрасте, когда организм не успевает существенно повлиять на развитие иммунной защиты.
Тем не менее есть и положительные факторы. Как ни мала антигенность опухолей, она всё-таки есть, и экспериментальные
животные могут быть специфически иммунизированы против них. У больных с иммунодефицитом или иммуносупрессией опухоли некоторых тканей возникают чаще, чем в норме, хотя у мышей, лишённых Т-клеток, этого не происходит. Клетки, которые убивают опухоли in vitro и отторгают вторичные импланта-ты (резистентность к реинвазии), обнаруживаются у животных с растущими первичными опухолями. Обнадёживает способность опухолей регрессировать самопроизвольно или после частичного повреждения в результате химиотерапии либо хирургического вмешательства. Представление о противоопухолевом иммунитете в последние годы меняется и от общепринятой теории Т-клеточного надзора (в сущности, попытки обосновать отторжение трансплантата) приближается к концепции, согласно которой естественный (на рисунке вверху) и адаптивный (внизу) иммунитет защищает против разных опухолей, как это происходит, например, при внедрении болезнетворных микроорганизмов.
68
Канцерогенез. Антигены, связанные с опухолью. У мышей такие химические агенты, как метилхолантрен, бензпирен и др., вызывают развитие опухолей, каждая из которых имеет уникальные идиотипические антигены, тогда как опухоли, вызванные вирусами, например полиома, лейкоз Гросса и др., несут вирусные антигены. Оба варианта агентов могут быть использованы для иммунизации против последующего воздействия. Такие антигены получили название «опухолеассоциированные трансплантационные антигены». У человека лишь 3 вируса (все ДНК-вирусы) тесно связаны с опухолями, а именно вирус Эп-стайна-Барр (лимфома Беркитта), вирус цитомегалии (саркома Капоши) и вирус папилломы. РНК-ретровирусы, активируя он-когены клеток хозяина, могут вызывать образование опухоли.
Эмбриональные антигены отсутствуют на нормальных зрелых клетках и вновь появляются на злокачественных. Диагностически значимы раково-эмбриональный антиген при раке толстой кишки и альфа-фетопротеин при раке печени. Антигены, характерные для стадий деления и созревания клетки, очень редки в нормальных тканях и часто присутствуют в опухолях (например, антиген стволовой клетки при остром лимфобластном лейкозе).
ЕСТЕСТВЕННЫЙ ИММУНИТЕТ
Макрсфаги (МФ) и NK-клетки (рис. 9), особенно активированные, могут сдерживать рост опухоли in vitro (цитостаз) или разрушать её (цитолиз). Поскольку не доказано, что макрофаги и МК-клетки способны распознавать опухоли per se, остаётся предположить, что эта активность является общей ростконтролиру-ющей функцией. Опыты на животных показывают, что при ин-тенсииной стимуляции макрофаги выделяют фактор некроза опухоли (ФНО), который разрушает некоторые опухоли in vivo, но вызывает побочные эффекты — потерю массы тела и др. ФНО действует в синергизме с интерфероном. ИФ-гамма необходим для активации макрофагов и NK-клеток. Некоторые опухолевые клетки могут активировать комплемент по альтернативному пути. Эти и другие механизмы играют роль в устойчивости бестимусных мышей к спонтанному образованию опухолей.
АДАПТИВНЫЙ ИММУНИТЕТ
Антитела. Как и в случае с микроорганизмами, антитела эффективнее действуют против свободных клеток (лейкозы, мета-стазирующие опухоли), чем против солидных опухолей. Антитела могут содействовать росту опухоли (эффект усиления), возможно, за счёт формирования комплексов с растворимыми антигенами и блокады опосредованной Т-клетками цитотоксич-ности. Опыты на мышах инбредных линий показывают, что антительный ответ более эффективен, чем активированные макрофаги, для защиты от химических канцерогенов.
Клеточный иммунитет. Разрушение опухолей цитотокси-ческими Т-лимфоцитами легко демонстрируется in vitro, а у мышей и in vivo. Некоторые опухолевые клетки утрачивают в процессе формирования многие нормальные антигены, в том числе молекулы ГКГС класса I, и становятся недоступными для Т-киллеров. Т-хелперы активируют макрофаги и выделяют ФНО бетта. Существует теория, согласно которой слабые Т- клеточные реакции способствуют росту опухоли.
Супрессия. Предполагается, что, подавляя действие Т-киллеров, Т-супрессоры способствуют развитию рака кожи у мышей, вызванного ультрафиолетовым облучением. Больные с лим-фомой Беркитта обычно имеют высокий уровень содержания вируса Эпстайна-Барр. Можно предположить, что опухоли из инфицированных В-клеток возникают из-за того, что супрес-сированные Т-киллеры не могут выполнять свои защитные функции. Вероятным кофактором супрессии является малярия.
Дата: 2018-12-28, просмотров: 478.