Представление антигена. Антигенпредставляющие клетки (АПК), несущие молекулы ГКГС класса II, способны связывать собственные пептиды, но для стимуляции Т-лимфоцита должны иметь костимулирующие молекулы (например, В7; рис. 14) и/или секретировать цитокины (например, ИЛ-1). В противном случае Т-лимфоцит может получить негативный сигнал и стать неотвечаемым.
Клональная элиминация. В основу клонально-селекцион-ной теории австралийского иммунолога Ф. Бёрнета (1959) легло предположение о том, что лимфоциты индивидуально ограничены в распознавании антигена, а лимфоциты, распознающие «свои» антигены, уничтожаются на раннем этапе развития в центральных органах иммунной системы. Для Т-лимфоцитов это достигается негативной селекцией в тимусе (рис. 10), а для большинства (но не для всех) В-лимфоцитов — в костном мозге. Определяющим фактором, по-видимому, является аффинность (чем выше аффинитет, тем вероятнее элиминация).
В-клеточный рецептор (иммуноглобулин). В-клеточные рецепторы могут быть заняты антигеном в нестимулирующей форме. В период эмбрионального развития В-лимфоциты могут сбрасывать поверхностные иммуноглобулины и не замещать их, что равнозначно клональной элиминации. Тем не менее В-лимфоциты, способные связывать некоторые «свои» антигены (например, тиреоглобулин), найдены у нормальных животных. Поскольку V-гены В-лимфоцитов подвержены соматическим мутациям, возможно изменение их специфичности, и, следовательно, помимо центральной, необходима периферическая толерантность.
Т-клеточные рецепторы утрачивают стимулирующую способность в присутствии специфических антигенов в растворённой форме. Очевидно, в сыворотке также присутствуют блокирующие факторы, так как Т-лимфоциты, прокультивированные в отсутствие «своей» сыворотки, способны проявлять аутореак-тивность. Сходный механизм найден у так называемых мозаичных мышей, где мирно сосуществуют клетки, теоретически способны; убивать друг друга. Суперантигены (рис. 14), например стафилококковые энтеротоксины, способны вызывать элиминацию всех Т-лимфоцитов с определённым типом Vp-цепей Т-клеточкого рецептора.
Клетки-супрессоры. Считается, что некоторые Т-клетки способны узнавать и подавлять аутореактивные лимфоциты. В ответ на искусственно вызванную аутореактивность (рис. 36) вырабатываются Т-клетки, участвующие в её подавлении. Тем не менее существование Т-супрессоров в качестве отдельной линии лимфэцитов вызывает серьёзные сомнения.
Антиидиотипическая сеть. Как и в случае с супрессорными клетками, антиидиотипические антитела (рис. 22) найдены у животных с установившимся иммунитетом, который они регулируют в определённой степени, но роль их в поддержании нормальной толерантности пока неясна.
ИНДУКЦИЯ ТОЛЕРАНТНОСТИ
Растворимые антигены. АПК обычно не способны к представлению растворимых антигенов, которые вследствие этого менее иммуногенны, но более толерогенны. Возможно, растворимые антигены блокируют рецепторы лимфоцитов и стимуляцию Т-клеток.
Эмбриональный или неонатальный период. Было установлено, что введение антигена в эти периоды жизни индуцирует толерантность. Возможно, в её основе заложены клональная элиминация и неспособность незрелых АПК представлять антиген. В-клетки эмбриона могут частично становиться толерантными, что связано с различиями в замещении их иммуно-глобулиновых рецепторов (см. выше). Имеются доказательства, что альфа-фетопротеин как основной сывороточный белок эмбриона способен подавлять аутореактивные Т-лимфоциты.
Оральный путь. Антигены, поступившие через кишечник, впервые обрабатываются макрофагами печени, которые удаляют им-муногенные агрегаты и другие комплексы, оставляя лишь растворимые толерогены. Кроме того, АПК в кишечнике могут быть специализированы для индукции толерантности, чтобы предотвращать иммунный ответ на пищевые антигены.
АПК. Любое подавление функций АПК, включая введение антител к их молекулам ГКГС, создаёт условия для снижения иммуно-генности и для индукции толерантности. Толерантность, индуцированная введением антител, может привести к усилению роста опухоли, трансплантата (эффект усиления). Действием антител к молекулам ГКГС объясняется, по-видимому, и благотворное влияние переливаний крови на выживаемость трансплантата почки. Антитела к CD4 молекуле частично эффективны в индукции Т-клеточной толерантности к антигену, вводимому в то же время.
Высокие дозы антигена обычно более толерогенны, но повторные инъекции очень малых доз антигена тоже индуцируют Т-клеточную толерантность. Как правило, Т-клеточная толерантность индуцируется легче и на более длительный период, чем толерантность В-клеток.
«Антигенное самоубийство». Конъюгирование антигена с токсическими препаратами, радиоизотопами и др. даёт возможность направленного разрушения специфических Т- и В-лимфоцитов без последствий для окружающих клеток. Подобный принцип применялся для элиминации опухолевых клеток с использованием конъюгатов специфических антител с токсинами (рис. 31).
Комплексы антиген-антитело способны иногда индуцировать толерантность, блокируя рецепторы. В зависимости от природы и соотношения антител и антигена комплексы, напротив, могут быть высокоиммуногенными.
Неиммуногенные носители, такие, как «свои» материалы или недеградируемые молекулы (например, D-аминокислоты), могут обеспечивать толерогенность гаптенов, которые на нормальных носителях являются антигенными. Это явление использовалось для подавления специфического IgE-ответа при аллергии.
Антиидиотипические антитела уже испытывались при лечении аутоиммунных заболеваний и могут оказаться полезными при трансплантации. К сожалению, супрессируя один идиотип, можно способствовать выработке других антител к тому же антигену, что ставит под сомнение целесообразность такого подхода.
49
22. ИДИОТИПЫ, АНТИИДИОТИПЫ И ИХ СЕТИ
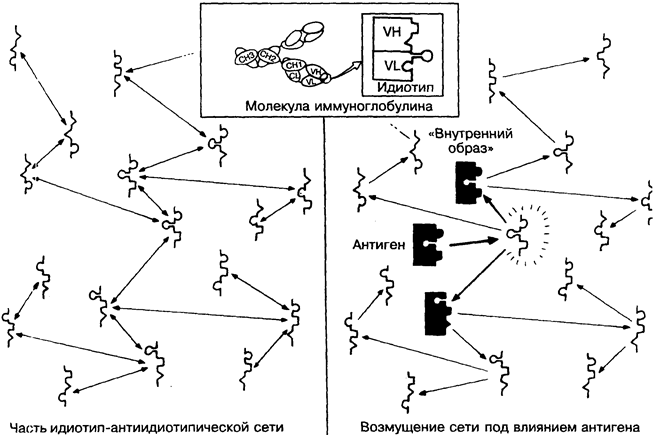
Учитывая, что антигенраспознающие участки антител Т-кле-точных рецепторов кодируются в чрезвычайно большом разно-образии именно для того, чтобы распознавать практически любые предсказуемые молекулярные формы, нет ничего удивительного, что некоторые из них распознают друг друга. В таких случаях одну молекулу называют идиотипом (Id), а другую — антиидиотипом (анти-Id). Теоретически они могут быть не только антителами, но и молекулами Т-клеточных рецепторов (на рисунке вверху схематично показана локализация идиотипичес-ких детерминант в активном центре антитела).
Из этого можно сделать несколько важных выводов. Во-первых, очевидно, что это пример аутореактивности или аутоим-мунитета. Во-вторых, неизвестно, как антиидиотип влияет на клетку, синтезирующую идиотипы, и наоборот, а также каковы последствия этих влияний на иммунный ответ в целом. Кроме того, сомнению подвергается привычное деление молекул на рецепторы и антигены. Действительно, молекула Ig-рецептора к определённому антигену сама оказывается антигеном для нескольких других Ig-молекул, для которых в свою очередь существуют рецепторы, и т.д. Таким образом, напрашивается вывод, что для каждого чужеродного антигена в этой практически бесконечной цепи где-то должна найтись молекула рецептора, по
конфигурации точно соответствующая этому антигену, — его «внутренний образ». Иными словами, все антигены окружающей среды должны быть представлены в организме на лимфоцитах.
В этом случае бактерии, вирусы и др. не вносят в организм ничего действительно чужеродного, и сеть из взаимодействующих между собой рецепторов (левая часть рисунка) должна существовать в организме и без их вторжения. Однако антигены из окружающей среды стимулируют синтез дополнительных антител, нарушающих равновесное состояние сети (правая часть рисунка), что приводит к образованию множества идио-типов и антиидиотипов, некоторые из которых (выделены на рисунке более темным цветом) частично или полностью соответствуют исходному антигену.
В 1974 г. английский иммунолог Н. Ерне впервые сформулировал все эти возможности и объединил их в теорию идио-тип-антиидиотипической сети, многочисленные аспекты которой нашли отражение во многих областях иммунологии. Сейчас трудно даже представить все возможные варианты практического приложения сетевой теории для регуляции иммунного ответа, лечения аутоиммунных заболеваний, создания вакцин и т.д. Имеется немного иммуннологических ситуаций, где бы не обсуждались вопросы, связанные с сетевой теорией.
Дата: 2018-12-28, просмотров: 385.