БЦЖ — ослабленные туберкулёзные бациллы. Применяется для лечения больных с меланомой, саркомой и другими опухолями, особенно в комплексе с другими методами. Главное им-мунологическое воздействие направлено на активацию макрофагов и NK-клеток. Большое количество бактериальных и других иммуностимулирующих агентов используется в активации противоопухолевой защиты (рис. 41).
Цитокины После успешных опытов с ФНО на животных многочисленные цитокины испытаны у больных раком. В настоящее время широко используются при лечении рака лишь ИФ-альфа и ИЛ-2. Положительный эффект бактериального экстракта (токсин Коули), применённого более 100 лет назад, возможно, связан с его сильным действием на продукцию цитокинов.
СПЕЦИФИЧЕСКАЯ ИММУНОТЕРАПИЯ
Активная иммунизация. Ослабленные облучением, химическими агентами и другими воздействиями, опухолевые клетки и клеточные гибридомы оказываются эффективными при вакцинации животных до возникновения опухоли. Хорошие результаты даёт активная иммунизация в сочетании с химиотерапией или хирургическим вмешательством. Перспективны эксперименты по трансфекции опухолевых клеток генами цитокинов. Реинъекция таких клеток способна вызвать не только отторжение опухоли, но и возникновение иммунной памяти. В наиболее удачных опытах в иммунный ответ вовлекались главным образом цитотоксические Т-клетки.
Пассивная иммунизация. Теоретически антитела могут удалять блокирующие антигены, способствуя тем самым проявлению Т-клеточного ответа. Испытаны клетки, сенсибилизированные против опухоли больного, но они могут происходить от животных, что вызывает проблему отторжения при трансплантации больному. Моноклональные антитела к опухолеассоции-рованным антигенам, конъюгированные с токсическими препаратами и др., могут усилить разрушение опухоли. Используется метод «антигенного самоубийства» при специфической имму-носупрессии (рис. 38). Антиидиотипические антитела тормозят развитие В-клеточных лейкозов.
Лимфоциты из крови больного, активированные in vitro цито-кином ИЛ-2 (лимфокинактивированные киллеры), и лимфоциты непосредственно из опухоли (лимфоциты, инфильтрирующие опухоль) в некоторых случаях способны вызывать поражение опухоли.
69
32. НЕЖЕЛАТЕЛЬНЫЕ ПРОЯВЛЕНИЯ ИММУНИТЕТА. ОБЩАЯ СХЕМА
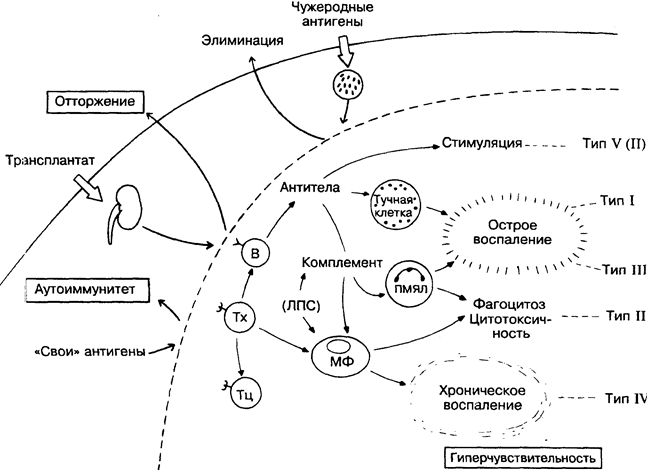
Эффективность иммунной системы, полезная в борьбе с инфекциями (верхняя часть рисунка), имеет и негативные стороны. Наличие широкого спектра рецепторов, специфически распознающих антигены и приводящих в действие мощные эффек-торные механизмы, в ряде случаев может обернуться против хозяина. Во-первых, иногда механизмы, сдерживающие реагирование лимфоцитов против «своих» антигенов, оказываются неэффективными (аутоиммунитет; внизу слева); кроме того, возникают ситуации, когда отторжение трансплантата нежелательно. Во-вторых, сильные эффекторные факторы (комплемент, гранулоциты, макрофаги и др.; в центре) могут повреждать окружающие ткани по типу гиперчувствительности.
Классификация патологических иммунных реакций никогда не отличалась особой стройностью. Аллергия первоначально означала любые отклонения в реакции иммунной системы на повторную встречу с антигеном. Гиперчувствительность, вместо того чтобы обозначать вредное для организма реагирова
ние, отражала только время, необходимое для проявления порой безобидных (например, кожные тесты) реакций и подразделялась по этому принципу на острую, немедленную и замедленную. На сегодня иммунология накопила достаточно знаний, чтобы классифицировать патологические иммунные реакции по типу задействованных эффекторных механизмов. Речь идет о схеме Джелла и Кумбса (тип I-IV; справа), которая сохранила привычные значения терминов «аллергия» и «гиперчувствительность», но расширила значение последней за счёт аутоиммунитета и отторжения трансплантата. Тем не менее большинство иммунологов предпочитают употреблять термин «аллергия» для определения немедленной реакции гиперчувствительности (тип I), например, к пыльце растений. Несмотря на это, необходим новый взгляд на сущность тех процессов, которые происходят в результате специфического распознавания и действия эффекторных механизмов, ведущих к повреждению ткани.
70
Т-хелперы. Распознавание Т-хелпером несущей части антигенной детерминанты необходимо как для стимуляции В-лим-фоцита к синтезу антител, так и для активации макрофагов. Не доказано, что Т-хелперы реагируют на абсолютно неизменённые собственные антигены in vivo (рис. 22, 36).
В — В-лимфоциты — предшественники антителообразующих клеток. Распознают «свои» антигенные детерминанты в норме. Они могут переключиться на продукцию аутоантител при частичной или перекрёстной реакции на «свои» антигены, если Т-хелперы распознают «не свои» детерминанты на том же антигене (например, лекарство или вирус; рис. 36).
Тц — цитотоксические Т-лимфоциты, способные убивать алло-генные или изменённые «свои» клетки-мишени. Цитолитичес-кая активность по отношению к «своим» нормальным клеткам демонстрируется in vitro, но не наблюдается в чистом виде in vivo, возможно, из-за её блокады.
Тучные клетки. Базофильные гранулы тучных клеток содержат вазоактивные амины и другие медиаторы, которые осво-бождаются после того, как фиксированные на поверхности клетки IgE связывают аллерген, что приводит к быстрому локальному (аллергия) или системному (анафилаксия) воспалению (рис. 33).
Иммунные комплексы. Связывание антител с антигеном — основа нормального гуморального ответа. Если растворимые иммунные комплексы не фагоцитируются, а циркулируют в крови, активируя комплемент, полиморфно-ядерные лейкоциты и тромбоциты, то они могут вызвать тканевые повреждения (рис. 34).
Комплемент. Активированный иммунными комплексами комплемент участвует не только в элиминации антигена, но и в повреждении тканей. Анафилатоксины СЗа и С5а действуют на тучные клетки, а опсонин СЗЬ и литический комплекс С5-С9 способствуют разрушению трансплантированных клеток и через аутоантитела — собственных клеток организма.
ПМЯЛ — полиморфно-ядерные лейкоциты. Опосредуемый комплементом хемотаксис ПМЯЛ приводит к их быстрому накоплению в очаге воспаления, где они фагоцитируют иммунные комплексы. Лизосомальные ферменты гранулоцитов способны вызывать деструкцию тканей (например, феномен Артюса).
Тр — тромбоциты. Комплексы антиген-антитело связывают и агрегируют тромбоциты, что ведёт к выделению вазоактивных аминов а закупорке сосудов. Агрегация тромбоцитов является одной из характеристик отторжения трансплантата почки.
МФ — макрофаги. Фагоцитирующие макрофаги под влиянием Т-клеток накапливаются и активируются в очаге персистенции
антигена и вызывают некроз тканей или образование гранулём (рис. 35). Медленное поступление моноцитов и макрофагов в участок подкожной инъекции антигена характеризует замедленный тип гиперчувствительности. Макрофаги могут быть активированы и непосредственно бактериальными продуктами. Так, бактериальный эндотоксин липополисахарид (ЛПС) стимулирует освобождение ФНО и ИЛ-1. Эти цитокины в больших дозах могут вызвать коллапс сосудов и повреждение некоторых органов. Эндотоксический шок с участием цитокинов характерен для инфекций, вызванных менингококками и другими грамотрицательными бактериями. Кроме того, эндотоксины непосредственно активируют комплемент (по альтернативному пути) и запускают процесс свёртывания крови.
ТИПЫ ГИПЕРЧУВСТВИТЕЛЬНОСТИ (классификация Джелла и Кумбса с добавлениями):
I. Острая реакция (немедленная, анафилактическая, реагино-вая) опосредуется IgE-антителами (иногда IgG) вместе с тучными клетками, например, сенная лихорадка.
II. Опосредуемая цитотоксическими антителами класса IgM или IgG вместе с комплементом, К-клетками или фагоцитами реакция, например, трансфузионные реакции, многие аутоиммунные заболевания. Возможно, это не гиперчувствительность, а проявления аутоиммунитета и реакций отторжения трансплантата. Подобные возражения привели к появлению реагирования по типу V (см. ниже).
III. Опосредуемая иммунными комплексами; воспаление с участием комплемента, полиморфно-ядерных и других лейкоцитов, например, феномен Артюса, сывороточная болезнь, хронический гломерулонефрит.
IV. Опосредуемая клетками (замедленная, туберкулинового типа): Т-зависимая активация макрофагов, эозинофилов и других клеток, например, туберкулоидная лепра, шистосомный цирроз, отторжение трансплантата, кожная сыпь вирусной природы.
V. Стимулирующая — сравнительно недавно появившаяся подгруппа реагирования типа II. Сюда можно отнести случаи прямой стимуляции антителами функции клеток (например, стимуляция тиреоидстимулирующего рецептора щитовидной железы при тиреотоксикозе). Следует выделить отдельный тип гиперчувствительности для блокирующих и усиливающих антител противоопухолевого иммунитета, а также для поликло-нальной активации В-лимфоцитов, например, при трипаносомо-зе. Важную роль в процессах гиперчувствительности играют многие цитокины.
71
33. АЛЛЕРГИЯ И АНАФИЛАКСИЯ
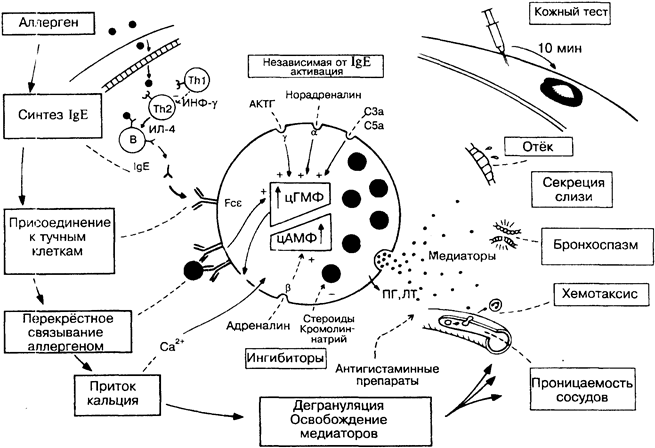
Из проявлений гиперчувствительности наиболее распространены реакции I типа по классификации Джелла и Кумбса. К ним относятся патологические расстройства разной степени тяжести — от распространённых аллергических состояний, таких как сенная лихорадка, крапивница, экзема, до редких, но тяжелых анафилактических реакций на пенициллин, пчелиный яд и др. В основе этих видов патологии лежат дегрануляция тучных клеток под действием специфических IgE-антител и освобождение медиаторов воспалительных процессов. Таким образом, это случаи острого воспаления (рис. б), индуцированного не инфекцией или повреждением тканей, а конкретным антигеном. Системное освобождение медиаторов (анафилаксия) характеризуется бронхоспазмом, рвотой, кожными высыпаниями, отёком слизистой оболочки горла и полости носа, сосудистым коллапсом и может привести к смерти. Локальное освобождение медиаторов характеризуется чаще всего каким-либо одним из этих симптомов в зависимости от зоны воздействия антигена. Aнтигены, запускающие эти реакции, известны как аллергены. Людей, страдающих чрезмерной аллергией, называют ато-
пиками. Обычно заболевание имеет наследственную природу и сопровождается множеством конституциональных аномалий. Поскольку одним из сильных аллергенов являются антигены гельминтов, то существует мнение, что такая разрушительная и явно бесполезная форма иммунного ответа сохранилась с того времени, когда гельминтозы представляли серьёзную угрозу для выживания человека. Тем не менее антитела класса IgE эффективны при минимальных повреждениях (например, глисты в кишечнике), быстро и специфически вызывая воспалительный процесс с привлечением лейкоцитов из кровотока.
Воспалительные процессы тесно связаны с функционированием вегетативной нервной системы. Через влияние симпатических (альфа и бетта) и парасимпатических (гамма) рецепторов на внутриклеточные уровни циклических нуклеотидов АМФ (аденозин-монофосфат) и ГМФ (гуанозинмонофосфат) возможна регуляция активности тучной клетки в освобождении медиаторов (рис. 24). Дегрануляция тучных клеток может произойти в результате действия факторов повреждения тканей (рис. 6) или активации комплемента (рис. 34).
72
IgE — основной класс реагиновых (гомоцитотропных, кожно-сенсибилизирующих) антител. В норме составляют менее 1/10000 всех сывороточных иммуноглобулинов. При аллергии и глистной инвазии общее содержание IgE в крови возрастает более чем в 30 раз, а содержание специфических IgE-антител — более чем в 100 раз. Дегрануляция тучной клетки происходит после того, как связанные с Fc епсилон-рецепторами антитела класса IgE взаимодействуют с аллергеном. При внутрикожной инъекции аллергена сенсибилизированному индивиду уже через несколько минут развивается немедленная кожная реакция. Состояние гиперчувствительности может быть перенесено морской свинке с сывороткой. Это тест на пассивную кожную анафилаксию. Антитела класса IgG, удаляя аллерген, способны предотвратить дегрануляцию тучных клеток. Некоторые подклассы IgG (для человека — IgG4), напротив, могут вызвать реагиновый тип реакции.
Тх — Т-хелпер. Продукция IgE В-лимфоцитами — высокозависимый от Т-клеток процесс. У больных атопией аллергены стимулируют цитокины Th2 (ИЛ-4, ИЛ-5 и др.), в отличие от здоровых, у которых преобладают цитокины Th1. По-видимому, ИФ-гамма ингибирует синтез IgE-антител, и в этом отношении цитокины Th1 рассматриваются как супрессорные при аллергии. Это является убедительным подтверждением существования разных субпопуляций Т-хелперов у человека. Показано также, что многие другие факторы, выделяемые Т-лимфоцитами, участвуют в регуляции синтеза IgE.
Тучные клетки. Тканевые тучные клетки отличаются от ба-зофилов крови главным образом по содержанию медиаторов. Существуют значительные различия между тучными клетками, локализующимися в соединительных тканях вокруг кровеносных ее судов, и тучными клетками в лёгких, кишечнике (тучные клетки слизистых тканей). Тучные клетки слизистых тканей отличаются тем, что регулируются Т-лимфоцитами и, как считают некоторые исследователи, происходят из них.
Са2+. Перекрёстное связывание IgE-рецепторов антигеном сопровождается изменениями липидов клеточной мембраны. Это приводит к притоку в клетки кальция, увеличению количества аденилатциклазы и как следствие к возрастанию уровня цАМФ.
цАМФ, цГМФ — циклические аденозин- и гуанозинмонофос-фаты, относительные уровни которых регулируют клеточную активность. Падение величины соотношения цАМФ/цГМФ в результате притока Са2+ или стимуляции альфа- и гамма-рецепторов вызывает дегрануляцию клетки. Стимуляция бетта-рецептора, например, адреналином, приводит к обратному эффекту. У больных с атопией может быть частичный дефект функции бетта-рецепторов, ведущий к высвобождению излишнего количества медиаторов.
МЕДИАТОРЫ
Многие медиаторы предсуществуют в гранулах тучных клеток, включая гистамин (увеличивает проницаемость сосудов и сужает бронхи), факторы хемотаксиса нейтрофилов и эозинофи-лов и фактор, стимулирующий тромбоциты к освобождению собственных медиаторов. После дегрануляции тучные клетки продуцируют простагландины (ПГ) и лейкотриены (ЛТ, рис. 6), которые действуют подобно гистамину, но медленнее.
ИНГИБИТОРЫ
Кромолиннатрий (интал) и стероиды (например, бетамета-зон) подавляют высвобождение медиаторов, стабилизируя лизо-сомальные мембраны. В клинической аллергологии применяются также антигистаминные препараты, которые не нейтрализуют другие медиаторы; адреналин, изадрин и др., стимулирующие бетта-рецепторы; антихолинергические средства, например атропин, блокирующие гамма-рецепторы; теофиллин, который повышает уровень цАМФ. Для клинической практики важны новые лекарственные препараты, воздействующие на молекулярные механизмы регуляции функций клеток иммунной системы.
Дата: 2018-12-28, просмотров: 403.