(ГЗТ)
Ведуща,я характеристика клеточного иммунитета — антиген-специфическая память, которая оценивается in vitro по пролиферации лимфоцитов или продукции цитокинов, например, ИФ-g, или in vivo по ответу на внутрикожное введение антигена. При положительной реакции ГЗТ через 2-3 дня в месте инъекции антигена появляется припухлость с покраснением кожи (типичный пример — проба Манту на туберкулёз). Хотя ГЗТ часто коррелирует с протективным иммунитетом, подобного рода ответ может наблюдаться с участием базофилов, известный как гиперчувствительность Джона Моута.
КОНТАКТНАЯ ЧУВСТВИТЕЛЬНОСТЬ
При этом варианте ГЗТ антигены (обычно молекулы растительной или химической природы) захватываются антигенпредстав-ляющими клетками Лангерганса в коже, где Т-клетки-хелперы реагируют с ними. Через 1-2 дня развивается экземоподобная реакция с отёком и инфильтрацией мононуклеарными клетками.
ХРОНИЧЕСКОЕ НЕИММУННОЕ ВОСПАЛЕНИЕ
Субстанции, которые не могут быть переварены макрофагами или токсичны для них, приводят к формированию гранулём даже у животных, лишённых Т-лимфоцитов, т.е. они способны активировать (или раздражать) макрофаги без помощи Т-клеток. К таким субстанциям относятся тальк, кремнезём, асбест, вата, некоторые металлы и их соли, отдельные бактериальные продукты (например, пептидогликан клеточных стенок стрептококков группы А).
ГРАНУЛЁМЫ
Гранулёмы образуются вследствие постоянного привлечения макрофагов в очаг воспаления, вызванного персистирующим антигеном или токсичными субстанциями. Иммунные комплексы также стимулируют образование гранулём.
Повреждение тканей может быть вызвано лизосомальными ферментами макрофагов и, возможно, специализированными ци-тотоксическими молекулами, такими как ФНО.
Эпителиальные клетки — большие клетки, окружающие не-кротизированные очаги ткани. Возможно, происходят из макрофагов, специализированных в большей степени на секреции ферментов, чем на фагоцитозе. Имеются данные, что развитие эпи-телиоидных клеток связано с клеточным иммунитетом.
Гигантские клетки образуются в результате слияния макрофагов. Чаще всего обнаруживаются в гранулёмах, сформированных вокруг инородных тел.
Эозинофилы часто присутствуют в гранулёмах, куда привлекаются факторами Т-клеток и, возможно, иммунными комплексами.
Фиброз вокруг гранулёмы представляет собой попытку репарации. Долговременные гранулёмы (например, при закрытой форме туберкулёза) могут в конце концов обызвествляться, как очаг Гона в лёгких, обнаруживаемый при рентгеноскопии у многих здоровых людей.
ГРАНУЛЕМАТОЗНЫЕ ЗАБОЛЕВАНИЯ
Кроме общеизвестных случаев, гранулёмы найдены при некоторых заболеваниях неясной этиологии, возможно, связанных с действием раздражителя или иммунных факторов. Некоторые из наиболее изученных заболеваний приведены ниже.
Саркоидоз характеризуется образованием гранулём в лёгких, коже, глазах и других органах. Интересная особенность заболевания — выраженный дефицит Т-клеточного иммунитета и часто повышение уровня иммуноглобулинов и антителообразования.
Болезнь Крона (регионарный илеит) отчасти сходна с сарко-идозом, но обычно поражает только кишечник. Считается, что болезнь вызывается аутоиммунным ответом против антигенов кишечника, стимулированным перекрёстно реагирующими бактериями. Вероятно, язвенный колит имеет сходную этиологию.
Перемежающийся артериит — хроническое воспалительное заболевание артерий с образованием гранулём, в которых преобладают гигантские клетки.
Первичный билиарный цирроз — редкое аутоиммунное заболевание (рис. 36), при котором гранулёмы формируются вокруг жёлчных протоков.
Эозинофильная гранулёма характеризуется преобладанием в гранулёмах эозинофилов, что наблюдается в основном при гельминтозах, редко в костной ткани.
77
36. АУТОИММУНИТЕТ
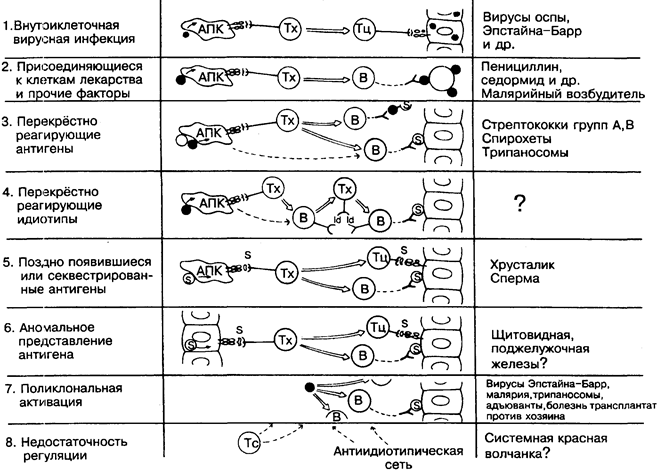
Аутоиммунитет является зеркальным отражением толерантности, демонстрируя утрату организмом толерантности к «своим» антигенам. В норме иммунная система сдерживает аутореактивность лимфоцитов с помощью регуляторных механизмов (рис. 21). Нарушение их может привести к аутоим-мунной патологии.
На рисунке приведены 8 возможных вариантов развития аутоиммунного ответа. Часто могут наблюдаться одновременно 2 из них или более, являясь причиной аутоиммунного заболевания.
- «Своя» клетка, несущая чужеродные антигены, может быть уничтожена вместе с ними (примеры 1 и 2; на рисунке чужеродные антигены выделены чёрным).
- При наличии аутореактивных В-лимфоцитов, когда клональ-ная элиминация оказалась недостаточной для элиминации всех аутореактивных В-клеток (рис. 21), инвазивные микроорганизмы, имеющие общие с хозяином антигенные детерминанты, способны вызвать выработку аутоантител к «своим» (S) антигенам (примеры 3 и 4).
- Антигены, появившиеся на более поздней стадии развития организма или освободившиеся из так называемых забарь-ерных тканей, при контакте с иммунной системой воспринимаются как «чужие» (пример 5).
- Представление антигена клетками, которые не специализированы для этой функции, может привести к аутореактив-ности (пример 6).
- Аутоареактивные В-лимфоциты могут быть стимулированы непосредственно поликлональныни активаторами в обход обычных условий активации (пример 7).
- Наконец, нарушение регуляции в идиотип-антиидиотипи-ческой сети, в системе клеток-супрессоров может привести к тому, что аутоиммунная реакция становится причиной заболевания (пример 8).
Следует отметить, что малая распространённость монокло-нальных аутоантител ставит под сомнение идею, что аутоанти-тело является новым мутантным антителом, хотя в отдельных случаях она принимается.
Пониманию сущности аутоиммунитета значительно помогли опыты на животных. Выработка аутоантител здоровыми животными в ответ на введение перекрёстно реагирующих антигенов (частично «своих») позволила предположить наличие кооперации между аутореактивными В-лимфоцитами и нереагирующими Т-клетками (пример 3). Спонтанное развитие аутоиммунных заболеваний у животных инбредных линий мышей и кур помогло обнаружить многообразие генетических влияний на уровне В-лимфоцитов, субпопуляций Т-клеток, макрофагов, тканей-мишеней и гормонов. Аутоиммунные заболевания чаще встречаются и более тяжело протекают у женщин.
78
ИНДУКЦИЯ АУТОРЕАКТИВНОСТИ
Вирусы, особенно распространяющиеся почкованием (рис. 20, 26), связываются с молекулами ГКГС класса I, и этот комплекс распознаётся цитотоксическими Т-лимфоцитами. Другие вирусы, например, гриппа, присоединяясь к эритроцитам, способны запускать аутоантителообразование.
Лекарственные препараты часто связываются с клетками крови непосредственно (например, седормид с тромбоцитами, пенициллин с эритроцитами) или в комплексе с антителами (например, хинидин). В случае с альфа-метилдофа антитела направлены к клеточным антигенам, обычно к резус-антигенам групп крови, к которым особенно нестабильна В-клеточ-ная толерантность.
Перекрёстно реагирующие антигены, т.е. общие антигенные детерминанты микроорганизма и хозяина, могут стимулировать Т-хелперы для молчащих аутореактивных В-клеток (например, патология сердца при стрептококковой инфекции, бо-лезнь Чагаса). Изучение компьютерных баз данных белковых последовательностей подтверждает, что многие аутоантигены имеют общие с вирусами и бактериями последовательности аминокислот и, следовательно, аномальный ответ на инфекцию может быть важным пусковым механизмом для многих аутоим-мунных заболеваний.
Перекрёстно реагирующие идиотипы. Идея основана на демонстрации существования идиотипспецифических Т-хелпе-ров и общего идиотипа у антител разной специфичности. Этим можно объяснить существование при некоторых инфекциях (например, микоплазмозе) аутоантител, не реагирующих с организмом.
Поздно появившиеся (сперма) или секвестрированные (белок хрусталика) антигены впервые контактируют с лимфоцитами только после повреждения содержащего их органа (травма глаза, воспаление яичка при эпидемическом паротите) и воспри-нимаются как «чужие».
Аномальное представление антигена может наблюдаться, если в результате вирусной инфекции на поверхности нормальных тканевых клеток появляются молекулы ГКГС класса II. Наиболее изучен в этом отношении тиреоидит. Пусковым фактором в экспрессии молекул класса II может быть ИФ-гамма.
Поликлональная активация, в том числе аутоиммунных В-лимфоцитов, может происходить под действием многочисленных микробных продуктов (эндотоксины, ДНК и др.). Вирус Эпстайна-Барр заражает непосредственно В-лимфоциты и делает их длительно пролиферирующими.
Недостаточность регуляции хотя наглядна, но труднодока-зуема. Выяснено, что при системной красной волчанке ослаблена супрессорная функция Т-клеток.
АУТОИММУННЫЕ БОЛЕЗНИ
Аутоантитела обнаружены при многих болезненных состояни-ях скорее как реальность, чем как причина (например, кардио-липиновые антитела при сифилисе). Ниже перечислены некоторые болезни, при которых аутоантитела играют основную роль в патологическом процессе.
Гемолитическая анемия и тромбоцитопения. Обычно иди-опатической природы, но может быть вызвана лекарственными препаратами. Степень деструкции клеток не всегда пропорциональна уровню аутоантител, что заставляет предположить наличие других пусковых факторов патологического процесса.
Тиреоидит. Аутоиммунную природу заболевания можно считать установленной. Может развиться в результате стимуляции (тиреотоксикоз) антителами к рецепторам гипофизарного тиреотропина или подавления (микседема) клеток, возможно, опосредуемого К-клетками и аутоантителами. Во многих случаях наблюдается аномальная экспрессия HLA-DR (класс II) антигенов на клетках щитовидной железы.
Пернициозная анемия развивается в результате дефицита внутреннего фактора желудка — нормального переносчика витамина B12. Дефицит может быть вызван аутоиммунным разрушением обкладочных клеток (атрофический гастрит) или аутоантителами непосредственно к внутреннему фактору.
Диабет, болезнь Аддисона (гипофункция надпочечников) и другие эндокринные заболевания часто возникают у одного больного или в семьях, что указывает на генетическую предрасположенность к ним. Основные повреждения вызываются главным образом Т-лимфоцитами.
Злокачественная миастения характеризуется перемежающимися дисфункциями нервно-мышечной трансмиссии, которая связана с аутоантителами, разрушающими постсинаптические рецепторы к ацетилхолину. Заболевание часто сопровождается аномалиями тимуса. Тимэктомия может дать положительный эффект, но его природа неясна.
Ревматоидный артрит характеризуется присутствием аутоантител к IgG, с которыми может быть связано развитие заболевания (ревматоидный фактор). Повреждение суставов, возможно, опосредуется иммунными комплексами и цитокинами. При этом и некоторых других аутоиммунных заболеваниях выявлена сильная связь с антигенами ГКГС, особенно D-локуса (DR3 и DR4), что указывает на ведущую роль Т-хелперов в развитии таких болезней. Нарушение гликолизирования молекул иммуноглобулинов наблюдается при этом и некоторых других заболеваниях.
Системная красная волчанка (СКВ). При СКВ аутоантитела направлены к ДНК и РНК, и отложение образовавшихся иммунных комплексов широко распространено в кровеносной системе, что позволяет определить это аутоиммунное заболевание как органонеспецифическое. Вероятно, органоспецифичес-кая (см. выше) и органонеспецифическая патология развивается совместно. Не совсем ясно, почему различные иммунные комплексы повреждают разные органы. Наиболее вероятно, что локализующую роль играет сам антиген.
79
37. ОТТОРЖЕНИЕ ТРАНСПЛАНТАТА
Успех пересадки органов между идентичными (сингенны-ми*) близнецами и отторжение во всех других случаях отражают удивительную способность иммунного распознавания поверхностных клеточных антигенов особей внутри вида. Это связано со специализацией Т-клеток в отношении определения изменённых антигенов ГКГС (рис. 18, 20), от чего зависит адаптивный ответ, и с огромным полиморфизмом в системе ГКГС (рис. 13). Возможно, при контакте с «не своими» молекулами ГКГС Т-клетки могут путать их со «своими» + антиген и в большинстве случаев, возможно, со «своими» + вирус, что было показано в экспериментах на мышах. Возможно, высокий полиморфизм ГКГС, т.е. большее разнообразие «своих» антигенов у вида, оставляет вирусу меньше шансов быть незамеченным и поразить весь вид. Это объяснение хуже подходит к антигенам групп крови и слабым антигенам гистосовместимости, но они и менее антигенны и полиморфны (например, 6 фенотипов АВО в сравнении с 1012 ГКГС). Это, впрочем, не отменяет проблемы совместимости по антигенам эритроцитов (групп крови) при трансфузиях, где действуют только антитела.
*Сингенный трансплантат — пересадка между генетически идентичными особями, аллотрансплантат (прежде — гомотрансплантат) — между неидентичными особями в пределах вида, ксенотрансплантат — между особями разных видов, аутотрансплантат— в пределах организма.
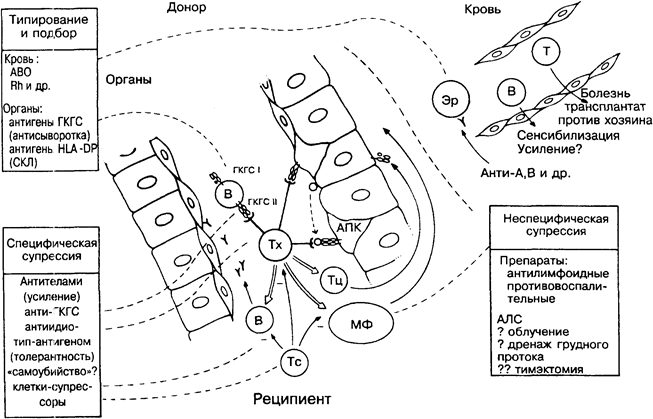
В зависимости от мишени отторжение трансплантата может быть опосредовано Т- и/или В-клетками совместно с их неспецифическими эффекторными помощниками (комплемент, цитотоксические клетки, макрофаги и др.). Антитела поражают клетки, циркулирующие в крови, и реагируют с эндотелием сосудов, например, пересаженного органа (на рисунке в центре) и запускают воспаления типа III, а Т-клетки действуют на солидные ткани непосредственно или через макрофаги (тип IV). У несенсибилизированных реципиентов эти процессы проявляются не ранее чем через неделю. Это подтверждает то, что отторжение вызывается адаптивным, а не естественным иммунитетом.
В настоящее время успех пересадки органов основан на возможно более тщательном подборе донора и реципиента по антигенам ГКГС (родственники, особенно сибсы) и на подавлении иммунного ответа (внизу справа). Лучшим решением было бы развитие специфической толерантности к антигенам ГКГС (внизу слева), но это пока вопрос будущего (рис. 38).
80
ТИПИРОВАНИЕ И ПОДБОР
Для переливания крови важно соблюдать простой принцип: А-и/или В-антигены выявляются в реакции агглютинации со специфическими антисыворотками. Этот тест необходим при любых трансфузиях крови, поскольку здоровые люди имеют антитела именно к тем антигенам, которых у него нет. Типирование Rh (резус)-антигенов проводится для исключения сенсибилизации матери антигенами, которые может иметь ожидаемый ребёнок, так как несовместимость по Rh-антигенам приводит к тяжёлой гемолитической болезни плода. Совместимость по минорным антигенам имеет значение для сенсибилизированных реципиентов при повторных трансфузиях. К возможным негативным последствиям переливания крови относится сенсибилизация реципиента к антигенам ГКГС на В-лимфоцитах донора. У пациентов с тяжёлыми иммунодефицитами возможно развитие болезни трансплантат против хозяина (БТПХ), при которой Т-лимфоциты донора реагируют против антигенов реципиента. Это основное осложнение при пересадке костного мозга.
При пересадке других органов (например, почек) необходимо типирование донора и реципиента по антигенам не только АВО, но и ГКГС Типирование антигенов ГКГС проводится с помощью микроцитотоксического теста, в котором используются В-лимфоциты (единственно доступные клетки, несущие оба типа антигенов ГКГС), моноспецифическая сыворотка и комплемент. Антигены ГКГС класса II, кодируемые в DP-локусе, могут быть выявлены смешанной реакцией лимфоцитов. Стимуляция Т-клеток реципиента В-лимфоцитами донора означает положительный ответ, т.е. различие по антигенам ГКГС класса II. Приживление трансплантата почки зависит от того, насколько тщательно донор и реципиент подобраны по антигенам ГКГС, особенно класса II (HLA-DR). Положительные результаты дают пересадки между родственниками, что предполагает наличие дополнительных, минорных локусов гистосовместимости. Опыты на мышах полностью подтверждают это предположение.
ОТТОРЖЕНИЕ
Отторжение начинается с распознавания Т-хелперами изменённых «своих» антигенов ГКГС класса II. Это происходит при прямом контакте с донорскими В-лимфоцитами или собственными антигенпредставляющими клетками. Распознавание может приходить и обычным путём — через захват антигенов донора антигенпредставляющими клетками хозяина. После этого В-лимфоциты, цитотоксические Т-лимфоциты и макрофаги за-пускают иммунный процесс, и каким именно способом будет отторгнут трансплантат, зависит от его природы. Некоторые сведения об этом представлены ниже.
Почка. Отторжение трансплантата почки может быть немедленным при несовпадении по антигенам эритроцитов АВО или наличии предсуществующих HLA антител, острым (от недель до месяцев) в результате иммунного ответа или хроническим (месяцы и годы) в результате болезни иммунных комплексов. Интересно, что трансплантат успешно сохраняется, если пересадке предшествовало переливание крови. Возможно, сыворот-
ка донора стимулирует у реципиента синтез усиливающих (блокирующих) антител к антигенам ГКГС класса II.
Костный мозг. Трансплантат интенсивно отторгается, в связи с чем приживление требует мощной иммуносупрессивной терапии. Доказано, что в отторжении участвуют NK-клетки. Кроме того, если из костномозгового трансплантата предварительно не удалены Т-лимфоциты, то после пересадки развивается БТПХ.
Печень. Пересаженная печень вызывает слабые реакции отторжения и даже способна индуцировать определённую степень толерантности. Типирование HLA менее важно.
Эндокринные органы очень хорошо приживаются после удаления из них клеток, несущих антигены ГКГС класса II.
Кожа. Отторжение трансплантатов кожи осуществляется исключительно Т-лимфоцитами.
Роговица и хрящ, не имея кровоснабжения, не иммунизируют реципиента и обычно успешно приживаются (привилегированный трансплантат).
Нормальный плод не отторгается, возможно, при действии специфических клеток-супрессоров, хотя представляет собой явный аллогенный трансплантат. Это объясняют также действием блокирующих и иммуносупрессивных факторов сыворотки, особыми свойствами плаценты и трофобласта плода, но тем не менее до конца непонятно, почему плод не отторгается.
ИММУНОСУПРЕССИЯ (рис. 38)
Неспецифическая супрессия. В послеоперационном периоде рекомендовано применение цитотоксических препаратов и циклоспорина А, супрессирующих деление лимфоцитов, вместе со стероидами в качестве противовоспалительных средств.
АЛС — антилимфоцитарная сыворотка. Иногда применяется, чтобы не повредить делящиеся нелимфоидные клетки (костного мозга, кишечника и других органов). В настоящее время применяют моноклональные антитела к СD4-антигену.
Дренаж грудного протока и тимэктомию иногда используют для удаления Т-лимфоцитов.
Облучение. Тотальное рентгеновское облучение оказывает мощное иммуносупрессирующее действие. При остром кризисе отторжения для удаления лимфоцитов применяют местное облучение (например, почек) или экстракорпоральное облучение крови.
Специфическая супрессия направлена на антигены, вызывающие ответ, или на рецепторы клеток, которые этот ответ опосреду-ют. Воздействие антителами может вызывать эффект усиления.
«Самоубийство» специфических Т- и В-лимфоцитов происходит in vitro при связывании ими антигена, конъюгированного с летальным радиоактивным изотопом или токсическим агентом.
Супрессорные клетки или антитела, мимикрирующие нормальный сетевой контроль, могут привести к устойчивой толерантности. В клинической практике применить этот метод пока не удаётся.
81
38. ИММУНОСУПРЕССИЯ
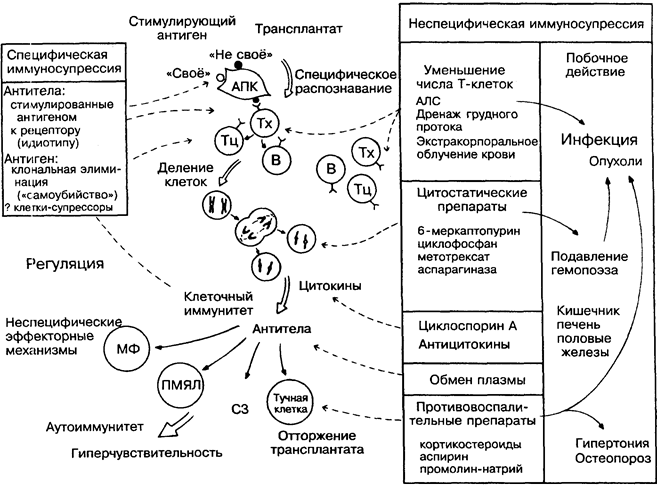
Супрессия иммунного ответа как неотъемлемая часть ведения больных после пересадки органа находит всё большее применение в лечении тяжёлых состояний гиперчувствитель-ности и аутоиммунитета. К сожалению, современные методы иммуносупрессии ещё далеки от специфичности и вызывают разнообразные побочные эффекты (на рисунке справа). Основная задача иммуносупрессивной терапии состоит в том, чтобы специфически подавить Т- и/или В-клетки и их эффекты, не нарушив другие жизненно важные функции.
Антилимфоцитарная сыворотка (АЛС) эффективно освобождает организм от циркулирующих лимфоцитов (в основном Т-клеток). Однако при этом удаляются и Т-лимфоциты, осуществляющие нормальный иммунный ответ, в частности, на инфекцию. Важной стадией иммунного ответа (в центре) является пролиферация лимфоцитов, поэтому лекарственные препараты, ингибирующие деление клеток, оказываются эффективными
иммунодепрессантами. Те же лекарства, давая хорошие результаты при лечении больных раком, подавляют рост разных тканей, например, костного мозга или эпителия кишечника. Третьей точкой приложения является подавление неспецифических эффекторных механизмов воспалительных процессов (нижняя часть рисунка). В то же время повреждаются нормальные защитные функции.
Ясно, что необходимы средства, направленные на антиген-специфические лимфоциты, подавляющие их функцию главным образом через поверхностные рецепторы (вверху слева). Один из подходов — применение специфических антигенов, вызывающих «самоубийство» лимфоцитов за счёт токсических факторов, входящих в конъюгат с антигеном, реагирующим со специфическим рецептором. Экспериментальные результаты подтверждают возможность такого метода иммуносупрессии.
82
Дата: 2018-12-28, просмотров: 432.