Самый характерный пример — нарколепсия, наблюдаемая только у носителей DR2 антигена; впрочем, причины этого неизвестны. Интересны также артропатии крестцово-подвздошного сустава (анкилозирующий спондилит, болезнь Рейтера и др.), при которых HLA B27 аллель наблюдается в 95% случаев, т.е. почти в 20 раз чаще, чем обычно. Достаточно убедительно доказана связь многих других заболеваний, в том числе почти всех аутоиммунных, с частными антигенами или группами антигенов HLA (чаще всего D-области). Вероятнее всего, это объясняется различием в способности разных молекул HLA представлять микробные полипептиды или «свои» антигены. Возможно, имеется связь с генами других областей, особенно класса III. Тенденция некоторых HLA аллелей (например, А1 и В8) не разделяться, а оставаться сцепленными, называется неравновесным сцеплением. Возможно, такие комбинации являются жизненно важными, так как с ними может быть связана повышенная устойчивость к заболеванию или, напротив, повышенная чувствительность к нему. Вся эта область предоставляет широчайший простор для исследований.
33
14. Т-КЛЕТОЧНЫЙ РЕЦЕПТОР
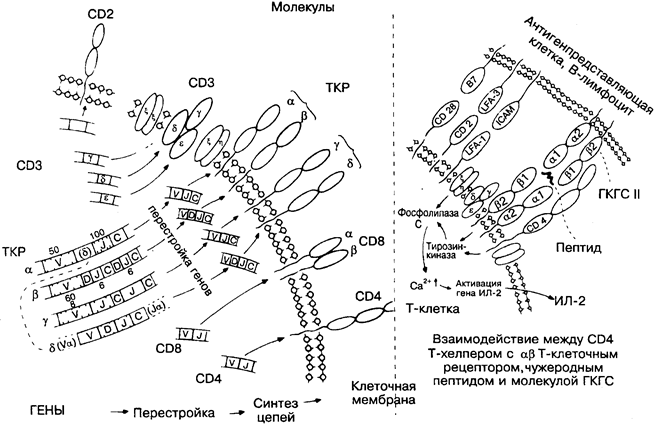
Многие годы в иммунологии существовала ситуация, когда было известно, что Т-лимфоциты имеют на поверхности рецептор для антигена, сходный с антителами на В-лимфоцитах, но было неясно, насколько идентичны эти молекулы. Вопрос был снят в 1983-1984 гг., когда применение моноклональных антител и ДНК-зондов позволило точно установить, что и на молекулярном, и на генетическом уровне Т-клеточный рецептор уникален.
Рецептор Т-лимфоцита имеет характерную для суперсемейства иммуноглобулинов структуру, а именно состоящие из доменов полипептидные цепи, соединённые дисульфидными связями. Молекула рецептора имеет 2 основные цепи (альфа, бетта или, в отдельных случаях, гамма, дельта), состоящие из 2 доменов каждая. Кроме того, во взаимодействии Т-лимфоцита с молекулами ГКГС уча-сгвуют молекулы CD3, CD4 и CD8. В правой части рисунка представлен процесс распознавания Т-хелпером чужого антигена в ассоциации с молекулой ГКГС. Сведения об этом процессе постоянно пополняются новыми данными. Особенно эф-
фективно в этом отношении тестирование последствий генетического удаления («нокаутирование» гена) индивидуальных компонентов различных молекул, показанных на рисунке.
Необычность рецепторных белков состоит в том, что кодирующие их гены расположены на хромосоме не рядом, а через некоторые промежутки и для совмещения соответствующих генов происходит вырезание лежащих между ними сегментов ДНК, а потом РНК. Этот процесс, известный как перестройка генов, происходит только в Т-лимфоцитах, тогда как во всех других клетках гены остаются в нефункциональном состоянии зародышевой линии. Перестройка генов наблюдается в индивидуальном Т-лимфоците, что обеспечивает ему уникальный рецептор и как следствие уникальную антигенраспознающую способность. Аналогичный процесс происходит с генами иммуноглобулинов В-клеток (рис. 15). На этом и следующем рисунке серым цветом выделены участки генов и белков, которые, как считается, произошли из примитивного У(вариабельного)-региона (рис. 12), хотя и проявляют разную степень вариабельности.
34
ТКР — Т-клеточный рецептор. Состоит из одной альфа- (м. м. 50 000) и одной бетта- (м. м. 45 000) цепи, каждая из которых имеет внешний (вариабельный) и внутренний (константный) домены, внутримембранный и цитоплазматический короткий участки. На ранней стадии эмбрионального развития, а также в некоторых органах (кишечник, кожа) Т-лимфоциты могут иметь альтернативные рецепторы с гамма- дельта-цепями и распознавать иные антигены по сравнению с альфа- бетта Т-лимфоцитами. На рис. 10 даны происходящие в тимусе процессы позитивной и негативной селекции, в результате чего развиваются индивидуальные Т-лимфоциты, распознающие собственные молекулы ГКГС вместе с чужеродным пептидом.
CD3 — молекулярный комплекс, состоящий из 3 цепей: гамма (м. м. 25 000), 5 (м. м. 20 000) и эпсилон (м. м. 20 000), который играет существенную роль во всех функциях Т-клеток. Т-клеточный рецептор, CD3 и сигнальные двухцепочечные молекулы (кси кси и кси эта) вместе образуют комплекс, взаимодействующий с антигеном (молекула ГКГС плюс пептид). Это взаимодействие ведёт к активации клетки по крайней мере через два внутриклеточных процесса, задействующих тирозинкиназу и фосфолипазу С, что в конечном счёте приводит к пролиферации клетки и высвобождению цитокинов.
CD4 — одноцепочечная поверхностная молекула (м. м. 60 000) Т-хелпера, участвующая в его взаимодействии с молекулами ГКГС класса II. CD4 является рецептором, через который ВИЧ проникает в Т-клетку (рис. 40).
CD8 — поверхностная молекула большинства цитотоксичес-ких Т-лимфоцитов, участвующая во взаимодействии с молекулами ГКГС класса I. CD8 человека состоит из 2 одинаковых цепей, ее мышиный аналог — из 2 разных (Ly 2/3).
Подчеркивая тесную связь с Т-клеточным рецептором, молекулы CD4 и CD8 иногда называют корецепторами.
CD2, CD28, LFA-1 — три из многих адгезивных молекул, поддерживающие контакт Т-лимфоцита с антигенпредставляю-щими клетками или В-лимфоцитами (рис. 12). Особую роль играет молекула CD28, распознающая молекулу В7 как существенный костимулятор Т-клеточной активации. Считается, что в отсутствие костимуляции Т-клетка приобретает состояние неотвечаемости, которое может быть важным при развитии ауто-реактивности.
Перестройка генов. Гены ТКР содержат до 100 V-генов и множество J-генов. Для формирования отдельной цепи необходимо, чтобы по одном гену из них соединялось с С-геном. Это осуществляется вырезанием лежащих между ними сегментов ДНК. Подобный же процесс в информационной РНК заканчивается созданием конечной VDJC РНК, кодирующей полипептидную цепь. С учётом всех возможных комбинаций альфа- и бетта-цепей общее число различающихся молекул ТКР в организме может достигать 1010. CD4- и CD8-гены хотя и имеют явное V-генное происхождение, не перестраиваются и кодируемые ими молекулы не обладают таким разнообразием.
Антиген. В случае, представленном на рисунке, антиген в виде короткого пептида распознаётся молекулой ГКГС класса II и Т-клеточным рецептором (рис. 17). Достаточно полное распознавание с вовлечением взаимодействия CD4—молекула ГКГС класса II приводит к изменению молекулы CD3, в результате чего возрастает уровень внутриклеточного кальция и, возможно, других ионов. Т-лимфоцит активируется для выполнения своих запрограммированных функций. В случае активации цитотоксического Т-лимфоцита молекула CD8 связывается с молекулой ГКГС класса I, присутствующей на клетке-мишени.
ИЛ-2 — интерлейкин-2. Лимфокин, необходимый для начальной пролиферации Т-клеток, также действует на В-клетки, макрофаги, эозинофилы и др. (рис. 23). Зависимость между природой активирующего сигнала и разновидностью синтезируемого цитокина пока не совсем ясна. Эксперименты с клонируемыми Т-клетками, особенно на мышах, дают основания для заключения, что некоторые CD4 Т-клетки (Т-хелперы типа 1) продуцируют главным образом ИФ-7 и другие цитокины, активирующие макрофаги, хотя клоны других CD4 Т-клеток (Т-хелперы типа 2) преимущественно вырабатывают факторы, помогающие в антителопродукции (ИЛ-4, ИЛ-5, ИЛ-6 и др.). В настоящее время такое разграничение функций CD4 Т-клеток наблюдается у человека.
Суперантигены. Имеется одно исключение в очень высокой специфичности взаимодействия Т-клетка—пептид—ГКГС. Некоторые вирусы и стафилококковые энтеротоксины обладают способностью связываться с бетта-цепью ТКР и молекулой ГКГС класса II вне пептидсвязывающего участка. В результате активируется не единственный клон Т-лимфоцитов, а целое семейство клонов, что приводит к повышенной продукции цитокинов с возможными повреждающими эффектами.
35
15. СИНТЕЗ И МНОГООБРАЗИЕ АНТИТЕЛ
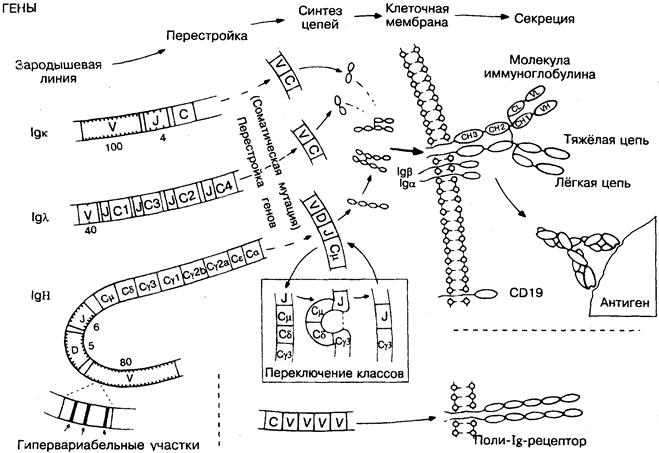
В отличие от молекул ГКГС и Т-клеточных рецепторов, антитела, т.е. молекулы иммуноглобулинов, известны уже очень давно. С момента определения их структуры прошло почти 30 дет — достаточно времени, чтобы они стали едва ли не самыми изученными молекулами в биологии.
Типичная молекула иммуноглобулина (Ig) имеет несколько более сложную структуру, чем Т-клеточные рецепторы или молекулы ГКГС, и состоит из 2 лёгких и 2 тяжёлых цепей (рис. 16). Каждая цепь имеет константные и вариабельные участки, характеризующие специализацию и специфичность молекулы. Различия в константных участках тяжёлых цепей позволяют разделить молекулы Ig на классы и подклассы с различными биологическими функциями. Вариабельные области оп-
ределяют специфичность антигенсвязывающего центра молекулы.
При кодировании антител гены для тяжёлых и лёгких цепей совмещаются в В-лимфоците аналогично генам Т-клеточных рецепторов: перестройка генов на уровне ДНК и вырезка сегментов информационной РНК. Существенное отличие состоит в том, что для В-клеток возможны последующие соматические мутации вариабельных областей, исключённые в случае Т-клеток. После перестройки полипептидные цепи синтезируются на рибосомах наравне с другими белками, собираются и транспортируются либо на клеточную поверхность, где они выполняют функции В-клеточных рецепторов, либо в кровь, где они выполняют функции антител.
36
Ig. К иммуноглобулинам относят все глобулины, проявляющие активность антител. Старое обозначение «гамма-глобулин» оказалось не совсем удачным, так как не все антитела обладают гамма-электрофоретической подвижностью.
IgK, IgU, IgH — 3 генных локуса, распложенных на разных хромосомах. Кодируют лёгкие (к, лямбда) и тяжёлую (Н) цепи молекулы иммуноглобулина. Типичная молекула иммуноглобулина состоит из 2 Н-цепей и 2 L-цепей (обе лямбда- или обе к-цепи).
Зародышевая линия — все гены, участвующие в постепенном превращении первичных половых клеток в гаметы. Мутации и другие генетические изменения этих генов наследуются и предоставляют материал для естественного отбора. Изменения в генах любых других клеток (не половых) называются соматическими и потомству не передаются. Изменения ДНК В-лимфоцитов, вызывающие появление новой молекулы Ig, относятся именно к соматическим мутациям. Гены зародышевой линии обязательно присутствуют в ДНК, и многие из них кодируют антитела к распространённым бактериям. Возможно, бактериальные инфекции были одним из главных стимулов эволюции антител.
V — гены вариабельной области. Количество вариантов этих генов колеблется от 2 (лямбда-цепь мыши) до 350 (к-цепь мыши; на рисунке представлены гены человека). Наибольшее разнообразие наблюдается в 3 коротких гипервариабельных областях, кодирующих аминокислоты антигенсвязывающего участка молекулы.
С — гены константной области. Кодируют единственный домен лёгкой и 3 или 4 домена тяжёлой цепи (СН1, 2, 3, 4). В зависимости от того, какой из 8 (у мыши) или 9 (у человека) генов С-области используется В-лимфоцитом, синтезированная молекула Ig будет принадлежать к различным классам и подклассам (IgM, IgG и др.; рис. 16).
J — гены соединительной области. Кодируют короткий J-фрагмент антитела. Интересно, что Н- и к-цепи кодируются J-генами, расположенными рядом, а в случае лямбда-цепи каждый С-ген имеет соответствующий ему J-генный фрагмент. У примитивных позвоночных повторы VJC-сегментов значительно снижают число возможных комбинаций.
D — гены D-области. Обнаружены только в IgH-генах, за счёт которых получается дополнительная гипервариабельность.
Перестройка генов — процесс, аналогичный перестройке генов ТКР в Т-лимфоците. Сначала вырезаются сегменты ДНК (интроны), лежащие между V- и J- (и D- для IgH)-генами, и отдельные V-, J- (D)-генные сегменты совмещаются. После их транскрипции на РНК уже из неё вырезается участок между V(D)J-ceгментом и С-областью. Образовавшаяся информационная РНК кодирует полную V(D)JC-цепь антител.
Переключение классов иммуноглобулинов — процесс дальнейшего вырезания сегментов ДНК в индивидуальных В-клетках, позволяющий одному и тому же сегменту VDJ присоединяться к разным С-генам. Образующиеся в результате различных соединений антитела имеют одинаковую специфичность, но разные константные участки, что определяет разные свойства антител. Переключение на продуцирование того или иного класса или подкласса антител зависит от выделяемых Т-клетками цитокинов. ИЛ-4 стимулирует синтез IgE, ИЛ-5 — синтез IgA, ИФ-гамма — синтез IgG3 и т.д. (примеры опытов на мышах).
CD19. Связывание молекулы CD19 — необходимое условие активации В-клетки. Таким образом, CD19, аналогично молекулам CD4, CD8 и CD28 Т-лимфоцита, выполняет функцию корецептора В-лимфоцита. Обнаруженный на В-клетках рецептор к комплементу CR2 — ещё один корецептор В-клеточной активации.
Молекула CD19 — надёжный маркёр В-лимфоцитов, так как не экспрессируется на клетках других типов.
Поли-Ig-рецептор — молекула, обнаруженная на секреторных клетках эпителия. Способствует перемещению Ig в секреты (например, слизь, молоко, желчь). Состоит из V-подобных доменов, что ещё раз иллюстрирует многофункциональность суперсемейства иммуноглобулинов.
Происхождение разнообразия. Огромное число антител разной специфичности объясняется 4 факторами: 1) в результате перестройки могут быть соединены любые V-, D- и J-генные сегменты; 2) тяжёлая цепь может соединяться с лёгкой к- или лямбда-цепями; 3) соединения V-D и D-J не всегда находятся точно на одном месте; 4) в V-генах отдельной В-клетки могут происходить случайные соматические мутации, вызывающие небольшие изменения активного центра молекулы. Иногда такие изменения приводят к повышенному аффинитету антител для антигена. Трудно точно определить число различных анти-генсвязывающих участков, получаемых при комбинации всех 4 факторов, но, возможно, оно превышает 108.
Важно, что разнообразие в ГКГС формируется совершенно иными путями. Особь имеет лишь один или два аллельных варианта каждого гена. Таким образом, особи разных видов отличаются друг от друга в большей степени по генам и молекулам ГКГС, чем по В- и Т-клеточным рецепторам.
Iga, Igp — молекулы, образующие связь между клеточно-по-верхностными Ig и внутриклеточными сигнальными путями активации по аналогии CD3 на Т-клетках.
37
16. СТРУКТУРА И ФУНКЦИИ АНТИТЕЛ
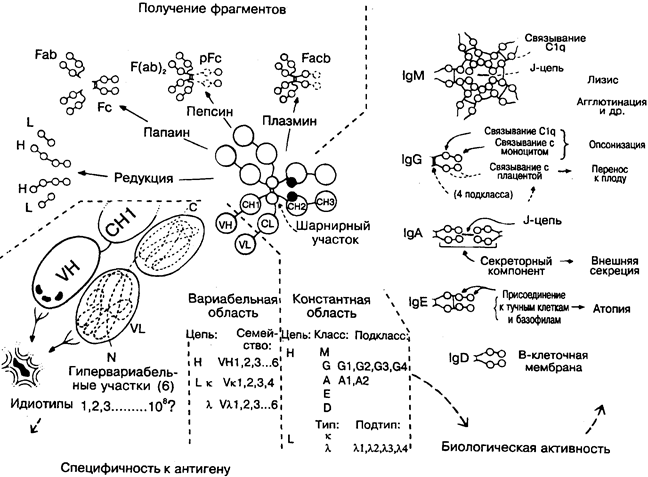
Учитывая, что антитела в сыворотке являются смесью около 100 млн мало различающихся типов молекул, легко представить, что изучение их структуры было очень нелёгкой задачей. Первым шагом в этой области было химическое расщепление молекул антител на фрагменты (на рисунке вверху слева). Более совершенные методы, такие как секвенирование аминокислотных последовательностей и рентгенокристаллография, основывались на применении полностью гомогенных (моноклональных) антител. Раньше их можно было получить в форме миеломных белков, продуцируемых опухолевыми В-лимфоцитами. С появлением метода гибридом (рис. 9) стало возможным получать моноклональные антитела разной специфичности в неограниченных количествах.
Типичная молекула антитела (IgG) состоит из 12 расположенных попарно доменов, образующих 2 лёгкие (L) и 2 тяжёлые (Н) цепи, сшитые через цистеиновые остатки дисульфидными связями. Молекула имеет гибкую структуру, напоминающую по конфигурации букву Y. В каждой цепи М-концевые домены наиболее вариабельные, остальные относительно константные. Типичная молекула IgG имеет 2 антигенсвязывающих (активных) центра, каждый из которых образован 6 (по 3 на каждой цепи) гипервариабельными участками вариабельной(V)-области
(слева на рисунке). В этих участках наблюдается максимум вариаций аминокислотных последовательностей. В константной (С) области варьируют в основном участки, взаимодействующие с комплементом или различными клеточными рецепторами. В правой части рисунка схематично показаны константные области 5 классов антител Ig — М, G, А, Е и D. Сочетания различных V- и С-областей дают огромное количество молекул, способных запустить любой из имеющихся эффекторных механизмов против любого антигена. Основная структура (типа IgG; м. м. около 160000) может образовывать димеры (IgA;
м. м. 400 000) или пентамеры (IgM; м. м. 900 000).
Существуют сравнительно недавно эволюционно сформировавшиеся межвидовые различия, особенно в подклассах тяжёлых цепей (на рисунке представлены примеры для Ig человека). В последнее время все больше внимания уделяется боковым углеводным цепям, составляющим иногда до 12% всей молекулы. Возможно, с ними связана секреция молекул. Выявлено их нарушение при некоторых заболеваниях. На рисунке молекула Ig изображена крайне схематично. На самом деле она имеет трёхмерную конфигурацию, что показано на примере связывания с антигеном в правой верхней части рис. 16.
38
Фрагменты, полученные при химической обработке молекул Ig:
Н, L: тяжёлые и лёгкие цепи, которые связаны только ди-сульфидными связями и легко разделяются под действием восстановителя.
Fab: интигенсвязывающий фрагмент (расщепление папаи-ном и.ельной молекулы).
Fc: кристаллизуемый относительно гомогенный фрагмент (расцепление папаином).
F(ab)2: два Fab-фрагмента, объединённых дисульфидными связями (расщепление пепсином). pFc: димер из СНЗ-доменов (расщепление пепсином). Facb: молекула Ig без СНЗ-доменов (расщепление плазми-ном).
Цепи. Хотя тяжёлые (Н) и лёгкие (лямбда, к) цепи кодируются генами разных хромосом, гомология последовательностей подтверждает, что все Ig-домены произошли от общей молекулы-предшественницы длиной около 110 аминокислот (рис. 12).
Классы. Физические, антигенные и функциональные различия между константными областями определяют 5 основных классов тяжёлых цепей — М, G, А, Е и D и соответствующие им 5 классов иммуноглобулинов. У большинства высших биологических видов присутствуют антитела всех 5 классов.
IgM. В процессе эволюции антитела класса IgM появились первыми. Они же первыми синтезируются в ответ на первичную антигенную стимуляцию (рис. 3). Так как они имеют пен-тамерную структуру с 10 активными центрами, то они эффективны в связывании и агглютинации микроорганизмов.
IgG — антитела класса IgG при иммунном ответе появляются в сыворотке вслед за IgM. Обладают способностью активно связываться своим Fc-участком с Clq (рис. 5) и рецепторами фагоцитов (рис. 8). Поступают во внесосудистые пространства и (через плаценту) к плоду. Большинство биологических видов имеют несколько подклассов IgG (см. ниже).
IgA — основные антитела, содержащиеся в секрете (слюна, пот), в лёгких, кишечнике, моче. Имеют дополнительную структуру — секреторный компонент, предохраняющий молекулу антитела от расщепления. Основная функция IgA — предотвращать проникновение антигенов с внешних поверхностей в ткани.
IgE способны через Fc-фрагмент связываться с тучными клетками и стимулировать их дегрануляцию (рис. 33).
IgD действуют на поверхности В-клеток, выполняя регулирующие функции. IgD мыши вместо 3 константных областей тяжёлой цепи имеет только 2.
Подклассы, подтипы. Небольшие вариации в константных областях колекул одного класса определяют подклассы антител. Больше всего их у IgG. Варианты константных областей лёгких цепей иногда обозначают как подтипы. Эти варианты, присутствующие у всех представителей данного вида, называются изотипами. Различные антигены вызывают синтез раз
личных подклассов IgG (например, у человека вирусы стимулируют синтез IgGI и IgG3, полисахариды — синтез IgG2), однако природа этой связи ещё неизвестна.
Аллотипы. Варианты иммуноглобулиновых молекул между отдельными представителями вида называются аллотипами. Они генетически детерминированы, возможно, регулируются генетическими факторами и связаны главным образом с С-областями. Их биологические функции пока точно не установлены. В отличие от групп крови, аллотипические детерминанты присущи отдельным В-клеткам. Закон аллельного исключения обеспечивает возможность экспрессии только одного аллотипа (алле-ля) Ig на отдельной В-клетке. Это означает, что для синтеза антител используется только один из двух наборов хромосом клетки, вероятно, тот, в котором раньше осуществилась успешная перестройка генов.
Гипервариабельные области — 6 участков вариабельных областей тяжёлой и лёгкой цепей (по 3 на каждой), приблизительно равные по аминокислотному набору (нижняя левая часть рисунка). При свёртывании молекулы в (3-складчатую структуру сближаются и образуют антигенсвязывающий центр. Разнообразие антигенсвязывающих участков обеспечивается за счёт огромной вариабельности кодирующих участков ДНК и необычайной подверженности генов гипервариабельных областей соматическим мутациям. Сходные последовательности позволяют объединять V-гены в семейства.
Идиотипы. Антигенсвязывающий участок одной молекулы антитела может быть распознан и связан другой антительной молекулой. В этом случае они называются соответственно идио-типическими и антиидиотипическими антителами. Антиидиоти-пические антитела присоединяются примерно к тому же участку гипервариабельной области, что и антиген. Антиидиотипичес-кие антитела образуются в норме и могут участвовать в регуляции иммунного ответа (рис. 22).
Шарнирный участок. За счёт повторных пролиновых остатков в этом участке молекулы обеспечиваются гибкость и чувствительность к протеолитическому расщеплению. В IgM шарнирный участок имеет размеры нормального домена и обозначается СН2. Два других константных домена обозначаются СНЗ и СН4. То же присуще молекуле IgE.
J-цепь — гликопептидная молекула, обеспечивающая полимеризацию IgA и IgM.
Секреторный компонент — полипептид, происходящий из поли-Ig-рецептора (рис. 15) и включаемый в структуру IgA в эпителиальных клетках, что обеспечивает транспорт через эпителий и секрецию в кишечник, слюну, слёзную жидкость, молоко и др., где IgA является преобладающим.
Clq — первый компонент классического пути активации комплемента. Шестивалентный гликопротеин, активируемый при связывании с СН2-доменом IgM и IgG некоторых подклассов (у человека IgGI и IgG3) (рис. 5).
39
17. РАСПОЗНАВАНИЕ И ПЕРЕРАБОТКА АНТИГЕНА
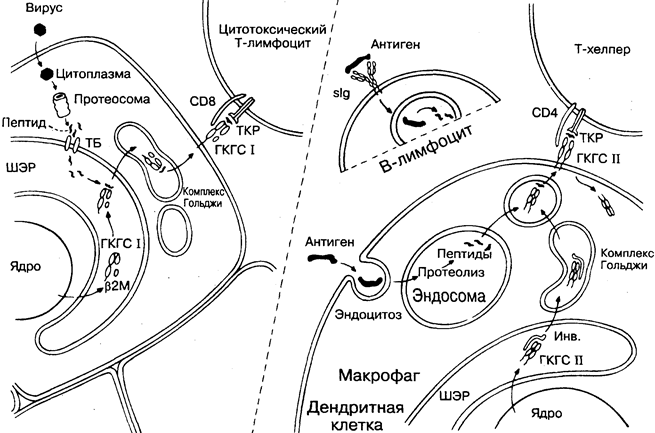
В разделе 14 упоминался чужеродный пептид, который связывается молекулами ГКГС и распознаётся Т-клеточными рецепторами. Одним из достижений современной иммунологии стало выяснение механизмов, лежащих в основе образования и взаимодействия этого пептида с молекулами ГКГС. На рисунке приведены два различных процесса, названных как «путь класса I» (слева) и «путь класса II» (справа).
Первое доказательство того, что ГКГС вовлечён в представление антигена Т-клеткам, продемонстрировано феноменом рестрикции (ограничения) по ГКГС. Оказалось, что Т-лимфоцит, специфичный к антигену и ГКГС, распознаёт одновременно обе молекулы. Позже было установлено, что цитотоксическая Т-клетка реагирует на ядерные антигены вируса, не проявляющиеся на поверхности вируса. Как может Т-клетка «видеть» такие хорошо скрытые антигены?
Ответ даётся в левой половине рисунка.
Пептиды, происходящие из вируса, связываются с молекулой ГКГС класса I внутри клетки, и затем комплекс транспортируется на поверхность клетки, где Т-клетка распознаёт комбинацию пептид—молекула ГКГС и при соответствующих усло-
виях убивает клетку, инфицированную вирусом (более подробно см. рис. 20).
В то же время установлено, что подобный процесс происходит в профессиональных антигенпредставляющих клетках, которые активируют Т-хелперы, с тем отличием, что они содержат молекулы ГКГС класса II, транспортирующие пептиды на поверхность клетки (правая половина рисунка). В отличие от пути класса I данный процесс происходит в эндосомально-лизосомальных вакуолях, в которых нормально расщепляется чужеродный материал (рис. 8).
Недавно показано, что В-лимфоциты, получающие Т-клеточную помощь, также способны перерабатывать и представлять антиген, но лишь в тех случаях, когда он поступает внутрь клетки через её поверхностные иммуноглобулины (рис. 18). Таким образом, главная функция молекул ГКГС состоит в транспортировке на клеточную поверхность фрагментов внутриклеточных белков. Т-лимфоциты распознают пептиды и в случае их чужеродности пролиферируют в клоны и оказывают помощь макрофагам или В-лимфоцитам или разрушают заражённые вирусом клетки (более подробно см. последующие рисунки).
40
ПУТЬ КЛАССА I
Вирус. Синтезируемые в клетке вирусные белки находятся в цитоплазме наряду со «своими» белками.
ШЭР — шероховатый эндоплазматический ретикулум, синтезирующий белки, в том числе и молекулы ГКГС.
ГКГС I - молекула ГКГС класса I, состоящая из бетта2-микроглобулина и единственной альфа-цепи с 3 доменами. Полностью устойчивой становится только после связывания пептида (см. ниже).
Протеосома — цилиндрический комплекс протеолитических ферментов, способных расщеплять белки на короткие пептиды.
ТБ — двухцепочечный транспортный белок, доставляющий пептиды из цитоплазмы в ШЭР.
Пептиды — обычно последовательность 8-10 аминокислот. Связывание с молекулой ГКГС обеспечивается концевыми аминокислотами пептида, проникающими в желобок между первым и вторым доменом а-цепи молекулы ГКГС класса I. Эта связь имеет высокий аффинитет, но не так специфична, как для антитела и ТКР. Таким образом, 6 различных типов молекул ГКГС класса I (рис. 13), присутствующих на каждой клетке, способны связывать широкий спектр пептидов, в том числе полученных из «своих» белков.
Комплекс Гольджи — органоид, ответственный за дальнейшую транспортировку белков из ШЭР в другие участки, включая поверхность клетки, где комплекс ГКГС—пептид становится доступным для соответствующих Т-лимфоцитов.
ТКР — Т-клеточный рецептор. Селекция, происходящая в тимусе (рис. 10), обеспечивает возможность активации только тех лимфоцитов, рецепторы которых распознают и пептид, и молекулу ГКГС. Это высокоспецифическое взаимодействие обеспечивает сохранность клеток, на которых экспрессированы только «свои» пептиды.
CD8 — молекула на поверхности цитотоксических Т-лимфоцитов. Распознаёт молекулу ГКГС класса I, что необходимо до того, как цитотоксическая Т-клетка убьёт клетку, инфицированную вирусом.
ПУТЬ КЛАССА II
Антиген. Любой чужеродный материал, захваченный в результате фагоцитоза и эндоцитоза, попадает в вакуоли эндоцитарного пути, или эндосомы, к которым относятся также кислые лизосомы. Различные протеолитические ферменты могут действовать при соответствующих значениях рН. При микробной инфекции цельный микроб подвергается разрушению в этих условиях.
slg — поверхностный иммуноглобулин, с помощью которого В-лимфоциты связывают антиген, который затем подвергается эндоцитозу.
ГКГС II — молекула ГКГС класса II. Состоит из двух цепей, образующих между концевыми доменами альфа1- и бетта1-цепей пептидсвязывающий желобок. Наибольшая специфичность связана с бетта-цепью. В процессе синтеза молекулы связывание предупреждается специальным белком, названным инвариабельной цепью (на рисунке — Инв.), которая впоследствии отделяется и заменяется продуцируемыми пептидами в эндосомах.
Пептиды. Молекулы ГКГС класса II способны присоединять пептиды длиной до 20 аминокислот, в том числе происходящие из микробов в эндосомах и «свои» пептиды (многие их которых происходят из самих молекул ГКГС).
CD4 — корецептор, взаимодействующий с молекулой ГКГС класса II. Экспрессирован на Т-хелперах, взаимодействует с В-лимфоцитами или макрофагами.
Таким образом, тип Т-клеточного ответа определяется следующими факторами: 1) тип Т-клетки — CD8 цитотоксический или CD4 хелпер; 2) класс молекулы ГКГС — 1 или II; 3) цитоплазматическое или эндосомальное происхождение пептида, связываемого молекулой ГКГС; 4) инфекция — вирусная или микробная. Существуют, конечно, и исключения (рис. 26-29).
41
18. ГУМОРАЛЬНЫЙ ИММУННЫЙ ОТВЕТ
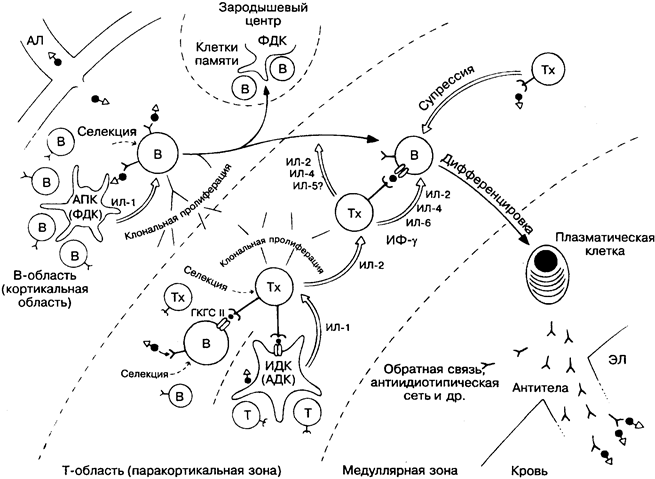
Животные, которые родились и выращивались в безмикробных условиях, практически не содержат иммуноглобулинов в сыворотке, но уровень их быстро достигает обычных показателей (10-20 мг/мл, или 6-1016 молекул) сразу после создания нормального микробного окружения. Это показывает, что антитела синтезируются только в ответ на стимуляцию чужеродными антигенами. Процесс известен как антительный ответ.
На рисунке схематично изображён срез лимфатического узла. Антиген поступает из тканей (слева вверху), и антитела освобождаются в кровь (справа внизу). Антиген составляет комбинацию из 2 детерминант (компонентов): гаптенной (черные кружки) и несущей (белые треугольники). В-лимфоцит распознаёт гаптенную детерминанту и синтезирует специфичные к ней антитела. Несущая детерминанта взаимодействует с Т-лимфоцитом и необходима для полной активации В-клетки. Обычно антигены имеют множество различных гаптенных и несущих детерминант (например, вирусы, бактерии и др.), тогда как небольшие молекулы могут действовать только как гапте-ны (например, токсины). Но даже небольшая, но хорошо выраженная антигенная детерминанта стимулирует гетерогенную
популяцию В-лимфоцитов, каждая из которых продуцирует антитела со слабыми различиями в специфичности и аффинитете.
Основными стадиями иммунного ответа являются распознавание и переработка антигена (рис. 17), селекция соответствующих индивидуальных Т- и В-клеток, их пролиферация в клоны и дифференцировка в функционально зрелые клетки. Каждый из перечисленных этапов характеризуется множественными межклеточными взаимодействиями, опосредуемыми в основном цитокинами (белые стрелки). Существуют и другие регулирующие факторы, но их значение пока неясно. Большая часть межклеточных взаимодействий проходит в лимфатических узлах или селезёнке, но образование антител — только в лимфоидной ткани.
Повторный ответ на тот же антиген, или ответ по вторичному типу, происходит гораздо быстрее и эффективнее благодаря большему количеству предшественников В- и Т-клеток, увеличившемуся разнообразию классов иммуноглобулинов и более высокому аффинитету антител. Ответ по вторичному типу означает, что в организме развилась иммунная память об антигене, что является целью большинства вакцин (рис. 41).
42
АЛ — аффезентный лимфатический сосуд, по которому антигены и нагруженные антигенами клетки поступают в лимфатический узел (рис. 11).
АПК — антигенпредставляющая клетка. Для запуска лимфоцитов в активацию антиген должен быть представлен на поверхности специализированных клеток. Различные дендритные клетки лим4»оидных тканей, клетки Лангерганса в коже и др. (рис. 7) выполняют эту функцию; часть из них выделяет ИЛ-1. Клетки, представляющие антиген Т-лимфоцитам, должны иметь поверхностные молекулы ГКГС класса II. За исключением небольших пептидов, которые могут непосредственно связываться с молекулами ГКГС класса II, другие антигены должны быть переработаны (расщеплены до пептидов) (рис. 17).
ФДК — фолликулярная дендритная клетка, специализированная для представления антигена В-лимфоцитам в В-клеточных фолликулах.
ИДК — интердигитальная дендритная клетка, специализированная для представления антигена Т-лимфоцитам в Т-клеточ-ной зоне или в паракортикальном слое.
Селекция. Лишь небольшая часть лимфоцитов распознаёт и связывает специфический антиген. Следовательно, эти молекулы селекционируются антигеном. Связывающими рецепторами являются поверхностные иммуноглобулины В-клеток и Т-кле-точный рецептор в случаях с Т-клетками, которые распознают антиген вме:те с молекулой ГКГС (рис. 14, 17).
Клональная пролиферация. Отобранные В-лимфоциты начинают активно делиться с образованием клонов идентичных клеток. Основным стимулятором пролиферации является растворимый продукт АПК — ИЛ-1. Для В-клеточной пролиферации также требуются Т-клеточные цитокины и взаимодействие через адгезивные молекулы (рис. 14). Пролиферация Т-лимфоцитэв усиливается другими растворимыми факторами (ИЛ-2), которые они продуцируют сами (рис. 23). Сочетание селекции антигенами с последующей клональной пролиферацией приводит в целом к ответу лимфоцитов, получившему название «клональная селекция».
Дифференцировка. Пролиферирующие В-лимфоциты становятся чувствительными к факторам, выделяемым Т-хелпе-рами. Идентифицированным факторам присвоены номера ин-терлейкиноз, но многие известные цитокины в той или иной мере усиливают рост или функции В-лимфоцитов. Некоторые антигены, особенно антигены с многочисленными повторяющимися детерминантами, способны стимулировать дифферен-цировку В-лимфоцитов без помощи Т-клеток. Такие антигены называют тимуснезависимыми (Т-независимыми). Обычно это
бактериальные полисахариды. Как правило, они стимулируют лишь IgM-ответ, представляющий более примитивную форму ответа.
Плазматические клетки. Для синтеза и секреции антител в В-лимфоците развиваются рибосомы и эндоплазматический ре-тикулум, отчего цитоплазма становится базофильной, а ядро располагается эксцентрично. Плазматические клетки, живущие только несколько дней, способны секретировать до 2000 молекул антител в секунду.
ЭЛ — эфферентный лимфатический сосуд, через который антитела, секретируемые в медуллярном слое, поступают в лимфу, а затем в кровь и распространяются по всему организму.
Клетки памяти. Некоторые В-лимфоциты не дифференцируются в плазматические клетки-антителопродуценты, а сохраняются как клетки памяти, увеличение которых и быстрое реагирование формируют высокоэффективный вторичный ответ. В-клетки памяти мало отличаются от их предшественников (больше поверхностных Ig, более вероятная циркуляция в крови), но сохраняют ту же специфичность к антигену. Генерация В-клеток памяти происходит в зародышевых центрах и требует присутствия комплемента. Также необходимы Т-клетки, так как Т-независимый иммунный ответ не оставляет иммунной памяти. Т-хелперы также развиваются в клетки памяти, но где это происходит, ещё не выяснено. Неизвестно также, как долго живут клетки памяти и нуждаются ли они в повторной стимуляции.
Супрессия. Некоторые Т-клеточные цитокины, особенно те, которые стимулируют макрофаги, подавляют функцию В-клеток. Этим можно объяснить некоторые случаи супрессорного действия Т-клеток. Существование отдельной линии Т-супрессо-ров в настоящее время не подтверждается.
Отрицательная обратная связь. Антитела, особенно IgG, могут подавлять антителообразование путём элиминации антигена или предупреждения стимуляции В-клеток.
Антиидиотипическая сеть. Известный иммунолог Н. Ерне предположил (впоследствии это подтвердилось), что идиотипы антител (уникальные по конфигурации участки активных центров) способны выполнять роль антигена и вызывать В- и Т-кле-точный ответ, в результате чего иммунная реакция постепенно затухает. Это привело к появлению интересной концепции сети антиидиотипических рецепторов, согласно которой антиидио-типические антитела несут в себе «внутренний образ» чужеродных антигенов (рис. 22). Однако истинная роль идиотип-антиидиотипических сетей в регуляции обычного антительного ответа ещё неясна. Возможно, наиболее значимым в регуляции продукции антител является удаление антигена.
43
19. ВЗАИМОДЕЙСТВИЕ АНТИГЕНА И АНТИТЕЛА И ИММУННЫЕ КОМПЛЕКСЫ
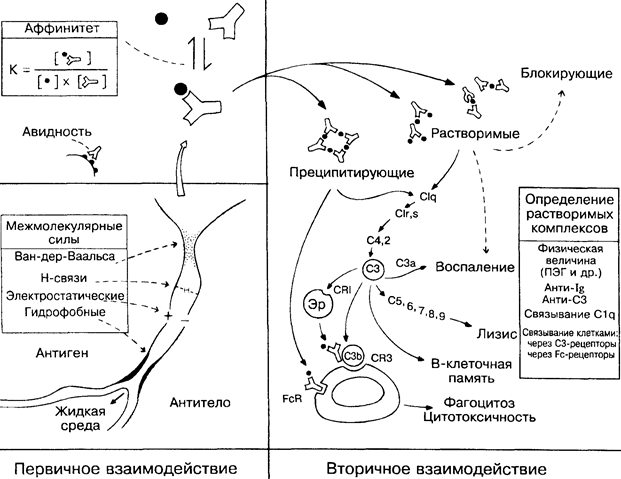
Антиген стимулирует синтез антител, которые соединяются с этим антигеном. Оба процесса основаны на взаимной ком-плементарности конфигураций антигенной детерминанты и ан-тигенсвязывающего участка антитела, образованного гиперва-риабельными участками тяжёлой и лёгкой цепей (рис. 16). Чем ближе это соответствие, тем интенсивнее нековалентные силы между ними (гидрофобные, электростатические и т.д.: на рисунке слева внизу) и тем выше аффинитет (слева вверху). Связывание антигена двумя активными центрами антитела увеличивает прочность соединения и характеризуется авидностью.
Способность связываться только с определённой антигенной детерминантой характеризует специфичность антител. Специфичность основана на огромном числе различающихся по конфигурации активных участков, которое заложено в V-генах и ещё более увеличивается в результате соматических мутаций (рис. 15). В результате в организме образуются миллионы антител различной специфичности, что составляет антительный репертуар.
Последствия соединения антитела с антигеном могут быть различными. Иногда, как в случае тех микроорганизмов и токсинов которым для проявления патогенного свойства необхо
димо прикрепиться к поверхностным рецепторам клетки, нейтрализующего действия антител, связывающих антигенные детерминанты, оказывается достаточно. Чаще всё-таки требуется взаимодействие антител с другими эффекторными агентами, такими, как комплемент или фагоциты. О значении этого вторичного взаимодействия говорит уже то, что проявления дефицита комплемента и миелоидных клеток приводят почти к таким же последствиям, как дефицит антител (рис. 39).
Соединение из антигена и антитела называют иммунным комплексом. В зависимости от природы и соотношения антигена и антител иммунные комплексы могут быть мелкими (растворимыми) или крупными (преципитирующими) (справа вверху). Обычно они удаляются фагоцитарными клетками в результате взаимодействия Fc-участка антитела с комплементом и поверхностными рецепторами фагоцитов (в центре внизу; см. также рис. 8). В некоторых случаях комплексы циркулируют в крови и вызывают воспалительное поражение органов (рис. 34) или подавляют иммунитет, например, к опухолям или паразитам. Обнаружение иммунных комплексов и идентификация входящих в их состав антигенов представляют большой практический интерес и проводятся с помощью многочисленных методик.
44
Дата: 2018-12-28, просмотров: 400.