(ГМ), или КОЕ-ГМ, — общий колониеобразующий предшественник для гранулоцитов и моноцитов, способный дифференцироваться в различные клетки миелоидного ряда в зависимости от присутствия ростового или колониестимулирую-щего фактора.
Нейтрофил — самый распространённый лейкоцит крови. Гранулы этой короткоживущей фагоцитарной клетки содержат большое количество бактерицидных веществ.
Эозинофил (ЭО) — лейкоцит с крупными преломляющими гранулами, в которых содержится значительное количество основных, или катионных, белков, возможно, важных для киллинга (уничтожения) больших паразитов, включая червей.
Базофил (БФ) — лейкоцит с крупными базофильными гранулами, в которых содержатся гепарин и вазоактивные амины, важные для воспалительного процесса.
Нейтрофилы, эозинофилы и базофилы объединяют под общим названием «гранулоциты».
Моноцит (Моно) — самая большая ядросодержащая клетка крови. Проникая в ткани, созревает в макрофаг.
Макрофаг (МФ) — основной оседлый фагоцит в тканях и серозных жидкостях брюшины, плевры и др.
Мегакариоцит (МК) — клетка-предшественник тромбоцита.
Тромбоцит (Тр) — небольшая клетка, участвующая в гемо-стазе и выделяющая многие медиаторы воспалительных процессов (рис.6).
Т — происходящий из тимуса лимфоцит.
Гормоны тимуса — многочисленные короткие пептиды, экстрагируемые из эпителия тимуса (например, тимозин) и участвующие в дифференцировке Т-лимфоцитов (рис. 9-11).
В — происходящий из костного мозга (у птиц — из бурсы) лимфоцит, предшественник антителообразующих клеток. В эмбриональный период роль бурсы может выполнять печень.
Плазматическая клетка — происходящая из В-лимфоци-тов клетка-антителопродуцент. Плазматические клетки редко обнаруживаются в крови, но найдены в селезёнке, лимфатических узлах и других органах, где они вырабатывают антитела.
Тучная клетка — крупная тканевая клетка, сходная с базо-филом по морфологии и функции, развивается в тканях. При повреждении тканей быстро инициирует воспалительный процесс (рис.23).
Факторы роста. Пролиферация и дифференцировка гемопоэтических клеток контролируются теми же молекулами (за исключением эритропоэтина и гормонов тимуса), которые действуют в иммунном ответе, т.е. интерлейкинами (рис. 23). Но некоторые из них были открыты гематологами и называются колониестимулируюшими факторами (КСФ), благодаря чему ИЛ-3, например, называется также мульти-КСФ.
15
5. КОМПЛЕМЕНТ
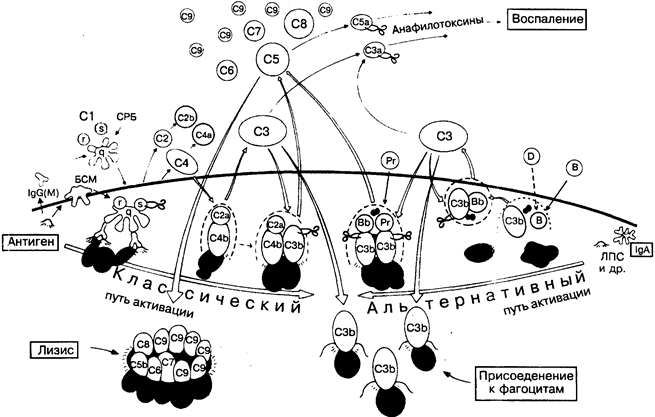
В сыворотке крови найдено более 15 белков, составляющих систему комплемента. Последовательно активируясь, они образуют биологически активные соединения, способные вызывать воспалительные процессы (на рисунке вверху справа), лизис клеток (внизу слева) и, осаждаясь на клеточных мембранах, стимулировать фагоцитоз (компонент CЗb, мощный опсонин; внизу справа). Всё это важные компоненты защиты от микроорганизмов, и любые дефекты системы комплемента способны серьёзно ослабить сопротивляемость организма многим, особенно бактериальным, инфекциям (рис. 39).
Верхняя часть рисунка относится к сыворотке (жидкой фазе), нижняя — к поверхности клеток, где в основном и происходят каскад активации (пунктирные полукружия на рисунке) и сборка компонентов комплемента. Активация комплемента может осуществляться двумя способами. Классический путь (описанный первым) начинается после связывания специфических антител класса 1§0 или 1^М (рис. 16) с поверхностными антиге-
нами (в центре слева). Альтернативная активация (в центре справа), возможно, более примитивная, инициируется многими полисахаридами и некоторыми антителами. Ряд этапов активации зависит от ионов Са2+ или Mg2+.
Несмотря на то что специализированные инактиваторы (на рисунке их символ — ножницы) и малая продолжительность жизни активных продуктов сводят активацию комплемента к местным проявлениям, чрезмерная активация всё же вызывает достаточно выраженные побочные эффекты (рис. 34).
Учитывая, что способностью активировать комплемент без участия антител обладают молекулы липидов и углеводов (например, манноза, полисахариды), можно предположить, что исходным назначением системы комплемента было распознавание небелковых структур на поверхности бактерий, и только с появлением антител у позвоночных (рис. 3) практически любые чужеродные молекулы обрели способность активировать комплемент.
16
КЛАССИЧЕСКИЙ ПУТЬ
Называется классическим по той причине, что долгое время был единственно известным. Главная его особенность — необходимость специфического взаимодействия антигена и антитела, активирующего компоненты С1, С2 и С4, которые в свою очередь формируют конвертазу, расщепляющую СЗ.
Белок, связывающий маннозу (БСМ). Сходная с Сlq молекула, распознающая некоторые микробные компоненты (например, дрожжевой маннан) и активирующая субкомпоненты Clr и Cls.
С реактивный белок (СРБ) в больших количествах продуцируется во время ответа в острой фазе воспаления (рис. 6). Связываясь с фосфорилхолином бактерий, активирует субкомпонент Clq.
Иммуноглобулин (Ig). Igm или подклассы IgG (IgG3, 1 и 2 у человека), когда связывают антиген, распознаются Clq, что ведёт к классическому пути активации.
С1. Ca2+ -зависимое соеденение 3-х субкомпонентов: Clq (мол. масса — м. м. 400 000). Clr (м. м. 170 000) и Cls (м. м. 80 000). Молекула Clq имеет 6 валентностей для Ig, связываясь колла-геноподобными фибриллами. Связывание Clq с молекулой Ig активирует проферменты Clr и Cls, которые в свою очередь активируют С2 и С4.
С2 (м. к. 120000). С2 расщепляется субкомпонентом Cls на малый (C2b) и большой (C2a) фрагменты.
С4 (м. м. 240 000). Аналогично расщепляется на малый (C4a) и большой (C4b) фрагменты. После этого C4b и С2а объединяются и прикрепляются к комплексу антиген-антитело или к мембране, если антиген связан с клеткой, образуя конвертазу СЗ. Некоторые исследователи предпочитают, чтобы обозначение «а» относилось только к малым фрагментам при обозначении как С2, так и С4, потому что пептид «а» меньшего размера.
СЗ (м. м. 180 000). Основной компонент всех реакций комплемента. Расщепляется конвертазой СЗ на малый (СЗа) и большой (C3b) фрагменты. Часть C3b оседает на мембране, и через него происходит соединение с фагоцитарными клетками, имеющими соответствующие рецепторы, а часть остаётся связанной с С2а и С4b, образуя конвертазу С5. Обнаружено 2 инактивато-ра, которые быстро расщепляют СЗb с образованием свободного фрагмента СЗс и связанного с мембраной СЗd.
С5 (м. м. 180 000). Расщепляется конвертазой С5 на малый (С5а) и большой (С5b) фрагменты. С5а и анафилатоксин СЗа воздействуют на тучные клетки, гранулоциты и гладкие мышцы, стимулируя воспалительные процессы, а фрагмент С5b начинает сборку С6, С7 и С9 в мембраноатакующий, или литический, комплекс.
Рецепторы к комплементу (СК). Обнаружено 3 типа поверхностных молекул, способных связывать различные продукты расщепления СЗ. Это СК1 на эритроцитах, CR1 и CRЗ на фагоцитарных клетках (рис. 8), где они действуют как опсони-ны, и CR2 на В-лимфоцитах. Возможно, CR2 участвует и в индукции иммунной памяти. Именно через этот рецептор в клетку проникает вирус Эпстайна-Барр (рис. 26).
АЛЬТЕРНАТИВНЫЙ ПУТЬ
В активации комплемента по альтернативному пути не участвуют ионы кальция и компоненты С1, С2 и С4. Как следствие не требуется и специфического взаимодействия антигена и антитела. Активация начинается сразу с компонента СЗ под действием различных молекул: липополисахаридов (ЛПС), других бактериальных продуктов или агрегатов некоторых типов антител, включая IgA (рис. 16). Активация комплемента по альтернативному пути — это циклический процесс, поддерживаемый сложными обратными связями.
В — фактор В (м. м. 100 000). Образует комплекс с C3b независимо от того, продуктом какого пути активации тот является. Обладает структурным и функциональным сходством с С2; как и С2, кодируется генами, расположенными в ГКГС (рис. 13). У птиц, не имеющих С2 и С4, С1 активирует фактор В.
D — фактор D (м. м. 25 000). Фермент, действующий на комплекс C3b-B, в результате чего образуется активная конвертаза, обозначаемая на языке специалистов по комплементу как C3bBb.
Пропердии (Pr; м. м. 220 000). Первый выделенный компонент альтернативного пути активации. Некоторое время считался активатором, теперь же ясно, что он только стабилизирует комплекс C3b-B, расщепляющий СЗ на СЗа и СЗb. Полученный таким образом СЗb в свою очередь взаимодействует с факторами В и D, в результате чего количество СЗb возрастает (положительная обратная связь) с большими усиливающими возможностями (компенсируется факторами I и H — инактива-торами СЗ).
ЛИТИЧЕСКИЙ ПУТЬ
Лизис клеток — одна из реакций, в которой участвуют компоненты комплемента. Начинается с расщепления фрагмента С5 одной из двух его конвертаз: СЗb-С2а-С4b при классическом или СЗb-Bb-Br при альтернативном пути активации. В обоих случаях дальнейший процесс одинаков.
С6 (м. м. 150 000), С7 (м. м. 140 000), С8 (м. м. 150 000), С9 (м. м. 80 000). По одной молекуле С6, С7, С8, С5b и 10 или более молекул С9 образуют мембраноатакующий комплекс, имеющий форму цилиндрической трубки. Проникая в мембрану бактерий, эритроцитов и других клеток, комплекс приводит к истечению содержимого клетки и её гибели. Естественно, бактерии нашли множество способов избежать этого (рис. 27).
17
6. ОСТРОЕ ВОСПАЛЕНИЕ
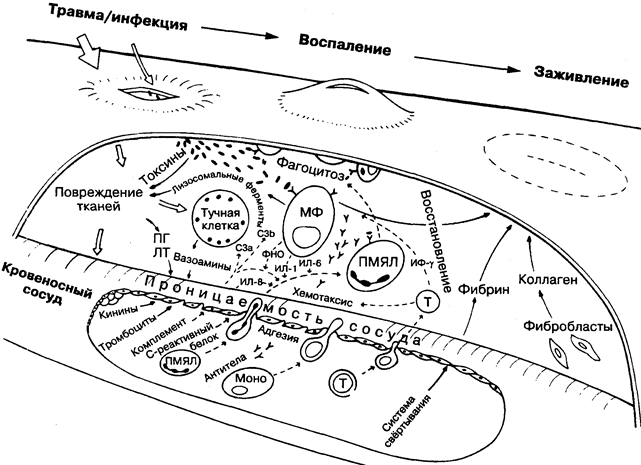
Считать ли воспаление частью иммунитета — проблема для специалистов, но в борьбе с инфекциями организм использует все возможные средства, в том числе и воспалительные процессы. На рисунке слева направо схематично представлен процесс повреждение-воспаление-заживление для тканей (верхняя часть рисунка) и кровеносных сосудов (нижняя часть). Наиболее частая причина воспаления — бактериальные инфекции (на рисунке обозначены чёрными палочками), без которых, разумеется, не обходится и повреждение тканей. При повышенной проницаемости сосудистого эндотелия эритроциты и компоненты сыворотки (внизу) проникают в ткани (вверху) и накапливаются там, вызывая основные симптомы воспаления:
покраснение, жар, отёк, болезненность.
Роль антител и лимфоцитов в воспалительных процессах подробно изложена в разделах 32-36, основная их задача состоит в стимуляции и локализации предсуществующих механизмов естественной защиты. Выпадение этой функции может закончиться летальным исходом.
Центральную роль в воспалительных процессах играют тканевые тучные клетки, макрофаги и поступающие из крови полиморфно-ядерные лейкоциты. Если по какой-либо причине воспаление не закончится через несколько дней, то оно становится хроническим, а главная роль переходит к макрофагам и Т-лимфоцитам (рис. 35).
18
Тучная клетка — большая тканевая клетка; её базофильные гранулы, содержащие гепарин и вазоактивные амины, легко дегранулируются при механическом повреждении, нагревании, под действием ультрафиолетовых лучей, при некоторых аллергических состояниях (рис. 33).
Простагландины (ПГ) и лейкотриены (ЛТ). Семейство ненасыщенных жирных кислот (м. м. 300-400), продуктов метаболизма арахидоновой кислоты. Являются компонентом большинства клеточных мембран. Отдельные ПГ и ЛТ вызывают различные, но перекрывающие друг друга эффекты. Вместе ответственны за индукцию боли, лихорадку, хемотаксис полиморфно-ядерных лейкоцитов, увеличение сосудистой проницаемости. Некоторые из них подавляют функцию лимфоцитов.
Вазоамины — вазоактивные амины (гистамин, серотонин и др.), увеличивают проницаемость сосудов. Продуцируются тучными клетками, тромбоцитами и базофилами.
Система киников — серия сывороточных пептидов. При последовательной активации вызывают расширение и повышенную проницаемость сосудов.
Комплемент — система сывороточных белков, активируемых непосредственно (альтернативный путь) или комплексом антиген-антитело (рис. 5).
СЗ и С5а — анафилатоксины, стимулирующие тучные клетки к выделению вазоактивных аминов.
Опсонизация. Присоединившийся к частице фрагмент СЗb (рис. 5) облегчает её захват фагоцитами, несущими СЗ-рецеп-тор. Присутствие антител усиливает прочность присоединения за счёт связи с Fc-рецептором.
С реактивный белок (м. м. 130000). Продуцируемый в печени пентамерный глобулин, происхождение которого восходит к беспозвоночным. Появляясь в сыворотке через несколько часов после травмы или инфицирования, присоединяется к фосфорилхолину на поверхности бактерий, активирует комплемент и стимулирует фагоцитоз, выполняя сходные с антителами функции при некоторых бактериальных инфекциях. Входит в группу белков острой фазы воспаления (белки, концентрация которых возрастает при воспалении). К этой же группе относятся многие составляющие комплемента, другие микробсвязываю-щие молекулы и ингибиторы ферментов. Ответ острой фазы может рассматриваться как быстрая, но очень специфическая попытка реагировать на любую инфекцию или повреждение.
Полиморфно-ядерный лейкоцит (ПМЯЛ) — основная подвижная фагоцитарная клетка, от которой главным образом и зависит уничтожение проникших в ткани бактерий.
Моноцит (Моно) — предшественник тканевых макрофагов (МФ на рисунке), удаляющих повреждённые ткани и микроорганизмы. Тканевые макрофаги — основные продуценты цито-кинов ФНО, ИЛ-1 и ИЛ-6, которые вызывают острую фазу ответа, изменения сосудистого эндотелия, а затем процессы репарации в тканях (рис. 23).
Лизосомальные ферменты — бактерицидные ферменты (например, лизоцим, миелопероксидаза и др.), освобождаемые из лизосом полиморфно-ядерных лейкоцитов, моноцитов, макрофагов и др. Способны повреждать как инфицированные, так и нормальные ткани.
Адгезия. Полиморфно-ядерные лейкоциты, моноциты и лимфоциты задерживаются и прикрепляются к стенке сосуда через изменённые цитокинами поверхностные молекулы. Существуют чётко определённые группы адгезивных молекул и их мишеней (селектины, интегрины, суперсемейство Ig).
Хемотаксис — направленное движение фагоцитарных клеток к очагу воспаления (в отличие от случайных ускорений перемещения — хемокинеза). Возможно, феномен хемотаксиса объясняется способностью клеток следовать градиенту концентрации факторов хемотаксиса: С5а, СЗа, лейкотриенов и хемоки-нов, таких, как ИЛ-8.
Т-лимфоцит, стимулированный антигеном, переходит в бласт-ную форму и выделяет цитокины, например ИФ-у (рис. 23), повышающие активность макрофагов.
Система свёртывания крови — важнейшая часть процесса заживления, имеющая несколько общих этапов активации с комплементом и кининами.
Фибрин — конечный продукт свёртывания крови; в тканях — матрикс, в который мигрируют фибробласты, чтобы запустить процесс заживления.
Фибробласты — важная тканевая клетка, мигрирующая в фибриновый сгусток и выделяющая коллаген — необычайно прочный высокомолекулярный полимер, придающий заживающей ране эластичность и прочность. После этого в поражённом участке образуются новые капилляры и восстанавливается нормальное строение ткани.
19
7. ФАГОЦИТАРНЫЕ КЛЕТКИ. СИСТЕМА МОНОНУКЛЕАРНЫХ ФАГОЦИТОВ
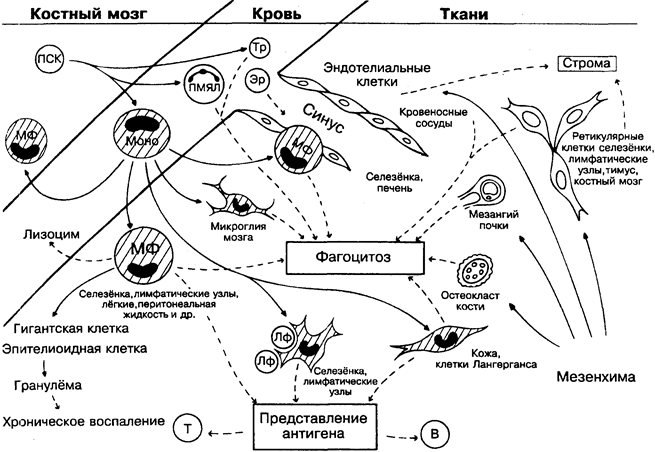
Частицы продуктов распада, образовавшихся в результате гнойного процесса, поступают в кровоток или в ткани и быстро удаляются специализированными клетками. Свойство этих клеток захватывать красители, коллоиды и др. дало основание анатомам объединить широко распространённые по организму фагоцитарные клетки в ретикулоэндотелиальную систему. В неё включили сосудистый эндотелий, ретикулярные тканевые клетки (на рисунке справа вверху) и различные типы макрофагов чья обычная функция направлена на клиренс продуктов распада собственного организма, а также убитых и переваренных бактерий.
Более поздние исследования выявили существенные различия между фагоцитарными клетками, происходящими из костного мозга через моноцит крови (затушёвано), и теми, которые сформировались непосредственно в тканях (правая часть рисунка). Поскольку ретикулярные и эндотелиальные ткани вы
полняют скорее структурные, чем фагоцитарные, функции, в настоящее время вместо понятия «ретикулоэндотелиальная система» употребляют понятие «система мононуклеарных фагоцитов» (СМФ).
Взаимодействие СМФ с адаптивным иммунитетом начали изучать сравнительно недавно. Все, что известно о влиянии антител на фагоцитоз, а Т-лимфоцитов на прочие функции макрофагов, подробно изложено в разделах 8 и 35. Здесь важно подчеркнуть, что В- и Т-лимфоциты не способны полноценно реагировать на чужеродный антиген, не представленный должным образом. Считалось, что антигенпредставляющими клетками являются макрофаги, но сейчас ясно, что имеются специальные популяции клеток в коже и лимфоидных органах, способные связывать и расщеплять белковые антигены на короткие пеп-тиды, которые ассоциируются с молекулами ГКГС и затем распознаются Т-лимфоцитами.
20
Эндотелиальные клетки выстилают внутреннюю поверхность кровеносных сосудов. Способны захватывать краситель, но полноценными фагоцитарными способностями не обладают. Доказано, что при определённых условиях клетки эндотелия могут представлять антиген лимфоцитам, а также секретировать цитокины и реагировать на них подобно макрофагам.
Ретикулярные клетки. Основные поддерживающие или стромальные клетки лимфоидных органов, обычно связанные с подобными коллагену ретикулиновыми волокнами. В связи с этим их нелегко отличить от фибробластов и других отростчатых (дендритных) клеток (см. ниже).
Мезангий. Мезангиальные клетки находятся в почечных клубочках (гломерулах) и способны фагоцитировать попавший туда материал, особенно комплексы антиген-антитело.
Остеокласт — большая многоядерная клетка, обеспечивающая резорбцию, а также формирование костной ткани. Найдены подтверждения тому, что их функция регулируется Т-лимфоцитами.
Дендритные клетки. Обладающие слабыми фагоцитарными способностями клетки Лангерганса в эпидермисе и подобные, но не фагоцитирующие клетки лимфоидных фолликулов в селезёнке и лимфатических узлах — основные клетки Т-клеточной стимуляции. Т-лимфоциты распознают чужеродные антигены в ассоциации с клеточно-поверхностными антигенами, кодируемыми ГКГС (генетическая область, непосредственно вовлечённая во все виды иммунных процессов; рис. 13, 14, 17, 20). Существуют также отдельные фолликулярные дендритные клетки, которые специализируются на захвате комплексов антигеь-антитело и представлении антигена В-клеткам. Вероятно, наблюдаемые в лимфе вуалевые клетки представляют собой клетки Лангерганса, несущие антиген в лимфатические узлы, где они становятся интердигитальными дендритными клетками. Дендритные клетки также участвуют в реакциях отторжения чужеродного трансплантата (рис. 37).
Лимфоциты (Лф) часто обнаруживают в тесном контакте с дендритными клетками (рис. 17,18). Это, возможно, происходит там,, где имеют место представление антигена и кооперация Т- и В-клеток.
Полипотентная стволовая клетка (ПСК) костного мозга — родоначальница всех клеток крови.
Тромбоцит (Тр). Помимо активного участия в свёртывании крови, способен фагоцитировать комплексы антиген-антитело.
Эритроцит (Эр) способен присоединять комплексы антиген-антитело-комплемент посредством CR1-рецептора к комплементу (рис. 5) и транспортировать их в печень для удаления макрофагами. Процесс иногда называют иммуноприлипанием.
Полиморфно-ядерный лейкоцит (ПМЯЛ) — главная фагоцитарная клетка крови. Обычно её не включают в СМФ.
Моноцит (Моно) образуется в костном мозге и, поступая через кровоток в ткани, созревает в макрофаг. Возможно, специализированные антигенпредставляющие клетки также произошли из моноцитов.
Макрофаг (МФ) — оседлый или долгоживущий тканевый фагоцит. Макрофаги могут находиться в свободном состоянии в тканях или закрепляться на стенках кровеносных синусов, где отслеживают в крови чужеродные частицы, ослабленные эритроциты и др. Эта способность наиболее сильно выражена в печени, где макрофаги называют клетками Купфера. Подобные функции альвеолярные макрофаги выполняют в лёгких, где очищают альвеолы от свободных частиц и микробов. Макрофаги (как и полиморфно-ядерные лейкоциты) обладают ценной способностью распознавать не только чужеродный материал, но и связанные с ним антитела и/или комплемент, что существенно ускоряет процесс фагоцитоза (рис. 8).
Синусы — извилистые каналы в печени, селезёнке и других органах, через которые проходит кровь, чтобы достичь вен. Множество макрофагов, выстилающих стенки синусов, очищают протекающую кровь от повреждённых или покрытых антителами клеток и других частиц. Процесс настолько эффективен, что за считанные минуты печень и селезёнка очищают кровь от большой дозы частичек угля, чернея при этом буквально на глазах.
Микроглия — фагоцитарная клетка мозга. Происходит, вероятно, из поступающих с кровью моноцитов.
Лизоцим — важный бактерицидный фермент, выделяемый в кровь и биологические секреты макрофагами. Макрофаги секретируют многие другие естественные гуморальные факторы: интерферон, некоторые компоненты комплемента, цитотоксические факторы и др.
Гигантская клетка, эпителиоидная клетка — клетки, происходящие из макрофагов, обнаруживаются в местах хронического воспаления; соединяются в твёрдую массу или гранулёму, где локализованы и ограничены стенкой токсические вещества или непереваренные частицы.
21
8. фагоцитоз
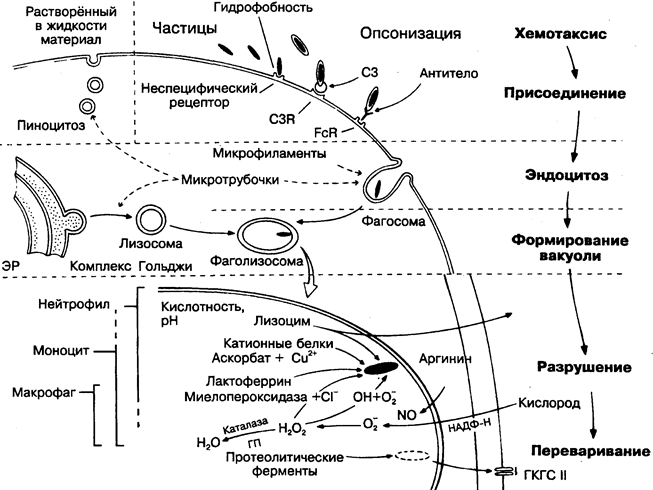
Многочисленные клетки поглощают чужеродный материал, но способность к усилению этой активности в ответ на опсонизацию антителами и/или комплементом, так же как приобретение специфичности к антигену, ограничивается клетками миелоидного ряда, а именно полиморфно-ядерными лейкоцитами, моноцитами и макрофагами. На этом основании их называют профессиональными фагоцитами.
Процесс фагоцитоза, т.е. присоединение (на рисунке вверху), поглощение (эндоцитоз; в центре) и переваривание (внизу), практически одинаков у всех миелоидных клеток. Основные различия состоят в используемых лизосомальных ферментах. Различаются, разумеется, и сами клетки: гранулоциты живут недолго (часы и дни) и часто погибают в процессе фагоцитоза в отличие от макрофагов, осуществляющих фагоцитоз неоднократно. Мак-
рофаги лишены некоторых наиболее деструктивных ферментов. Они также способны активно секретировать некоторые ферменты (например, лизоцим). Очень велики межвидовые различия в количественных соотношениях лизосомальных ферментов.
На рисунке показан процесс фагоцитоза обычных бактерий (обозначены чёрными палочками), Если бактерия имеет капсулу (на рисунке обведена контуром), то без предварительной опсонизации фагоцитоз невозможен. Некоторые этапы фагоцитоза, приведённые на рисунке, могут активно подавляться микроорганизмами (рис. 27-29) или оказаться специфически дефектными в результате генетических нарушений (рис. 39), что в обоих случаях приводит к неспособности эффективно удалять микроорганизмы или чужеродный материал и как следствие к хронической инфекции и/или хроническому воспалению.
22
Хемотаксис — движение клеток в направлении градиента молекул, пыделенных микроорганизмом.
Пиноцитоз (поглощение жидкости) — поглощение клеткой растворимых веществ, диаметр которых не превышает 1 мкм.
Гидрофобность. Гидрофобные группы тяготеют к гидрофобной поверхности клеток. Возможно, этим объясняется распознавание повреждённых клеток, денатурированных белков и др. Многие вирулентные бактерии в качестве защитного механизма имеют полисахаридную капсулу, которая снижает гидрофоб-ность и блокирует присоединение.
Неспецифические рецепторы. В некоторых случаях фагоциты имеют поверхностные структуры, комплементарные широкому спектру веществ, которые они распознают и связывают. Обычно это углеводы.
C3 R — рецептор к СЗb, продуцируемому из СЗ при активации комплемента бактериями по классическому или альтернативному пути (рис. 5). Присутствует на фагоцитарных клетках и некоторых лимфоцитах.
FcR — Fc-рецептор; фагоциты и большинство лимфоцитов, тромбоцитов и других клеток могут связывать антитело (обычно IgG) через Fc-фрагмент.
Опсонизация А. Райт открыл, а Г.Б. Шоу в своей книге «Выбор врача» впервые подробно описал феномен опсонизации, состоящий в том, что Fc- и СЗ-рецепторы значительно облегчают и ускоряют процесс распознавания и захвата чужеродных частиц фагоцитами. Возможно, опсонизация — один из наиболее важных процессов, с помощью которых антитело помогает преодолеть инфекции, особенно бактериальные.
Фагосома — вакуоль, образованная при инвагинации участка поверхностной мембраны с прикреплённой на ней чужеродной частицей.
Микротрубочки — короткие жёсткие структуры, которые состоят из белка тубулина и соединяются в каналы для вакуолей, чтобы транспортировать вещества внутрь клетки. Они поддерживают также жёсткость мембраны.
Микрофиламенты — сократимые цитоскелетные нити, ответственные за активность мембраны при пиноцитозе и образовании фагосом. Основной компонент — белок актин, а у промежуточных микрофиламентов — виментин.
Эндоплазматический ретикулум (ЭР) (цитоплазматичес-кая сеть). Мембранная система уплощённых мешков (цистерн) и трубочек, с которой рибосомы связаны в синтезе многих сек-ретируемых белков.
Комплекс Гольджи — органоид, в котором продукты ЭР упакованы и везикулы (рис. 17).
Лизосома — окружённая мембраной упаковка гидролитических ферментов, обычно активных в кислой среде (кислая фос-фатаза, ДНКаза и т.д.). Лизосомы имеют условия для секреции и переваривания, обнаружены почти во всех клетках. Они особенно выражены в макрофагах и гранулоцитах, которые также имеют отдельные везикулы, содержащие лизоцим и другие ферменты. Вместе с лизосомами они образуют гранулы. По характеру окрашивания гранулы характеризуют различные типы клеток (нейтрофилы, базофилы и эозинофилы). Новообразовавшуюся лизосому, ещё не содержащую какого-либо субстрата, называют первичной.
Фаголизосома — вакуоль, образованная слиянием фагосомы и лизосомы, в которой происходит уничтожение и переваривание микроорганизмов.
Лактоферрин — белок, подавляющий бактерии, лишая их железа, с которым связывается с крайне высоким аффинитетом.
Катионные белки — антимикробные агенты (например, фа-гоцитин, лейкин), обнаруженные в некоторых полиморфных гранулах. Эозинофилы особенно богаты катионными белками, которые они могут секретировать при дегрануляции, что делает клетку высокоцитотоксичной.
Аскорбат. Взаимодействует с ионами меди и перекисью водорода. Способен оказывать бактерицидное действие.
Кислород. Большинство фагоцитарных процессов аэробны, т.е. требуют присутствия кислорода. При реакциях ферментов с участием НАДФ-Н-оксидазы и супероксиддисмутазы кислород поэтапно превращается в супероксид (О2), перекись водорода (Н2О2) и, наконец, в гидроксильные ионы (ОН) и синглетный кислород (O2-). Эти свободные радикалы крайне токсичны для многих микроорганизмов, но быстро уничтожаются клеточными ферментами, такими, как каталаза и глутатионпероксидаза (ГП). Не удивительно, что такие же ферменты вырабатывают многие бактерии (рис. 27). Недавно выяснилось, что получаемая в фагоцитах из аргинина окись азота (NO) тоже токсична.
Миелопероксидаза. Вместе с перекисью водорода и галоге-нид-ионами (например, хлоридами) является важным антимикробным ферментом. Миелопероксидаза отсутствует в зрелых макрофагах, но в какой-то мере может быть замещена каталазой.
Лизоцим (мурамидаза) — основной секреторный продукт макрофагов, присутствующий в крови в количествах порядка 1 мг/мл. Лизирует многие сапрофиты (например, Micrococcus lysodeicticus) и некоторые патогенные бактерии, повреждённые антителами и/или комплементом.
Протеолитические ферменты — кислая фосфатаза, липаза, эластаза, бетта-глюкуронидаза и катепсины. Важны в переработке антигена для взаимодействия с молекулами ГКГС класса II (рис. 17). Обычно именно по ним идентифицируют лизосомы.
23
9. ЛИМФОЦИТЫ
Как клетка адаптивного иммунитета лимфоцит имеет некоторые уникальные характеристики: узкоспециализированные рецепторы, позволяющие каждой клетке отвечать на индивидуальный антиген (основа специфичности), клональная пролиферация, длительная продолжительность жизни (основа иммунной памяти), рециркуляция из тканей обратно в кровоток. Из этого следует, что специфическая память после локального ответа на антиген распространяется о нём по всему организму.
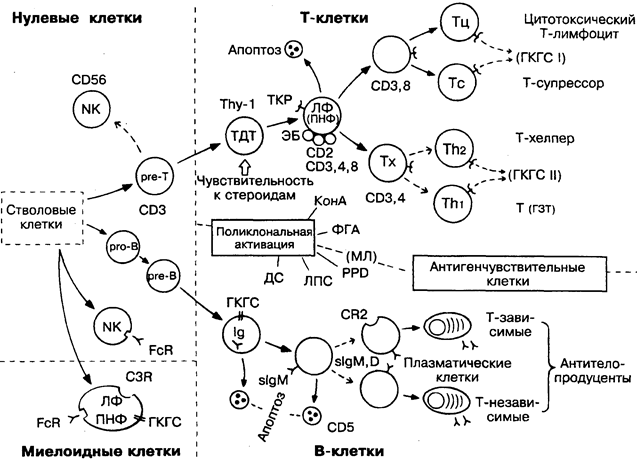
Открытие в 60-х годах двух популяций лимфоцитов — Т (тимусзависимые) и В (зависимые от бурсы или костного мозга) — означало для клеточной иммунологии почти то же, что открытие ДНК для молекулярной биологии. Первым отличительным свойством Т-клеток явилось то, что они помогают В-лимфоцитам в продукции антител. В дальнейшем на основании различия функциональных и структурных характеристик были выявлены субпопуляции лимфоцитов. Сейчас различают 3 или 4 субпопуляции Т-лимфоцитов (на рисунке справа вверху). На рисунке, согласно классификации CD (рис. 44), показаны основные поверхностные структуры (маркёры) лимфоцитов на разных этапах дифференцировки, а также этапы, где впервые появляются другие значимые поверхностные молекулы.
Клетки, сходные с лимфоцитами, но не имеющие явно выраженных маркёров Т- или В-клеток, обозначаются иногда как
нулевые (слева). Эта группа, возможно, включает ранние Т- и В-клетки, моноциты и NK-клетки (естественные киллеры, участвующие в противоопухолевом и противовирусном иммунитете). Нулевые клетки составляют до 10% всех лимфоцитов в крови и лимфоидных органах.
Одним из замечательных достижений биологии стало получение практически бессмертной гибридомы, образованной слиянием отдельного лимфоцита с опухолевой клеткой. Это дало возможность получать в неограниченных количествах специфические моноклональные антитела, происходящие от одного В-лимфоцита. Такие антитела широко применяются в диагностике и лечении заболеваний и исследовании поверхностных структур клеток. Так, классификация лимфоцитов и многих других клеток сейчас основана главным образом на реагировании с ними широкого набора типирующих моноклональных антисывороток (см. раздел 44).
Получение in vitro бессмертных Т-лимфоцитов возможно только при тщательном комбинировании воздействий специфического антигена и неспецифических факторов роста, таких, как ИЛ-2 (рис. 23). Свойства полученных линий или клонов должны помочь в изучении нормальных функций Т-лимфоцитов, но в этой области ещё много проблем.
24
НУЛЕВЫЕ КЛЕТКИ
NK (естественные киллеры) — клетки, оказывающие цитоток-сическое действие на клетки, инфицированные вирусом, и, возможно, некоторые опухоли.
Миелоидные клетки. Моноциты, макрофаги, гранулоциты и некоторые Т- и NK-клетки активно проявляют антителозависи-мую клеточную цитотоксичность (АЗКЦ). Иногда их объединяют под общим названием «К-клетки».
FcR — Fc-рецептор. Рецептор к Fc-фрагменту антител (обычно антител класса IgG). Обеспечивает присоединение эффекторов АЗКЦ к клеткам-мишеням.
ЛИМФОЦИТЫ (Т- КЛЕТКИ)
Терминальная дезоксинуклеотидилтрансфераза (ТДТ). ДНК-полимераза, участвующая в генерации разнообразия генов Т-клеточных рецепторов. Обнаруживается в основном в незрелых тимоцитах коркового слоя тимуса.
Т-клеточный рецептор (ТКР) для антигена. Структура сходна с поверхностными иммуноглобулинами В-лимфоцитов.
Пуриннуклеозидфосфорилаза (ПНФ). Пуриновый фермент, присутствующий в Т-клетках и моноцитах, но не в В-клетках человека. Также потенциально полезный маркёр (рис. 39).
Лизосомальные ферменты (ЛФ) (например, кислая фосфа-таза, эстеразы). Обнаружены в клетках миелоидной линии и в меньших количествах в Т-клетках.
Thy-1 (первоначально — тета) — поверхностный антиген Т-клеток мышей, существующий в двух аллельных формах. Встречается на клетках кожи и мозговой ткани. За 30 лет, прошедших с момента открытия, его назначение так и не было разгадано.
CD (cluster of differentiation) — классификация, основанная на реактивности с различными моноклональными антителами, распознающими поверхностные молекулы. Позволяет классифицировать Т- и В-клетки и линии их развития. Полный перечень CD молекул приведён в разделе 44, но следует помнить, что наряду с ними сохраняются некоторые старые функциональные обозначения (СЗ-рецептор, рецептор к эритроцитам барана и др.).
Поликлональная активация — одновременная стимуляция большого количества лимфоцитов, т.е. возникновение сразу многих клонов в отличие от одного или нескольких при обычной активации антигеном. Поскольку первым проявлением активации часто является митоз, то поликлональные активаторы называют также митогенами. К митогенам относятся многие растительные лектины, например, конканавалин А (КонА), фито-гемагглютинин (ФГА), которые избирательно связываются с углеводными компонентами клеточных мембран, предназначенными, возможно, для распознавания микробных структур.
Эритроциты барана (ЭБ). Большинство Т-клеток человека присоединяют эритроциты барана через рецептор CD2 с обра-
зованием in vitro розеток. Подобная реакция Т-клеток с отдельными гетерологичными эритроцитами характерна для многих видов (например, кошка, морская свинка). Как и ответ на митогены, это полезный маркёр без функционального назначения. Следует отличать этот тест от использования ЭБ в качестве антигена, часто применяемого в экспериментальной иммунологии.
Цитотоксические Т-лимфоциты (Тц) — главные клетки противовирусного иммунитета (рис. 20, 26).
Т-супрессоры (Тс). Их существование в качестве отдельной линии лимфоцитов до сих пор вызывает серьёзные сомнения.
Т-хелперы (Тх) — CD4 Т-клетки, которые играют важную роль практически во всех иммунных реакциях, опосредуемых клетками и антителами (рис. 17, 18, 20). Различные CD4 Т-клетки продуцируют разные наборы цитокинов: Th2 секретируют набор цитокинов, необходимый для гуморального иммунного ответа, а Th1 (известны также как клетки гиперчувствительности замедленного типа — ГЗТ) — цитокины для клеточного иммунного ответа.
В-ЛИМФОЦИТЫ (В-КЛЕТКИ)
Ig. slg — цитоплазматический и поверхностный иммуноглобулины соответственно, основная структура В-клетки, распознающая специфический антиген (рис. 12,15).
ГКГС II. Антигены, кодируемые в области ГКГС класса II, представлены главным образом на В-клетках и макрофагах и вовлекаются во взаимодействие с CD4 Т-клетками (рис. 13,14,17).
CR2 — рецептор В-лимфоцитов к СЗ-компоненту комплемента; может быть вовлечён в генерацию анамнестического ответа.
Декстрансульфат (ДС). Липополисахариды (ЛПС; например, эндотоксин сальмонеллы). Очищенное белковое производное туберкулина ( PPD). Оказывают митогенное действие только на В-клетки, возможно, на разные стадии функционирования.
Митоген лаконоса (МЛ). Оказывает митогенное действие на Т- и В-лимфоциты, если присутствуют оба типа клеток. К сожалению, идеального митогена для В-клеток человека не существует.
Т-зависимость, Т-независимость. Синтез некоторых антител, главным образом IgM, происходит без помощи Т-хелперов и называется тимуснезависимым. В нём участвуют различные В-клетки, и, вероятно, в процессе эволюции он возник раньше других. В подавляющем большинстве случаев антителообразующая функция В-лимфоцитов является тимусзависимой.
Апоптоз — запрограммированная гибель клеток. Процесс, в результате которого клетка гибнет без вреда для окружающих тканей. Очень большое количество В- и Т-клеток погибает по этому механизму, если в них не произошла перестройка генов рецепторов или если они становятся аутореактивными (рис. 36).
25
10. ЦЕНТРАЛЬНЫЕ ЛИМФОИДНЫЕ ОРГАНЫ И ЛИМФОПОЭЗ
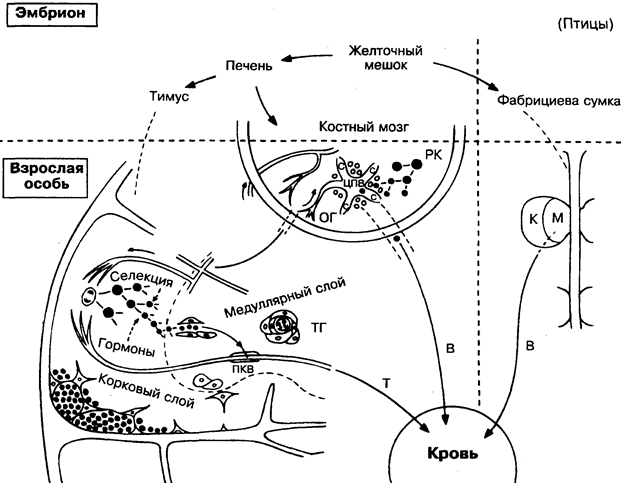
Первым серьёзным доказательством существования различающихся популяций лимфоцитов были взаимодополняющие последствия удаления у птиц в раннем возрасте тимуса (которое ведёт главным образом к нарушению клеточного иммунитета), и фабрициевой сумки (вызывающего нарушение антитель-ного ответа). Поиск аналога фабрициевой сумки у млекопитающих продолжался долго. Одно время считалось, что это лимфоидная ткань, ассоциированная с кишечником. На самом деле аналога как такового не существует. В период внутриутробного развития В-лимфоциты созревают в печени, а у взрослых — в костном мозге.
Продукция В- и Т-лимфоцитов — весьма случайный и, на первый взгляд, расточительный процесс, который, в отличие от другой формы гемопоэза, включает перестройку генов, чтобы каждая клетка приобрела уникальный рецептор (рис. 14, 15), и уничтожение всех тех клеток, у которых перестройка прошла неудачно и которые имеют рецепторы, способные распознавать
молекулы «своего» и, таким образом, являются аутореактивны-ми (рис. 36). Так как процесс распознавания антигена Т-клет-ками более сложен и задействует не только антиген, но и молекулы ГКГС (рис. 13, 14, 17), то и продукция Т-клеток — более усложнённый процесс, требующий двух раздельных этапов селекции: один для «своих» молекул ГКГС и другой против собственных антигенов.
Вокруг самого тимуса споры не утихают до сих пор. Так и неясно, ограничено ли действие гормонов тимуса только границами органа, действительно ли тельца Гассаля — зона разрушения клеток. Зачем нужны два вида Т-клеточных рецепторов — альфа/бетта и гамма/дельта? Как может один и тот же Т-клеточный рецептор подвергаться селекции дважды, причём в противоположных направлениях? Неизвестна также роль тимуса при старении. Здесь столько нерешённых вопросов, что остаётся удивляться, как это ещё не воскресили теорию Галена, согласно которой тимус — вместилище души!
26
Желточный мешок — источник самой ранней гемопоэти-ческой ткани, включая предшественники лимфоцитов.
ФАБРИЦИЕВА СУМКА (бурса; лат. bursa Fabricii) — специальный орган для дифференцировки В-лимфоцитов у птиц — выступ заднего отдела клоаки, содержащий многочисленные фолликулы и крипты. Сумка достигает максимальных размеров через несколько недель после вылупления птенца, затем постепенно атрофируется. У млекопитающих аналогичный орган не найден, хотя его роль пытались приписывать аппендиксу, миндалинам и др.
Медуллярый слой (М) — область, где первые стволовые клетки заселяют фолликулы бурсы.
Корковый слой (К) — место пролиферации В-лимфоцитов.
ПЕЧЕНЬ
У млекопитающих печень — главный гемо- и лимфопоэтичес-кий орган в период внутриутробного развития.
КОСТНЫЙ МОЗГ Родоначальные клетки (РК) для В-клеточной линии.
Область гемопоэза (ОГ). Точная анатомическая локализация лимфопоэза в печени и костном мозге неизвестна. Предполагается, что он происходит наряду с гемопоэзом других клеток в тесном контакте с макрофагами и клетками стромы. Здесь же в результате неудачной перестройки генов иммуноглобули-нов (рис. 9,15) или чрезмерной аутореактивности погибает около 70% всех развившихся В-клеток.
Синус (С) собирает дифференцированные клетки перед их выходом в кровь через центральную вену.
ТИМУС
Парный дольчатый орган, расположенный в верхнем отделе переднего средостения (у птиц — шеи); происходит из выпячивания в области 3-го и 4-го жаберных карманов. Аналогично бурсе максимальных размеров достигает в ранние сроки жизни, но атрофируется медленнее. Здесь костномозговые стволовые клетки преобразуются в зрелые Т-лимфоциты.
Гормоны. Многочисленные растворимые факторы, экстрагированные из тимуса, стимулируют созревание Т-клеток, о чём свидетельствуют функциональные свойства, поверхностные
маркёры или оба параметра. Общепринятой терминологии ещё нет, приводимый список далеко не полон:
Тимозин альфа1 (м. м. 3108), бетта1 (м. м. 8451), бетта4 (м. м. 4982).
Тимопоэтин I, II (м. м. 9562).
Тимозин (м. м. 3108), В (м. м. 8451), В4 (м. м. 4982).
Тимический гуморальный фактор (м. м. 3220).
Тимостимулин (м. м. 12 000).
Сывороточный фактор тимуса (тимулин) (м. м. 857).
Корковый слой — интенсивно окрашиваемый внешний слой, упакованный лимфоцитами, разделёнными удлинёнными эпителиальными клетками. Основное место пролиферации и селекции Т-лимфоцитов.
Медуллярный слой — внутренний, преимущественно эпителиальный, слой, куда перед выходом в кровь и лимфатические сосуды мигрируют лимфоциты из коркового слоя. Возможно, на границе медуллярного и коркового слоев проходят заключительные этапы селекции.
Посткапиллярная венула (ПКВ). через которую лимфоциты поступают в вены тимуса и затем в кровь.
Тельца Гассаля (ТГ) — специфичные для тимуса структуры, в которых эпителиальные клетки концентрически уплотнены и кератинизированы и где, возможно, удаляются клетки, подвергшиеся апоптозу.
Селекция. Ввиду своей значимости и сложности процесс селекции Т-лимфоцитов вызвал пристальное внимание. На сегодня известно, что он состоит из следующих стадий:
1) СD4-СD8-клетки пролиферируют во внешнем регионе коркового слоя, становятся CD4+ CD8+ и перестраивают гены Т-клеточного рецептора;
2) под влиянием стромальных клеток тимуса Т-лимфоциты, чьи ТКР распознали одну из имеющих «своих» молекул ГКГС (рис. 13,14), выживают, а все остальные гибнут;
3) клетки, распознавшие молекулу ГКГС класса I, теряют CD4 и сохраняют CD8, а клетки, распознавшие молекулу ГКГС класса II, сохраняют CD4 и теряют CD8 и, таким образом, становятся одинарными позитивными;
4) под влиянием макрофагов и дендритных клеток, представляющих «свои» антигены в виде коротких пептидов (рис. 17), элиминируются потенциально аутореактивные Т-клетки;
5) оставшиеся от исходной популяции клетки (около 2%) покидают тимус и образуют кооперацию периферических Т-лимфоцитов.
27
11. ПЕРИФЕРИЧЕСКИЕ ЛИМФОИДНЫЕ ОРГАНЫ И РЕЦИРКУЛЯЦИЯ ЛИМФОЦИТОВ
Способность к рециркуляции из крови в ткань и обратно через лимфоидную систему является уникальной для лимфоцитов и вместе с большой продолжительностью жизни и специфичностью к индивидуальным антигенам определяет их центральную роль в адаптивном иммунном ответе.
В результате кругооборота лимфоцитов, особенно в селезёнке и лимфатических узлах, обеспечивается максимальный контакт антигенпредставляющих клеток, недавно получивших воздействие антигена, с Т- и В-лимфоцитами, преадаптированными к ответу на этот антиген. В других условиях это происходит крайне редко.
Возросшие Т- и В-клеточные популяции распространяются по организму с готовностью к новой встрече с тем же антигеном, обеспечивая вторичный ответ.
Разные типы лимфоцитов заселяют различные области лим-фоидных органов (Т- и В-зоны), что вызвано уникальностью
местных хемотаксических факторов либо способностью различных лимфоцитов к распознаванию локальных структур, таких, как адгезивные молекулы на поверхности клеток сосудистого эндотелия или дендритных антигенпредставляющих клеток (рис. 7). В целом лимфатические узлы отвечают на антигены, вводимые в ткань, которые они дренируют, а селезёнка — на антигены, находящиеся в крови.
Кишечник, лёгкие, молочные железы и внешние слизистые оболочки также имеют свои собственные, менее специализированные лимфоидные зоны, которые в некоторой степени имеют отдельную сеть рециркуляции клеток, обозначаемых как лимфоидная ткань, ассоциированная со слизистыми оболочками. Это относится и к коже — лимфоидная ткань, ассоциированная с кожей (ЛТАКж). В каждом случае локальная лимфоидная система специализирована в отношении антигена, который с наибольшей вероятностью поступает в эти зоны.
28
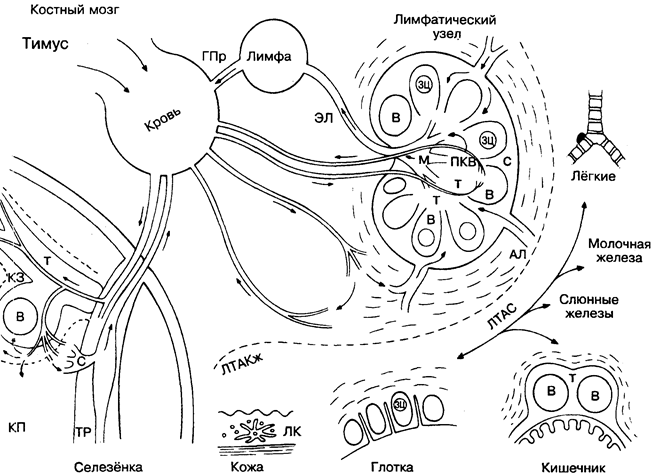
ЛИМФАТИЧЕСКИЙ УЗЕЛ
Лимфатические узлы составляют основную массу организованной лимфоидной ткани. Они расположены таким образом, что лимфа из большинства участков тела проходит через ряд лимфатических узлов до поступления в грудной проток (ГПр), который впадает в левую подключичную вену. Этот путь обеспечивает вновь рециркуляцию лимфоцитов через кровь.
Афферентный и эфферентный лимфатические сосуды, по которым лимфа поступает из ткани сначала в периферические, а затем в. центральные лимфатические узлы.
Лимфатический синус, через который лимфа поступает из афферентных лимфатических сосудов в корковые и медуллярные синусы.
Медуллярный синус собирает лимфу для выхода через эфферентный лимфатический сосуд. Именно в медуллярном слое происходит образование антител и преобладают плазматические клетки.
Зародышевый центр (ЗЦ) — зона большого числа клеток, которые развились в фолликуле после антигенной стимуляции. Предполагается, что он является местом генерации В-клеток памяти. Содержит специальные фолликулярные дендритные клетки, способные длительно (недели, возможно, годы) удерживать на своей поверхности связанный антиген.
Область Т-лимфоцитов, или паракортикальная зона, содержит в основном Т-лимфоциты, а также В-лимфоциты, мигрирующие в медуллярный слой. Дендритные клетки специализированы для представления антигена Т-лимфоцитам. Возможно, эта зона является наиболее вероятной для Т-В-клеточной кооперации. В других условиях это происходит крайне редко.
Посткапиллярная венула — специализированная венула с высоким кубическим эндотелием, через которую лимфоциты из крови поступают в паракортикальную зону, а затем в эфферентный лимфатический сосуд.
Селезёнка
Селезенка отличается от лимфатических узлов отсутствием лимфатического дренирования и наличием большого количества эритроцитов. У некоторых животных может быть эритропоэтическим органом или депо крови.
Трабекула (ТР) — соединительнотканная структура, окружающая сосуды, в основном венозные.
Область Т-лимфоцитов — лимфоидная муфта, состоящая главным образом из Т-клеток вокруг артерии.
Область В-лимфоцитов, или лимфоидный фолликул, располагается обычно по одну сторону лимфоидной муфты. Зародыше
вые центры находятся в фолликуле в непосредственной близости к фолликулярной артерии.
Краевая зона (КЗ) расположена между лимфоидной областью и красной пульпой, где лимфоциты поступают главным образом из кровотока в лимфоидную область, а эритроциты и плазматические клетки заселяют красную пульпу.
Красная пульпа (КП) — ретикулярная ячеистая сеть, через которую кровь проходит в венозные синусоиды и в которой обнаруживаются и удаляются повреждённые эритроциты. Для контраста лимфоидная область обозначается как белая пульпа. Макрофаги в красной пульпе и краевой зоне могут сохранять антиген подобно дендритным клеткам лимфатических узлов. Как и медуллярный слой лимфатических узлов, красная пульпа содержит множество плазматических клеток.
Синусоиды — большие полости, в которых собирается кровь перед поступлением в селезёночную вену.
Дата: 2018-12-28, просмотров: 486.