СПИСОК СОКРАЩЕНИЙ
АВМ - артериовенозная мальформация
АД - артериальное давление
АДГ - антидиуретический гормон
АКТГ - адренокортикотропный гормон
ВКИ - вентрикулокраниальный индекс
ВП - вызванные потенциалы
ВЧГ - внутричерепная гипертензия
ВЧД - внутричерепное давление
ВЧО - объем внутричерепных компонентов
ВЧОВЛ - высокочастотная осцилляторная вентиляция легких
ГЭБ - гематоэнцефалический барьер
ГЭК - гидроксиэтилкрахмал
ДСА - дигитальная субтракционная ангиография
ЖКТ - желудочно-кишечный тракт
ИВЛ - искусственная вентиляция легких
КО - коэффициент овершута
КТ - компьютерная томография
КТА - КТ-ангиография
ЛСК - линейная скорость кровотока
МК - мозговой кровоток
МНО - международное нормализованное отношение
МПК - минимальная подавляющая концентрация
МРА - магнитно-резонансная ангиография
МРТ - магнитно-резонансная томография
НИВЛ - неинвазивная вентиляция легких
ОРДС - острый респираторный дистресс-синдром
ОФЭКТ - однофотонная эмиссионная компьютерная томография
ОЦК - объем циркулирующей крови
ОЦН - острая церебральная недостаточность
ПДКВ - положительное давление в конце выдоха
ПЭТ - позитронно-эмиссионная томография
САК - субарахноидальное кровоизлияние
СВ - сердечный выброс
ТГВГ - тромбоз глубоких вен голеней
ТКДГ - транскраниальная допплерография
ТЛТ - тромболитическая терапия
ТЭЛА - тромбоэмболия легочной артерии
УЗИ - ультразвуковое исследование
ЦВД - центральное венозное давление
ЦК - церебральный комплаенс
ЦПД - церебральное перфузионное давление
ЧМТ - черепно-мозговая травма
ЧСС - частота сердечных сокращений
ШКГ - шкала комы Глазго
ЭЭГ - электроэнцефалография, электроэнцефалограмма
АСМV - искусственно-вспомогательная вентиляция легких (от assisted controlled mechanical ventilation)
BiPAP - вентиляция легких с двумя фазами положительного давления в дыхательных путях (от biphasic positive airway pressure)
CaO2 - содержание кислорода в артериальной крови
CMV - управляемая (искусственная) вентиляция легких (от controlled mechanical ventilation)
CPAP - самостоятельное дыхание с постоянно положительным давлением в дыхательных путях (от continuous positive airway pressure)
CvjO2 - содержание кислорода в оттекающей от мозга крови
DO2 - доставка кислорода
EtCO2 - концентрация углекислого газа в выдыхаемом воздухе
FiO2 - концентрация кислорода во вдыхаемой смеси
PaCO2 - напряжение двуокиси углерода в артериальной крови
PaO2 - напряжение кислорода в артериальной крови
PbrO2 - напряжение кислорода в веществе головного мозга
PCV - вентиляция с контролируемым давлением (от pressure control ventilation)
PS - поддержка дыхания давлением (от pressure support)
SIMV - синхронизированная принудительная перемежающаяся вентиляция легких (от synchronized intermittent mandatory ventilation)
SvjO2 - насыщение гемоглобина кислородом в луковице внутренней яремной вены
SаO2 - насыщение гемоглобина артериальной крови кислородом
WFNS - Международная федерация неврологических хирургов (от World Federation of Neurologic Surgeons)
ВВЕДЕНИЕ
Интенсивная терапия больных с острой церебральной недостаточностью (ОЦН) - крайне актуальная проблема современной нейрохирургии и нейрореаниматологии. Черепно-мозговая травма (ЧМТ), геморрагический инсульт, разрывы артериальных аневризм головного мозга и ишемический инсульт остаются одними из главных причин смертности и инвалидизации пациентов трудоспособного возраста.
При возникновении как травматического, так и нетравматического внутричерепного кровоизлияния или ишемического инсульта развиваются первичное и вторичное повреждения вещества мозга. Первичным называют поражение мозга, вызванное воздействием непосредственно повреждающего агента (например, травмы, геморрагического инсульта или разрыва артериальной аневризмы головного мозга). В области первичного повреждения ткань мозга погибает. Вокруг погибших клеток формируется зона перифокального торможения, или зона пенумбры (рис. 1, см. цв. вклейку). В этой зоне клетки мозга сохраняют жизнеспособность, но становятся крайне чувствительными к малейшим изменениям доставки кислорода и питательных субстратов.
Ухудшение состояния пенумбры, или условно интактного вещества мозга, вследствие каких-либо воздействий после развития первичного повреждения называют вторичным ишемическим повреждением ткани мозга. Так, частота развития вторичных ишемических повреждений головного мозга у больных с внутричерепными кровоизлияниями составляет 39-91%, а изменения, характерные для ишемии, выявляют у 80-90% умерших больных.
Один из факторов, способствующих понижению устойчивости вещества мозга к ишемическим повреждениям, - уменьшение мозгового кровотока (МК) в первые несколько суток после развития внутричерепной катастрофы. Нормальное функционирование головного мозга человека возможно лишь при условии постоянного и достаточного кровоснабжения, объем которого значительно больше, чем во всех других органах. Несмотря на небольшую массу головного мозга (2% от массы тела), на его кровоснабжение расходуется 20% сердечного выброса. В головном мозге поддерживается высокий уровень метаболической активности, однако мозг не имеет запасов питательных веществ, и даже кратковременные нарушения церебральной перфузии могут привести к нарушению его функций.
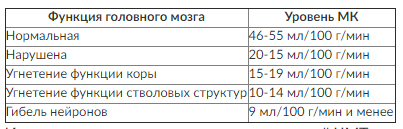
Нормальная скорость объемного МК составляет 46-55 мл/100 г/мин. Она различна в коре головного мозга и белом веществе. Кровоток в коре головного мозга значительно выше, чем в белом веществе, и в норме составляет 50-60 мл/100 г/мин. Нормальными значениями МК в белом веществе мозга считают 20-30 мл/100 г/мин. Снижение МК до уровня ниже 10-15 мл/100 г/мин приводит к развитию выраженной ишемии головного мозга и коррелирует с вероятностью неблагоприятного прогноза заболевания (табл. 1).
Таблица 1. Зависимость функционального состояния головного мозга от МК
Известно, что в первые сутки после тяжелой ЧМТ мозговой кровоток в зоне пенумбры снижается примерно в 2 раза по сравнению с нормой. В последующие 2-3 сут МК восстанавливается до нормальных значений, однако в некоторых случаях развивается церебральная гиперемия. У больных с субарахноидальным кровоизлиянием (САК) вследствие разрыва церебральных аневризм мозговой кровоток в первые сутки после кровоизлияния несколько увеличивается, в последующие 2-3 сут уменьшается до 30-40 мл/100 г/мин и достигает нормальных значений к исходу седьмых суток после кровоизлияния.
В раннем периоде внутричерепного кровоизлияния может наблюдаться мозаичность мозгового кровотока. Объемный МК в зоне ушиба и прилегающей ткани мозга существенно снижается по сравнению с интактным веществом мозга.
Несмотря на снижение МК, метаболическая активность головного мозга в условиях повреждения значительно возрастает. Формируется несоответствие между потребностью поврежденной ткани в кислороде и его доставкой к головному мозгу. Недостаток кислорода приводит к переходу клеток мозга на анаэробный метаболизм, что выражается в повышении концентрации лактата в веществе головного мозга.
Развитие вторичных ишемических повреждений головного мозга повышает риск развития летального исхода и ухудшает неврологическое восстановление больных с ОЦН. В связи с этим профилактика и лечение вторичных повреждений мозга - важнейшая задача интенсивной терапии пострадавших с тяжелой ЧМТ, больных с нетравматическими внутричерепными кровоизлияниями и ишемическим инсультом.
К основным факторам вторичного ишемического повреждения головного мозга относят артериальную гипотензию, гипоксемию, гипер- и гипокапнию, анемию, гипертермию и внутричерепную гипертензию. Все эти состояния запускают цепь патологических реакций, приводящих к нарушению доставки кислорода и питательных субстратов к клеткам головного мозга.
Наиболее значимые факторы вторичного повреждения мозга - артериальная гипотензия и гипоксемия. Возникновение даже кратковременных эпизодов артериальной гипотензии и гипоксемии у больных с ОЦН, находящихся в критическом состоянии, приводит к увеличению летальности и частоты неблагоприятных неврологических исходов.
Важный фактор вторичного ишемического повреждения мозга - гипокапния. Снижение напряжения CO2 в артериальной крови вызывает вазоконстрикцию и приводит к выраженным нарушениям перфузии головного мозга. Так, длительная гипокапния сопровождается увеличением летальности у пострадавших с тяжелой и больных с нетравматическими внутричерепными кровоизлияниями.
Концентрация гемоглобина влияет на эффективность доставки кислорода к пораженному мозгу. В экспериментальных исследованиях показано, что возникновение выраженной анемии при развитии внутричерепного кровоизлияния сопровождается появлением ишемического паттерна церебрального метаболизма. Анемию считают независимым фактором риска развития неблагоприятного исхода и ишемического вазоспазма у больных с САК вследствие разрыва артериальной аневризмы головного мозга.
Частота развития гипертермии у больных с ОЦН достигает 70%. Гипертермия - важный фактор вторичного повреждения мозга, приводящий к увеличению летальности и времени пребывания больных в отделении реанимации и стационаре. Повышение температуры тела сопровождается ростом потребления кислорода, что приводит к увеличению мозгового кровотока и повышению внутричерепного давления, а также может сопровождаться нарушением ауторегуляции МК.
Частота развития внутричерепной гипертензии у пострадавших с ЧМТ и больных с нетравматическими внутричерепными кровоизлияниями составляет 30-80%. Возникновение внутричерепной гипертензии повышает вероятность развития неблагоприятного исхода заболевания.
Практически все методы, используемые в практике работы отделений нейрореанимации, связаны с профилактикой и лечением вторичных ишемических повреждений головного мозга. К мероприятиям, способствующим восстановлению и поддержанию нормальной церебральной перфузии и оксигенации, относят снижение внутричерепного давления, поддержание нормокапнии, увеличение концентрации кислорода во вдыхаемой смеси, создание артериальной гипертензии, гиперволемии и гемодилюции.
В настоящем руководстве представлены современные принципы обследования и лечения больных с травматическими и нетравматическими внутричерепными кровоизлияниями, находящихся в критическом состоянии.
ЗРАЧКОВЫЕ НАРУШЕНИЯ
Следующие зрачковые нарушения позволяют определить локализацию очага поражения (рис. 2-1):
• умеренный миоз с сохраненной реакцией на свет как элемент синдрома Горнера - поражение задневентральных отделов гипоталамуса (начальные проявления транстенториальной дислокации) или латеральных отделов продолговатого мозга и спинного мозга на шейном уровне;
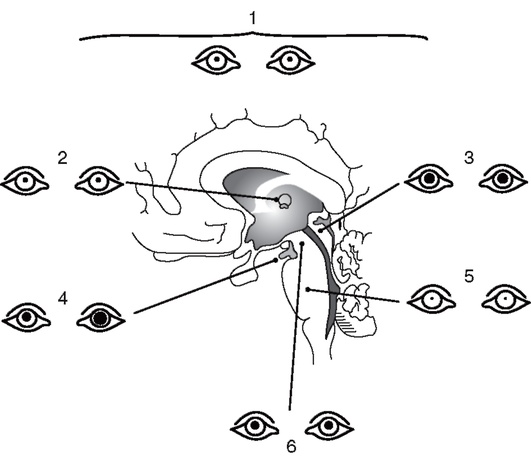
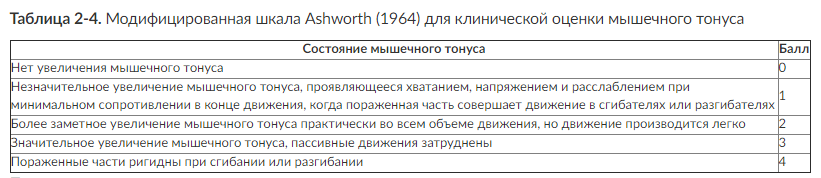
Рис. 2-1. Состояние зрачков у больных в коматозном состоянии при различной локализации поражения структур мозга (по Plam F., Posner J., 1986): 1 - нарушения метаболизма (узкие зрачки, реагирующие на свет); 2 - диэнцефальное поражение (узкие зрачки, реагирующие на свет); 3 - тектальное поражение (широкие фиксированные зрачки, гиппус); 4 - височно-тенториальная дислокация (поражение III нерва, широкий фиксированный зрачок на стороне поражения); 5 - поражение моста (точечные зрачки); 6 - поражение среднего мозга (фиксированные умеренно расширенные зрачки)
• умеренный мидриаз, отсутствует реакция на свет - поражение покрышки моста и области ядер среднего мозга;
• резкое двустороннее сужение зрачков - поражение покрышки моста, обычно при кровоизлиянии;
• односторонний фиксированный мидриаз - поражение III нерва, прижатие его крючком гиппокампа к краю намета мозжечка при височно-тенториальной дислокации.
ГЛАЗОДВИГАТЕЛЬНЫЕ НАРУШЕНИЯ
При исследовании движений глаз у способных к контакту больных сопоставляют произвольные и рефлекторные движения глаз и век. У больных в коматозном состоянии исследуют только рефлекторные движения глаз и век.
Оценка положения век
В состоянии комы и во сне глаза закрыты в результате тонического напряжения круговых мышц глаз (лицевой нерв, ретикулярная формация ствола мозга). Тонус мышц век оценивают, приподнимая и освобождая их. У больных в коме после освобождения поднятые веки постепенно закрываются. Неполное смыкание свидетельствует о нарушении функции лицевого нерва на этой стороне. Выраженное сопротивление открыванию глаз или быстрое смыкание век может наблюдаться при психической ареактивности (истерия) и блефароспазме «органического» генеза. Иногда при коматозном состоянии отмечается широкое, тоничное открытие глаз при отсутствии мигательных движений. Очаг поражения при таком состоянии локализуется в мосту мозга.
Мигательный рефлекс
Наличие спонтанных мигательных движений свидетельствует о сохранности ретикулярной формации моста мозга, а наличие мигательных движений в ответ на свет и звук - о сохранности соответствующих афферентных путей. Отсутствие мигательных движений на одной из сторон отмечается при нарушении функций лицевого нерва, на двух сторонах - при структурном или метаболическом нарушении функций ретикулярной формации.
Птоз (опущение) верхнего века
Птоз верхнего века наблюдается при нарушении функции m. levator palpebrae, которая иннервируется глазодвигательным нервом (ядро в среднем мозге). Поражение глазодвигательного нерва в орбите и на основании черепа, его волокон и ядра в стволе проявляется односторонним птозом с расширением зрачка и нарушением его реакции на свет на той же стороне. Двусторонний птоз наблюдается при поражении оральных отделов среднего мозга. При нарушении симпатической иннервации глаза также возникает птоз, входящий в этом случае в состав синдрома Горнера (птоз, миоз, энофтальм). При этом птоз, как правило, бывает неполным (сужение глазной щели) и сопровождается сужением зрачка с живой реакцией на свет. При церебральной патологии птоз наблюдается в основном при поражении нижних отделов моста и продолговатого мозга.
Нарушения взора (содружественных движений глаз)
Корковый центр взора находится в лобной доле и обеспечивает содружественный поворот глазных яблок в противоположную сторону. Повреждение коркового центра или его связей с медиальным продольным пучком приводит к парезу взора в сторону. Так, при повреждении левой лобной доли развивается парез взора вправо: глазные яблоки отклоняются влево, невозможен взор в сторону гемипареза конечностей. При раздражении коркового центра взора (эпилептический припадок, первые часы кровоизлияния) взор обращен в противоположную сторону. Например, при раздражении левой лобной доли глазные яблоки отклонены вправо.
Существует также центр горизонтального взора в мосту мозга в области ядра отводящего нерва. При поражении мостового центра, в отличие от коркового, возникает паралич взора в сторону очага, глаза обращены в сторону парализованных конечностей. Также при этом нарушается окулоцефалический рефлекс.
Окулоцефалический рефлекс (феномен головы и глаз куклы)
Рефлекс вызывают, быстро поворачивая и кратковременно удерживая голову больного то вправо, то влево, а также разгибая и сгибая шею (рис. 2-2). При этом глаза отклоняются в противоположном направлении (например, при повороте головы влево глаза отклоняются вправо). Исследовать этот рефлекс можно только при отсутствии травмы шейного отдела позвоночника. У пострадавших с тяжелой ЧМТ голову можно поворачивать только в горизонтальной плоскости. Нормальный окулоцефалический рефлекс отражает сохранность лабиринтов, проприорецепторов шеи, вестибулярных ядер и их связей с ядрами глазодвигательных нервов, медиальным продольным пучком. Если при поворотах головы глазные яблоки остаются в прежнем положении, то повреждение локализуется на уровне ядер отводящих нервов, вестибулярных ядер и их связей. Если при поворотах головы сохранено отведение глаза, но нарушено приведение, то очаг поражения расположен на уровне медиального продольного пучка, осуществляющего связи между ядрами отводящего и глазодвигательного нервов. Асимметричное несодружественное отклонение глаз и несодружественные движения глаз при оценке окулоцефалического рефлекса свидетельствуют о структурном повреждении ствола мозга.
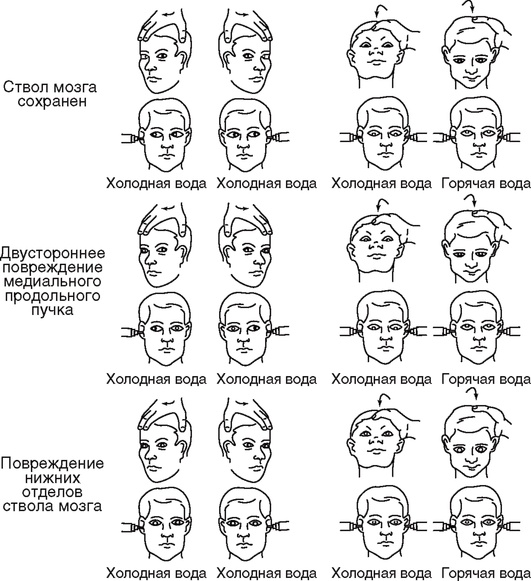
Рис. 2-2. Глазодвигательные рефлексы у больных в бессознательном состоянии. Движения глазных яблок во время оценки окулоцефалического (верхний ряд каждого рисунка) и окуловестибулярного (нижний ряд каждого рисунка) рефлексов при различных повреждениях головного мозга (по Plam F., Posner J., 1986)
Окуловестибулярный рефлекс (холодовая проба)
Пробу проводят в тех случаях, когда при оценке окулоцефалического рефлекса не удалось выявить каких-либо движений глазных яблок, а также в случае предположительной травмы черепа или шейного отдела позвоночника. Перед проведением пробы необходимо произвести отоскопию и убедиться в целости барабанных перепонок. При сохранном стволе мозга от варолиева моста до среднего мозга введение ледяной воды в слуховой проход вызывает отклонение глазных яблок в сторону раздражаемого слухового прохода. Вертикальные отклонения глазных яблок можно оценить с помощью одновременной стимуляции обеих барабанных перепонок. Так же как и рефлекс «глаз куклы», положительный окуловестибулярный рефлекс наблюдается при коматозном состоянии, развившемся вследствие двустороннего поражения полушарий головного мозга или угнетения их функций метаболического генеза. Отсутствие окуловестибулярного рефлекса указывает на поражение среднего мозга или моста.
Парез взора вверх
Парез взора вверх возникает при поражении на медиодиэнцефальном уровне (претектальная зона, область задней комиссуры) или при двустороннем поражении медиального продольного пучка. У больных в состоянии сопора и комы оценить вертикальный взор можно, раздражая роговицу глаза (при этом должно происходить отклонение глаз вверх), а также исследуя окулоцефалический рефлекс. Содружественное отклонение глаз вниз может отмечаться при аксиальной дислокации головного мозга вследствие сдавления среднего мозга.
Разностояние глазных яблок по вертикали
Разностояние глазных яблок по вертикали (симптом Гертвига-Мажанди) наблюдается при поражении дорсолатеральных отделов моста и медиального продольного пучка. Симптом возникает при дислокации ствола мозга и возникновении патологических процессов в задней черепной ямке.
Поплавковые движения глаз
Поплавковые движения глаз - периоды быстрых содружественных движений глаз вниз с последующим возвращением в исходное положение отмечаются при повреждениях каудальных отделов моста.
Плавающие движения глазных яблок
Плавающие движения глазных яблок у больных в коматозном состоянии напоминают таковые при сне у здорового человека и свидетельствуют о сохранности стволовых структур. Такие движения глазных яблок наблюдаются при двустороннем полушарном или диффузном повреждении мозга.
Корнеальный рефлекс
Корнеальный рефлекс - смыкание век при легком прикосновении к роговице глаза. Дуга рефлекса включает первую ветвь тройничного нерва, основное чувствительное ядро тройничного нерва, ядро и волокна лицевого нерва (уровень средней и нижней части моста мозга). Смыкание век обычно сопровождается отклонением глазных яблок вверх (феномен Белла), которое обеспечивается связями с ядрами глазодвигательного нерва (покрышка среднего мозга). Корнеальный рефлекс снижается или исчезает при поражении ствола мозга в области задней и средней черепных ямок. Постепенное угасание рефлекса может свидетельствовать о нарастании аксиальной дислокации.
НАРУШЕНИЯ ДВИГАТЕЛЬНОЙ СФЕРЫ
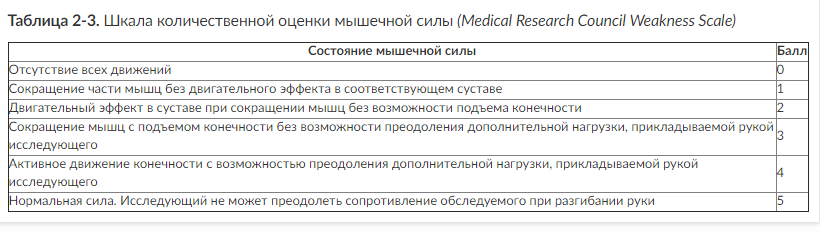
У больных с ОЦН, находящихся в коматозном состоянии, исследование двигательных функций проводят для топической диагностики и определения динамики течения заболевания. Оценивают двигательные реакции, возникающие при нанесении болевых раздражений на различные части тела (грудина, супраорбитальные точки, ногтевое ложе) с обеих сторон. Нормальная реакция проявляется отталкиванием раздражителя, отдергиванием конечностей, отстранением тела и может сопровождаться гримасой на лице и стоном. Оценивают симметричность движений и мышечную силу. Для оценки мышечной силы следует использовать шкалу количественной оценки мышечной силы (табл. 2-3).
Особое внимание следует обращать на симметричность мышечного тонуса. Пассивными движениями во всех конечностях последовательно проверяют наличие сгибательного (декортикационный) и разгибательного (децеребрационный) гипертонуса. Гипертонус указывает на топический уровень первичного повреждения и стадию дислокационного процесса. Количественно мышечный тонус можно измерить в баллах модифицированной шкалы Ashworth, 1964 (табл. 2-4).
Патологическими считают следующие двигательные реакции.
• Сгибание рук и разгибание ног (декортикационная ригидность). При нанесении раздражения развивается медленное сгибание рук, запястий и пальцев с приведением рук в сочетании с разгибанием, поворотом внутрь и подошвенным сгибанием ног. Фрагментарные проявления этой реакции имеют такое же локально-диагностическое значение, как и полные, и отражают меньший размер и меньшую степень воздействия патологического очага. Патологические сгибательные реакции рук с разгибанием или без разгибания ног наблюдаются при преобладании поражения полушарий мозга и редко сочетаются с глазодвигательными нарушениями.
• Разгибание рук и ног (децеребрационная ригидность). Руки разогнуты, приведены и пронированы; ноги разогнуты, приведены, подошвенное сгибание стоп. Такая двигательная реакция характерна для вовлечения в патологический процесс среднего мозга и оральных отделов моста при массивном двустороннем полушарном поражении, патологическом процессе в задней черепной ямке со сдавлением ствола мозга и прогрессирующей дислокации на тенториальном уровне. Глазодвигательные нарушения отмечаются у большинства больных. Спонтанные, возникающие без воздействия внешнего раздражителя тонические спазмы, преимущественно разгибательные, но также чередующиеся со сгибанием в руках, С.Н. Давыдов (1919) назвал горметонией (от греческого horme - приступ и tonos - напряжение). Горметонические спазмы цикличны, обладают определенным ритмом и продолжительностью и могут иметь тетра-, пара- и моноплегическое распределение. Они часто совпадают с дыхательными движениями. Н.К. Боголепов (1953), изучая двигательные нарушения у больных с кровоизлияниями в мозг, выделил симптомы, позволяющие определить сторону поражения при наличии горметонии у больного, находящегося в коматозном состоянии:
— меньшее смыкание глазной щели на стороне паралича;
— на стороне паралича ощущается меньшее сопротивление (напряжение) при попытке пассивно раскрыть веки;
— пассивно поднятое верхнее веко на здоровой стороне опускается и закрывает глаз быстрее, чем на парализованной;
— при постукивании по скуловым дугам на здоровой стороне сокращается лицевая мускулатура, на стороне паралича сокращение отсутствует;
— при вызывании рефлексов орального автоматизма (хоботкового, губного, ладонно-подбородкового) выявляется асимметрия: мышцы рта и подбородка не сокращаются на стороне паралича;
— иногда снижается роговичный рефлекс на стороне паралича;
— поворот головы и глаз в сторону очага поражения;
— рефлекторное отведение нижней челюсти в сторону паралича и частичный спазм жевательной мускулатуры при вызывании корнеального рефлекса на здоровой стороне;
— меньшая выраженность менингиального симптома Кернига на стороне паралича в силу развивающейся гипотонии;
— наличие двигательного беспокойства и насильственных движений в конечности на стороне очага;
— изменение рефлексов: большая выраженность сухожильных и защитных рефлексов, меньшая выраженность суставных и кожных рефлексов на стороне паралича;
— положение стопы: на стороне паралича - поворот кнаружи, на стороне очага - тоническое вращение внутрь;
— рано возникающий цианоз дистальных отделов ноги на стороне паралича;
— отставание при дыхании половины грудной клетки на стороне паралича;
— редко - эпилептические припадки, начинающиеся с противоположных очагу конечностей;
— при повороте головы в сторону очага исчезает тонус разгибателей предплечья противоположной руки и одновременно на руке, к которой обращен подбородок, развивается тоническое сгибание, усиливается тонус разгибателей предплечья;
— патологический разгибательный рефлекс большого пальца ноги в начальной стадии комы появляется раньше на стороне паралича, в конечной стадии комы он угасает раньше на стороне паралича;
— иногда у больных на стороне, противоположной параличу, возникают избыточные движения в руке и ноге, чаще флексорного типа.
Горметонию часто сопровождают вегетативные нарушения: гипергидроз, гиперемия лица, гипертермия, артериальная гипертензия, сердечные и дыхательные аритмии, острые эрозии желудочнокишечного тракта (ЖКТ).
• Разгибательные реакции рук с атонией или слабой сгибательной реакцией ног возникают у больных с поражением ствола мозга на уровне покрышки моста, вестибулярных ядер.
• Мышечная атония, или отсутствие двигательных реакций, может возникать как при поражении периферического двигательного нейрона (например, при полинейропатии), так и при нарушении двигательных путей на уровне нижних отделов моста и продолговатого мозга. Исследование тонуса мышц в остром периоде поражения головного мозга у больных, находящихся в коматозном состоянии, позволяет установить наличие паралича и сторону поражения мозга. Для этого используют следующие приемы (Боголепов Н.К., 1962).
— Исследуют симптомы гипотонии век (см. выше).
— Поднимают обе вытянутые руки больного и отпускают их. На стороне паралича вследствие резкой гипотонии рука падает как плеть, причем не ощущается того минимального напряжения, которое остается даже в коматозном состоянии в непарализованной конечности.
— Сгибают обе руки в локтевом суставе на 90° и отпускают их. На стороне паралича кисть и предплечье падают более пассивно.
— Пытаются насильно разводить пальцы на руках. На стороне паралича отмечается меньшее тоническое напряжение, чем на здоровой стороне.
— Сгибают бедра под прямым углом к туловищу, а голени под прямым углом к бедрам. На стороне паралича нога, пассивно разгибаясь, больше отпадает кнаружи.
— Путем осмотра и пальпации определяют состояние мышц бедра. На стороне паралича отмечается уплотнение бедра и кажущееся увеличение (расширение) его вследствие потери тонуса бедренных мышц.
— Исследуют симптом Кернига. На стороне паралича напряжение сгибателей голени выражено слабее и отсутствует содружественное сгибание парализованной ноги при исследовании нижнего симптома Брудзинского.
— Сгибают голову вперед для определения ригидности мышц затылка. Парализованная нога при этом остается неподвижной, в то время как другая сгибается (верхний симптом Брудзинского).
— Разгибают ногу в коленном суставе, поднимая стопу за пятку и прижимая колено к постели (симптом Оршанского).
— Исследуют симптом ротированной стопы: обе стопы пассивно поворачивают кнаружи до крайнего предела, затем руки быстро убирают. При этом стопа парализованной ноги не возвращается окончательно в исходное положение вследствие нарушения тонуса и силы мышц, вращающих ногу.
— Нарушенные двигательные реакции свидетельствуют как об уровне, так и о стороне максимального повреждения мозга. Наличие патологических сгибательных реакций рук при наличии или отсутствии разгибательных реакций ног позволяет сделать предположение о более распространенном и менее тяжелом супратенториальном поражении. Наличие разгибательной реакции рук и ног указывает на более глубинные и тяжелые, но все же преимущественно супратенториальные повреждения. Разгибательная реакция рук, сочетающаяся со сгибанием ног, наблюдается при нарушении функций ствола мозга в области моста. Диффузная мышечная атония с отсутствием реакций на стимуляцию обычно коррелирует с повреждением ствола на нижнем понтомедуллярном уровне или дистальнее его (Plam F., Posner J., 1986).
МЕНИНГИАЛЬНЫЕ СИМПТОМЫ
К основным менингиальным симптомам относят:
• ригидность мышц затылка;
• симптом Кернига (тоническое напряжение мышц-сгибателей тазобедренных и коленных суставов);
• тризм (тоническое напряжение жевательных мышц);
• тоническое сокращение лицевых мышц, возникающее на стороне раздражения при перкуссии по скуловой дуге (симптом Бехтерева), давлении на переднюю стенку слухового прохода, супраорбитальную точку.
Основными причинами возникновения менингиальных симптомов у больных с ОЦН являются:
• раздражение мозговых оболочек при САК и вентрикулярном кровоизлиянии, а также при оболочечной гематоме;
• вовлечение мозговых оболочек в воспалительный процесс при менингите, менингоэнцефалите и т.п.;
• раздражение оболочек мозга вследствие внутричерепной гипертензии, увеличения объема мозга при отеке и острой гидроцефалии;
• нарушение функций подкорково-стволовых тоногенных образований при дислокации, ушибе мозга.
Нередко наблюдается сочетание нескольких факторов. Увеличение выраженности менингиальных симптомов может свидетельствовать о развитии менингита, повторного кровоизлияния, внутричерепной гипертензии, окклюзионной гидроцефалии и дислокационного синдрома. Диссоциация менингеальных симптомов по оси тела наблюдается при поражении и дислокации стволово-подкорковых структур (преобладание симптома Кернига над ригидностью мышц затылка) и при локализации патологического процесса (кровоизлияние, травматическая гематома) в задней черепной ямке (преобладание ригидности затылочных мышц над симптомом Кернига). Симптом Кернига может иметь латерализационное значение: он более выражен на стороне оболочечной гематомы, асимметричного САК и абсцесса мозга и менее выражен на стороне центрального паралича (при полушарном кровоизлиянии).
ДИСЛОКАЦИЯ СТВОЛА ГОЛОВНОГО МОЗГА
Один из факторов, определяющих тяжесть состояния больного с ОЦН, - дислокация и сдавление ствола мозга. Ствол мозга на уровне среднего мозга окружен плотным краем мозжечковой вырезки, а на границе продолговатого и спинного - краем большого затылочного отверстия (рис. 2-3).
При увеличении объема содержимого супратенториального пространства в зависимости от расположения патологического очага и направления смещения мозга наблюдаются следующие виды дислокации головного мозга (рис. 2-4):
• вклинение поясной извилины под большой серповидный отросток (боковая дислокация);
• вклинение диэнцефальной области в тенториальное отверстие и смещение ствола вниз (каудально) по оси - центральная или транстенториальная дислокация;
• вклинение крючка гиппокампа между краем мозжечкового намета и ножкой мозга, приводяшая к боковому смещению и сдавлению среднего мозга (височно-тенториальная дислокация).
При увеличении объема содержимого субтенториального пространства, которое в норме занимает ствол мозга и мозжечок, развивается вклинение части червя мозжечка в тенториальную вырезку со сдавлением верхних отделов среднего и промежуточного мозга (мозжечково-тенториальная дислокация) или/и направленная вниз дислокация миндаликов мозжечка в большое затылочное отверстие со сдавлением и смещением продолговатого мозга (см. рис. 2-4). Непосредственное давление на покрышку моста и среднего мозга приводит к ишемии и отеку этих структур.
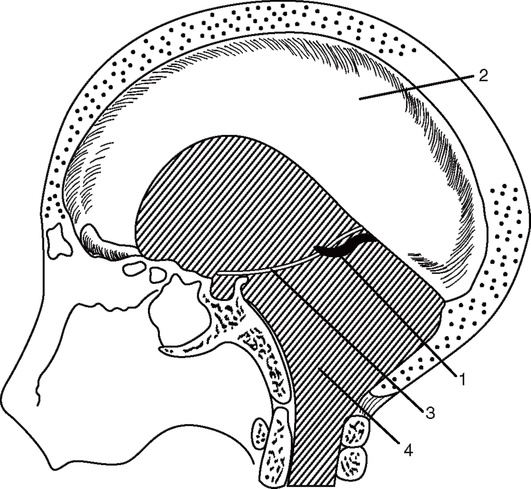
Рис. 2-3. Большой серповидный отросток и намет мозжечка на саггитальном распиле черепа: 1 - большая вена мозга (вена Галена); 2 - большой серповидный отросток; 3 - свободный край мозжечкового намета; 4 - большое затылочное отверстие (по Блинкову С.М., Смирнову Н.А., 1967)
При супратенториальных объемных поражениях мозга патологические изменения проявляются вазомоторным параличом, полнокровием, отеком, распространяющимся на соседние участки мозга сначала радиально от очага, а затем рострокаудально (сверху вниз). Этот процесс непрерывно прогрессирует. Патологические изменения распространяются в рострокаудальном направлении, напоминая неуклонно продвигающуюся волну, которая создает серию последовательных срезов функциональных нарушений. Этот процесс наблюдается даже тогда, когда тенториальное вклинение и смещение вниз в конечном итоге приводят к повреждению ствола мозга, и отражается в определенной последовательности появления клинических симптомов. Последовательно возникают дыхательные, офтальмологические и двигательные нарушения, указывающие на угнетение функций сначала диэнцефальной области, затем среднего мозга, моста и продолговатого мозга (Plam F., Posner J., 1986).
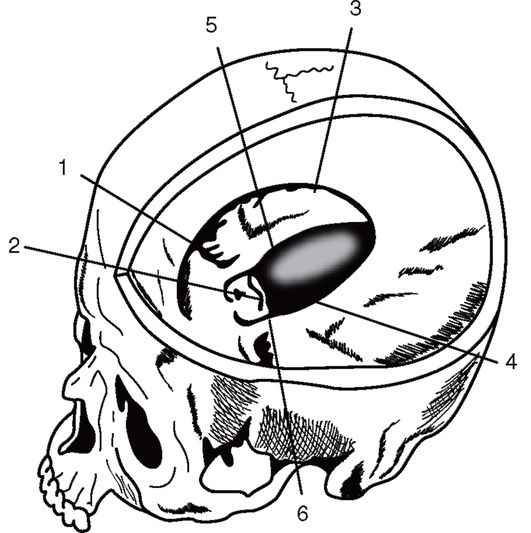
Рис. 2-4. Большой серповидный отросток и намет мозжечка: 1 - край малого крыла основной кости; 2 - спинка турецкого седла; 3 - свободный край большого серповидного отростка; 4,5 - свободный край намета мозжечка; 6 - каменисто-клиновидная связка (по Блинкову С.М., Смирнову Н.А., 1967)
Боковая дислокация (рис. 2-5) возникает при поражениях полушарий головного мозга, преимущественно в лобных и теменных долях. Отмечается смещение поясной извилины под большой серповидный отросток. Почти всегда диагностируют смещение промежуточного мозга через вырезку намета мозжечка.
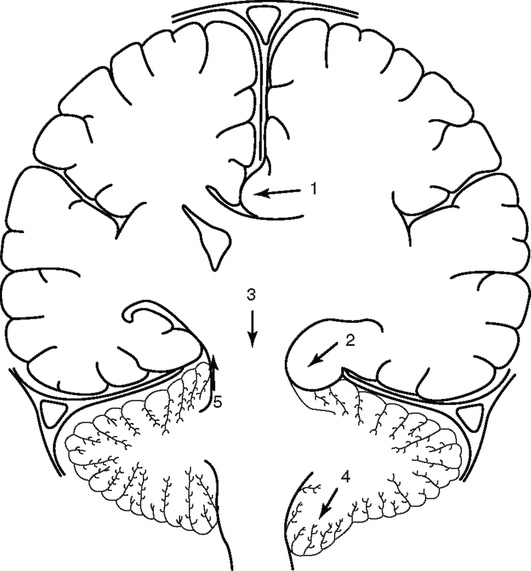
Рис. 2-5. Основные виды дислокации головного мозга: 1 - боковая - под большой серповидный отросток; 2 - височно-тенториальная (вклинение крючка гиппокампа через вырезку мозжечкового намета); 3 - центральная транстенториальная или аксиальная; 4 - дислокация миндаликов мозжечка в большое затылочное отверстие; 5 - мозжечково-тенториальная или направленная вверх транстенториальная дислокация при изолированном повышении субтенториального давления
При центральной транстенториальной дислокации выделяют следующие стадии.
• Диэнцефальная стадия. Нарушается концентрация внимания и память, возникает состояние возбуждения или сонливости. Затем (ранняя диэнцефальная стадия) дыхание прерывается зевотой, глубокимим вдохами, паузами, иногда по типу Чейна-Стокса. Зрачки сужены, фотореакции вызываются только сильным светом. Глазные яблоки в состоянии содружественного покоя или совершают содружественные плавающие движения. Окулоцефалические рефлексы не нарушены. Адекватные двигательные реакции на болевое раздражение; двусторонний рефлекс Бабинского; возможно паратоническое сопротивление (противодержание).
• Стадия среднего мозга - верхних отделов моста. Кома. Тахипноэ. Возможны колебания температуры и развитие несахарного диабета. Зрачки расширяются до 3-5 мм и фиксируются. Трудно вызывается окулоцефалический рефлекс. В покое - обездвиженность. При болевом раздражении - децеребрационная ригидность, особенно на стороне, противоположной полушарному очагу.
• Стадия нижних отделов моста - верхних отделов продолговатого мозга. Кома. Дыхание поверхностное, частое (20-40 в минуту) или атактическое. Зрачки средней величины, на свет не реагируют. Окулоцефалический рефлекс отсутствует. Обездвиженность и мышечная атония. Отсутствие реакции на боль. Двусторонний рефлекс Бабинского, иногда - защитный рефлекс сгибания ног при раздражении стопы.
• Стадия продолговатого мозга (терминальная). Дыхание замедленное, нерегулярное по частоте и глубине, периоды гаспинга. Пульс меняется от замедленного до учащенного, артериальная гипотония. В итоге происходит остановка дыхания. Зрачки максимально расширяются. Мышечная атония.
При височно-тенториальной дислокации выделяют следующие стадии.
• Ранняя стадия глазодвигательного нерва. Сознание может быть ненарушенным (или наблюдается оглушение). Умеренная анизокория с ослаблением реакции расширенного зрачка на свет. Двигательные нарушения обусловлены полушарным очагом. Дыхание, движения глаз, окулоцефалические рефлексы не нарушены. Состояние больного может изменяться в течение нескольких часов от ясного сознания до глубокой комы.
• Поздняя стадия глазодвигательного нерва. Быстрое прогрессирование симптомов вклинения. Гипервентиляция. Резкая анизокория с мидриазом на стороне вклинения. Фотореакция расширенного зрачка отсутствует, затем полная офтальмоплегия. Нарушение, затем отсутствие окулоцефалического рефлекса. Гомолатеральный полушарному очагу гемипарез вследствие сдавления противоположной ножки мозга вырезкой намета мозжечка. Двусторонние патологические симптомы, затем децеребрационная ригидность.
• Стадия среднего мозга - верхних отделов моста. Кома. Зрачок, противоположный ранее расширенному, расширяется и фиксируется. Гиперпноэ. Нарушение или отсутствие окулоцефалических рефлексов. Двусторонняя децеребрационная ригидность. С этого момента клинические признаки вклинения крючка гиппокампа соответствуют клиническим признакам центрального вклинения.
Дислокация миндаликов мозжечка в большое затылочное отверстие приводит к компрессии продолговатого мозга и полному прекращению функции дыхания и кровообращения.
Мозжечково-тенториальная, или направленная вверх транстенториальная, дислокация представляет собой смещение мозжечка и промежуточного мозга через тенториальную вырезку. Данный вид дислокации возникает при увеличении объема структур задней черепной ямки. Происходит сдавление дорсальной поверхности промежуточного мозга, прилежащих сосудов и водопровода мозга, развивается обструктивная гидроцефалия. Зрачки сужены и фиксированы по средней линии, отмечается децеребрационная или, реже, декортикационная ригидность. При оценке окулоцефалических и окуловестибулярных рефлексов диагностируют паралич взора вверх при живых латеральных движениях.
Глава 3. Нейромониторинг
Мониторинг - важная часть интенсивной терапии больных с ОЦН, находящихся в критическом состоянии.
По объему используемых методов обследования можно выделить несколько уровней мониторинга.
• Уровень 1. Постоянный мониторинг частоты сердечных сокращений (ЧСС) и ритма сердца, пульсоксиметрия, определение концентрации углекислого газа в выдыхаемом воздухе (EtCO2), центрального венозного давления (ЦВД), газового состава артериальной и венозной крови. Дискретное неинвазивное измерение артериального давления (АД).
• Уровень 2. Постоянный мониторинг ЧСС и ритма сердца, пульсоксиметрия, определение EtCO2, ЦВД, газового состава артериальной и венозной крови. Постоянное инвазивное измерение АД. Определение внутричерепного давления (ВЧД) и насыщения гемоглобина кислородом в луковице яремной вены (SvjO2).
• Уровень 3. Постоянный мониторинг ЧСС и ритма сердца, пульсоксиметрия, определение EtCO2, ЦВД, газового состава артериальной и венозной крови. Постоянное иназивное измерение АД. Определение ВЧД и SvjO2. Оценка напряжения кислорода в веществе головного мозга и биохимического состава интерстициальной жидкости мозга. Электрофизиологический мониторинг. Измерение объемного МК.
У больных с САК вследствие разрыва артериальной аневризмы головного мозга, находящихся в критическом состоянии, следует ежедневно исследовать линейную скорость МК при помощи транскраниальной допплерографии.
В данной главе не имеет смысла останавливаться на рутинных методах мониторинга, повсеместно используемых в реанимационной практике, поэтому здесь будут рассмотрены методы оценки системной гемодинамики, внутричерепного давления, мозгового кровотока, оксигенации, метаболизма и функции мозга.
МОНИТОРИНГ ГЕМОДИНАМИКИ
В настоящее время в распоряжении реаниматолога существует множество методов оценки системной гемодинамики. Среди инвазивных методик наиболее удобна и точна транспульмональная термодилюция, среди неинвазивных - чрезпищеводная допплерография.
ИНВАЗИВНОЕ ИЗМЕРЕНИЕ АРТЕРИАЛЬНОГО ДАВЛЕНИЯ
Инвазивное измерение позволяет в непрерывном режиме оценивать АД и вовремя диагностировать и лечить эпизоды артериальной гипотензии. При одновременном измерении ВЧД мониторы автоматически рассчитывают церебральное перфузионное давление (ЦПД) (рис. 3-1, см. цв. вклейку).
Для проведения инвазивного мониторинга АД катетеризируют лучевую артерию и через соединительную трубку, заполненную физиологическим раствором, к катетеру подсоединяют датчик давления. Перед катетеризацией лучевой артерии необходимо оценить сохранность коллатерального кровотока по артериальной ладонной дуге. Для этого проводят пробу Аллена. Одновременно пережимают как лучевую, так и локтевую артерии, прекращая кровоснабжение кисти. Затем отпускают локтевую артерию, сохраняя компрессию лучевой артерии, и оценивают время, за которое кисть становится розовой. Если цвет кожных покровов восстанавливается в течение 5 с, то коллатеральное кровообращение в кисти считают сохранным. Если же бледность кожных покровов сохраняется, то коллатеральное кровообращение считают нарушенным. В этом случае катетеризация лучевой артерии может привести к ишемическим расстройствам.
В клинических условиях провести пробу Аллена не всегда возможно. В таких случаях на большой палец кисти больного надевают датчик для пульсоксиметрии и оценивают амплитуду плетизмографической кривой и показатель сатурации. Пережимают лучевую артерию и определяют динамику амплитуды волны и данных сатурации. Если указанные параметры не изменились, то коллатеральный кровоток считают сохранным.
Для правильной оценки ЦПД датчик для измерения АД следует фиксировать на уровне отверстия Монро, проецируя его на середину расстояния между наружным углом глазницы и наружным отверстием наружного слухового прохода (рис. 3-2, см. цв. вклейку).
ТРАНСПУЛЬМОНАЛЬНАЯ ТЕРМОДИЛЮЦИЯ
Для проведения измерений катетеризируют одну из подключичных или внутренних яремных вен, а также устанавливают специальный катетер с термистором в бедренную артерию в проксимальном направлении (рис. 3-3, см. цв. вклейку). Артериальный доступ позволяет осуществлять постоянный мониторинг показателей системной гемодинамики, температуры крови и забор проб артериальной крови. В катетер, установленный в центральную вену, вводят холодный раствор, температуру которого фиксирует специальный термодатчик. После прохождения малого круга кровообращения холодовую метку улавливает термодатчик, расположенный в бедренной артерии. По полученным данным монитор выстраивает кривую термодилюции и рассчитывает параметры системной гемодинамики. Методика транспульмональной термодилюции позволяет оценивать сердечный выброс, преднагрузку, периферическое сосудистое сопротивление, содержание внесосудистой воды в легких и другие важные параметры системной гемодинамики.
Для улучшения индивидуальной оценки измеряемых параметров их принято оценивать в отношении к площади поверхности тела, выраженной в м2 (табл. 3-1).
Таблица 3-1. Нормальные значения основных показателей системной
гемодинамики, определяемых при помощи транспульмональной термодилюции

ЧРЕСПИЩЕВОДНАЯ ДОППЛЕРОГРАФИЯ
Для проведения измерений в пищевод вводят специальный зонд с ультразвуковым датчиком на конце. Монитор регистрирует скорость кровотока в нисходящей аорте и рассчитывает сердечный выброс, ударный объем сердца и периферическое сосудистое сопротивление (рис. 3-4, см. цв. вклейку).
ИЗМЕРЕНИЕ ВНУТРИЧЕРЕПНОГО ДАВЛЕНИЯ
Внутричерепное давление представляет собой разницу между давлением в полости черепа и атмосферным давлением. Измерение ВЧД позволяет выявить внутричерепную гипертензию, оценить ее выраженность и рассчитать ЦПД.
У взрослого человека в положении на спине нормальные значения ВЧД составляют 7-15 мм рт.ст. (табл. 3-2). Показанием к терапии считают стойкое увеличение ВЧД выше 20 мм рт.ст.
Показаниями для мониторинга ВЧД у пострадавших с ЧМТ считают угнетение уровня бодрствования по ШКГ до 8 баллов и менее при наличии изменений на КТ головного мозга в виде:
• гематом;
• очагов ушибов;
• отека;
• аксиальной дислокации.
При отсутствии изменений на КТ головного мозга решение о начале мониторинга ВЧД принимают при наличии двух или более факторов:
• возраст более 40 лет;
• появление одноили двусторонних познотонических реакций. Познотонические реакции свидетельствуют о наличии функционального разобщения ствола и полушарий головного мозга и представляют собой сгибательную или разгибательную реакцию в конечностях (декортикационная и децеребрационная ригидность) в ответ на болевое раздражение;
• систолическое АД менее 90 мм рт.ст.
Показанием для установки датчика измерения ВЧД у больных с нетравматическими внутричерепными кровоизлияниями считают угнетение уровня бодрствования до 10 и менее баллов по ШКГ.
Показанием для мониторинга ВЧД у пациентов с ишемическим инсультом является развитие злокачественной формы массивного ишемического инсульта в бассейне средней мозговой артерии с угнетением уровня бодрствования по ШКГ до 9 баллов и менее.
Определение ВЧД проводят с помощью различных устройств. Возможно измерение ВЧД в субдуральном, субарахноидальном и эпидуральном пространствах. К достоинствам такого измерения относят простоту установки датчиков и низкую вероятность травматизации вещества мозга. Однако применение данных устройств часто не обеспечивает необходимой точности. Показания датчика могут искажаться при избыточном локальном давлении на него, например, костных выступов.
Чаще всего используют мониторинг внутрижелудочкового давления. Преимущество использования данного метода заключается в возможности одновременного измерения ВЧД и удаления цереброспинальной жидкости. Для внутрижелудочкового измерения ВЧД используют различные способы:
• вентрикулярный дренаж, подключаемый к тензометрическому датчику измерения давления (гидравлические системы, монитор «Liquoguard»);
• двухпросветный пневматический датчик. Один просвет датчика необходим для измерения ВЧД с помощью раздутого воздухом баллончика, расположенного на конце датчика, второй просвет - для сброса ЦСЖ (монитор «Spiegelberg»);
• интегрированный в вентрикулярный дренаж датчик микродеформации (микрочип) или фиброоптический датчик (мониторы «Codman», «Camino», «MPRO2», «Sophyssa»).
В клинической практике для внутрижелудочкового измерения ВЧД наиболее часто используют гидравлические системы и монитор Шпигельберга.
Гидравлическая система
Принцип работы гидравлической системы основан на передаче давления столба цереброспинальной жидкости на тензометрический датчик давления. После установки вентрикулярного катетера к нему в стерильных условиях присоединяют измеряющую систему. Проводят калибровку измеряющего устройства по атмосферному давлению, после чего открывают вентрикулярный катетер и начинают регистрацию ВЧД (рис. 3-5, см. цв. вклейку). Для правильного измерения ВЧД датчик давления должен быть закреплен на уровне отверстия Монро. Если датчик расположен ниже уровня отверстия Монро, то значение ВЧД будет завышено, а если выше, то занижено. Использование гидравлических систем имеет ряд недостатков. Основные из них - опасность развития инфекционных осложнений и большая вероятность блокирования катетера из-за нарастающей компрессии желудочков и обтурации его просвета сгустком крови. Необходима периодическая калибровка внешнего измерительного устройства из-за колебаний атмосферного давления. При тяжелом поражении головного мозга установка вентрикулярного катетера часто невозможна из-за небольших размеров спавшихся желудочков. В настоящее время существуют одноразовые системы для одновременного измерения внутричерепного давления и контролируемого сброса цереброспинальной жидкости. Использование таких систем позволяет не только эффективно контролировать ВЧД, но и уменьшать частоту развития инфекционных осложнений, связанных с вентрикулостомией.
Монитор Шпигельберга
Для проведения измерений в желудочек мозга устанавливают специальный двухпросветный вентрикулярный катетер (рис. 3-6, см. цв. вклейку). На конце катетера расположен баллончик, соединенный с измерительным устройством. Второй канал катетера предназначен для удаления цереброспинальной жидкости. После проведения вентрикулостомии монитор заполняет баллончик воздухом и по степени давления цереброспинальной жидкости на стенки баллончика определяет ВЧД.
Разделение каналов для регистрации ВЧД и сброса цереброспинальной жидкости позволяет измерять внутричерепное давление даже в условиях обтурации или дислокации вентрикулярного катетера, что невозможно при применении гидравлических систем (рис. 3-7). При использовании прибора не требуется ручной калибровки измерительного устройства по атмосферному давлению.
Помимо измерения ВЧД монитор Шпигельберга позволяет определять церебральную податливость, или комплаенс мозга (рис. 3-8, см. цв. вклейку). Для этого к каналу катетера, по которому удаляют цереброспинальную жидкость, присоединяют тензометрический датчик давления. Монитор нагнетает 0,2 мл воздуха в баллончик и одновременно фиксирует изменение ВЧД. Отношение введенного объема к изменению ВЧД называют податливостью, или комплаенсом, мозга.
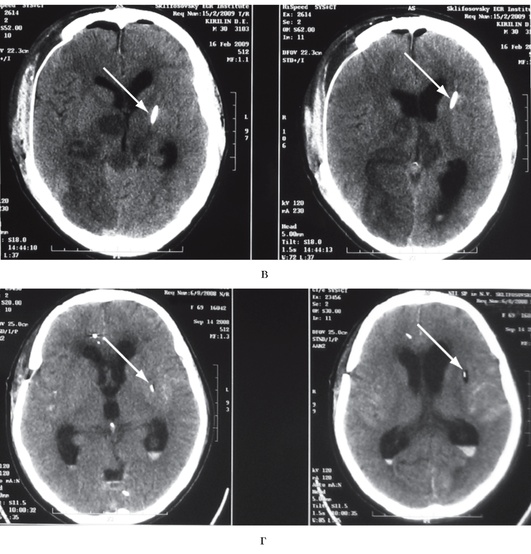
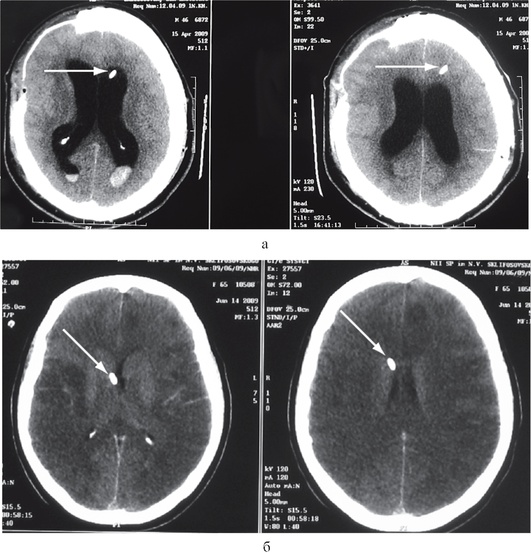
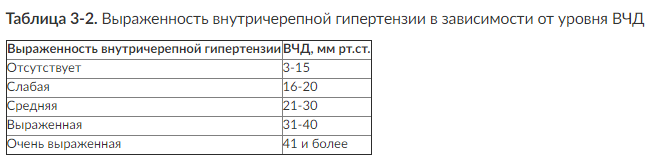
Рис. 3-7. Примеры внутрижелудочкового измерения ВЧД при помощи гидравлической системы (а, б, в)и монитора Шпигельберга (г): а - правильная установка катетера в передний рог левого бокового желудочка (стрелка), ВЧД можно измерять; б - катетер установлен в правый боковой желудочек (стрелка), однако в связи с выраженным отеком мозга боковые желудочки значительно сужены, что не позволит измерять ВЧД при помощи гидравлической системы; в - неудачная попытка дренирования переднего рога левого бокового желудочка: катетер установлен в вещество мозга (стрелка), измерение ВЧД невозможно; г - неудачная попытка дренирования переднего рога левого бокового желудочка: датчик монитора Шпигельберга установлен в вещество мозга (стрелка), однако баллончик на конце датчика позволяет определять ВЧД интрапаренхиматозно
Альтернатива внутрижелудочковому определению ВЧД - использование паренхиматозных датчиков. К достоинствам паренхиматозного измерения относят низкий риск травматизации вещества мозга и развития инфекционных осложнений, простоту установки и отсутствие необходимости в перекалибровке. Датчики устанавливают либо через фрезевое отверстие, либо через специальные устройства для фиксации в вещество лобной или височной доли, противоположной очагу основного поражения, на глубину 1-1,5 см (рис. 3-9). Для правильного измерения ВЧД локализация датчика в веществе мозга должна быть приближена к уровню отверстия Монро.
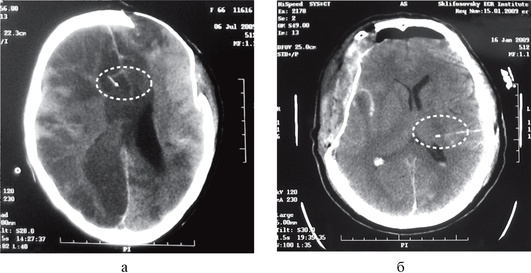
Рис. 3-9. Паренхиматозное измерение внутричерепного давления (положение датчиков для измерения ВЧД отмечено пунктирной линией): а - правильная установка паренхиматозного датчика; б - датчик установлен ниже отверстия Монро, что может привести к завышению значений ВЧД
В настоящее время для паренхиматозного измерения ВЧД используют различные датчики:
• пневматический датчик с раздуваемым воздухом баллончиком на конце (монитор «Spiegelberg»);
• датчик микродеформации (микрочип) (мониторы «Codman», «MPRO2», «Pressio», «Liquoguard»);
• фиброоптический датчик (монитор «Camino»).
В клинической практике для паренхиматозного измерения ВЧД наиболее часто используют мониторы Шпигельберга, «Codman» и «MPRO2».
Монитор Шпигельберга
Методика измерения принципиально не отличается от внутрижелудочкового измерения ВЧД. В вещество мозга устанавливают однопросветный катетер с баллончиком на конце. После установки катетера монитор заполняет баллончик воздухом и по степени давления ткани мозга на стенки баллончика определяет ВЧД.
Монитор «Codman»
Принцип работы датчика «Codman» основан на регистрации ВЧД специальным измерительным устройством (микрочипом), расположенным на конце датчика (рис. 3-10, см. цв. вклейку). Полученная с микрочипа информация выводится на экран прикроватного монитора. Особенность монитора заключается в необходимости калибровки датчика на границе водной и воздушной сред перед установкой в вещество мозга.
Монитор «MPRO2»
Для измерения ВЧД используется специальный фиброоптический катетер (рис. 3-11, см. цв. вклейку). Датчик не требует специальной калибровки перед установкой в вещество мозга и позволяет одновременно определять ВЧД, напряжение кислорода в веществе головного мозга и температуру мозга. Катетер можно устанавливать как через специальное фиксирующее устройство, так и через фрезевое отверстие с помощью подкожного туннеля.
В настоящее время в процессе исследования находятся отоакустические методы измерения ВЧД. Они основаны на изменении комплаенса барабанной перепонки в ответ на изменения давления перелимфы в лабиринте улитки при колебаниях ВЧД. Одна из перспективных разработок - оценка ВЧД по диаметру зрительного нерва, определяемому с помощью ультразвукового исследования глаза (рис. 3-12, см. цв. вклейку).
Для точной оценки степени внутричерепной гипертензии следует сначала устанавливать датчик ВЧД, а затем приступать к основному этапу операции. Измерение ВЧД прекращают, если в течение 24-48 ч ВЧД находится в нормальных пределах, не превышая 20 мм рт.ст.
МЕТОДЫ ОЦЕНКИ МОЗГОВОГО КРОВОТОКА
Существующие в настоящее время методы мониторинга позволяют определять глобальный и регионарный объемный кровоток, а также оценивать линейную скорость кровотока в основных артериях головного мозга.
В клинической практике наиболее часто используют следующие методы оценки МК:
• метод Кети-Шмидта;
• позитронно-эмиссионную томографию;
• однофотонную эмиссионную компьютерную томографию;
• термодиффузию;
• транскраниальную допплерографию.
Метод Кети-Шмидта позволяет с высокой точностью проводить количественную оценку МК в мл/мин на 100 г вещества мозга. Метод разработан в 1948 г. S. Kety и C. Shmidt и основан на ингаляции оксида азота (N2O) с последующим измерением его концентрации в периферической артериальной крови и в луковице внутренней яремной вены. По полученным данным на основании принципа Фика рассчитывают МК. Принцип Фика основан на том, что концентрация в ткани мозга вещества, которое не метаболизируется мозгом и легко диффундирует в него, пропорциональна разнице концентрации этого вещества в притекающей артериальной и оттекающей венозной крови. Таким образом, при увеличении МК артерио-венозная разница в концентрации N2O будет уменьшаться, а при его снижении - увеличиваться. Метод Кети-Шмидта был модифицирован для использования не только оксида азота, но и других газов (например, криптона и ксенона). Метод позволяет определять только общий МК и не дает возможности измерения кровотока в различных областях головного мозга.
Позитронно-эмиссионная томография (ПЭТ) позволяет одновременно получать томографические срезы и осуществлять регионарные исследования метаболизма и МК. Метод основан на внутривенном или ингаляционном введении включающихся в биологические процессы меченых изотопов (11С, 18F, 15O и др.), с последующей их индикацией в веществе мозга. ПЭТ позволяет определять регионарный объемный МК, то есть объемный кровоток в различных отделах головного мозга (рис. 3-13, см. цв. вклейку). Следует отметить, что метод не может быть применен непосредственно у кровати больного и требует транспортировки пациента в отделение томографии. Возможности использования ПЭТ ограничиваются также дороговизной таких томографов и необходимостью размещения их вблизи циклотрона для производства препаратов, содержащих быстрораспадающиеся изотопы.-
Однофотонная эмиссионная компьютерная томография (ОФЭКТ) позволяет определять регионарный мозговой кровоток по распределению радиоактивных изотопов (133Xe, 99Tc) в веществе мозга. Захват изотопов клетками мозга происходит в течение 5 мин после их внутривенного введения, а полное удаление из вещества мозга - в течение 24 ч. ОФЭКТ не позволяет проводить достоверную количественную оценку объемного мозгового кровотока. Определить изменения кровотока в различных областях мозга можно только при сравнении интенсивности накопления изотопов при повторных исследованиях. Таким образом, ОФЭКТ может быть использована только для динамической оценки МК с интервалами между исследованиями не менее суток.
Термодиффузия - единственный метод, позволяющий количественно оценивать регионарный объемный МК в постоянном режиме непосредственно у кровати больного (рис. 3-14, см. цв. вклейку). В вещество головного мозга устанавливают специальный датчик с двумя термисторами. Проксимальный (пассивный) термистор определяет температуру мозга, а дистальный - активно нагревается. МК рассчитывают по следующей формуле:
МК (мл/мин на 100 г вещества мозга)=Кх(1/V-1/V0),
где К - константа теплопроводности головного мозга; V - разница электрического напряжения между двумя термисторами; V0 - разница электрического напряжения между двумя термисторами при отсутствии кровотока.
Транскраниальная допплерография (ТКДГ) - неинвазивный метод оценки линейной скорости кровотока по магистральным сосудам шеи и головного мозга (рис. 3-15, см. цв. вклейку). Принцип ТКДГ основан на феномене изменения частоты ультразвуковой волны при отражении от движущихся форменных элементов крови. Допплерограмма - графическое представление распределения линейных скоростей эритроцитов в исследуемом участке артерии за сердечный цикл. Дуплексная (двойная) допплерография позволяет одновременно проводить эхотомографию и допплерографию, что обеспечивает визуализацию на экране монитора не только функциональных показателей мозгового кровотока, но и структурно-морфологического изображения экстра- и интракраниальных сосудов.
ТКДГ у больных с внутричерепными кровоизлияниями проводят с целью:
• диагностики и динамической оценки ангиоспазма, развивающегося после разрыва артериальных аневризм головного мозга;
• оценки состояния ауторегуляции МК;
• неинвазивой диагностики внутричерепной гипертензии.
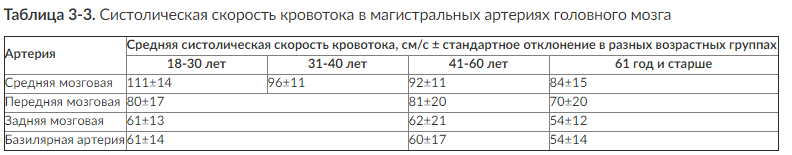
Стандартный протокол транскраниальной допплерографии включает в себя определение систолической (ЛСКс), диастолической (ЛСКд) и средней (ЛСКср) линейных скоростей кровотока (ЛСК) во внутренних сонных, средних, передних, задних мозговых и базилярной артериях (табл. 3-3). Рассчитывают полушарный индекс кровотока (индекс Линдегаарда), который представляет собой отношение средней скорости кровотока в средней мозговой артерии к средней скорости кровотока в экстракраниальном сегменте внутренней сонной артерии (в норме до 3,0). При ангиоспазме вследствие субарахноидального кровоизлияния после разрыва артериальной аневризмы индекс Линдегаарда увеличивается до 6-9.
остояние ауторегуляции мозгового кровотока оценивают при помощи компрессионного теста по коэффициенту овершута (КО) (отношение ЛСКср первого пика после прекращения компрессии ипсилатеральной общей сонной артерии к ЛСКср в покое) (рис. 3-16, см. цв. вклейку). Нормальные значения КО составляют 1,2-1,5. При значениях КО, близких к 1,0, констатируют нарушение ауторегуляции мозгового кровотока. В качестве косвенного признака внутричерепной гипертензии используют пульсационный индекс, который рассчитывают как отношение разности между ЛСКс и ЛСКд к ЛСКср (в норме 0,8-0,9) (рис. 3-17, см. цв. вклейку).
Следует отметить, что методика допплерографии не позволяет определять объемные показатели кровотока и обладает высокой «операторзависимостью» (например, полученные значения скорости кровотока зависят от угла наклона датчика). При динамическом наблюдении за линейной скоростью кровотока желательно, чтобы все исследования выполнялись одним специалистом.
МЕТОДЫ ОЦЕНКИ ОКСИГЕНАЦИИ И МЕТАБОЛИЗМА МОЗГА
К методам оценки оксигенации и метаболизма головного мозга относят: определение насыщения гемоглобина кислородом в яремной вене, прямое определение напряжения кислорода в ткани мозга, церебральную оксиметрию и микродиализ вещества головного мозга.
ЮГУЛЯРНАЯ ОКСИМЕТРИЯ
Метод основан на определении насыщения гемоглобина кислородом в оттекающей от головного мозга венозной крови. Датчик для измерения SvjO2 устанавливают ретроградно в луковицу внутренней яремной вены. Возможно использование как обычного катетера для катетеризации центральных вен (рис. 3-18, см. цв. вклейку), так и специального фиброоптического катетера (рис. 3-19, см. цв. вклейку). Установка центрального венозного катетера позволяет измерять SvjO2 дискретно в пробах крови, забираемых несколько раз в сутки.
Фиброоптический катетер дает возможность осуществлять постоянную югулярную оксиметрию с периодической калибровкой по данным SvjO2 в пробах венозной крови. Использование постоянного мониторинга улучшает выявляемость эпизодов ишемии и качество лечения больных.
После установки необходимо верифицировать положение катетера при помощи рентгенографии шейного отдела позвоночника в боковой проекции. Кончик катетера должен проецироваться на уровень сосцевидного отростка височной кости (рис. 3-20). При смещении катетера в дистальном направлении результаты измерений искажаются из-за примеси экстрацеребральной крови.
Существуют данные о неравномерности венозного оттока от головного мозга и отличии показателей SvjO2 в правой и левой внутренних яремных венах. В связи с этим существует три подхода к выбору стороны для проведения югулярной оксиметрии.
• Катетер устанавливают в ипсилатеральную по отношению к основному поражению вену.
• Определяют доминантную яремную вену либо при помощи допплерографии (оценивают диаметр левой и правой яремных вен и считают доминантной вену большего диаметра), либо по изменению ВЧД при поочередном пережатии обеих яремных вен. Катетер устанавливают на стороне большего увеличения ВЧД. Если давление увеличивается одинаково с обеих сторон, то катетеризируют правую яремную вену, так как в подавляющем большинстве случаев именно она доминантна.
• При невозможности проведения допплерографии и измерения ВЧД катетеризируют правую яремную вену.
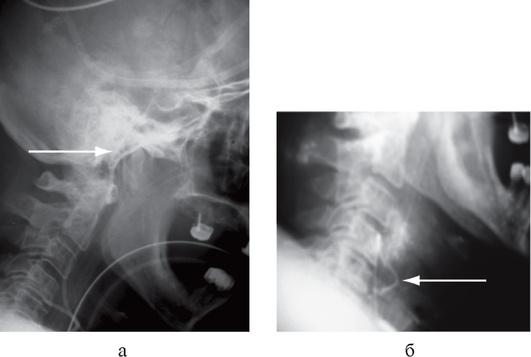
Рис. 3-20. Рентгенографический контроль положения катетера для измерения SvjO2(положение катетеров показано стрелками): а - правильное положение катетера; б - неправильное положение катетера
Показатель SvjO2 отражает соотношение доставки и потребления кислорода в головном мозге.
Доставку кислорода (DO2) вычисляют как произведение сердечного выброса (СВ) и содержания кислорода в артериальной крови (СаО2):
DO2 =CВxCaO2.
Содержание кислорода в артериальной (СаО2) и оттекающей от мозга (СvjО2) крови рассчитывают по формуле:
CO2=Hbx1,39xSO2+0,0031xPO2,
где Hb - концентрация гемоглобина; SO2 - насыщение гемоглобина кислородом; PO2 - напряжение кислорода.
Потребление кислорода (VO2) определяют путем умножения СВ на артерио-венозную разницу по кислороду:
VO2 =CВx(CaO2-CvjO2).
Количество кислорода, которое потребляет головной мозг, называют коэффициентом экстракции кислорода (O2ER) и определяют по отношению потребления кислорода к его доставке:
O2ER=VO2/DO2 или O2ER=(CaO2-CvO2)/CaO2.
Учитывая идентичность концентрации гемоглобина в артериальной и венозной крови, а также ничтожный вклад напряжения кислорода в содержание кислорода в крови, часто используют упрощенную формулу:
O2ER=(SaO2-SvjO2)/SaO2.
Поскольку больным с поражением головного мозга проводят искусственную вентиляцию легких дыхательными смесями с повышенным содержанием кислорода, у таких пациентов гемоглобин в артериальной крови всегда насыщен кислородом на 100% (или 1). Таким образом, коэффициент экстракции кислорода для головного мозга представляет собой:
O2ER=1-SvjO2.
Нормальными считают показатели SvjO2, находящиеся в пределах 55-75% при условии достаточной оксигенации артериальной крови. Таким образом, нормальные значения коэффициента экстракции кислорода для головного мозга составляют 25-45%. Снижение насыщения гемоглобина кислородом в оттекающей от мозга крови - один из первых признаков развивающейся церебральной ишемии. Уровень SvjO2 ниже 55% считают проявлением выраженной ишемии головного мозга. При снижении SvjO2 ниже 45% появляются симптомы спутанности сознания, а при уровне 24% и менее происходит утрата сознания. Наиболее частые причины эпизодов десатурации - низкое ЦПД, внутричерепная гипертензия, гипервентиляция, вазоспазм, анемия и гипоксемия.
Увеличение SvjO2 выше 75% (O2ER менее 25%) может свидетельствовать о развитии гиперемии головного мозга. Под гиперемией понимают избыточный объемный МК, составляющий более 60 мл/мин на 100 г вещества мозга (феномен «роскошной перфузии»). Однако для более точной диагностики гиперемии необходимо в совокупности оценивать уровень ВЧД и объемную скорость МК (при гиперемии будет отмечаться увеличение ВЧД и объемного МК). SvjO2 может повышаться при наличии патологического артерио-венозного сброса (например, при артерио-венозных мальформациях и травматическом каротиднокавернозном соустье), при увеличении фракции кислорода во вдыхаемой смеси, выраженном ограничении кровотока в ишемизированных областях головного мозга и при смерти мозга.
Югулярная оксиметрия позволяет оценивать глобальную церебральную оксигенацию, но не всегда отражает нарушения регионарной оксигенации головного мозга. Необходимо помнить, что проведение югулярной оксиметрии может сопровождаться осложнениями, связанными с выполнением пункции и катетеризации яремной вены. К ним относят повреждение сонной артерии, нервных стволов шейного сплетения, гнойно-септические осложнения и тромбоз яремной вены.
ПРЯМОЕ ОПРЕДЕЛЕНИЕ НАПРЯЖЕНИЯ КИСЛОРОДА В ВЕЩЕСТВЕ ГОЛОВНОГО МОЗГА (РbrO2)
В настоящее время в России существуют два вида приборов для определения PbrO2: «Licox» и MPRO2.
Монитор «Licox» определяет напряжение кислорода при помощи специального полярографического электрода Кларка непосредственно в веществе головного мозга. Этот метод был описан в 50-х годах прошлого столетия. Работа монитора основана на раздельной установке полярографического электрода и температурного датчика в вещество мозга (рис. 3-21, см. цв. вклейку). Принцип полярографического метода основан на диффузии кислорода через О2-проницаемую мембрану в электролитный раствор с последующим превращением О2 в гидроксильные ионы. Указанная реакция приводит к появлению электрического тока, величина которого прямо пропорциональна концентрации кислорода в электролитном растворе.
Работа монитора MPRO2 основана на измерении PbrO2 и температуры головного мозга при помощи специального фиброоптического катетера, устанавливаемого в вещество мозга. Помимо измерения напряжения кислорода и температуры монитор позволяет определять уровень внутричерепного давления.
Показатель PbrO2 соответствует напряжению кислорода во внеклеточном пространстве и отражает соотношение между доставкой и потреблением кислорода. В метаболически активной ткани существует градиент между артериальным и венозным концом капилляра, отражающий экстракцию кислорода тканью. В нормальных условиях концентрация кислорода в венозном конце капилляра и внеклеточном пространстве мозга практически одинакова, и PbrO2 отражает напряжение кислорода в венозном конце капилляра. Нормальные значения PbrO2 составляют 25-48 мм рт.ст. при напряжении кислорода в артериальной крови 80-120 мм рт.ст. Критически низкими значениями PbrO2 считают 8-15 мм рт.ст. Снижение PbrO2 ниже 10 мм рт.ст. значительно увеличивает риск летального исхода.
Важно проводить мониторирование PbrO2 в зоне, примыкающей к месту первичного повреждения (penumbra), так как основная цель интенсивной терапии заключается в улучшении оксигенации именно этих отделов мозга. Определение напряжения кислорода в веществе мозга имеет большое значение в подборе уровня ЦПД и определении резервов ауторегуляции мозгового кровотока (рис. 3-22).
Однако нужно помнить, что этот метод относится к регионарным, поэтому полученные результаты следует оценивать только в совокупности с данными о глобальной оксигенации головного мозга, полученными при югулярной оксиметрии. Напряжение кислорода в веществе мозга может зависеть от расположения датчика. Смещение его к корковым отделам или нахождение рядом с крупной артериолой может привести к завышению показателя PbrO2.
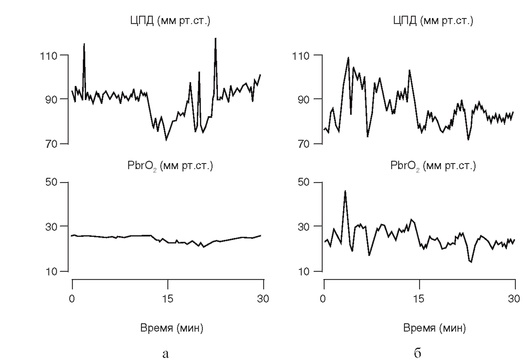
Рис. 3-22. Определение ауторегуляции мозгового кровотока при помощи мониторинга тканевого напряжения кислорода: а - пример интактной ауторегуляции МК: при изменении ЦПД напряжение кислорода в веществе мозга (PbrO2) не меняется; б - пример нарушенной ауторегуляции МК: изменения ЦПД приводят к однонаправленной динамике PbrO2 (по Dohmen С. et al., 2007)
ЦЕРЕБРАЛЬНАЯ ОКСИМЕТРИЯ
Церебральная оксиметрия (rSO2) - неинвазивный способ оценки регионарной оксигенации головного мозга. Принцип метода основан на детекции параинфракрасного излучения (длина волны 730 нм и 810 нм) двумя фотодиодами. Этот технический прием - разделение фотодиодов - используют для детекции сигнала от мозга, не смешанного с сигналами от экстрацеребральных тканей. Параинфракрасное излучение поглощается гемоглобином и его восстановленной фракцией. Поскольку в корковых отделах головного мозга 70-80% крови составляет венозная кровь, показания церебрального оксиметра отражают в основном насыщение кислородом гемоглобина венозной крови мозга. Датчик церебрального оксиметра располагают на коже лобной области на границе волосистой части головы. После подключения датчика к прибору на экран в постоянном режиме выводится показатель rSO2.
Используют как одноканальные, так и двухканальные церебральные оксиметры. Как и для SvjO2, нормальные значения rSO2 находятся в пределах 55-75% при условии нормальной оксигенации артериальной крови. Уровень rSO2 ниже 55% расценивают как проявление ишемии, а выше 75% - как развитие гиперемии головного мозга. Однако, как и в случае с югулярной оксиметрией, для точной установки диагноза гиперемии необходимо в совокупности оценивать уровень ВЧД и объемную скорость МК. Следует учитывать, что показатели rSO2 также могут увеличиваться при наличии патологического артерио-венозного сброса и увеличении фракции кислорода во вдыхаемой смеси.
Основное преимущество церебральной оксиметрии перед другими методами оценки церебральной оксигенации - неинвазивность. Этот простой в использовании метод позволяет осуществлять контроль регионарной оксигенации головного мозга при проведении различных кратковременных манипуляций (интубация трахеи, трахеостомия, санация трахеобронхиального дерева, фибробронхоскопия).
Однако этот метод часто дает артефактные результаты вследствие диспозиции датчиков и примеси экстрацеребральной крови. В связи с этим в настоящее время церебральную оксиметрию практически не используют для мониторирования оксигенации головного мозга у больных с ОЦН, находящихся в критическом состоянии.
ТКАНЕВОЙ МИКРОДИАЛИЗ
Динамическое исследование обмена веществ головного мозга - один из основных методов диагностики вторичных ишемических повреждений головного мозга у больных с поражением головного мозга, находящихся в критическом состоянии. Оценка церебрального метаболизма позволяет диагностировать вторичные повреждения головного мозга раньше, чем другие методы мониторинга.
Единственным прикроватным методом исследования метаболизма головного мозга является тканевой микродиализ, основанный на пассивной диффузии веществ, находящихся в интерстициальной жидкости головного мозга, через полупроницаемую мембрану (рис. 3-23, см. цв. вклейку).
Для проведения микродиализа используют специальные двухполостные катетеры, конечный отдел которых представлен полупроницаемой мембраной. Катетер устанавливают непосредственно в вещество головного мозга, а к его внутреннему каналу подключают специальный инфузионный насос с раствором, близким по электролитному составу к тканевой жидкости мозга. Когда раствор достигает полупроницаемой мембраны, происходит диффузия метаболитов из интерстициальной жидкости в полость катетера по градиенту концентрации. После прохождения полупроницаемой мембраны перфузионный раствор оттекает по наружной части катетера и накапливается в микроампуле. Для накопления достаточного количества диализата требуется 17-20 мин, после чего микропробирку помещают в специальный биохимический анализатор, позволяющий определять концентрации интересующих метаболитов.
Тканевой микродиализ используют у больных с внутричерепными нетравматическими кровоизлияниями и у пострадавших с тяжелой черепно-мозговой травмой, требующих мониторирования ВЧД.
Установку катетера в паренхиму мозга осуществляют либо через фрезевое отверстие, либо через специальное устройство для фиксации датчиков - bolt, которое закрепляют во фрезевом отверстии (рис. 3-24, см. цв. вклейку). У больных с субарахноидальным кровоизлиянием вследствие разрыва артериальной аневризмы головного мозга катетер устанавливают в отделы мозга, находящиеся в зоне кровоснабжения пораженной артерии. У больных с тяжелыми ушибами мозга один катетер устанавливают в зону, непосредственно прилежащую к очагу ушиба, а второй - помещают в неповрежденную область мозга. У пациентов с гипертензивными гематомами один катетер устанавливают в зону, непосредственно прилежащую к внутримозговой гематоме, а второй помещают в неповрежденную область мозга.
Катетеры для микродиализа содержат золотой фрагмент в дистальном конце, который легко идентифицируется при КТ мозга (рис. 3-25). Важно отметить, что не имеет смысла проводить микродиализ непосредственно в зоне ушиба или ишемическом очаге, так как они представляют собой зону уже состоявшихся некротических изменений.
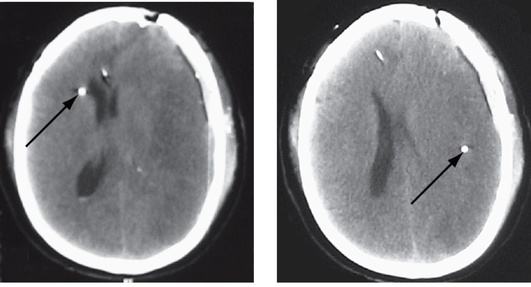
Рис. 3-25. Визуализация катетеров для тканевого микродиализа на компьютерной томограмме головного мозга (катетеры отмечены стрелками)

Микродиализ позволяет определять концентрацию глюкозы, глицерола и глутамата и отношение лактат/пируват в интерстициальной жидкости мозга (табл. 3-4). Глюкоза - единственный питательный субстрат для головного мозга. Основное количество глюкозы изначально поступает в астроциты. Доминирующим процессом, обеспечивающим образование АТФ в астроцитах, является гликолиз. Утилизация одной молекулы глюкозы приводит к образованию двух молекул пирувата и двух молекул АТФ. АТФ используется для поддержания трансмембранных ионных градиентов, обеспечивая работу АТФ-зависимых ионных помп (в основном К+-Ка+-АТФазы). Основное количество пирувата, образующегося в результате гликолиза в астроцитах, в дальнейшем не поступает в цикл трикарбоновых кислот и не подвергается окислительному фосфорилированию, а преобразуется в лактат, который выделяется в интерстициальное пространство и поступает в нейроны. В настоящее время появляется все больше доказательств того, что основной субстрат для питания нейронов именно лактат, а не глюкоза. В нейроне происходит преобразование лактата в пируват, который включается в цикл Кребса и дыхательную цепь, приводя к образованию 18 молекул АТФ на 1 молекулу пирувата. Таким образом, распад 1 молекулы глюкозы с учетом гликолиза и окислительного фосфорилирования приводит к образованию 38 молекул АТФ. Снижение концентрации глюкозы в интерстициальной жидкости головного мозга у больных с ОЦН свидетельствует о недостаточном кровоснабжении головного мозга и повышает риск летального исхода и вероятность развития выраженного неврологического дефицита.
тношение лактат/пируват позволяет выявить соотношение между анаэробным и аэробным метаболизмом в веществе мозга. В норме отношение лактат/пируват составляет 20-25. В нормальных условиях при наличии достаточного количества кислорода образование лактата в головном мозге невелико. В условиях ишемии нарушаются процессы окислительного фосфорилирования в митохондриях, происходит преобразование пирувата в лактат, в результате чего соотношение лактат/ пируват повышается. Повышение отношения лактат/пируват в остром периоде внутричерепного кровоизлияния у больных с разрывами церебральных аневризм считают предиктором летального исхода. Следует отметить, что увеличение концентрации лактата и отношения лактат/ пируват может происходить даже при достаточной доставке кислорода к тканям мозга. Такая ситуация может быть связана с развитием митохондриальной дисфункции в нейронах.
Концентрация глицерола прямо коррелирует со степенью повреждения клеточных мембран. Глутамат считают маркером эксайтотоксичности. Увеличение его концентрации также свидетельствует о выраженном клеточном повреждении.
ЭЛЕКТРОЭНЦЕФАЛОГРАФИЯ (ЭЭГ)
ЭЭГ - метод исследования головного мозга, основанный на регистрации его спонтанных электрических потенциалов (рис. 3-26, см. цв. вклейку).
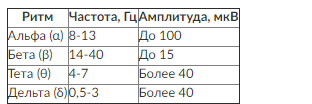
Интерпретация ЭЭГ основана на анализе структуры соотношения основных ритмов (табл. 3-5).
Таблица 3-5. Частотно-амплитудные диапазоны ЭЭГ
У больных с ОЦН ЭЭГ используют для:
• диагностики причины и глубины нарушения сознания;
• прогнозирования исхода комы;
• регистрации эпилептиформной активности и подбора противосудорожной терапии;
• анализа структуры цикла сон-бодрствование (полисомнография);
• подтверждения смерти мозга;
• оценки глубины седации.
В отделении неотложной нейрохирургии НИИСП им. Н.В. Склифосовского была создана классификация типов ЭЭГ у больных с САК вследствие разрыва артериальных аневризм, позволяющая предполагать прогноз лечебных мероприятий у каждого конкретного больного. Выделяют четыре типа ЭЭГ.
• I тип. Наличие минимальных изменений ЭЭГ (нерегулярность альфа-ритма) на фоне физиологической нормы, снижение амплитуды активности, медленная активность в диапазоне 5-7 Гц.
• II тип. Более выраженные изменения ЭЭГ. По всем отведениям доминирует полиморфная активность альфа-тета диапазона, сохранены зональные различия. В затылочных отведениях регистрируется полиморфный нерегулярный альфа-ритм. Патологическая активность медленного диапазона носит преимущественно диффузный характер.
• III тип. Альфа-ритм отсутствует. Регистрируются лишь отдельные группы волн альфа-диапазона. Преобладает активность тета-диапазона. Активность медленного диапазона носит преимущественно генерализованный характер, на фоне которого может регистрироваться межполушарная асимметрия.
• IV тип. Регистрируются грубые нарушения электрической активности с доминированием активности дельта-диапазона диффузного и билатерально-синхронного характера.
Чем выше тип ЭЭГ, тем хуже прогноз лечения. Наличие у больного ЭЭГ III-IV типа считают фактором риска при проведении оперативного вмешательства по выключению аневризмы из кровотока в остром периоде кровоизлияния.
Главное ограничение применения ЭЭГ - ее недостаточная надежность при изучении функциональных изменений мозга ниже коры, поскольку ЭЭГ-сигнал отражает преимущественно кортикальную активность.
ВЫЗВАННЫЕ ПОТЕНЦИАЛЫ (ВП)
ВП - метод исследования головного мозга, основанный на регистрации электрических реакций нервной системы на предъявляемый стимул. В зависимости от места стимуляции выделяют соматосенсорные, зрительные и акустически вызванные потенциалы. Их совокупность дает представление о сохранности восходящих проводящих путей. Оценить нисходящий пирамидный тракт позволяют двигательные потенциалы, получаемые при транскраниальной магнитной стимуляции коры. Основные изменения ВП состоят либо в увеличении времени прохождения сигнала (латентный период), либо в уменьшении амплитуды возбуждаемых волн.
ВП используют в комбинации с ЭЭГ для разрешения следующих задач:
• топическая диагностика повреждения спинного мозга;
• диагностика причины и глубины нарушения сознания;
• оценка глубины наркоза;
• прогнозирование исхода комы.
Из-за высокой стоимости и технической сложности ВП обычно используют только в специализированных отделениях нейрореанимации и нейрохирургических центрах.
ГИПЕРВЕНТИЛЯЦИЯ
При проведении ИВЛ у больных с ОЦН рекомендуется избегать профилактического использования гипервентиляции (PaCO2 25 мм рт.ст. и ниже). Гипокапния приводит к рефлекторному сужению артерий головного мозга и уменьшению внутричерепного давления (рис. 4-4, 4-5).
Таким образом, снижение ВЧД достигается за счет ограничения МК и может сопровождаться нарушением церебральной оксигенации и метаболизма.
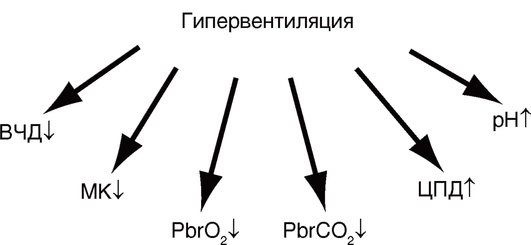
Рис. 4-4. Эффекты гипервентиляции на внутричерепное давление, МК, PbrO2, PbrCO2 и pH вещества мозга
Рис. 4-5. Влияние гипервентиляции на МК. При нормокапнии (а) отмечается нормальный церебральный кровоток. Гипокапния (б) приводит к спазму артерий головного мозга и уменьшению МК (по Ince С., 2008)
По нашим данным, уменьшение напряжения CO2 в артериальной крови больных с ОЦН с 33,6±3,9 мм рт.ст. до 25,4±4,8 мм рт.ст. сопровождается снижением ВЧД с 19± 11 мм рт.ст. до 13±7 мм рт.ст. SvjO2 снижается с 81±5% до 71±8%, PbrO2 в интактном веществе мозга - с 55,5+26,5 мм рт.ст. до 34,3+14,6 мм рт.ст., PbrO2 в пораженных отделах мозга - с 42+17 мм рт.ст. до 23,5+12,9 мм рт.ст. Кроме того, наблюдается выраженное падение концентрации глюкозы в интерстициальной жидкости головного мозга. Гипервентиляцию можно использовать как временную меру для снижения ВЧД, а также при резком неврологическом ухудшении. В течение первых 24 ч после развития поражения головного мозга следует избегать гипервентиляции в связи с возможностью ухудшения церебральной перфузии в условиях и так сниженного МК. При использовании гипервентиляции рекомендуется мониторировать SvjO2 и PbrO2 для оценки доставки кислорода к мозгу.
В случае невозможности коррекции гипокапнии при помощи подбора режимов ИВЛ проводят седативную терапию и при необходимости - миорелаксацию, переводя больного в контролируемые режимы вентиляции.
ДЫХАТЕЛЬНЫЙ ОБЪЕМ
При неповрежденных легких дыхательный объем должен составлять 8-10 мл/кг идеальной массы тела. При наличии повреждения легких необходимо уменьшить дыхательный объем до 6-7 мл/кг идеальной массы тела для предотвращения дальнейшего повреждения легочной ткани. Количество вентилируемых альвеол при развитии повреждения легких уменьшается за счет вовлечения части легочной паренхимы в патологический процесс и выключения ее из газообмена. Таким образом, ранее нормальный дыхательный объем (8-10 мл/кг идеальной массы тела) становится избыточным.
Степень повреждения легких определяют по совокупности клинико-лабораторных данных. Основные из них - рентгенография грудной клетки и отношение PaO2/FiO2. Отношение PaO2/FiO2 позволяет определить выраженность дыхательной недостаточности. Так, отношение PaO2/FiO2 менее 300 свидетельствует о нарушении легочного газообмена. В сочетании с двусторонней инфильтрацией на рентгенограмме грудной клетки значения РаО2/FiO2. от 300 до 201 соответствуют легкой степени ОРДС, от 200 до 101 - средней степени тяжести, 100 и менее - тяжелому ОРДС. При анализе только PaO2 можно не диагностировать серьезные нарушения легочного газообмена. Например, PaO2 80 мм рт.ст. можно достичь при вентиляции с FiO2 21% (воздух), 30% и 80%. Однако в первом случае отношение PaO2/FiO2 составит 381 (норма), во втором - 267 (острое легочное повреждение), в третьем - 100 (выраженное, практически терминальное, поражение легких).
ПОЛОЖИТЕЛЬНОЕ ДАВЛЕНИЕ В КОНЦЕ ВЫДОХА
Использование положительного давления в конце выдоха (ПДКВ) позволяет предотвратить коллабирование альвеол и увеличить функциональную остаточную емкость легких. Однако существуют данные о том, что применение высокого ПДКВ может сопровождаться повышением ВЧД.
Выделяют два основных механизма повышения ВЧД под влиянием ПДКВ.
1. Увеличение внутригрудного давления, которое приводит к повышению давления в полости правого предсердия и росту центрального венозного давления, что, в свою очередь, может сопровождаться нарушением венозного оттока из полости черепа.
2. Снижение преднагрузки левого желудочка сердца и уменьшение сердечного выброса за счет высокого внутригрудного давления. В результате происходит снижение артериального и церебрального перфузионного давлений, что сопровождается повышением ВЧД.
Факторами, определяющими повышение ВЧД под воздействием ПДКВ, являются:
• комплаенс легочной системы. При хорошей податливости легких отрицательные эффекты ПДКВ могут быть более выражены, чем при пониженном легочном комплаенсе;
• церебральный комплаенс. Сохранный церебральный комплаенс позволяет компенсировать повышение внутригрудного давления и нарушение венозного оттока из полости черепа. Снижение податливости мозга не позволяет компенсировать негативные эффекты ПДКВ и сопровождается увеличением ВЧД;
• гиповолемия - усиливает отрицательные эффекты ПДКВ;
• нарушение ауторегуляции мозгового кровообращения - снижает компенсаторные механизмы церебрального комплаенса.
ВЫСОКОЧАСТОТНАЯ ОСЦИЛЛЯТОРНАЯ ВЕНТИЛЯЦИЯ ЛЕГКИХ
Эффективным способом улучшения газообмена при развитии острого повреждения легких у больных с острой церебральной недостаточностью является использование высокочастотной осцилляторной вентиляции легких (ВЧОВЛ). Принципы ВЧОВЛ значительно отличаются от традиционной ИВЛ. Вентиляция осуществляется при помощи мембраны респиратора, которая, перемещаясь с высокой частотой, «загоняет» малые порции дыхательной смеси из контура респиратора в дыхательные пути больного (рис. 4-8, см. цв. вклейку).
Частота осцилляций может достигать 900 циклов в минуту. Респираторная поддержка при ВЧОВЛ осуществляется дыхательными объемами, меньшими, чем объем мертвого пространства дыхательных путей. Основным преимуществом ВЧОВЛ в сравнении с традиционной ИВЛ является возможность улучшения газообмена при низком риске баро- и волюмотравмы. К дополнительным преимуществам относят стабилизацию гемодинамики вследствие снижения внутригрудного давления и улучшение дренажной функции легких. Исследования, посвященные использованию ВЧОВЛ у пациентов с церебральной патологией, показали отсутствие отрицательного влияния осцилляторной вентиляции легких на ВЧД, церебральную оксигенацию и системную гемодинамику. ВЧОВЛ начинают при невозможности обеспечить легочный газообмен при традиционной ИВЛ в режиме протекции легких.
НЕИНВАЗИВНАЯ ВЕНТИЛЯЦИЯ ЛЕГКИХ
Большой интерес представляет возможность применения неинвазивной вентиляции легких (НИВЛ) у больных с ОЦН. НИВЛ может обеспечивать полноценную респираторную поддержку. Для НИВЛ применяют различные лицевые маски и специальные шлемы (рис. 4-9, см. цв. вклейку). Преимуществами НИВЛ перед ИВЛ с применением эндотрахеальной интубации являются:
• больший комфорт для больного;
• отсутствие необходимости в применении седативных препаратов и миорелаксантов, возможность оценки неврологического статуса;
• отсутствие осложнений, связанных с наличием интубационной трубки в трахее.
НИВЛ позволяет устранить явления гипоксемии и гипокапнии, понизить избыточную работу дыхания без проведения интубации трахеи и осуществления традиционной ИВЛ. Главными условиями проведения НИВЛ являются постоянный контакт с больным и возможность спонтанного дыхания пациента на случай непреднамеренного прерывания НИВЛ. Противопоказаниями к НИВЛ у больных с ОЦН являются: углубление уровня бодрствования до сопора/комы, бульбарные нарушения, отсутствие кашлевого рефлекса, острый синусит или средний отит, носовое кровотечение.
ПРЕКРАЩЕНИЕ РЕСПИРАТОРНОЙ ПОДДЕРЖКИ
ИВЛ прекращают при восстановлении устойчивого уровня бодрствования, стабилизации гемодинамических показателей и в первую очередь при восстановлении эффективного спонтанного дыхания.
Длительность периода отлучения от респиратора зависит от того, как долго больной находился на ИВЛ. В некоторых случаях при длительной ИВЛ у больных развивается мышечная слабость (так называемая респираторная полинейропатия), вынуждающая возобновлять ИВЛ.
После прекращения респираторной поддержки перед удалением трахеостомической трубки необходимо исключить у больного расстройства глотания. Для этого в трахеостомическое отверстие ретроградно вводят фибробронхоскоп и дают пациенту выпить воду с красителем. Если при глотании подкрашенная жидкость не попадает в трахею, трахеостомическую трубку можно удалять. Если же происходит заброс красителя в дыхательные пути, то трахеостомическую трубку удалять нельзя из-за риска аспирационного синдрома. До разрешения расстройств глотания такие пациенты остаются канюленосителями.
ОСТРЫЙ РЕСПИРАТОРНЫЙ ДИСТРЕСС-СИНДРОМ (ОРДС)
ОРДС представляет собой форму острой дыхательной недостаточности, которая входит в состав полиорганной недостаточности и возникает как неспецифическая реакция легких на различные повреждающие факторы. ОРДС характеризуется определенной клинической, функциональной, рентгенологической и патоморфологической картиной. ОРДС развивается у одного из десяти реанимационных пациентов. Летальность достигает 60%.
ДИАГНОСТИКА
В зависимости от факторов, вызвавших легочное повреждение, выделяют легочную и внелегочную формы ОРДС. К возникновению легочной формы приводят прямые факторы повреждения, а внелегочной - непрямые факторы повреждения.
К прямым факторам относят:
• аспирацию;
• утопление;
• пневмонию;
• ингаляцию токсических веществ;
• ушиб легкого;
• реперфузионное повреждение;
• жировую эмболию.
К непрямым факторам относят:
• сепсис;
• тяжелую сочетанную травму;
• массивную гемотрансфузию;
• острый панкреатит;
• искусственное кровообращение;
• острые отравления;
• диссеминированное внутрисосудистое свертывание;
• ожоги;
• черепно-мозговую травму;
• трансплантацию костного мозга.
Диагноз ОРДС устанавливают на основании клинико-лабораторных данных. Наиболее часто используют критерии Американо-Европейской согласительной конференции 1994 г.:
• острое начало;
• появление двусторонней инфильтрации на рентгенограмме грудной клетки;
• отсутствие признаков левожелудочковой недостаточности (давление заклинивания легочных капилляров 18 мм рт.ст. и менее);
• отношение PaO2/FiO2 менее 200.
ПАТОФИЗИОЛОГИЯ
Выделяют три стадии ОРДС: воспаление (ранняя экссудативная стадия), пролиферация (фибропролиферативная стадия) и фиброз (фиброзная стадия).
В стадии воспаления, которая может продолжаться в течение недели, происходит поражение микроциркуляторного русла легких (кризис микроциркуляции) вследствие образования и выброса в кровеносное русло цитокинов (фактор некроза опухолей, интерлейкины 1, 6, 8). Нарушение микроциркуляции приводит к развитию диссеминированного внутрисосудистого свертывания, тромбообразованию в микрососудах легких и нарушению легочного газообмена. Помимо газообменной функции нарушается метаболическая функция легких и их структура. Происходит снижение выработки плазмина (усиление тромбообразования), деградация сурфактанта (развитие микроателектазов), разрушение фибронектина (повышение проницаемости и накопление воды в легких), разрушение эластина (снижение растяжимости). Совокупность происходящих процессов приводит к усилению гипоксемии.
В фибропролиферативной стадии происходит пролиферация альвеолоцитов II типа и фибробластов. Разрешается отек легких и образуются гиалиновые мембраны.
В фиброзной стадии происходит фиброзирование интрестициальной ткани легких, интраальвеолярный фиброз, фиброз интимы сосудов и развитие гипертрофии мышечного слоя легочных артериол с облитерацией участков сосудистого русла.
ЛЕЧЕНИЕ
Специфическое лечение ОРДС отсутствует. Для борьбы с ОРДС необходимо устранение причины, приведшей к поражению легких (лечение сепсиса, панкреатита, санация очага инфекции).
Основные задачи интенсивной терапии включают:
• оптимизацию газообмена;
• уменьшение работы дыхания и снижение потребления кислорода дыхательными мышцами;
• предотвращение волюмотравмы и ателектатического повреждения легких;
• профилактику и лечение легочных инфекционных осложнений.
РЕСПИРАТОРНАЯ ПОДДЕРЖКА
Принципы респираторной поддержки при ОРДС включают:
• уменьшение дыхательного объема до 5-7 мл/кг идеальной массы тела (для уменьшения риска перерастяжения здоровых участков легких);
• подбор положительного давления в конце выдоха (поддержание легких в «раскрытом» состоянии);
• контроль давления в дыхательных путях (профилактика баротравмы легких);
• проведение маневров открытия альвеол (рекрутирующих маневров) путем кратковременного повышения давления в дыхательных путях (используют при внелегочной форме в начале стадии воспаления);
• по возможности - вентиляцию с более низким FiO2;
• ИВЛ в положении на животе (прон-позиция);
• проведение высокочастотной ИВЛ при неэффективности обычных методов респираторной поддержки.
ИНФУЗИОННАЯ ТЕРАПИЯ
В нормальных условиях характер обмена жидкости на уровне легочного капилляра существенно отличается от такового в периферических тканях и напоминает механизм обмена жидкости через гемато-энцефалический барьер. Развитие ОРДС приводит к выраженному нарушению сосудистой проницаемости и выходу жидкости в интерстициальное пространство легких. Таким образом, избыточная инфузионная терапия может приводить к усилению отека легочного интерстиция и усугублению нарушений газообмена.
Для правильного выбора объема и структуры инфузионной терапии у больных с ОРДС необходимо проводить мониторинг показателей системной гемодинамики. Желательно измерение показателей внесосудистой воды легких. Задачи инфузионной терапии у больных с ОРДС включают поддержание нормоволемии, нормальных показателей сердечного выброса, высокого коллоидно-онкотического давления плазмы крови и индекса внесосудистой воды легких в пределах 7 мл/кг и менее. Инфузионную терапию формируют в основном из коллоидных препаратов.
ВСПОМОГАТЕЛЬНЫЕ МЕТОДЫ ТЕРАПИИ
Вспомогательная терапия при ОРДС включает следующие методы.
• Глюкокортикоиды. Назначение глюкокортикоидов рекомендовано не всем пациентам с ОРДС. Применение стероидов через 14 и более дней от начала ОРДС приводит к увеличению летальности больных. Оправдано применение малых доз гидрокортизона (не более 300 мг/сут) в течение первых 5-7 сут у больных с резистентным септическим шоком и развившимся ОРДС с целью стабилизации гемодинамики.
• Препараты сурфактанта. Цель терапии - замещение поврежденного сурфактанта легких. Сурфактант начинают вводить в течение 48-72 ч после развития ОРДС. Эффективность терапии не доказана.
• Ингаляция оксида азота. Цель терапии - снижение давления в легочной артерии и постнагрузки правого желудочка. Оксид азота вызывает вазодилатацию только в вентилируемых участках легких, снижает внутрилегочный шунт крови и улучшает оксигенирующую функцию легких. Эффективность терапии не доказана.
• Экстракорпоральная мембранная оксигенация. Цель терапии - замещение оксигенирующей функции легких при помощи специального внешнего оксигенатора. Данная методика доступна только в ограниченном количестве специализированных центров.
ЦЕРЕБРАЛЬНОЕ ПЕРФУЗИОННОЕ ДАВЛЕНИЕ (ЦПД)
ЦПД представляет собой разницу между средним АД и ВЧД. В нормальных условиях МК остается стабильным в диапазоне изменения ЦПД от 50 до 150 мм рт.ст. При выходе ЦПД за указанные пределы, а также при нарушении ауторегуляции мозгового кровотока перфузия головного мозга становится полностью зависимой от уровня ЦПД (рис. 5-2).
Следует отметить, что вопрос о выборе оптимального уровня ЦПД при проведении интенсивной терапии у больных с ОЦН не решен. С одной стороны, повышение ЦПД при помощи инфузионной терапии и применения симпатомиметиков приводит к улучшению МК, оксигенации и метаболизма головного мозга, с другой стороны, может сопровождаться различными осложнениями (ОРДС, нарушениями функции миокарда и др.).
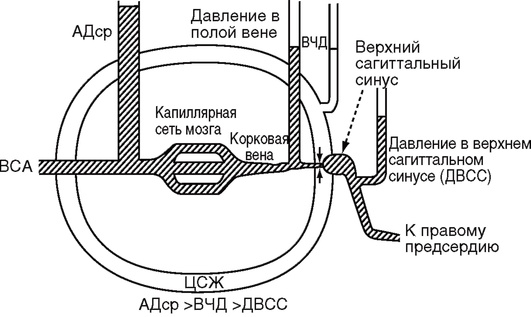
Рис. 5-1. Схема церебральной гемодинамики (по Huseby J., 1981)
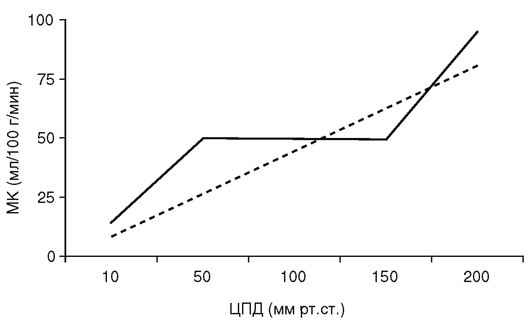
Рис. 5-2. Зависимость МК от уровня ЦПД. При сохранных механизмах ауторегуляции МК остается неизменным в диапазоне ЦПД 50-150 мм рт.ст. (сплошная линия), а при нарушении ауторегуляции становится полностью зависимым от уровня ЦПД (прерывистая линия)
Известно, что высокое ЦПД не гарантирует нормальной церебральной оксигенации. Даже при ЦПД, превышающем 80 мм рт.ст., напряжение кислорода в ткани мозга может находиться ниже ишемического порога.
Таким образом, для определения уровня ЦПД, необходимого конкретному больному, следует оценивать не только параметры системной гемодинамики, но и оксигенацию и метаболизм головного мозга.
ИНФУЗИОННАЯ ТЕРАПИЯ
Чаще всего в качестве причины артериальной гипотензии у больных с ОЦН, находящихся в критическом состоянии, выступает гиповолемия. По нашим данным, более половины больных с ЧМТ и нетравматическими внутричерепными кровоизлияниями при поступлении в отделение реанимации находятся в состоянии гиповолемии. Причинами гиповолемии чаще всего выступают кровопотеря, недостаточное поступление жидкости, повышенная температура тела, рвота, несахарный диабет, нарушения центрального механизма сосудистого тонуса.
Гиповолемия - это несоответствие объема циркулирующей крови (ОЦК) емкости сосудистого русла.
Выделяют абсолютную и относительную гиповолемию.
Абсолютная гиповолемия возникает при истинном дефиците объема циркулирующей крови. Наблюдается при недостаточном поступлении жидкости, кровопотере.
При относительной гиповолемии наблюдается достаточное, иногда даже избыточное, содержание жидкости в организме, но недостаточный ОЦК вследствие вазодилатации или повышенной проницаемости капилляров.
Дефицит ОЦК более 20% проявляется клинической симптоматикой, а дефицит ОЦК более 40% увеличивает вероятность летального исхода.
Гиповолемия вызывает централизацию кровообращения, обеспечивающую достаточное кровоснабжение жизненно важных органов (мозг, сердце) за счет ограничения кровотока в мышцах и внутренних органах. Централизация достигается за счет спазма преартериол и сопровождается шунтированием кровотока мимо органов и тканей, клеточной гипоксией, активацией патологических путей воспаления, синдромом системной воспалительной реакции. Длительное персистирование данного состояния повышает риск развития полиорганной недостаточности и неблагоприятных исходов у больных с поражением головного мозга.
Основной метод коррекции гиповолемии - инфузионная терапия. Быстрая коррекция волемического статуса у больных с ОЦН предотвращает развитие вторичных ишемических повреждений головного мозга и сопровождается снижением летальности.
ОЦЕНКА ВОЛЕМИЧЕСКОГО СТАТУСА
Решение о тактике инфузионной терапии выносят на основании результатов оценки волемического статуса больного. В реальной клинической практике врач ориентируется на показатели среднего АД, ЧСС и ЦВД. Однако данные параметры обладают низкой чувствительностью при оценке волемического статуса у пациентов, находящихся в критическом состоянии, и часто не соответствуют выраженности гиповолемии.
Среднее АД рассчитывают по следующей формуле:
АДср=(АДсист+2АДдиаст)/3.
Показатель АДср отражает как функцию миокарда, так и артериальный тонус. Так, низкие значения АДср могут наблюдаться как при низком сердечном выбросе и повышенном артериальном тонусе, так и при нормальном или повышенном сердечном выбросе и низком артериальном тонусе.
Высокая ЧСС - один из критериев гиповолемии. ЧСС повышается при низком ударном объеме сердца, так как при этом достигается нормальный минутный объем кровообращения. Однако ЧСС может увеличиваться и при нормальном волемическом статусе, например при гипертермии, болевом синдроме и т.д.
ЦВД отражает давление в полости правого предсердия во время диастолы и служит маркером преднагрузки миокарда. Нормальными считают значения ЦВД 10-12 мм рт.ст. (14-16 см вод.ст.). Важно знать, что ЦВД зависит не только от преднагрузки, но и от давления в дыхательных путях и грудной клетке, функций правых отделов сердца, наличия легочной гипертензии и других факторов. В связи с этим даже высокие значения ЦВД не всегда достоверно отражают волемический статус пациента.
Часто в практике нейрореаниматолога встречается ситуация, когда в условиях гиповолемии относительно нормальные показатели АДср и ЧСС поддерживаются за счет высокого периферического сосудистого сопротивления.
Для правильного выбора состава и объема инфузионной терапии следует оценивать показатели системной гемодинамики. В настоящее время наиболее удобным и точным инвазивным методом оценки системной гемодинамики у реанимационных больных считают транспульмональную термодилюцию, а неинвазивным методом - чреспищеводную допплерографию (см. главу «Нейромониторинг»).
ОБМЕН ЖИДКОСТИ МЕЖДУ КАПИЛЛЯРАМИ И ИНТЕРСТИЦИАЛЬНЫМ ПРОСТРАНСТВОМ
При определении состава вводимых инфузионных сред больным с ОЦН следует учитывать разницу в строении периферических и церебральных капилляров, а также влияние осмотического и онкотического давления плазмы крови на транскапиллярный обмен жидкости.
Осмоляльность - это молярное количество осмотически активных частиц на 1 кг растворителя.
Осмолярность - это молярное количество осмотически активных частиц на 1 л раствора.
Осмоляльность всегда несколько ниже осмолярности. Так, расчетная осмолярность раствора Рингер-лактат составляет около 275 мОсм/л, а осмоляльность - около 254 мОсм/кг Н2О.
Коллоидно-онкотическое давление входит в состав общей осмоляльности и создается крупными (например, белковыми) молекулами.
Обмен жидкости между капилляром и интерстициальным пространством зависит от величины гидростатического давления, а также разницы осмотического и онкотического давлений и определяется уравнением Старлинга-Лэндиса:
Q=K[(Pc-Ppc)- σ(Пс-Прс)],
где Q - поток жидкости; Р - гидростатическое давление; П - осмотическое давление; с - капиллярный; рс - интерстициальный; К - коэффициент проницаемости мембраны для воды; а - коэффициент отражения (показатель степени проницаемости мембраны для растворенного вещества, то есть если а<1, то мембрана в какой-то степени проницаема для растворенного вещества). Например, в физиологических условиях коэффициент отражения ГЭБ для натрия составляет 1,0, а для маннитола - 0,9. Таким образом, при сохранном ГЭБ он непроницаем для натрия, но проницаем для маннитола.
Осмолярность во внутри- и внеклеточном пространстве должна быть одинаковой. В условиях патологии вода перемещается из области с низкой осмолярностью в область с высокой осмолярностью с целью выравнивания осмолярности между пространствами.
Важно учитывать, что между транскапиллярным обменом жидкости в периферических тканях и головном мозге имеется существенная разница.
Эндотелий периферического капилляра имеет поры размером 65 ангстрем, в связи с чем небольшие ионы (Na+, Cl-) могут свободно проникать в интерстициальное пространство. Однако белки, имеющие больший размер, в условиях ненарушенной проницаемости не могут проникнуть в интерстиций (рис. 5-3).
Таким образом, концентрация электролитов в плазме и межклеточном пространстве одинакова, а транскапиллярный обмен жидкости поддерживается в основном за счет гидростатического градиента и онкотического давления белков плазмы крови.
Транскапиллярный обмен жидкости в головном мозге отличается от такового в периферических капиллярах. Наличие ГЭБ c размером пор не более 7-9 ангстрем не позволяет свободно проникать в межклеточное пространство мозга не только крупным молекулам, но и ионам (рис. 5-4). Так, коэффициент отражения для Na+ составляет 1,0, то есть мозг представляет собой исключительно чувствительный осмометр.
Осмоляльность плазмы крови можно рассчитать по следующей формуле:
Осмоляльность (мОсм/кг)=2х(Na++К+)+Глю/18+Моч/2,8,
где Na+ - концентрация натрия в плазме крови (ммоль/л); К+ - концентрация калия в плазме крови (ммоль/л); Глю - концентрация глюкозы в плазме крови (ммоль/л); Моч - концентрация мочевины в плазме крови (ммоль/л).
Нормальные значения осмоляльности составляют 280-285 мОсм/кг воды.
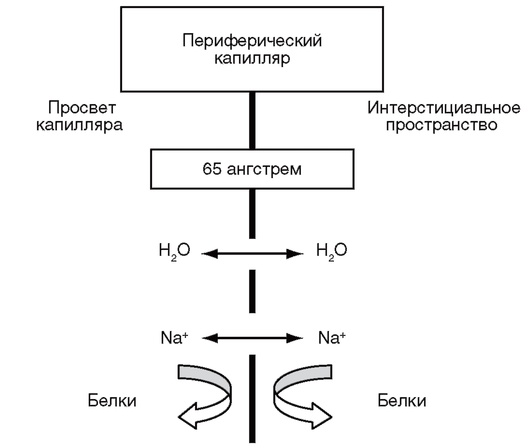
Рис. 5-3. Схематичное изображение периферического (соматического) капилляра. Стенка капилляра проницаема для воды (H2O) и мелких ионов, но непроницаема для белковых молекул (по Tommasino С., 2007)
У больного с ОЦН помимо основных осмотически активных субстратов (натрий, калий, глюкоза, мочевина) в плазме крови могут присутствовать и другие осмотически активные молекулы (например, маннитол, который используют для терапии синдрома внутричерепной гипертензии). Поэтому для точной оценки осмоляльности плазмы крови необходимо измерять ее прямым методом, а не рассчитывать по формулам.
Важно учитывать, что в условиях интактного ГЭБ обмен жидкости между капилляром и интерстициальным пространством мозга зависит не столько от колебаний коллоидно-онкотического давления, сколько от осмоляльности плазмы крови. При повреждении ГЭБ определенный вклад в транскапиллярный обмен жидкости начинает вносить онкотическое давление плазмы.
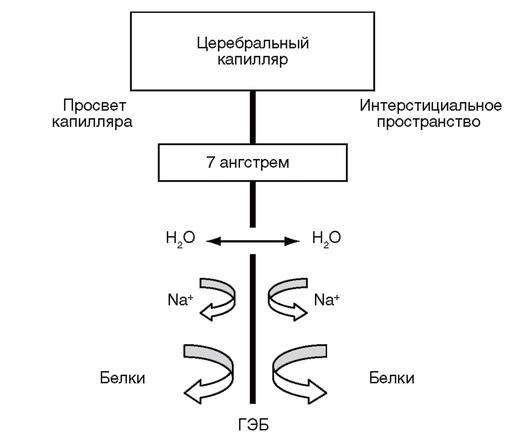
Рис. 5-4. Схематичное изображение церебрального капилляра. Наличие ГЭБ не позволяет мелким ионам и белковым молекулам проникать в интерстициальное пространство мозга (по Tommasino С., 2007)
ВЫБОР РАСТВОРА ДЛЯ ИНФУЗИИ
Для проведения инфузионной терапии у больных с ОЦН применяют как коллоидные, так и кристаллоидные препараты. Однако эти растворы принципиально отличаются друг от друга.
Коллоидные препараты циркулируют в плазме крови и в условиях интактной проницаемости капиллярной стенки не проникают в интерстиций. Применение коллоидов позволяет удерживать вводимую жидкость в сосудистом русле. Таким образом, коллоидные растворы необходимы для проведения волемической терапии. По некоторым данным, добавление коллоидного препарата в структуру инфузионной терапии приводит к уменьшению отека и повреждения головного мозга после ЧМТ.
Следует учитывать, что все коллоидные растворы обладают различными фармакологическими свойствами (рис. 5-5, см. цв. вклейку). При выборе препарата в первую очередь учитывают продолжительность и выраженность его волемического эффекта и безопасность.
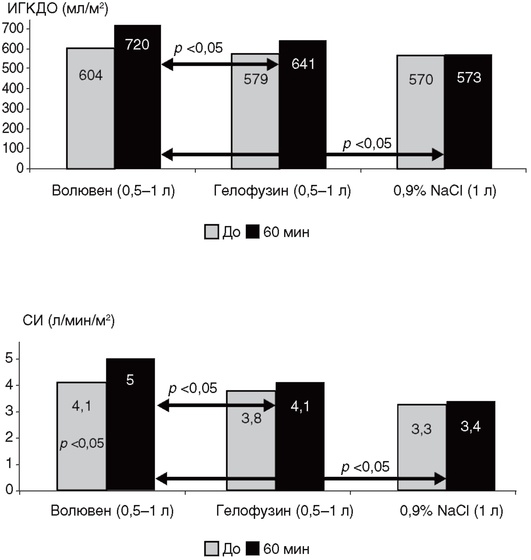
Рис. 5-5. Влияние различных растворов для инфузии на преднагрузку сердца: индекс глобального конечно-диастолического объема - ИГКДО (норма 680-800 мл/м2) и сердечный индекс - СИ (норма составляет 3-6 л/мин/м2). Скорость введения растворов составляет: 0,9% NaCl - 10-12 мл/кг/ч; волювен (6% ГЭК 130/0,4/9:1) - 10-12 мл/кг/ч; гелофузин (4% модифицированный желатин) - 10-12 мл/кг/ч. До - до начала инфузии; 60 мин - через 60 мин после начала инфузии (по Петрикову С.С. и соавт., 2008)
Важно следить за тем, чтобы препарат не накапливался в организме, обладал минимальным аллергогенным эффектом, не влиял на функции почек, печени и на гемостаз (рис. 5-6).
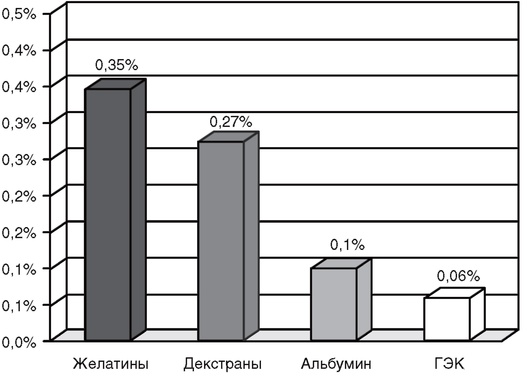
Рис. 5-6. Частота развития аллергических реакций при использовании коллоидных препаратов (по Laxenaire М.С. etal., 1995)
Различают природные и синтетические коллоиды. К природным коллоидам относят препараты человеческого альбумина, к синтетическим - растворы декстранов, желатины и гидроксиэтилкрахмала.
В настоящее время наибольшее распространение в лечении больных с ОЦН получили растворы гидроксиэтилкрахмала (ГЭК). ГЭК представляет собой производное амилопектина. Его синтезируют из крахмала кукурузы или картофеля. Амилопектин состоит из молекул D-глюкозы, соединенных в разветвленную цепь. С помощью окисиэтилена к молекулам глюкозы присоединяют гидроксиэтиловые группы. Гидроксиэтиловые группы делают крахмал более устойчивым к гидролизу амилазой и повышают время циркуляции препарата в сосудистом русле. Гидроксиэтилкрахмалы классифицируют в зависимости от их концентрации, молекулярной массы, молярного замещения и характера замещения.
В клинической практике обычно применяют крахмалы с концентрацией 6 и 10%. Чем выше концентрация раствора, тем больше его коллоидно-онкотическое давление и выраженнее волемический эффект.
По молекулярной массе ГЭК разделяют на высокомолекулярные (450-480 кДа), среднемолекулярные (130-200 кДа) и низкомолекулярные (40-70 кДа). Чем выше молекулярная масса, тем заметнее препарат накапливается в ретикулоэндотелиальной системе и влияет на функцию почек. Так, высокомолекулярные гидроксиэтилкрахмалы вызывают почечную недостаточность чаще, чем среднемолекулярные. В связи с этим максимальная разрешенная суточная доза 6% раствора ГЭК с молекулярной массой 450 кДа составляет 20 мл/кг массы тела, раствора ГЭК с молекулярной массой 200 кДа - 33 мл/кг массы тела, раствора ГЭК с молекулярной массой 130 кДа - 50 мл/кг массы тела.
Молярное замещение - отношение общего количества гидроксиэтилированных групп к общему количеству молекул глюкозы в растворе ГЭК. Например, молярное замещение 0,5 свидетельствует о том, что на 10 молекул глюкозы приходится 5 гидроксиэтиловых групп, а при молярном замещении 0,4 на 10 молекул глюкозы приходится 4 гидроксиэтиловые группы. Молярное замещение может быть низким (0,4-0,5) или высоким (0,6-0,7). Величина молярного замещения влияет на длительность циркуляции ГЭК в плазме крови и гемостаз. Чем выше молярное замещение, тем дольше препарат циркулирует в плазме крови и больше влияет на гемостаз, вызывая гипокоагуляцию.
Характер замещения указывает на то, к какому углеродному атому глюкозы прикреплено большее количество гидроксиэтиловых групп - С2 или С6 (рис. 5-7). Характер замещения может быть низким (менее 8) или высоким (более 8). Чем выше характер замещения (отношение С2/С6), тем медленнее происходит расщепление препарата в сосудистом русле и дольше продолжаются его эффекты.
В настоящее время наибольшей доказательной базой по эффективности и безопасности применения у больных с ОЦН обладает раствор гидроксиэтилкрахмала 130/0,4/9:1 (Волювен).
Наши исследования показали, что у больных с внутричерепными кровоизлияниями, находящихся в критическом состоянии, коррекция гиповолемии при помощи ГЭК 130/0,4/9:1 не только приводит к нормализации волемического статуса, но и сопровождается улучшением церебрального метаболизма в виде значимого уменьшения отношения лактат/пируват в пораженном веществе головного мозга.
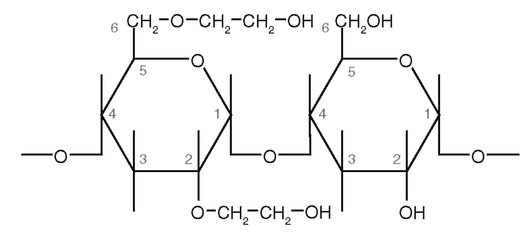
Рис. 5-7. Фрагмент химической формулы гидроксиэтилкрахмала. В положении С2 и С6 к молекуле глюкозы прикреплены гидроксиэтиловые группы (CH2СН2-ОН)
Кристаллоидные растворы в основном распределяются в интерстициальном пространстве. Через 1 ч после инфузии кристаллоидного раствора Рингер-лактат только 20% от введенного количества остается в сосудистом русле. В связи с этим данные препараты принципиально не подходят для применения в качестве объемозамещающих средств. Наиболее распространенный в клинической практике кристаллоидный раствор - физиологический раствор хлорида натрия (0,9% раствор NaCl). Однако характеристики физиологического раствора существенно отличаются от состава плазмы крови. Так, осмолярность плазмы крови составляет 290-295 мОсм/л, а 0,9% раствора NaCl - 308 мОсм/л. Выраженная разница наблюдается также по показателю рН и концентрации Cl-. рН плазмы крови в норме составляет 7,42, а pH физиологического раствора - 5,7, концентрация Cl- - 103 ммоль/л и 154 ммоль/л соответственно. Избыточное поступление хлоридов может вызывать гиперхлоремический метаболический ацидоз.
В настоящее время существуют кристаллоидные растворы, сбалансированные по электролитному составу. По сравнению с обычными кристаллоидами данные препараты более приближены к составу плазмы крови. Идеальный сбалансированный электролитный раствор должен иметь наиболее приближенные к плазме крови значения рН и концентрации натрия и хлоридов (табл. 5-1).
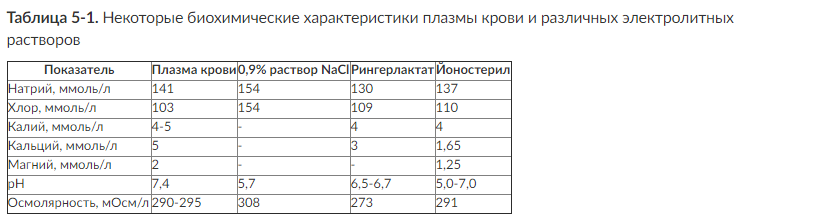
По нашим данным, применение в составе инфузионной терапии только кристаллоидных растворов приводит к заметному увеличению содержания внесосудистой воды в легких и выраженному снижению отношения PaO2/FiO2.
ОБЪЕМ ИНФУЗИОННОЙ ТЕРАПИИ
При расчете объема инфузионной терапии у больных с ОЦН, находящихся в критическом состоянии, следует учитывать физиологическую потребность в жидкости (30-40 мл/кг/сут), а также дополнительные факторы, влияющие на водный обмен. Фиксируют потери жидкости, связанные с дыханием и потоотделением (400-500 мл/сут), лихорадкой (10 мл/кг/ч на 1 °С), парезом кишечника (20 мл/кг/ч), стулом, полиурией и удалением спинномозговой жидкости. При проведении расчетов необходимо учитывать объем энтерального питания.
Больным с ОЦН назначают объем инфузионной терапии, достаточный для поддержания нормоволемии. Стараются поддерживать нулевой водный баланс. По нашим данным, в остром периоде как травматического, так и нетравматического внутричерепного кровоизлияния средний объем инфузионной терапии (без учета энтерального питания), необходимый для обеспечения нормоволемии, составляет 40-50 мл/кг/сут.
ИСПОЛЬЗОВАНИЕ СИМПАТОМИМЕТИКОВ
В случае недостаточной эффективности инфузионной терапии для повышения ЦПД применяют симпатомиметики (допамин, адреналин, норадреналин, мезатон и др.). Дозы допамина, при которых удается получить необходимый гипертензивный эффект, составляют 8-10 мкг/кг/мин, адреналина - 0,1-0,2 мкг/кг/мин, норадреналина - 0,2-0,3 мкг/кг/мин. Мезатон (фенилэфрин), как правило, применяют вместе с допамином и назначают по 0,2-0,5 мкг/кг/мин. Все симпатомиметики могут индуцировать полиурию (при условии купирования гиповолемии), что следует учитывать при расчете объема инфузионной терапии.
КОРРЕКЦИЯ ВОДНО-ЭЛЕКТРОЛИТНЫХ РАССТРОЙСТВ
Большое значение в лечении больных с ОЦН имеет коррекция водно-электролитных расстройств и в первую очередь гипер- и гипонатриемии.
НЕСАХАРНЫЙ ДИАБЕТ
Наиболее частая причина гипернатриемии у больных с ОЦН, находящихся в критическом состоянии, - несахарный диабет, развивающийся вследствие недостаточного синтеза и/или секреции антидиуретического гормона (АДГ), вырабатываемого в гипоталамусе. В нормальных условиях повышение осмоляльности плазмы крови стимулирует выброс АДГ, что приводит к снижению диуреза за счет повышенной реабсорбции воды в почках. У больных с поражением головного мозга снижение концентрации АДГ в плазме крови приводит к развитию полиурии и гипернатриемии. Помимо приведенных симптомов отмечают снижение осмоляльности и удельного веса мочи. При возникновении несахарного диабета назначают синтетический аналог АДГ - десмопрессин в следующих дозах: внутривенно - 4 мкг, назально (в виде спрея) - 10 мкг, перорально или в желудочный зонд - 0,1-0,2 мг - и корригируют дефицит ОЦК за счет инфузии кристаллоидных и коллоидных препаратов.
ИЗБЫТОЧНАЯ ПРОДУКЦИЯ АДГ И СИНДРОМ ЦЕРЕБРАЛЬНОЙ ПОТЕРИ СОЛИ
Избыточная продукция АДГ и синдром церебральной потери соли - наиболее частые причины развития гипонатриемии у больных с ОЦН. Дифференциальная диагностика этих состояний имеет большое значение для лечебной тактики (табл. 5-2). Важный дифференциальный признак - волемический статус. При избыточной продукции АДГ отмечается гиперволемия, а при синдроме церебральной потери соли - гипоили нормоволемия. Клинические симптомы гипонатриемии проявляются при снижении концентрации натрия в плазме крови до 120 ммоль/л. Основными клиническими симптомами считают угнетение уровня бодрствования до комы и возникновение тонических судорог.
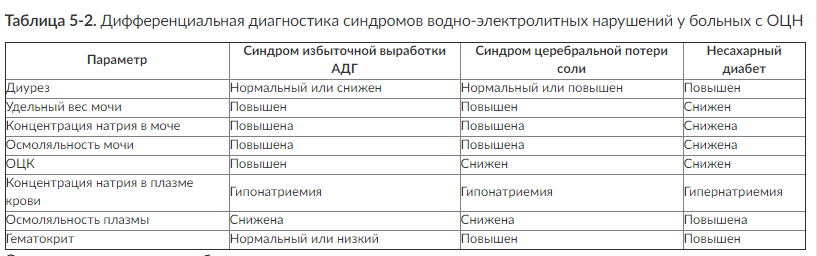
Основная задача терапии обоих синдромов - коррекция концентрации натрия в плазме крови.
Потребность в натрии рассчитывают по следующей формуле:
Необходимое количество натрия (ммоль) = = [125 или желаемая концентрация Na+ - Na+ фактический (ммоль/л)] × 0,6 × масса (кг).
Концентрацию натрия следует медленно (со скоростью 0,5-1 ммоль/л/ч) повышать до достижения уровня 125-130 ммоль/л. Для этого проводят инфузию 3% раствора NaCl (513 ммоль натрия в 1 л раствора) или 7,2% раствора NaCl в ГЭК 200/0,5 (ГиперХАЕС) (1232 ммоль натрия в 1 л раствора).
При избыточной выработке АДГ проводят дегидратационную терапию, а при синдроме церебральной потери соли корригируют гиповолемию. Для уменьшения выделения натрия с мочой при синдроме церебральной потери соли назначают кортикостероиды, обладающие минералокортикоидной активностью (флудрокортизона ацетат 0,2-0,4 мг/сут).
ТРАНСФУЗИОННАЯ ТЕРАПИЯ
Точные причины возникновения анемии у больных с ОЦН до конца не ясны. Возможные причины - кровопотеря, угнетение выработки эритропоэтина и разрушение эритроцитов при развитии системной воспалительной реакции. По данным экспериментальных исследований, выраженная анемия у животных с ОЦН сопровождается появлением ишемического паттерна церебрального метаболизма. Основная цель гемотрансфузии - обеспечение достаточной доставки кислорода к головному мозгу и периферическим тканям.
Важно помнить, что переливание компонентов донорской крови представляет собой операцию трансплантации чужеродной ткани и поэтому может представлять опасность для реципиента как в иммунологическом отношении (возможное развитие аллоиммунизации с образованием антител против антигенов эритроцитов и белков плазмы), так и с точки зрения возможного заражения инфекционными заболеваниями.
Лечение острой кровопотери у больных с поражением головного мозга объемом до 30% ОЦК (1500 мл) осуществляют с помощью инфузии только кристаллоидных и коллоидных растворов. Трансфузии компонентов крови в этих случаях противопоказаны.
Показаниями для трансфузии эритроцитов у пострадавших с ОЦН считают следующие состояния:
• кровопотеря, составляющая 30-50% ОЦК;
• снижение уровня гемоглобина до 70-80 г/л и гематокрита до 20-25%;
• снижение уровня гемоглобина до 81-90 г/л у лиц пожилого возраста, особенно страдающих ишемической болезнью сердца.
При необходимости ежедневного переливания эритроцитарной массы или массивной гемотрансфузии используют отмытые физиологическим раствором эритроциты.
Показаниями для использования свежезамороженной плазмы считают следующие состояния:
• кровопотеря, составляющая 25-30% ОЦК и выше;
• снижение концентрации фибриногена до 0,8 г/л;
• снижение протромбинового индекса до 60% и ниже;
• увеличение тромбинового времени или активированного частичного тромбопластинового времени более чем в 1,8 раза по сравнению с контролем.
Глава 7. Отек мозга
Повышение внутричерепного давления приводит к уменьшению МК и ишемии головного мозга и сопровождается выраженным ухудшением церебральной оксигенации и метаболизма.
ПАТОФИЗИОЛОГИЯ ВНУТРИЧЕРЕПНОЙ ГИПЕРТЕНЗИИ
Череп взрослого человека представляет собой замкнутую полость с ригидными стенками, в норме заполненную на 85% мозговым содержимым, на 10% - спинномозговой жидкостью и на 5% - кровью. В нормальных условиях эти соотношения обычно поддерживают постоянное ВЧД (0-13 мм рт.ст.). При возникновении внутричерепного кровоизлияния появление дополнительного объема приводит к конфликту внутричерепных компонентов (доктрина Monro-Kellie) (рис. 7-1). Реализация принципа Monro-Kellie зависит от скорости прогрессирования патологического процесса и резерва податливости (т.е. способности адаптироваться к увеличению объема) краниоспинальной и церебральной сосудистой системы. Резерв податливости внутричерепного содержимого называют церебральным комплаенсом (ЦК).
Церебральный комплаенс - свойство головного мозга обеспечивать постоянство внутричерепного давления путем создания резервных пространств в результате уменьшения объема спинномозговой жидкости и церебральной фракции крови:
ЦК=ΔВЧО/ΔВЧД,
где ΔВЧО - изменение объема внутричерепных компонентов (ВЧО); ΔВЧД - изменение внутричерепного давления.
Величина ЦК индивидуальна у каждого человека. Она зависит от объема межщелевых пространств и увеличивается при атрофии головного мозга или после резекции мозгового вещества во время нейрохирургических вмешательств. ЦК снижается при остром появлении патологических компонентов (гематома) или отеке мозга. При медленно прогрессирующих процессах, например растущей опухоли головного мозга, комплаенс значительное время остается нормальным, что объясняет длительное сохранение внутричерепной нормотензии.
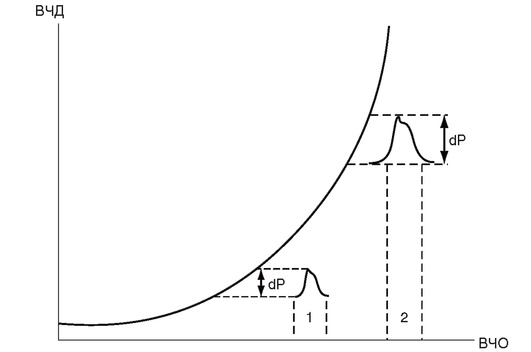
Рис. 7-1. Соотношение между ВЧО и ВЧД. На схеме видно, что одинаковый прирост ВЧО сопровождается различным увеличением ВЧД (dP) при нормальном (1) и сниженном (2) церебральном комплаенсе (по Piper I., 1997)
Физиологическое управление церебральным комплаенсом осуществляется путем контроля двух его компонентов - цереброспинальной жидкости и крови.
Объем цереброспинальной жидкости зависит от соотношения процессов ее образования хориоидальным сплетением желудочков и обратного всасывания (резорбции) преимущественно пахионовыми грануляциями. Средняя скорость образования цереброспинальной жидкости составляет 0,3 мл/мин (около 400-500 мл/сут). Нарушение ликвородинамики (например, при остром окклюзионном синдроме вследствие гематомы в задней черепной ямке, инфаркта мозжечка или опухоли III желудочка) приводит к накоплению цереброспинальной жидкости и развитию внутричерепной гипертензии.
Объем внутричерепной фракции крови зависит от метаболических потребностей мозга, системного АД, а также эффективности доставки кислорода и глюкозы. Наиболее важные параметры, количественно характеризующие кровообращение мозга, - ЦПД и объемный МК.
Поддержанию постоянного МК способствует его ауторегуляция.
Выделяют три основных механизма ауторегуляции МК: нейрогенный, химический и миогенный.
Нейрогенный механизм обеспечивает постоянство МК независимо от вертикального или горизонтального положения головы.
Химический механизм компенсирует МК в зависимости от концентрации растворенной в крови углекислоты.
Миогенный механизм стабилизирует МК при колебаниях системного давления. Таким образом, при остро развившейся артериальной гипотензии происходит вазодилатация капиллярной сети, что защищает нервную ткань от гипоксии и ишемии. При повышении системного АД церебральные сосуды сужаются (вазоконстрикция), предотвращая полнокровие и развитие вазогенного отека головного мозга. При несостоятельности вазодилататорного звена (например, при гипертонической болезни) возникает высокий риск развития ишемии и, наоборот, при слабости вазоконстрикторного звена (гипертонический криз у негипертоника) - риск вазогенного отека мозга.
Одна из наиболее частых причин развития внутричерепной гипертензии и нарушения церебральной перфузии - отек головного мозга. Отек мозга представляет собой возрастание количества внутриклеточной и/или внеклеточной жидкости, приводящее к увеличению объема мозга и развитию внутричерепной гипертензии. В зависимости от патогенеза выделяют несколько основных типов отека мозга.
• Вазогенный отек. Характеризуется увеличением объема внеклеточной жидкости. В норме ГЭБ непроницаем для натрия, и поступление этого иона во внутриклеточное пространство возможно только при помощи активного транспорта K+-Na+ АТФазой. Основной механизм формирования вазогенного отека - нарушение функции ГЭБ. При этом работа K+-Na+ АТФазы может не нарушаться. При повреждении ГЭБ происходит свободная диффузия натрия и других органических осмотически активных веществ в интерстициальное пространство мозга с привлечением свободной воды.
• Цитотоксический отек. Характеризуется увеличением объема внутриклеточной жидкости при сохранном ГЭБ. Основная причина формирования цитотоксического отека - нарушение функции натрий-калиевого насоса, обусловленное дефицитом энергии. При этом проницаемость ГЭБ может быть не нарушена. Основная причина развития цитотоксического отека - ишемия ткани мозга.
• Осмотический отек. Возникает при выраженной контузии вещества головного мозга, сопровождающейся массивным повреждением клеток мозга и ГЭБ и повышением осмоляльности в зоне поражения. Повышение осмоляльности в сочетании с нарушением ГЭБ приводит к привлечению воды и отеку зоны ушиба мозга.
• Интерстициальный отек. Наблюдается при развитии гидроцефалии и характеризуется увеличением объема интерстициального пространства вследствие нарушения оттока цереброспинальной жидкости. При данной форме отека мозга функция клеток мозга и ГЭБ сохранена.
В последнее время при обсуждении патогенеза отека мозга все большее внимание уделяют аквапоринам 4-го типа. Аквапорины 4-го типа - это специальные каналы, локализующиеся в астроцитах и отвечающие за транспорт воды. В экпериментальных исследованиях показано, что животные, у которых отсутствуют аквапорины 4-го типа, по-разному реагируют на различные виды отека мозга. Они лучше переживают цитотоксический отек и хуже - вазогенный.
ЛЕЧЕНИЕ ВНУТРИЧЕРЕПНОЙ ГИПЕРТЕНЗИИ
Коррекция внутричерепной гипертензии - одна из важнейших задач интенсивной терапии больных с поражением головного мозга, находящихся в критическом состоянии.
Для снижения повышенного ВЧД используют пошаговый подход.
• Выполняют компьютерную томографию головного мозга для исключения причин повышения ВЧД, требующих хирургической коррекции. При наличии вентрикулярного катетера проводят контролируемый сброс цереброспинальной жидкости (рис. 7-2, см. цв. вклейку). Следует учитывать, что удаление цереброспинальной жидкости - временная мера коррекции ВЧД, которая не приводит к улучшению оксигенации и метаболизма головного мозга (рис. 7-3).
• Обеспечивают возвышенное положение головного конца кровати (15-30°). Использование данной методики позволяет улучшить венозный отток от головного мозга и снизить ВЧД (рис. 7-4).
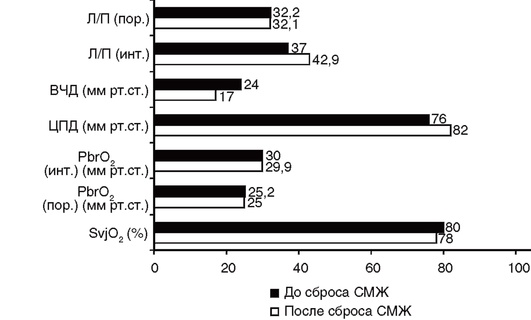
Рис. 7-3. Влияние контролируемого сброса спинномозговой жидкости на ВЧД, насыщение гемоглобина кислородом в луковице внутренней яремной вены (SvjO2), напряжение кислорода (PbrO2) и отношение лактат/пируват (Л/П) в пораженном (пор.) и интактном (инт.) веществе мозга. Снижение ВЧД с 24 до 17 мм рт. ст. не приводит к улучшению церебральной оксигенации и метаболизма
• Коррегируют гипертермию. Под гипертермией понимают повышение «ядерной» температуры тела до 38,3 °С и более. Температура головного мозга превышает «ядерную» температуру на 0,32-1,9 °С. Повышение температуры тела на 1 °С увеличивает метаболическую потребность мозга на 8% и приводит к нарастанию внутричерепного объема крови и повышению ВЧД. Повышение температуры всего на несколько градусов может очень быстро истощить резервы травмированного мозга. Основная причина повышения ВЧД при развитии гипертермии - увеличение МК и внутричерепного объема крови. У больных с внутричерепной гипертензией следует поддерживать «ядерную» температуру ниже 38 °С. Снижение температуры мозга всего на 1 °С приводит к значимому уменьшению ВЧД. Для коррекции гипертермии используют как медикаментозные, так и физические методы охлаждения. Хорошо зарекомендовали себя специальные охлаждающие водяные матрасы (рис. 7-5, см. цв. вклейку).
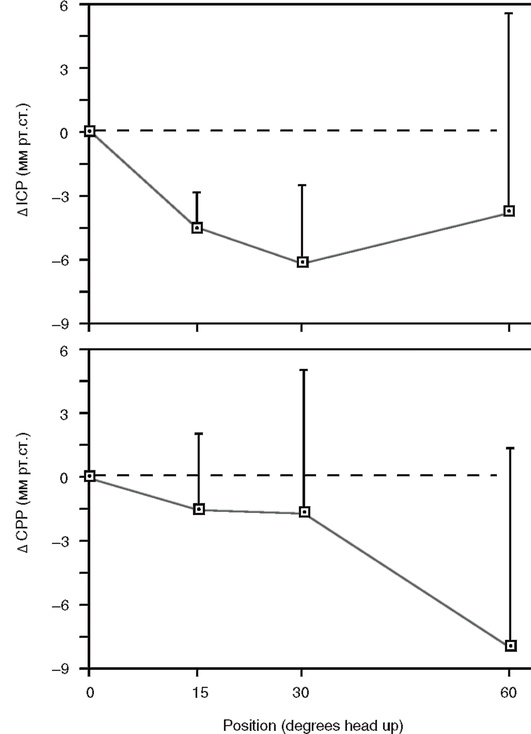
Рис 7-4. Влияние положения головного конца кровати на ВЧД и ЦПД. Подъем головного конца на 30° сопровождается снижением ВЧД на 6 мм рт.ст. (ΔICP) и ЦПД на 2 мм рт.ст. (ДСРР). Дальнейший подъем головного конца кровати до 60° приводит к повышению ВЧД и значительному снижению ЦПД (по Durward 1983)
• Осуществляют седативную терапию. В условиях повышенного ВЧД и сниженной краниоцеребральной податливости наличие двигательного возбуждения или борьба больного с аппаратом ИВЛ может привести к повышению внутригрудного давления и давления в яремных венах, что, в свою очередь, вызовет дальнейшее увеличение ВЧД. В связи с этим грамотная седация - один из ключевых факторов контроля ВЧД. У больного с поражением головного мозга восходящий поток болевой импульсации провоцирует формирование дополнительных очагов возбуждения в подкорковых областях. С одной стороны, в условиях сниженного порога судорожной готовности головного мозга это может спровоцировать появление судорог. С другой стороны, это вызовет локальное повышение метаболизма в зоне проекции болевой чувствительности, что будет способствовать расширению зоны первоначального повреждения. Вот почему многокомпонентная аналгезия и обязательная анестезия при любых манипуляциях с пациентом - обязательный компонент базовой терапии, особенно у пациентов с угнетенным сознанием. Основные препараты, применяемые для проведения седативной терапии и аналгезии, - пропофол, опиоиды и бензодиазепины.
• Купируют судороги. Развитие фокальных и вторично генерализованных эпилептических припадков в остром периоде ОЦН наблюдается у 3-4% больных. Возникновение судорожного синдрома увеличивает метаболизм мозга и приводит к повышению ВЧД. Для купирования судорог чаще всего используют бензодиазепины [10-20 мг (0,2-0,5 мг/кг) внутривенно болюсно и затем повторно 10 мг внутривенно или внутримышечно] или вальпроевую кислоту (5-15 мг/кг в сутки). При серии эпиприпадков или эпистатусе используют повторные внутривенные введения бензодиазепинов в дозах до 0,5 мг/кг или вальпроевую кислоту (10 мг/кг внутривенно в течение 3-5 мин и 0,6 мг/кг в виде внутривенной инфузии до 2500 мг/сут). При неэффективности данной терапии больного вводят в барбитуровый наркоз при помощи внутривенной инфузии тиопентала натрия (до 5-6 г/сут).
• Используют гиперосмолярные растворы. Введение гиперосмолярных растворов - наиболее распространенный метод нехирургической коррекции внутричерепной гипертензии. Использование подобных препаратов приводит к возникновению временного градиента осмотического давления между плазмой крови и интерстициальным пространством мозга, вызывая перемещение жидкости во внутрисосудистое пространство. Для снижения ВЧД можно применять маннитол, гипертонические растворы хлорида натрия и комбинацию гипертонического хлорида натрия с коллоидными препаратами. Наиболее часто для коррекции ВЧД применяют болюсное введение маннитола в дозе 0,25-1 г/кг массы тела. Следует отметить, что маннитол накапливается в клетках головного мозга и ЦСЖ, в связи с чем его повторные введения могут приводить к развитию феномена отдачи (ребаунд-эффект). Возможные осложнения при использовании маннитола - сердечная недостаточность, гиперкалиемия, почечная недостаточность и гиперосмолярный синдром. В последнее время с целью снижения ВЧД активно применяют гипертонические растворы хлорида натрия. Данные препараты изначально использовали не в целях снижения ВЧД, а для малообъемной реанимации у пациентов с геморрагическим шоком. По сравнению со стандартной противошоковой терапией малообъемная реанимация обеспечивает быстрое восполнение внутрисосудистого объема жидкости и приводит к увеличению сердечного выброса, артериального давления и улучшению микроциркуляции. Для увеличения продолжительности гемодинамических эффектов были созданы комбинации гипертонических растворов хлорида натрия с коллоидными препаратами. Добавление коллоида способствует продолжительному удержанию жидкости в сосудистом русле и создает дополнительное онкотическое давление. В настоящее время в России известна комбинация 7,2% раствора хлорида натрия с гидроксиэтилкрахмалом (ГиперХАЕС). По данным многоцентрового исследования Федерации анестезиологов и реаниматологов России, наиболее выраженное и продолжительное влияние на ВЧД оказывает именно комбинированный гипертонический раствор хлорида натрия с ГЭК (рис. 7-6). Помимо снижения ВЧД введение гипертонических растворов хлорида натрия приводит к улучшению оксигенации и метаболизма головного мозга. По нашим данным, гиперосмолярные растворы по-разному влияют на метаболизм мозга. Введение 15% раствора маннитола не приводит к улучшению церебрального метаболизма, а использование раствора ГиперХАЕС сопровождается выраженным улучшением метаболизма головного мозга в виде значительного увеличения концентрации глюкозы и пирувата в интерстициальной жидкости как интактного, так и пораженного вещества головного мозга. При применении гиперосмолярных растворов необходимо тщательно контролировать осмоляльность плазмы крови. Необходимо учитывать, что повышение осмоляльности до уровня более 320 мОсм/кг способствует развитию почечной недостаточности. Осмотический диурез, вызванный маннитолом и гипертоническими растворами натрия хлорида, может привести к гипотонии, особенно у пациентов с исходной гиповолемией. В связи с этим следует учитывать, что наиболее продолжительный эффект на ВЧД и системную гемодинамику оказывает комбинация гипертонического хлорида натрия с гидроксиэтилкрахмалом.
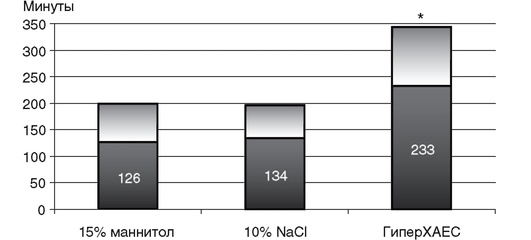
Рис. 7-6. Продолжительность эффекта различных гиперосмолярных растворов при коррекции внутричерепной гипертензии (время после окончания инфузии раствора, в течение которого ВЧД не превышало 20 мм рт.ст., М+σ); ♠ - p <0,05 по сравнению с 15% раствором маннитола и 10% раствором NaCl (по Полушину Ю.С. и соавт., 2009)
• Вводят барбитураты. Барбитураты вызывают снижение МК и угнетают церебральный метаболизм, а при использовании в высоких дозах могут уменьшать внутричерепной объем крови и снижать ВЧД. Однако применение барбитуратов может сопровождаться выраженной артериальной гипотензией и снижением ЦПД. Таким образом, при осуществлении данного вида терапии необходимо тщательно мониторировать гемодинамику и поддерживать ЦПД в необходимых пределах.
• Осуществляют управляемую гипотермию. Гипотермия - один из перспективных методов терапии внутричерепной гипертензии, рефрактерной к консервативным методам терапии. Умеренное снижение температуры головного мозга угнетает церебральный метаболизм, что, в свою очередь, может привести к уменьшению МК, внутричерепного объема крови и ВЧД. Нужно учитывать, что охлаждение больного до температуры 32-34 °С необходимо проводить очень быстро (в течение 30-60 мин), а согревание - очень медленно (0,2-0,3 °С/ч).
• Выполняют декомпрессивную краниотомию. Этот метод используют при неэффективности консервативных мероприятий в течение 6-12 ч с момента развития внутричерепной гипертензии. При выполнении декомпрессивной краниотомии необходимо стремиться к формированию достаточно большого костного дефекта и осуществлять свободную пластику твердой мозговой оболочки (рис. 7-7).
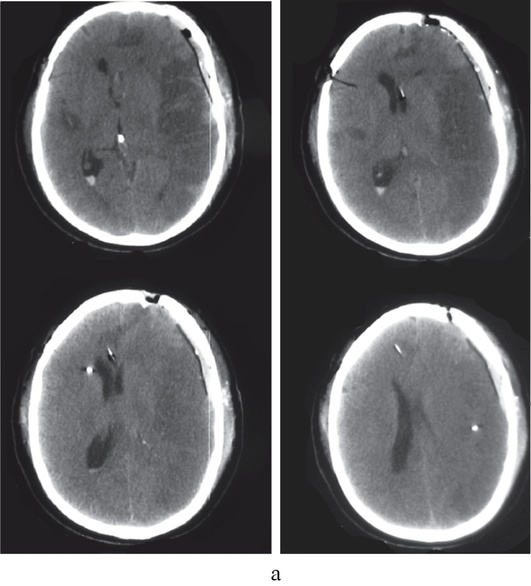
Рис. 7-7. КТ головного мозга больного с ангиоспазмом вследствие разрыва аневризмы левой внутренней сонной артерии: а - до выполнения декомпрессивной краниотомии (ВЧД - 28 мм рт.ст., отношение лактат/пируват в левом полушарии мозга - 250, в правом - 25); б - после проведения декомпрессивной краниотомии (ВЧД - 3 мм рт.ст., отношение лактат/пируват в левом полушарии мозга - 120, в правом -22)
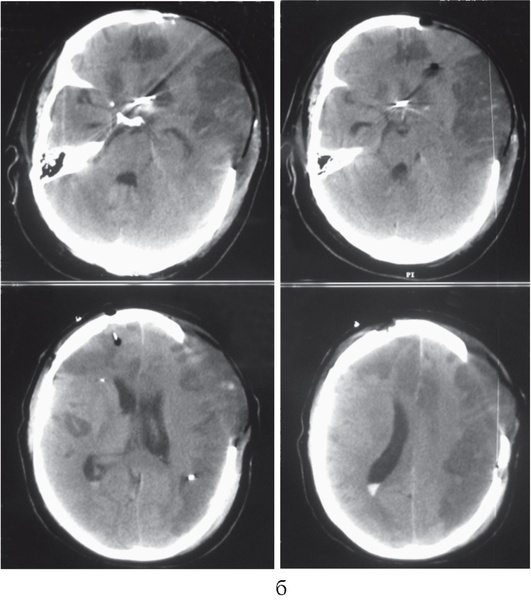
Рис. 7-7. Окончание
ИСПОЛЬЗОВАНИЕ ГЛЮКОКОРТИКОИДОВ ДЛЯ ЛЕЧЕНИЯ ОТЕКА ГОЛОВНОГО МОЗГА
В связи с недоказанностью эффекта глюкокортикоиды не используют в терапии внутричерепной гипертензии у больных с ОЦН.
Дополнительный иллюстрации
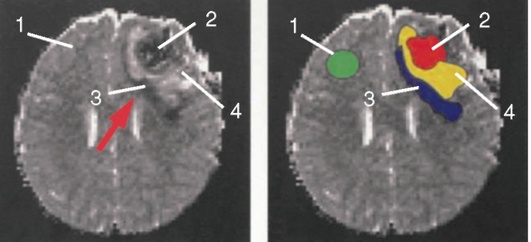
Рис. 1. Диффузионно-тензорная магнитно-резонансная томография больного с ушибом левой лобной доли. При картировании по видимому диффузионному коэффициенту (ADC-map) выявляются: интактное вещество мозга (1), зона первичного необратимого повреждения мозга (2), зона пенумбры, состоящая из зон, в которых преобладает вазогенный отек (3) или цитотоксический отек (4) (по Abate M.G. et al, 2008)
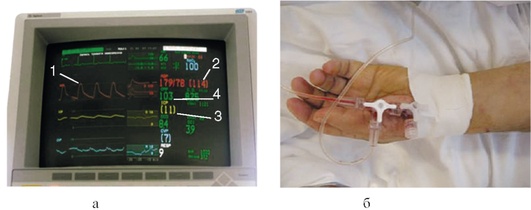
Рис. 3-1. Инвазивное измерение артериального давления: а - общий вид экрана прикроватного монитора: 1 - кривая АД; 2 - систолическое/диастолическое артериальное давление (среднее); 3 - внутричерепное давление; 4 - церебральное перфузионное давление; б - катетер, установленный в лучевую артерию для измерения АД и взятия проб артериальной крови
Рис. 3-2. Фиксация датчика для инвазивного измерения АД (1) для правильного расчета ЦПД (пунктирной линией показана проекция отверстия Монро)
Рис. 3-3. Оборудование для проведения транспульмональной термодилюции: а - внешний вид экрана прикроватного монитора с интегрированным блоком для транспульмональной термодилюции; б - катетер с термистором, установленный в бедренную артерию: 1 - канал для постоянного измерения АД; 2 - термодатчик для фиксации температуры артериальной крови
Рис. 3-3. Окончание: в - внешний вид больного с установленной системой для транспульмональной термодилюции: 1 - монитор; 2 - катетер с термистором, установленный в бедренную артерию; 3 - датчик для измерения температуры вводимого раствора; г - датчик для измерения температуры вводимого холодного раствора, прикрепленный к центральному венозному катетеру (показан стрелкой)
Рис. 3-4. Неинвазивный мониторинг системной гемодинамики при помощи чреспищеводной допплерографии: а - внешний вид монитора; б - датчик для чреспищеводной допплерографии, установленный в пищевод
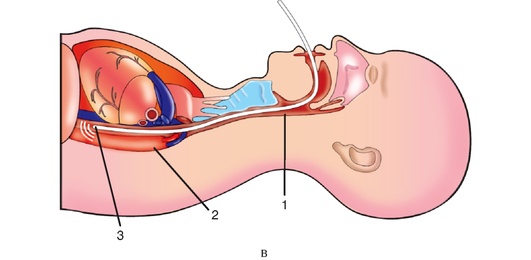
Рис. 3-4. Окончание: в - схема установки датчика для чреспищеводной допплерографии: 1 - пищевод; 2 - нисходящая аорта; 3 – датчик
Рис. 3-5. Система для внутрижелудочкового измерения ВЧД и контролируемого сброса цереброспинальной жидкости: 1 - датчик для измерения давления (должен быть фиксирован на уровне отверстия Монро); 2 - линейка для установки уровня сброса цереброспинальной жидкости, градуированная в см водного столба и мм ртутного столба; 3- колба для сбора цереброспинальной жидкости; 4 - воздушный клапан
Рис. 3-6. Внешний вид датчика для вентрикулярного измерения внутричерепного давления монитором Шпигельберга: 1 - баллончик для измерения давления; 2 - канал для удаления цереброспинальной жидкости; 3 - канал, подключаемый к монитору ВЧД; 4 - отверстия для удаления цереброспинальной жидкости

Рис. 3-8. Мониторинг ВЧД и церебрального комплаенса при помощи монитора Шпигельберга: 1 - канал для измерения ВЧД; 2 - тензометрический датчик давления; 3 - показатель ВЧД; 4 - показатель церебрального комплаенса
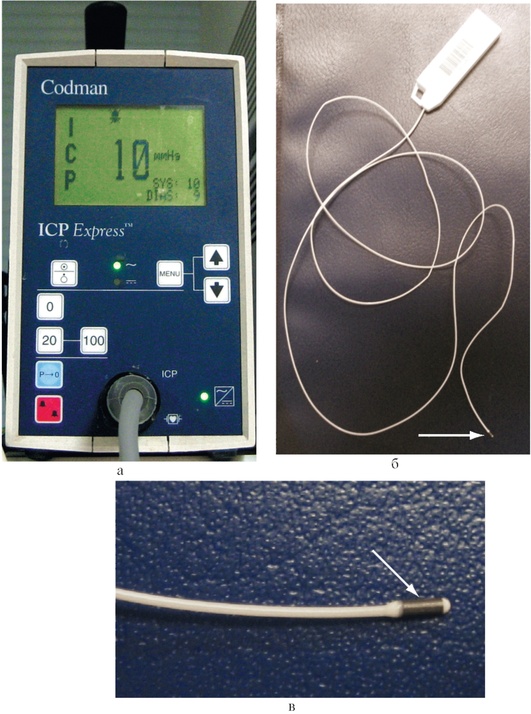
Рис. 3-10. Паренхиматозное измерение ВЧД монитором «Codman»: а - внешний вид монитора «Codman»; б, в - датчик для паренхиматозного измерения внутричерепного давления (стрелкой указан микрочип, измеряющий ВЧД)
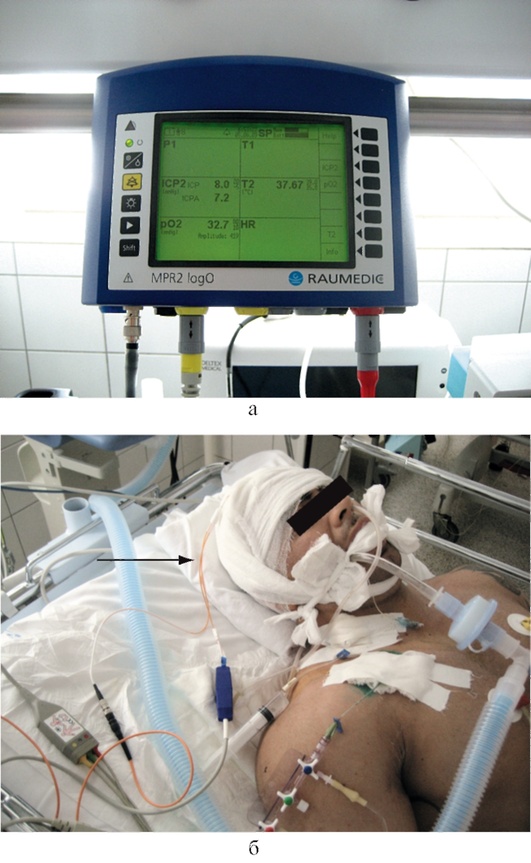
Рис. 3-11. Измерение ВЧД при помощи монитора MPRO2: а - внешний вид монитора; б - датчик, измеряющий ВЧД, PbrO2 и температуру головного мозга (стрелка)
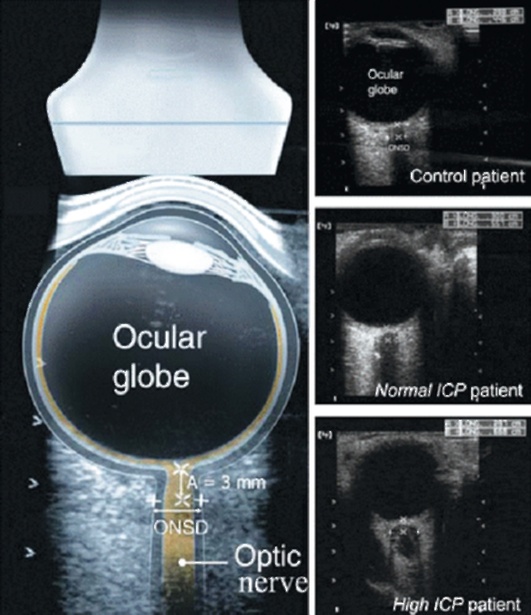
Рис. 3-12. Ультразвуковое исследование глаза: а - ультразвуковой датчик (1), глазное яблоко (ocular globe), зрительный нерв (optic nerve), диаметр влагалища зрительного нерва (ONSD), измеряемый на расстоянии 3 мм от глазного яблока (А); б - результаты УЗИ глаза у здорового человека; в - результаты УЗИ глаза у больного с ЧМТ при нормальном ВЧД; г - результаты УЗИ глаза у больного с ЧМТ при повышении ВЧД (отмечается расширение влагалища зрительного нерва) (по Geeraerts Т. et al., 2007)
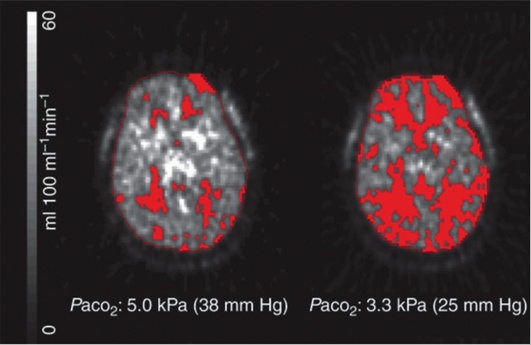
Рис. 3-13. Результаты ПЭТ больного с черепно-мозговой травмой до (а) и после (б) проведения гипервентиляции. Визуализируется выраженное снижение МК во время гипервентиляции (области с низким кровотоком отмечены красным цветом) (по Coles J., 2007)
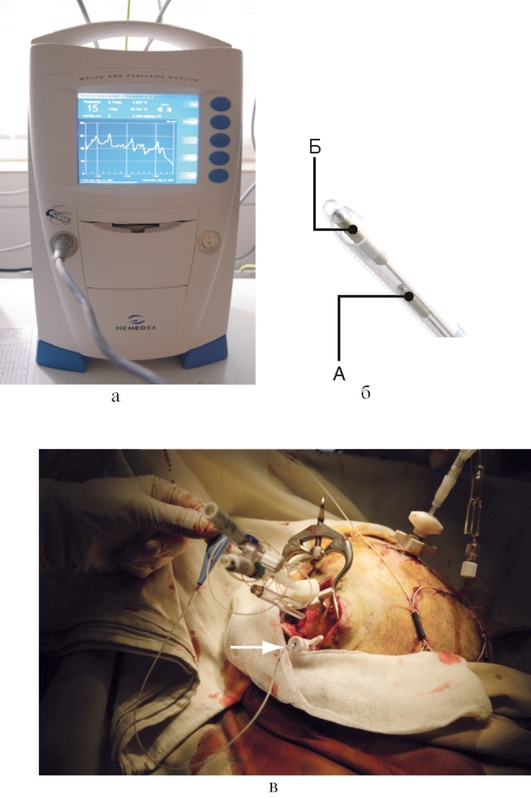
Рис. 3-14. Оборудование для измерения МК методом термодиффузии: 1 - внешний вид прибора; 2 - паренхиматозный датчик с пассивным (А) и активным (Б) термисторами; 3 - установка датчика в вещество мозга через специальное фиксирующее устройство (стрелка)
Рис. 3-15. Внешний вид прибора для проведения транскраниальной допплерографии
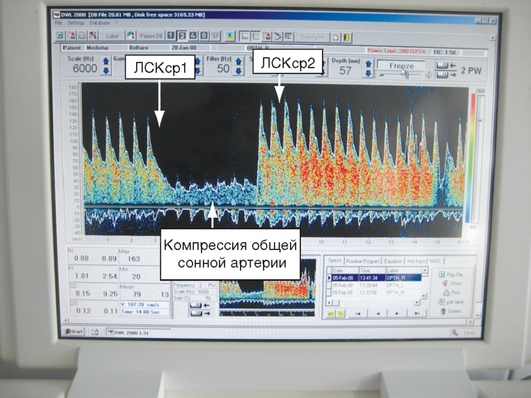
Рис. 3-16. Оценка ауторегуляции МК при помощи КО. ЛСКср1 меньше, чем ЛСКср2, коэффициент овершута составляет 1,3 (ауторегуляция сохранена)
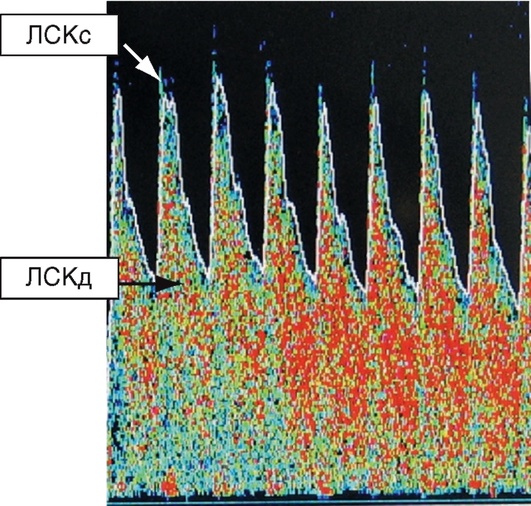
Рис. 3-17. Выявление внутричерепной гипертензии при помощи транскраниальной допплерографии. Допплерограмма больного с умеренной внутричерепной гипертензией (внутричерепное давление 22 мм рт.ст., пульсационный индекс 1,8)
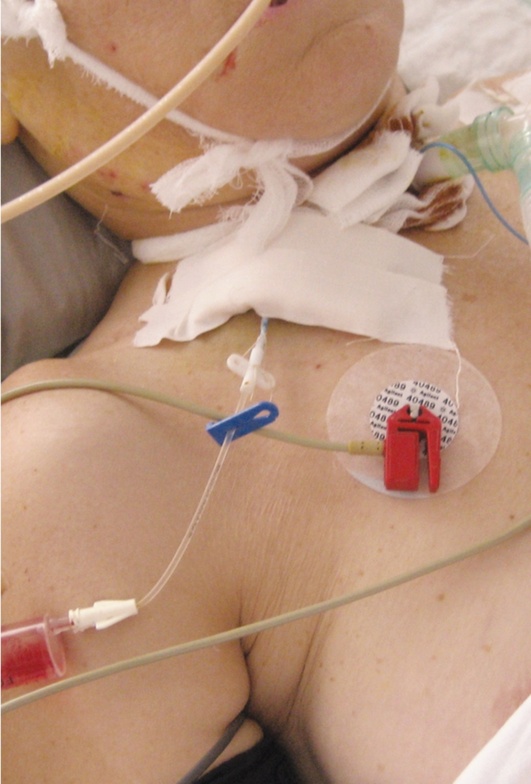
Рис. 3-18. Центральный венозный катетер, установленный ретроградно в луковицу внутренней яремной вены для дискретной оценки насыщения гемоглобина кислородом

Рис. 3-19. Приборы для постоянного измерения насыщения гемоглобина кислородом в венозной крови (а, б)
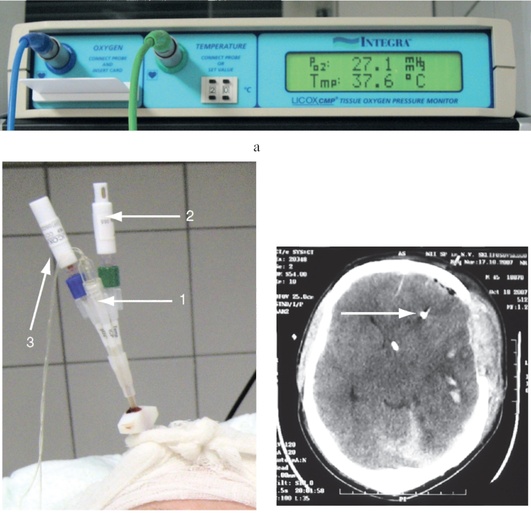
Рис. 3-21. Измерение напряжения кислорода в веществе головного мозга при помощи прибора «Licox»: а - внешний вид прибора «Licox»; б - внешний вид установленных датчиков: 1 - катетер для тканевого микродиализа; 2 - температурный датчик; 3 - датчик измерения PbrO2«Licox»; в - компьютерная томограмма головного мозга (положение датчика для измерения PbrO2 указано стрелкой)
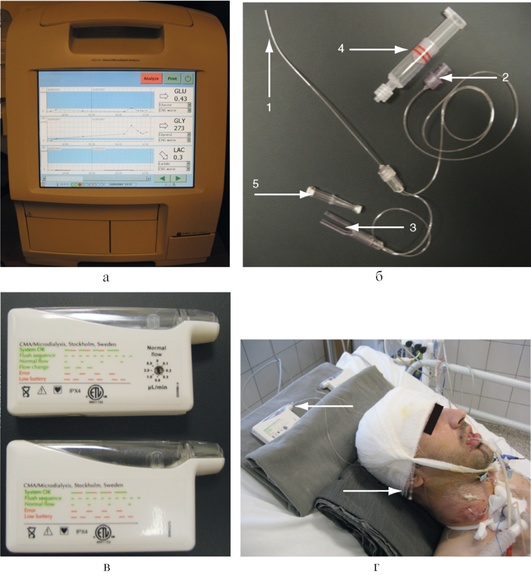
Рис. 3-23. Аппаратура для проведения тканевого микродиализа: а - портативный биохимический анализатор; б - катетер для тканевого микродиализа: 1 - полупроницаемая мембрана; 2 - порт для подсоединения инфузионного насоса; 3 - место для подсоединения микропробирки; 4 - шприц для перфузии; 5 - микропробирка; в - инфузионные насосы; г - внешний вид больного с установленными катетерами для тканевого микродиализа (стрелками отмечены инфузионный насос и место подсоединения микропробирки)
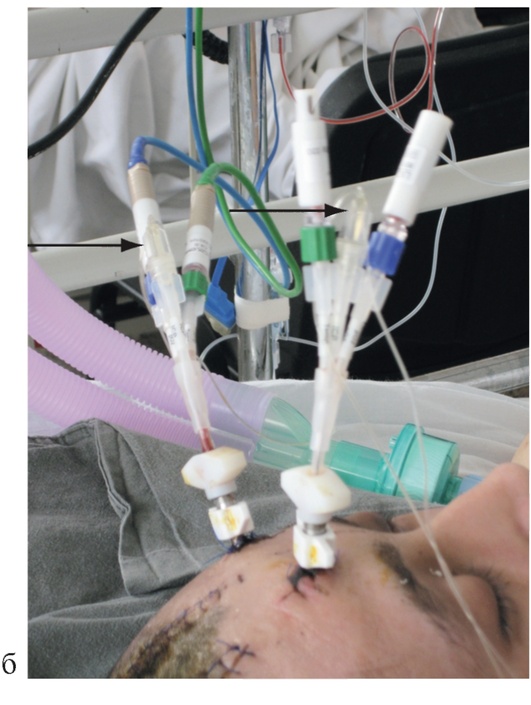
Рис. 3-24. Методы установки катетеров для тканевого микродиализа в вещество мозга (катетеры указаны стрелками): а - установка через фрезевое отверстие; б - установка через специальное устройство для фиксации датчиков – bolt
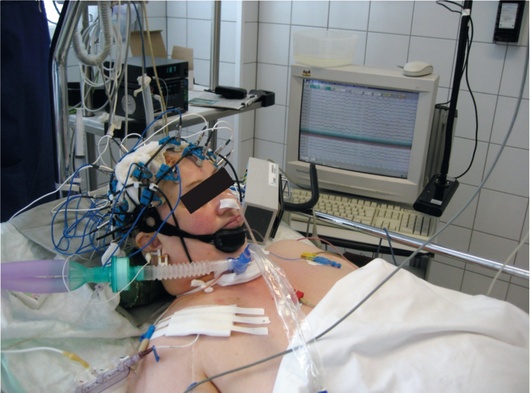
Рис. 3-26. Запись ЭЭГ у больного с внутричерепным кровоизлиянием

Рис. 4-2. Манометр для измерения давления в манжетах эндотрахеальных трубок
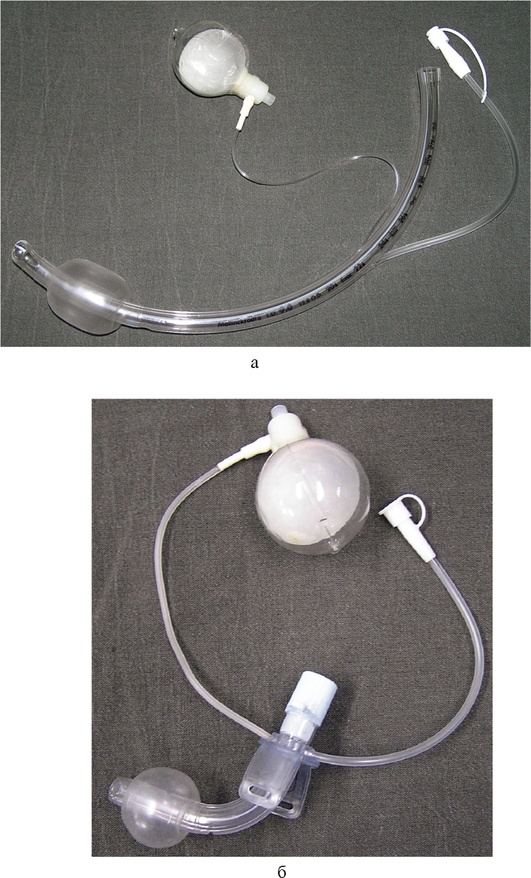
Рис. 4-3. Эндотрахеальные трубки с манжетами, оснащенными клапаном «Lanz» (а, б)

Рис. 4-6. Проведение респираторной поддержки во вспомогательном режиме ИВЛ. Наличие триггера позволяет аппарату ИВЛ поддерживать дыхательные попытки больного. Реальная частота дыхания (стрелка 1) превышает частоту дыхания, установленную врачом (стрелка 2)
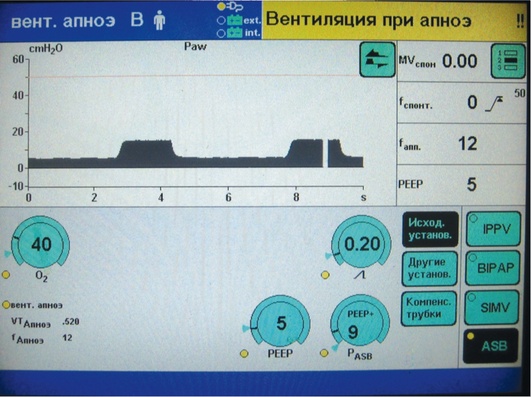
Рис. 4-7. Вентиляция при апноэ во время проведения респираторной поддержки во вспомогательном режиме ИВЛ. Аппарат ИВЛ осуществляет вентиляцию в контролируемом режиме с дыхательным объемом 520 мл и частотой дыхания 12 в минуту

Рис. 4-8. Проведение высокочастотной осцилляторной вентиляции легких у пострадавшего с тяжелой черепно-мозговой травмой, осложнившейся острым респираторным дистресс-синдромом
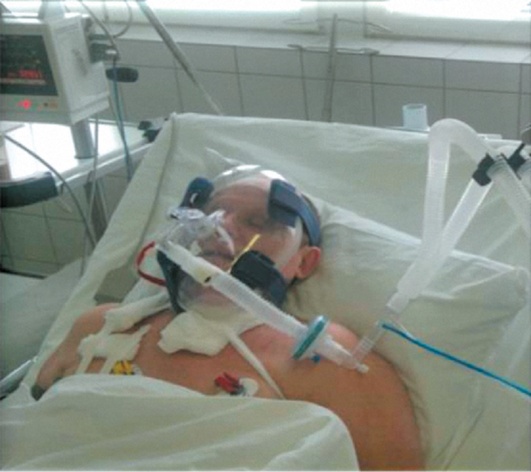
Рис. 4-9. Неинвазивная вентиляция легких при помощи лицевой маски
«Total-face» у больной в раннем послеоперационном периоде после клипирования аневризмы средней мозговой артерии
Рис. 6-1. Удаляемый стент-ретривер «SOLITAIRE»: а - внешний вид стента, б - удаление тромба из артериального сосуда при помощи стента-ретривера
Рис. 6-2. Активизация больного с внутричерепным кровоизлиянием при помощи специального тренажера «велосипед»
Рис. 7-2. Использование контролируемого сброса цереброспинальной жидкости для коррекции внутричерепной гипертензии: а - внешний вид системы для контролируемого сброса цереброспинальной жидкости; б - клинический пример [несмотря на гемодинамические и дыхательные нарушения уровень ВЧД (показано пунктирной линией) не повышен]
Рис. 7-5. Использование охлаждающего водяного матраса для контроля температуры тела: 1 - внешний вид прибора; 2 - водяной матрас; 3 - температурный датчик; 4 - температура тела пациента; 5 - температура матраса; 6 - заданная температура
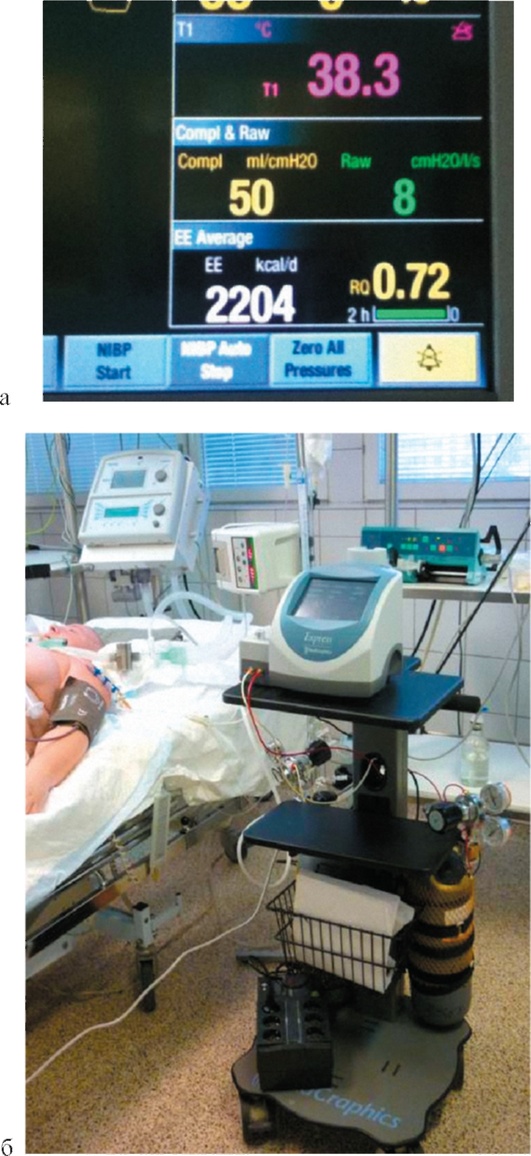
Рис. 8-1. Определение энергопотребности больного с острой церебральной недостаточностью: а - внешний вид экрана прикроватного монитора, оборудованного блоком непрямой калориметрии; б - внешний вид прибора для непрямой калориметрии
Рис. 8-2. Определение массы реанимационного больного: а - потолочные весы; б - весы, встроенные в реанимационную кровать

Рис. 8-3. Смесь для парентерального питания «три в одном». После разрыва разделительных перегородок все компоненты мешка (аминокислоты, глюкоза, жировая эмульсия) перемешивают и вводят пациенту
Рис. 9-4. Проведение надманжеточной аспирации: а - подключение системы к источнику вакуума (1) при помощи соединительной трубки (2); б - соединительная трубка (2), подключенная к вакууму, установлена в контрольную емкость (3); контрольная емкость при помощи соединительной трубки (4) присоединена к емкости для сбора надманжеточного содержимого (5). Наличие контрольной емкости предотвращает случайное попадание надманжеточного содержимого в источник вакуума; в - емкость для сбора надманжеточного содержимого при помощи соединительной трубки (6) присоединена к каналу трахеостомической трубки для надманжеточного дренирования (7)
Рис. 9-5. Обеспечение пациентов в отделении нейрореанимации отдельными аспирационными аппаратами (указаны стрелками)
Рис. 9-6. Внешний вид закрытой системы для санации трахеобронхиального дерева (1) и комбинированного дыхательного фильтра (2)

Рис. 9-7. Внешний вид дозаторов с антисептическими препаратами для обработки рук (указаны стрелками)
Рис. 9-8. Удаление цереброспинальной жидкости через поясничный дренаж. Колено системы для сбора цереброспинальной жидкости (указано стрелкой) установлено на уровне отверстия Монро
Рис. 9-9. Выполнение катетеризации бедренной артерии в стерильных условиях
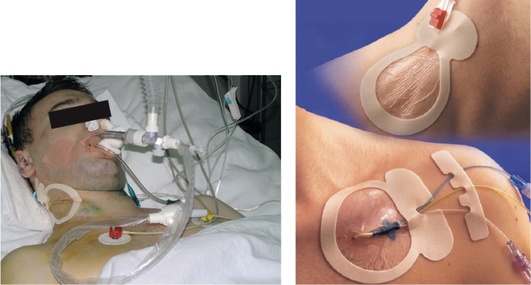
Рис. 9-10. Внешний вид стерильных защитных наклеек для центральных венозных катетеров
Рис. 9-11. Внешний вид стерильной защитной наклейки для периферического артериального катетера
Рис. 9-12. Внешний вид современной системы для дренирования мочевого пузыря, предотвращающей обратный заброс мочи
СПИСОК СОКРАЩЕНИЙ
АВМ - артериовенозная мальформация
АД - артериальное давление
АДГ - антидиуретический гормон
АКТГ - адренокортикотропный гормон
ВКИ - вентрикулокраниальный индекс
ВП - вызванные потенциалы
ВЧГ - внутричерепная гипертензия
ВЧД - внутричерепное давление
ВЧО - объем внутричерепных компонентов
ВЧОВЛ - высокочастотная осцилляторная вентиляция легких
ГЭБ - гематоэнцефалический барьер
ГЭК - гидроксиэтилкрахмал
ДСА - дигитальная субтракционная ангиография
ЖКТ - желудочно-кишечный тракт
ИВЛ - искусственная вентиляция легких
КО - коэффициент овершута
КТ - компьютерная томография
КТА - КТ-ангиография
ЛСК - линейная скорость кровотока
МК - мозговой кровоток
МНО - международное нормализованное отношение
МПК - минимальная подавляющая концентрация
МРА - магнитно-резонансная ангиография
МРТ - магнитно-резонансная томография
НИВЛ - неинвазивная вентиляция легких
ОРДС - острый респираторный дистресс-синдром
ОФЭКТ - однофотонная эмиссионная компьютерная томография
ОЦК - объем циркулирующей крови
ОЦН - острая церебральная недостаточность
ПДКВ - положительное давление в конце выдоха
ПЭТ - позитронно-эмиссионная томография
САК - субарахноидальное кровоизлияние
СВ - сердечный выброс
ТГВГ - тромбоз глубоких вен голеней
ТКДГ - транскраниальная допплерография
ТЛТ - тромболитическая терапия
ТЭЛА - тромбоэмболия легочной артерии
УЗИ - ультразвуковое исследование
ЦВД - центральное венозное давление
ЦК - церебральный комплаенс
ЦПД - церебральное перфузионное давление
ЧМТ - черепно-мозговая травма
ЧСС - частота сердечных сокращений
ШКГ - шкала комы Глазго
ЭЭГ - электроэнцефалография, электроэнцефалограмма
АСМV - искусственно-вспомогательная вентиляция легких (от assisted controlled mechanical ventilation)
BiPAP - вентиляция легких с двумя фазами положительного давления в дыхательных путях (от biphasic positive airway pressure)
CaO2 - содержание кислорода в артериальной крови
CMV - управляемая (искусственная) вентиляция легких (от controlled mechanical ventilation)
CPAP - самостоятельное дыхание с постоянно положительным давлением в дыхательных путях (от continuous positive airway pressure)
CvjO2 - содержание кислорода в оттекающей от мозга крови
DO2 - доставка кислорода
EtCO2 - концентрация углекислого газа в выдыхаемом воздухе
FiO2 - концентрация кислорода во вдыхаемой смеси
PaCO2 - напряжение двуокиси углерода в артериальной крови
PaO2 - напряжение кислорода в артериальной крови
PbrO2 - напряжение кислорода в веществе головного мозга
PCV - вентиляция с контролируемым давлением (от pressure control ventilation)
PS - поддержка дыхания давлением (от pressure support)
SIMV - синхронизированная принудительная перемежающаяся вентиляция легких (от synchronized intermittent mandatory ventilation)
SvjO2 - насыщение гемоглобина кислородом в луковице внутренней яремной вены
SаO2 - насыщение гемоглобина артериальной крови кислородом
WFNS - Международная федерация неврологических хирургов (от World Federation of Neurologic Surgeons)
ВВЕДЕНИЕ
Интенсивная терапия больных с острой церебральной недостаточностью (ОЦН) - крайне актуальная проблема современной нейрохирургии и нейрореаниматологии. Черепно-мозговая травма (ЧМТ), геморрагический инсульт, разрывы артериальных аневризм головного мозга и ишемический инсульт остаются одними из главных причин смертности и инвалидизации пациентов трудоспособного возраста.
При возникновении как травматического, так и нетравматического внутричерепного кровоизлияния или ишемического инсульта развиваются первичное и вторичное повреждения вещества мозга. Первичным называют поражение мозга, вызванное воздействием непосредственно повреждающего агента (например, травмы, геморрагического инсульта или разрыва артериальной аневризмы головного мозга). В области первичного повреждения ткань мозга погибает. Вокруг погибших клеток формируется зона перифокального торможения, или зона пенумбры (рис. 1, см. цв. вклейку). В этой зоне клетки мозга сохраняют жизнеспособность, но становятся крайне чувствительными к малейшим изменениям доставки кислорода и питательных субстратов.
Ухудшение состояния пенумбры, или условно интактного вещества мозга, вследствие каких-либо воздействий после развития первичного повреждения называют вторичным ишемическим повреждением ткани мозга. Так, частота развития вторичных ишемических повреждений головного мозга у больных с внутричерепными кровоизлияниями составляет 39-91%, а изменения, характерные для ишемии, выявляют у 80-90% умерших больных.
Один из факторов, способствующих понижению устойчивости вещества мозга к ишемическим повреждениям, - уменьшение мозгового кровотока (МК) в первые несколько суток после развития внутричерепной катастрофы. Нормальное функционирование головного мозга человека возможно лишь при условии постоянного и достаточного кровоснабжения, объем которого значительно больше, чем во всех других органах. Несмотря на небольшую массу головного мозга (2% от массы тела), на его кровоснабжение расходуется 20% сердечного выброса. В головном мозге поддерживается высокий уровень метаболической активности, однако мозг не имеет запасов питательных веществ, и даже кратковременные нарушения церебральной перфузии могут привести к нарушению его функций.
Нормальная скорость объемного МК составляет 46-55 мл/100 г/мин. Она различна в коре головного мозга и белом веществе. Кровоток в коре головного мозга значительно выше, чем в белом веществе, и в норме составляет 50-60 мл/100 г/мин. Нормальными значениями МК в белом веществе мозга считают 20-30 мл/100 г/мин. Снижение МК до уровня ниже 10-15 мл/100 г/мин приводит к развитию выраженной ишемии головного мозга и коррелирует с вероятностью неблагоприятного прогноза заболевания (табл. 1).
Таблица 1. Зависимость функционального состояния головного мозга от МК

Известно, что в первые сутки после тяжелой ЧМТ мозговой кровоток в зоне пенумбры снижается примерно в 2 раза по сравнению с нормой. В последующие 2-3 сут МК восстанавливается до нормальных значений, однако в некоторых случаях развивается церебральная гиперемия. У больных с субарахноидальным кровоизлиянием (САК) вследствие разрыва церебральных аневризм мозговой кровоток в первые сутки после кровоизлияния несколько увеличивается, в последующие 2-3 сут уменьшается до 30-40 мл/100 г/мин и достигает нормальных значений к исходу седьмых суток после кровоизлияния.
В раннем периоде внутричерепного кровоизлияния может наблюдаться мозаичность мозгового кровотока. Объемный МК в зоне ушиба и прилегающей ткани мозга существенно снижается по сравнению с интактным веществом мозга.
Несмотря на снижение МК, метаболическая активность головного мозга в условиях повреждения значительно возрастает. Формируется несоответствие между потребностью поврежденной ткани в кислороде и его доставкой к головному мозгу. Недостаток кислорода приводит к переходу клеток мозга на анаэробный метаболизм, что выражается в повышении концентрации лактата в веществе головного мозга.
Развитие вторичных ишемических повреждений головного мозга повышает риск развития летального исхода и ухудшает неврологическое восстановление больных с ОЦН. В связи с этим профилактика и лечение вторичных повреждений мозга - важнейшая задача интенсивной терапии пострадавших с тяжелой ЧМТ, больных с нетравматическими внутричерепными кровоизлияниями и ишемическим инсультом.
К основным факторам вторичного ишемического повреждения головного мозга относят артериальную гипотензию, гипоксемию, гипер- и гипокапнию, анемию, гипертермию и внутричерепную гипертензию. Все эти состояния запускают цепь патологических реакций, приводящих к нарушению доставки кислорода и питательных субстратов к клеткам головного мозга.
Наиболее значимые факторы вторичного повреждения мозга - артериальная гипотензия и гипоксемия. Возникновение даже кратковременных эпизодов артериальной гипотензии и гипоксемии у больных с ОЦН, находящихся в критическом состоянии, приводит к увеличению летальности и частоты неблагоприятных неврологических исходов.
Важный фактор вторичного ишемического повреждения мозга - гипокапния. Снижение напряжения CO2 в артериальной крови вызывает вазоконстрикцию и приводит к выраженным нарушениям перфузии головного мозга. Так, длительная гипокапния сопровождается увеличением летальности у пострадавших с тяжелой и больных с нетравматическими внутричерепными кровоизлияниями.
Концентрация гемоглобина влияет на эффективность доставки кислорода к пораженному мозгу. В экспериментальных исследованиях показано, что возникновение выраженной анемии при развитии внутричерепного кровоизлияния сопровождается появлением ишемического паттерна церебрального метаболизма. Анемию считают независимым фактором риска развития неблагоприятного исхода и ишемического вазоспазма у больных с САК вследствие разрыва артериальной аневризмы головного мозга.
Частота развития гипертермии у больных с ОЦН достигает 70%. Гипертермия - важный фактор вторичного повреждения мозга, приводящий к увеличению летальности и времени пребывания больных в отделении реанимации и стационаре. Повышение температуры тела сопровождается ростом потребления кислорода, что приводит к увеличению мозгового кровотока и повышению внутричерепного давления, а также может сопровождаться нарушением ауторегуляции МК.
Частота развития внутричерепной гипертензии у пострадавших с ЧМТ и больных с нетравматическими внутричерепными кровоизлияниями составляет 30-80%. Возникновение внутричерепной гипертензии повышает вероятность развития неблагоприятного исхода заболевания.
Практически все методы, используемые в практике работы отделений нейрореанимации, связаны с профилактикой и лечением вторичных ишемических повреждений головного мозга. К мероприятиям, способствующим восстановлению и поддержанию нормальной церебральной перфузии и оксигенации, относят снижение внутричерепного давления, поддержание нормокапнии, увеличение концентрации кислорода во вдыхаемой смеси, создание артериальной гипертензии, гиперволемии и гемодилюции.
В настоящем руководстве представлены современные принципы обследования и лечения больных с травматическими и нетравматическими внутричерепными кровоизлияниями, находящихся в критическом состоянии.
Глава 1. Обследование больного в отделении нейрореанимации
Обследование больного с подозрением на заболевание или повреждение головного мозга определяет тактику дальнейшего лечения пациента и является одной из важнейших задач реаниматолога.
Перед началом углубленного обследования больного необходимо обеспечить проходимость дыхательных путей и провести коррекцию гемодинамики.
ОБЩИЕ ПРИНЦИПЫ ОБСЛЕДОВАНИЯ
При поступлении в отделение реанимации пациентов с подозрением на заболевание или повреждение головного мозга проводят следующие обследования:
• осмотр всего тела пациента;
• клинико-неврологический осмотр с оценкой уровня бодрствования по шкале комы Глазго (ШКГ);
• ультразвуковое исследование (УЗИ) брюшной полости, забрюшинного пространства и грудной клетки;
• определение концентрации гемоглобина, количества эритроцитов и лейкоцитов, лейкоцитарной формулы, уровня гематокрита, глюкозы, мочевины, креатинина, билирубина плазмы крови, кислотно-основного состояния венозной и артериальной крови, концентрации натрия и калия в плазме крови;
• общеклиническое исследование мочи;
• рентгенографию органов грудной клетки;
• электрокардиографию в трех стандартных (aVR, aVL, aVF) и шести грудных отведениях;
• исследование крови и мочи на содержание алкоголя. При необходимости после консультации токсиколога определяют содержание в биологических средах барбитуратов, фенотиазинов, бензодиазепинов, высших спиртов и опиатов;
• компьютерную томографию (КТ) головного мозга. Относительными противопоказаниями к экстренному проведению КТ исследования считают некупированный геморрагический или травматический шок и/или нестабильную гемодинамику: систолическое артериальное давление (АД) ниже 90 мм рт.ст., необходимость постоянной инфузии симпатомиметиков.
С помощью КТ определяют:
• наличие патологического очага (очагов) и его (их) топическое расположение;
• наличие в очаге гиперденсивных и гиподенсивных зон, их количество и объем в см3;
• состояние паренхимы головного мозга - наличие отека мозга и зон ишемии (их количество, локализацию, объем, плотность);
• положение срединных структур мозга и степень (в мм) их смещения (если оно есть);
• состояние ликворосодержащей системы мозга: величину и положение желудочков с указанием вентрикулокраниальных индексов (рис. 1-1, табл. 1-1), форму желудочков, их деформацию и другие характеристики;
• состояние цистерн мозга;
• состояние борозд и щелей мозга;
• просвет суб- и эпидуральных пространств (в норме не определяются);
• состояние костных структур свода и основания черепа (наличие трещин, переломов);
• состояние и содержимое придаточных пазух носа;
• состояние мягких покровов черепа.
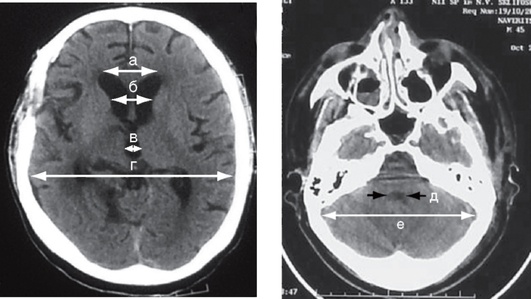
Рис. 1-1. Схема расчета вентрикулокраниальных индексов (ВКИ): ВКИ1 - отношение расстояния между самыми латеральными участками передних рогов боковых желудочков (а) к максимальному расстоянию между внутренними пластинками костей черепа (г); ВКИ2 - отношение ширины боковых желудочков на уровне головок хвостатых ядер (б) к максимальному расстоянию между внутренними пластинками костей черепа (г); ВКИ3 - отношение максимальной ширины III желудочка (в) к максимальному расстоянию между внутренними пластинками костей черепа (г); ВКИ4 - отношение ширины IV желудочка (д) к максимальному диаметру задней черепной ямки (е)
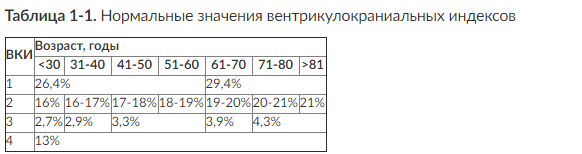
При отсутствии положительной динамики через 12-24 ч проводят повторную КТ головного мозга. При нарастании или появлении новой неврологической симптоматики выполняют экстренное КТ-исследование. Транспортировку больного на компьютерную томографию осуществляют в условиях непрекращающейся искусственной вентиляции легких (ИВЛ) при помощи транспортного аппарата с кислородным баллоном.
Кабинет компьютерной томографии должен быть оборудован аппаратурой для осуществления ИВЛ кислородо-воздушной смесью и монитором, позволяющим следить за функциями дыхания и кровообращения.
Кроме общих принципов существуют особенности обследования больных с различными видами ОЦН
ОСОБЕННОСТИ ОБСЛЕДОВАНИЯ ПОСТРАДАВШИХ С ЧЕРЕПНО-МОЗГОВОЙ ТРАВМОЙ
При поступлении в отделение реанимации пострадавшего с тяжелой ЧМТ, помимо проведения общего обследования, необходимо:
• обратить особое внимание на запах изо рта, наличие ссадин, кровоподтеков, деформаций суставов, изменений формы грудной клетки и живота, наличие истечения крови и спинномозговой жидкости из ушей и носа, кровотечения из уретры и прямой кишки;
• провести рентгеновское исследование черепа в двух проекциях, шейного, грудного и поясничного отделов позвоночника, грудной клетки, костей таза и, при необходимости, костей верхних и нижних конечностей;
• организовать осмотр больного нейрохирургом, хирургом, травматологом;
• учитывая высокую частоту повреждений позвоночника у пострадавших с ЧМТ, у каждого госпитализированного пострадавшего КТ головного мозга следует сочетать с КТ-исследованием позвоночника;
• при краниофациальном повреждении и подозрении на ликворею необходимо провести КТ головы во фронтальной проекции.
ОСОБЕННОСТИ ОБСЛЕДОВАНИЯ БОЛЬНЫХ С СУБАРАХНОИДАЛЬНЫМ КРОВОИЗЛИЯНИЕМ ВСЛЕДСТВИЕ РАЗРЫВА АРТЕРИАЛЬНОЙ АНЕВРИЗМЫ ГОЛОВНОГО МОЗГА
При поступлении в отделение реанимации больного с клинической картиной САК помимо общих мероприятий обследования необходимо следующее.
1. Оценить тяжесть состояния пациента по шкалам W. Hunt-R. Hess или W. Hunt-E. Kosnik, WFNS (табл. 1-2, 1-3, 1-4).
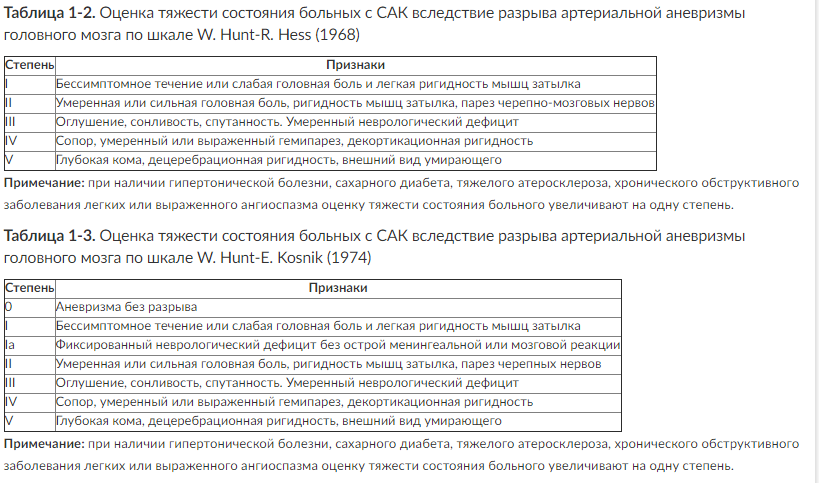

Чем выше оценка по шкалам W. Hunt-R.Hess, W. Hunt-E. Kosnik и WFNS, тем тяжелее состояние больного. Шкалы W Hunt-R. Hess и W. Hunt-E. Kosnik и WFNS используют для определения риска оперативного вмешательства у больных с разрывом артериальной аневризмы головного мозга. Тяжелое состояние больного (IV-V степень тяжести) - фактор риска оперативного вмешательства в остром периоде кровоизлияния. При проведении операции выключения аневризмы из кровотока в первые 3 сут после кровоизлияния у больных со степенью тяжести I-III исход заболевания обычно благоприятный, а у пациентов со степенью тяжести IV-V - чаще неблагоприятный (таким больным проводят лечение в отделении реанимации, а после улучшения состояния проводят оперативное вмешательство).
2. Определить анатомическую форму кровоизлияния по данным КТ головного мозга (табл. 1-5, 1-6; рис. 1-2).

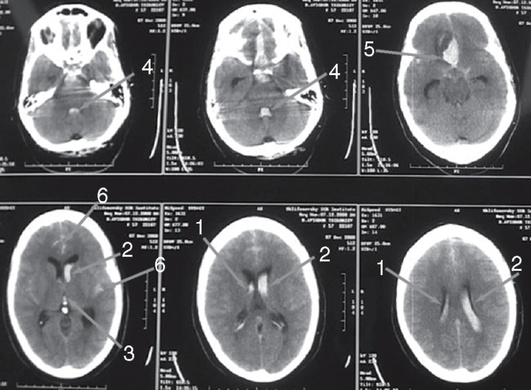
Рис. 1-2. КТ головного мозга больного с разрывом аневризмы передней соединительной артерии. На аксиальных срезах определяется кровоизлияние в правый (1) и левый (2) боковые, III (3) и IV (4) желудочки мозга, внутримозговая гематома в правой лобной доле (5), диффузное САК (6). IV желудочек расширен. Оценка по шкале D.A. Graeb - 8 баллов, по шкале C.M. Fisher - III степень
Количество и распространенность излившейся крови хорошо коррелирует с тяжестью состояния больных и прогнозом заболевания. Выраженное базальное САК считают прогностически неблагоприятным, так как почти у всех больных оно сопровождается развитием ангиоспазма. Чем выше оценка по шкале C.M. Fisher, тем больше вероятность развития вазоспазма и ишемических изменений головного мозга.
3. Провести поясничную пункцию для верификации САК в том случае, если при КТ нет признаков кровоизлияния, но имеется клиническая картина САК. Следует учитывать, что в редких случаях у пациентов может развиваться клиническая картина САК за счет роста купола аневризмы или кровоизлияния в стенку аневризмы; при этом признаки САК на КТ и в анализах ЦСЖ отсутствуют. При извлечении пробы цереброспинальной жидкости необходимо оценить ее визуально и провести микроскопический анализ, а также количественно измерить давление в спинномозговом канале (табл. 1-7). Противопоказаниями для проведения поясничной пункции считают:
— нарастающий двусторонний мидриаз;
— анизокорию;
— застой на глазном дне;
— наличие признаков дислокации на КТ головного мозга;
— смещение срединных структур мозга при выполнении эхоэнцефалоскопии.
4. Установить локализацию имеющихся у пациента церебральных аневризм. Существует три лучевых метода непосредственной визуализации церебральных аневризм: дигитальная субтракционная ангиография (ДСА), магнитно-резонансная ангиграфия (МРА) и КТ-ангиография (КТА).
Дигитальную субтракционную ангиографию (ДСА) наиболее часто используют для верификации артериальных аневризм головного мозга. Первичная ДСА выявляет церебральную аневризму в 50-80% случаев всех нетравматических САК. Исследование должно быть выполнено в следующем объеме: два каротидных бассейна и два вертебральных бассейна. Исследуют как интракраниальные, так и экстракраниальные отделы магистральных артерий мозга. При планировании проведения вазореконструктивных операций дополнительно селективно исследуют бассейны наружных сонных артерий. ДСА выполняют в прямой, боковой, косой, а при необходимости в других, атипичных, проекциях. Помимо выявления аневризм необходимо оценивать характер имеющегося ангиоспазма и особенности коллатерального кровообращения.
При наличии у пациента типичных признаков аневризматического САК, ангиографических признаков сосудистого спазма и отсутствии на ангиограммах аневризмы целесообразно через 3-4 нед после кровоизлияния провести повторное ангиографическое исследование, что позволяет выявить ранее не контрастированные аневризмы приблизительно у 3% больных. Выполнение третьего ангиографического исследования через 5-6 мес после кровоизлияния позволяет дополнительно верифицировать аневризмы менее чем у 1% больных.
Магнитно-резонансная ангиография (МРА) обеспечивает верификацию внутричерепных аневризм с чувствительностью 74-100% и специфичностью 76-100% в сравнении с ДСА. МРА проводят с целью скрининга пациентов с высоким риском наличия церебральной аневризмы и лиц, перенесших САК, у которых двукратное ангиографическое исследование не выявило аневризмы.
Трехмерная КТА обладает чувствительностью 87,9-97% и специфичностью 95-100% в сравнении с ДСА. В отличие от ДСА КТА позволяет получать трехмерное изображение и определять взаиморасположение аневризмы с близлежащими костными структурами, что особенно важно при открытых операциях на гигантских аневризмах и аневризмах труднодоступной локализации (параклиноидной и вертебробазилярного бассейна). КТА проводят с целью скрининга у пациентов с высоким риском наличия церебральной аневризмы и у больных, перенесших САК, у которых двукратное ангиографическое исследование не выявило аневризмы в случае, если проведение МРА противопоказано. Проведение КТА показано больным с разрывами церебральных аневризм при наличии внутричерепной гематомы большого объема, требующей экстренного удаления (при выявлении на КТА аневризмы ДСА таким больным можно не проводить);
• провести осмотр офтальмологом глазного дна, определение остроты и полей зрения;
• осуществить электроэнцефалографию с оценкой типа изменений электроэнцефалограммы (ЭЭГ), записать акустические стволовые вызванные потенциалы;
• выполнить транскраниальную и экстракраниальную допплерографию, вычислить индекс Линдегаарда.
ОСОБЕННОСТИ ОБСЛЕДОВАНИЯ БОЛЬНЫХ С ГЕМОРРАГИЧЕСКИМ ИНСУЛЬТОМ
При поступлении в отделение реанимации больных с подозрением на геморрагический инсульт помимо общего обследования проводят:
• терапевтический осмотр и в случае необходимости кардиологический осмотр;
• двустороннюю каротидную и вертебральную ангиографию.
Ангиографию осуществляют при отсутствии гипертонического анамнеза, при расположении гематомы, нетипичном для гипертензивного кровоизлияния, но характерном для разрыва артериовенозной мальформации (субкортикально, на стыке лобной и теменной, височной и затылочной долей), артериальной аневризмы (в области основания лобной доли, сильвиевой щели, на стыке лобной и височной долей), при наличии базального субарахноидального кровоизлияния и при молодом возрасте пациента (менее 45 лет) для исключения разрыва аневризмы или мальформации.
ОСОБЕННОСТИ ОБСЛЕДОВАНИЯ БОЛЬНЫХ С ИШЕМИЧЕСКИМ ИНСУЛЬТОМ
Для оценки степени тяжести ишемического инсульта применяют шкалу NIHSS (National Institutes of Health Stroke Scale).
Суммарный балл по шкале NIHSS от 1 до 6 соответствует инсульту легкой степени тяжести, 7-13 - инсульту средней степени тяжести, 14 и более - тяжелому инсульту.
Немедленное выполнение нейровизуализации является обязательным условием диагностики ишемического инсульта. В первые часы от развития инсульта изменения на компьютерной томографии носят невыраженный характер, что делает оценку объема очага крайне затруднительной. Однако существуют ранние компьютернотомографические признаки ишемического поражения головного мозга, которые выявляют у 60% пациентов с ишемическим инсультом и могут быть условно разделены на две группы.
1. Признаки, связанные с цитотоксическим отеком:
а) симптом утраты контраста между серым и белым веществом в области лентикулярного ядра;
б) симптом утраты контраста между серым и белым веществом в области головки хвостатого ядра;
в) симптом сдавления корковых борозд;
г) симптом утраты ребристой структуры островка.
2. Признаки, связанные с повышением рентгеновской плотности церебральных артерий:
а) симптом гиперденсивной средней мозговой артерии;
б) симптом гиперденсивной задней мозговой артерии;
в) симптом «Точки» - повышение рентгеновской плотности в проекции М3 сегмента СМА может свидетельствовать о тромбозе данного сегмента артерии;
г) симптом гиперденсивной базилярной артерии.
Типичный инфаркт мозга в бассейне магистральной артерии на КТ имеет клиновидные очертания, пониженную по сравнению с нормальным мозгом плотность, четко отграничен и занимает территорию определенного бассейна.
Стандартный протокол магнитно-резонансной томографии, включающий Т1- и Т2-взвешенные изображения, а также режим с подавлением сигнала свободной воды (FLAIR), имеет невысокую чувствительность в отношении выявления острой церебральной ишемии. Наибольшей чувствительностью для выявления ишемических изменений головного мозга обладают диффузионно-взвешенные изображения. Диффузионно-взвешенные изображения позволяют отчетливо визуализировать область ишемического поражения головного мозга в первые минуты от начала заболевания, включая маленькие очаги ишемии в области базальных ганглиев, кортикальную ишемию, а также ишемию в области мозжечка и мозгового ствола.
Выполнение дуплексного сканирования артериальных сосудов, кровоснабжающих головной мозг, у пациентов с ишемическим инсультом является не менее важным, чем нейровизуализация. Именно дуплексное сканирование брахиоцефальных артерий зачастую помогает установить причину ишемического инсульта, выявить тромбоз, диссекцию, стенозы артерий и принять правильное решение о тактике лечения.
При подозрении на кардиоэмболический характер инсульта необходимо выполнение следующих методов диагностики:
• ЭКГ;
• трансторакальной ЭхоКГ;
• суточного мониторирования ЭКГ по Холтеру;
• чреспищеводной ЭхоКГ
Дата: 2018-12-21, просмотров: 797.