РЕПЕРФУЗИОННАЯ ТЕРАПИЯ
Реперфузионная терапия является наиболее эффективным и безопасным методом лечения ишемического инсульта. Основной целью реперфузионной терапии является спасение жизнеспособной области мозга (пенумбры) и предотвращение дальнейшего распространения области инфаркта. Проведение реперфузионной терапии при ишемическом инсульте возможно в рамках так называемого терапевтического окна, составляющего для различных видов тромболитической терапии (ТЛТ) от 4,5 до 6 ч от момента возникновения первых симптомов заболевания.
Выделяют три вида реперфузионной терапии:
1) Системную (внутривенную);
2) Селективную (внутриартериальную);
3) Механическую.
СИСТЕМНАЯ ТРОМБОЛИТИЧЕСКАЯ ТЕРАПИЯ
Внутривенная тромболитическая терапия при помощи тканевого активатора плазминогена (rt-PA) была разрешена Инспекцией по контролю за качеством пищевых и лекарственных продуктов США (FDA) к применению у пациентов с ишемическим инсультом в 1996 г. В настоящее время терапевтическое окно для проведения системной ТЛТ составляет 4,5 ч. В качестве тромболитика для проведения ТЛТ при ишемическом инсульте разрешен только рекомбинантный тканевой активатор плазминогена, который применяют из расчета 0,9 мг/кг массы тела. Максимальная доза препарата не должна превышать 90 мг. Введение rt-PA осуществляют следующим образом: 10% от общей дозы препарата вводят в/в болюсно в течение 1 мин, оставшиеся 90% - в/в в течение 60 мин.
Показаниями для применения системной ТЛТ при ишемическом инсульте являются:
1. Время от начала развития симптомов ишемического инсульта не более 4,5 ч.
2. Балл по шкале NIHSS от 5 до 25 включительно.
Несмотря на высокую эффективность, у системной тромболитической терапии имеется целый ряд противопоказаний.
1. Наличие гиперчувствительности к гентамицину.
2. Наличие гиперчувствительности к rt-PA.
3. Обширное кровотечение в момент принятия решения о начале терапии или в предшествующие 6 мес, геморрагический диатез.
4. Одновременное эффективное лечение оральными антикоагулянтами (например, варфарином) при МНО более 1,3.
5. Хирургическое вмешательство на головном и/или спинном мозге в анамнезе.
6. Наличие аневризмы сосудов головного мозга.
7. Внутричерепное кровоизлияние в анамнезе.
8. Подозрение на наличие геморрагического инсульта в момент принятия решения о начале терапии.
9. Тяжелая неконтролируемая артериальная гипертензия.
10. Обширное хирургическое вмешательство или любая обширная травма в течение предыдущих 10 дней (любая травма, полученная в результате развивающегося инфаркта миокарда), недавно перенесенная ЧМТ.
11. Длительная или травматичная сердечно-легочная реанимация (>2 мин) в предыдущие 10 дней.
12. Роды в предыдущие 10 дней.
13. Недавно произведенная пункция некомпримируемого сосуда (например, подключичная или яремная вена).
14. Тяжелые заболевания печени (печеночная недостаточность, цирроз, портальная гипертензия, варикозное расширение вен пищевода, активный гепатит).
15. Наличие бактериального эндокардита, перикардита.
16. Наличие острого панкреатита.
17. Подтвержденная язвенная болезнь желудка или двенадцатиперстной кишки в течение последних 3 мес.
18. Наличие артериальной аневризмы, дефектов развития артерий/ вен.
19. Наличие новообразования с повышенным риском кровотечения.
20. Появление первых симптомов инсульта более чем за 4,5 ч до начала инфузии препарата или отсутствие точных сведений о времени начала заболевания.
21. Быстрое улучшение состояния или слабая выраженность симптомов к моменту начала инфузии препарата.
22. Тяжело протекающий инсульт (оценка по шкале NIHSS более 25 баллов и/или наличие выраженных изменений мозга по данным КТ и/или МРТ).
23. Указание на наличие судорог в дебюте инсульта.
24. Сведения о перенесенном инсульте или серьезной травме головы в предшествующие 3 мес.
25. Возникновение предыдущего инсульта на фоне сахарного диабета.
26. Указание на использование гепарина в предшествующие 48 ч (при условии наличия повышенного АЧТВ).
27. Количество тромбоцитов менее 100 тыс. в 1 мкл.
28. Систолическое АД более 185 мм рт.ст., или диастолическое АД более 110 мм рт.ст., или необходимость использования интенсивной терапии (внутривенного введения гипотензивных средств) для коррекции артериальной гипертензии.
29. Концентрация глюкозы в плазме крови менее 3 ммоль/л или более 20 ммоль/л.
30. Возраст моложе 18 лет.
СЕЛЕКТИВНАЯ ТРОМБОЛИТИЧЕСКАЯ ТЕРАПИЯ
Первым исследованием, показавшим эффективность и безопасность внутриартериальной тромболитической терапии при ишемическом инсульте, было двойное слепое рандомизированное плацебо-контролируемое исследование PROACT (Prolyse in Acute Cerebral Thromboembolism), при котором активатор плазминогена (рекомбинантная проурокиназа, r-pro-UK) вводили внутриартериально пациентам с ишемическим инсультом с ангиографически подтвержденной окклюзией проксимального сегмента СМА (сегменты М1 или М2) в пределах 6 ч терапевтического окна. Результаты исследования показали, что частота успешной реперфузии у больных, которым провели внутриартериальную ТЛТ, была выше, чем в группе плацебо. Статистически значимой разницы между группами по частоте геморрагических трансформаций, явившихся причиной неврологического ухудшения, выявлено не было.
Показания и противопоказания к селективной тромболитической терапии не отличаются от таковых при системном тромболизисе. Однако при внутриартериальном введении препарата терапевтическое окно может составлять до 6 ч от начала развития симптомов ишемического инсульта.
Следует отметить, что в настоящее время в инструкции по применению рекомбинантного тканевого активатора плазминогена отсутствуют показания к его внутриартериальному введению.
МЕХАНИЧЕСКАЯ ТРОМБОЭМБОЛОЭКСТРАКЦИЯ
В связи с тем, что медикаментозная тромболитическая терапия может быть противопоказана части пациентов с ишемическим инсультом, поступивших в периоде терапевтического окна, были предприняты попытки поиска альтернативных методов лечения, одним из которых является механическое удаление тромба.
Важно отметить, что четко сформулированные показания и противопоказания к использованию устройств для тромбоэмболоэкстракции при ишемическом инсульте отсутствуют. В большинстве случаев применение данных устройств целесообразно при тромбозе крупного церебрального сосуда (например, внутренней сонной артерии, сегмента М1 средней мозговой артерии).
Применение удаляемых стентов у пациентов с ишемическим инсультом на фоне окклюзии крупного сосуда является наиболее эффективным методом лечения. В настоящее время для проведения механической тромбоэмболоэкстракции наиболее часто используют удаляемый стент-ретривер SOLITAIRE (рис. 6-1, см. цв. вклейку).
Механическая тромбоэмболоэкстракция может сопровождаться рядом осложнений, основными из которых являются следующие.
1. Геморрагическая трансформация очага ишемического поражения.
2. Перфорация артерии.
3. Развитие церебрального вазоспазма.
4. Диссекция артерии.
ПРОФИЛАКТИКА ТРОМБОЗА ГЛУБОКИХ ВЕН ГОЛЕНИ
Тромбоз глубоких вен голеней (ТГВГ) - нейротрофическое осложнение иммобилизационного синдрома. ТГВГ - основная причина развития тромбоэмболии легочной артерии (ТЭЛА), возникновение которой резко увеличивает риск развития летального исхода. Частота ТГВГ у больных с поражением головного мозга колеблется от 25 до 43%, а ТЭЛА - от 0,7 до 7%. Основной метод диагностики ТГВГ - УЗИ вен нижних конечностей (при необходимости и других бассейнов). Его проводят каждые 5-7 сут нахождения больного в отделении нейрореанимации.
Факторами риска образования внутривенных тромбов считают:
• стаз венозной крови;
• повреждение сосудистой стенки;
• длительную иммобилизацию;
• наличие внутривенных тромбозов в анамнезе;
• беременность;
• острый инфаркт миокарда;
• использование эстрогенов;
• дефицит антитромбина 3;
• дефицит протеина С;
• нефротический синдром;
• застойную сердечную недостаточность;
• ожирение;
• возраст старше 40 лет;
• ДВС-синдром;
• васкулиты.
Частота развития ТЭЛА может быть значительно снижена при помощи своевременной профилактики.
С первых суток нахождения больного в отделении нейрореанимации необходимо использовать компрессионные чулки или периодическую пневмокомпрессию ног (при условии отсутствия ран на ногах) вплоть до перевода больного на амбулаторное лечение. В комплексе с механической профилактикой следует применять низкомолекулярные гепарины или небольшие дозы нефракционированного гепарина. Проведение гепаринотерапии в острейшем периоде внутричерепного кровоизлияния может повышать риск повторного внутричерепного кровотечения. В связи с этим больным с внутричерепными кровоизлияниями травматического и нетравматического генеза гепаринотерапию начинают через 3-4 сут после развития заболевания. Нефракционированный гепарин вводят в дозе 5000 ЕД 3-4 раза в сутки под кожу живота. Цель гепаринотерапии - поддержание активированного частичного тромбопластинового времени (АЧТВ) на уровне в 1,5-2 раза выше нормальных значений (50-60 с).
Более безопасно применение низкомолекулярных гепаринов: надропарина кальция (фраксипарина) в дозе 0,3-0,6 мл/сут подкожно, эноксапарина натрия (клексана) в дозе 0,2-0,4 мл/сут подкожно, далтепарина натрия (фрагмина) 2500 ЕД/сут подкожно. Применение низкомолекулярных гепаринов не требует специального лабораторного контроля. Хороший способ профилактики тромбообразования - ранняя активизация больного при помощи специальных устройств (рис. 6-2, см. цв. вклейку).
По мере активизации больного и увеличения времени его нахождения в вертикальном положении до 3 ч и более профилактику ТЭЛА можно прекратить.
Глава 7. Отек мозга
Повышение внутричерепного давления приводит к уменьшению МК и ишемии головного мозга и сопровождается выраженным ухудшением церебральной оксигенации и метаболизма.
ПАТОФИЗИОЛОГИЯ ВНУТРИЧЕРЕПНОЙ ГИПЕРТЕНЗИИ
Череп взрослого человека представляет собой замкнутую полость с ригидными стенками, в норме заполненную на 85% мозговым содержимым, на 10% - спинномозговой жидкостью и на 5% - кровью. В нормальных условиях эти соотношения обычно поддерживают постоянное ВЧД (0-13 мм рт.ст.). При возникновении внутричерепного кровоизлияния появление дополнительного объема приводит к конфликту внутричерепных компонентов (доктрина Monro-Kellie) (рис. 7-1). Реализация принципа Monro-Kellie зависит от скорости прогрессирования патологического процесса и резерва податливости (т.е. способности адаптироваться к увеличению объема) краниоспинальной и церебральной сосудистой системы. Резерв податливости внутричерепного содержимого называют церебральным комплаенсом (ЦК).
Церебральный комплаенс - свойство головного мозга обеспечивать постоянство внутричерепного давления путем создания резервных пространств в результате уменьшения объема спинномозговой жидкости и церебральной фракции крови:
ЦК=ΔВЧО/ΔВЧД,
где ΔВЧО - изменение объема внутричерепных компонентов (ВЧО); ΔВЧД - изменение внутричерепного давления.
Величина ЦК индивидуальна у каждого человека. Она зависит от объема межщелевых пространств и увеличивается при атрофии головного мозга или после резекции мозгового вещества во время нейрохирургических вмешательств. ЦК снижается при остром появлении патологических компонентов (гематома) или отеке мозга. При медленно прогрессирующих процессах, например растущей опухоли головного мозга, комплаенс значительное время остается нормальным, что объясняет длительное сохранение внутричерепной нормотензии.
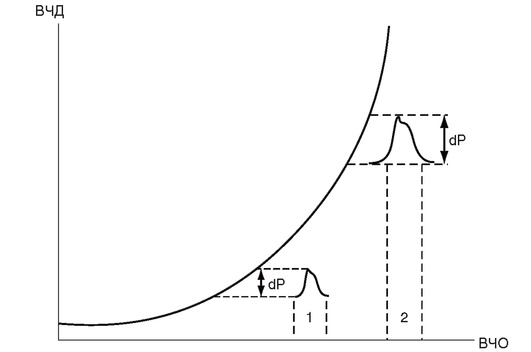
Рис. 7-1. Соотношение между ВЧО и ВЧД. На схеме видно, что одинаковый прирост ВЧО сопровождается различным увеличением ВЧД (dP) при нормальном (1) и сниженном (2) церебральном комплаенсе (по Piper I., 1997)
Физиологическое управление церебральным комплаенсом осуществляется путем контроля двух его компонентов - цереброспинальной жидкости и крови.
Объем цереброспинальной жидкости зависит от соотношения процессов ее образования хориоидальным сплетением желудочков и обратного всасывания (резорбции) преимущественно пахионовыми грануляциями. Средняя скорость образования цереброспинальной жидкости составляет 0,3 мл/мин (около 400-500 мл/сут). Нарушение ликвородинамики (например, при остром окклюзионном синдроме вследствие гематомы в задней черепной ямке, инфаркта мозжечка или опухоли III желудочка) приводит к накоплению цереброспинальной жидкости и развитию внутричерепной гипертензии.
Объем внутричерепной фракции крови зависит от метаболических потребностей мозга, системного АД, а также эффективности доставки кислорода и глюкозы. Наиболее важные параметры, количественно характеризующие кровообращение мозга, - ЦПД и объемный МК.
Поддержанию постоянного МК способствует его ауторегуляция.
Выделяют три основных механизма ауторегуляции МК: нейрогенный, химический и миогенный.
Нейрогенный механизм обеспечивает постоянство МК независимо от вертикального или горизонтального положения головы.
Химический механизм компенсирует МК в зависимости от концентрации растворенной в крови углекислоты.
Миогенный механизм стабилизирует МК при колебаниях системного давления. Таким образом, при остро развившейся артериальной гипотензии происходит вазодилатация капиллярной сети, что защищает нервную ткань от гипоксии и ишемии. При повышении системного АД церебральные сосуды сужаются (вазоконстрикция), предотвращая полнокровие и развитие вазогенного отека головного мозга. При несостоятельности вазодилататорного звена (например, при гипертонической болезни) возникает высокий риск развития ишемии и, наоборот, при слабости вазоконстрикторного звена (гипертонический криз у негипертоника) - риск вазогенного отека мозга.
Одна из наиболее частых причин развития внутричерепной гипертензии и нарушения церебральной перфузии - отек головного мозга. Отек мозга представляет собой возрастание количества внутриклеточной и/или внеклеточной жидкости, приводящее к увеличению объема мозга и развитию внутричерепной гипертензии. В зависимости от патогенеза выделяют несколько основных типов отека мозга.
• Вазогенный отек. Характеризуется увеличением объема внеклеточной жидкости. В норме ГЭБ непроницаем для натрия, и поступление этого иона во внутриклеточное пространство возможно только при помощи активного транспорта K+-Na+ АТФазой. Основной механизм формирования вазогенного отека - нарушение функции ГЭБ. При этом работа K+-Na+ АТФазы может не нарушаться. При повреждении ГЭБ происходит свободная диффузия натрия и других органических осмотически активных веществ в интерстициальное пространство мозга с привлечением свободной воды.
• Цитотоксический отек. Характеризуется увеличением объема внутриклеточной жидкости при сохранном ГЭБ. Основная причина формирования цитотоксического отека - нарушение функции натрий-калиевого насоса, обусловленное дефицитом энергии. При этом проницаемость ГЭБ может быть не нарушена. Основная причина развития цитотоксического отека - ишемия ткани мозга.
• Осмотический отек. Возникает при выраженной контузии вещества головного мозга, сопровождающейся массивным повреждением клеток мозга и ГЭБ и повышением осмоляльности в зоне поражения. Повышение осмоляльности в сочетании с нарушением ГЭБ приводит к привлечению воды и отеку зоны ушиба мозга.
• Интерстициальный отек. Наблюдается при развитии гидроцефалии и характеризуется увеличением объема интерстициального пространства вследствие нарушения оттока цереброспинальной жидкости. При данной форме отека мозга функция клеток мозга и ГЭБ сохранена.
В последнее время при обсуждении патогенеза отека мозга все большее внимание уделяют аквапоринам 4-го типа. Аквапорины 4-го типа - это специальные каналы, локализующиеся в астроцитах и отвечающие за транспорт воды. В экпериментальных исследованиях показано, что животные, у которых отсутствуют аквапорины 4-го типа, по-разному реагируют на различные виды отека мозга. Они лучше переживают цитотоксический отек и хуже - вазогенный.
ЛЕЧЕНИЕ ВНУТРИЧЕРЕПНОЙ ГИПЕРТЕНЗИИ
Коррекция внутричерепной гипертензии - одна из важнейших задач интенсивной терапии больных с поражением головного мозга, находящихся в критическом состоянии.
Для снижения повышенного ВЧД используют пошаговый подход.
• Выполняют компьютерную томографию головного мозга для исключения причин повышения ВЧД, требующих хирургической коррекции. При наличии вентрикулярного катетера проводят контролируемый сброс цереброспинальной жидкости (рис. 7-2, см. цв. вклейку). Следует учитывать, что удаление цереброспинальной жидкости - временная мера коррекции ВЧД, которая не приводит к улучшению оксигенации и метаболизма головного мозга (рис. 7-3).
• Обеспечивают возвышенное положение головного конца кровати (15-30°). Использование данной методики позволяет улучшить венозный отток от головного мозга и снизить ВЧД (рис. 7-4).
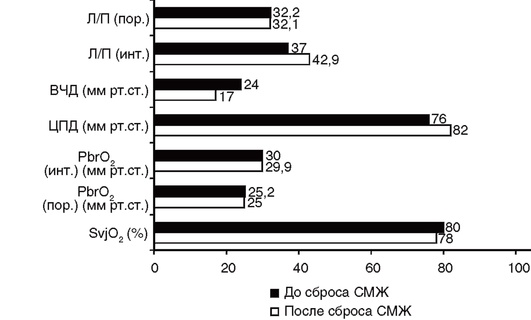
Рис. 7-3. Влияние контролируемого сброса спинномозговой жидкости на ВЧД, насыщение гемоглобина кислородом в луковице внутренней яремной вены (SvjO2), напряжение кислорода (PbrO2) и отношение лактат/пируват (Л/П) в пораженном (пор.) и интактном (инт.) веществе мозга. Снижение ВЧД с 24 до 17 мм рт. ст. не приводит к улучшению церебральной оксигенации и метаболизма
• Коррегируют гипертермию. Под гипертермией понимают повышение «ядерной» температуры тела до 38,3 °С и более. Температура головного мозга превышает «ядерную» температуру на 0,32-1,9 °С. Повышение температуры тела на 1 °С увеличивает метаболическую потребность мозга на 8% и приводит к нарастанию внутричерепного объема крови и повышению ВЧД. Повышение температуры всего на несколько градусов может очень быстро истощить резервы травмированного мозга. Основная причина повышения ВЧД при развитии гипертермии - увеличение МК и внутричерепного объема крови. У больных с внутричерепной гипертензией следует поддерживать «ядерную» температуру ниже 38 °С. Снижение температуры мозга всего на 1 °С приводит к значимому уменьшению ВЧД. Для коррекции гипертермии используют как медикаментозные, так и физические методы охлаждения. Хорошо зарекомендовали себя специальные охлаждающие водяные матрасы (рис. 7-5, см. цв. вклейку).
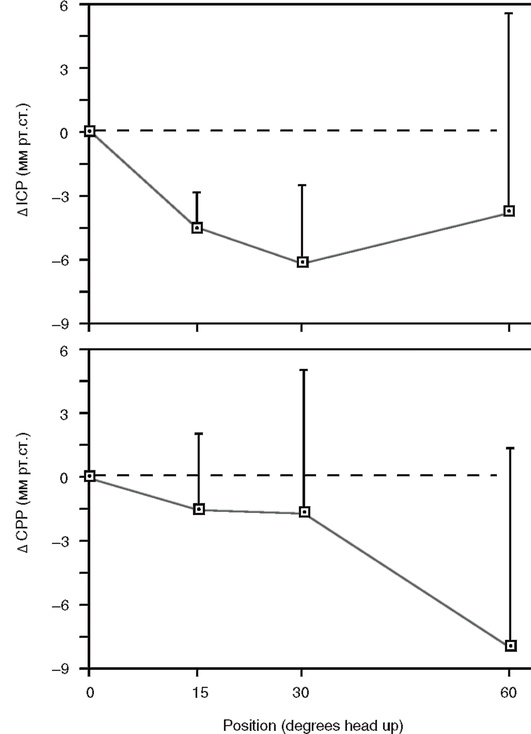
Рис 7-4. Влияние положения головного конца кровати на ВЧД и ЦПД. Подъем головного конца на 30° сопровождается снижением ВЧД на 6 мм рт.ст. (ΔICP) и ЦПД на 2 мм рт.ст. (ДСРР). Дальнейший подъем головного конца кровати до 60° приводит к повышению ВЧД и значительному снижению ЦПД (по Durward 1983)
• Осуществляют седативную терапию. В условиях повышенного ВЧД и сниженной краниоцеребральной податливости наличие двигательного возбуждения или борьба больного с аппаратом ИВЛ может привести к повышению внутригрудного давления и давления в яремных венах, что, в свою очередь, вызовет дальнейшее увеличение ВЧД. В связи с этим грамотная седация - один из ключевых факторов контроля ВЧД. У больного с поражением головного мозга восходящий поток болевой импульсации провоцирует формирование дополнительных очагов возбуждения в подкорковых областях. С одной стороны, в условиях сниженного порога судорожной готовности головного мозга это может спровоцировать появление судорог. С другой стороны, это вызовет локальное повышение метаболизма в зоне проекции болевой чувствительности, что будет способствовать расширению зоны первоначального повреждения. Вот почему многокомпонентная аналгезия и обязательная анестезия при любых манипуляциях с пациентом - обязательный компонент базовой терапии, особенно у пациентов с угнетенным сознанием. Основные препараты, применяемые для проведения седативной терапии и аналгезии, - пропофол, опиоиды и бензодиазепины.
• Купируют судороги. Развитие фокальных и вторично генерализованных эпилептических припадков в остром периоде ОЦН наблюдается у 3-4% больных. Возникновение судорожного синдрома увеличивает метаболизм мозга и приводит к повышению ВЧД. Для купирования судорог чаще всего используют бензодиазепины [10-20 мг (0,2-0,5 мг/кг) внутривенно болюсно и затем повторно 10 мг внутривенно или внутримышечно] или вальпроевую кислоту (5-15 мг/кг в сутки). При серии эпиприпадков или эпистатусе используют повторные внутривенные введения бензодиазепинов в дозах до 0,5 мг/кг или вальпроевую кислоту (10 мг/кг внутривенно в течение 3-5 мин и 0,6 мг/кг в виде внутривенной инфузии до 2500 мг/сут). При неэффективности данной терапии больного вводят в барбитуровый наркоз при помощи внутривенной инфузии тиопентала натрия (до 5-6 г/сут).
• Используют гиперосмолярные растворы. Введение гиперосмолярных растворов - наиболее распространенный метод нехирургической коррекции внутричерепной гипертензии. Использование подобных препаратов приводит к возникновению временного градиента осмотического давления между плазмой крови и интерстициальным пространством мозга, вызывая перемещение жидкости во внутрисосудистое пространство. Для снижения ВЧД можно применять маннитол, гипертонические растворы хлорида натрия и комбинацию гипертонического хлорида натрия с коллоидными препаратами. Наиболее часто для коррекции ВЧД применяют болюсное введение маннитола в дозе 0,25-1 г/кг массы тела. Следует отметить, что маннитол накапливается в клетках головного мозга и ЦСЖ, в связи с чем его повторные введения могут приводить к развитию феномена отдачи (ребаунд-эффект). Возможные осложнения при использовании маннитола - сердечная недостаточность, гиперкалиемия, почечная недостаточность и гиперосмолярный синдром. В последнее время с целью снижения ВЧД активно применяют гипертонические растворы хлорида натрия. Данные препараты изначально использовали не в целях снижения ВЧД, а для малообъемной реанимации у пациентов с геморрагическим шоком. По сравнению со стандартной противошоковой терапией малообъемная реанимация обеспечивает быстрое восполнение внутрисосудистого объема жидкости и приводит к увеличению сердечного выброса, артериального давления и улучшению микроциркуляции. Для увеличения продолжительности гемодинамических эффектов были созданы комбинации гипертонических растворов хлорида натрия с коллоидными препаратами. Добавление коллоида способствует продолжительному удержанию жидкости в сосудистом русле и создает дополнительное онкотическое давление. В настоящее время в России известна комбинация 7,2% раствора хлорида натрия с гидроксиэтилкрахмалом (ГиперХАЕС). По данным многоцентрового исследования Федерации анестезиологов и реаниматологов России, наиболее выраженное и продолжительное влияние на ВЧД оказывает именно комбинированный гипертонический раствор хлорида натрия с ГЭК (рис. 7-6). Помимо снижения ВЧД введение гипертонических растворов хлорида натрия приводит к улучшению оксигенации и метаболизма головного мозга. По нашим данным, гиперосмолярные растворы по-разному влияют на метаболизм мозга. Введение 15% раствора маннитола не приводит к улучшению церебрального метаболизма, а использование раствора ГиперХАЕС сопровождается выраженным улучшением метаболизма головного мозга в виде значительного увеличения концентрации глюкозы и пирувата в интерстициальной жидкости как интактного, так и пораженного вещества головного мозга. При применении гиперосмолярных растворов необходимо тщательно контролировать осмоляльность плазмы крови. Необходимо учитывать, что повышение осмоляльности до уровня более 320 мОсм/кг способствует развитию почечной недостаточности. Осмотический диурез, вызванный маннитолом и гипертоническими растворами натрия хлорида, может привести к гипотонии, особенно у пациентов с исходной гиповолемией. В связи с этим следует учитывать, что наиболее продолжительный эффект на ВЧД и системную гемодинамику оказывает комбинация гипертонического хлорида натрия с гидроксиэтилкрахмалом.
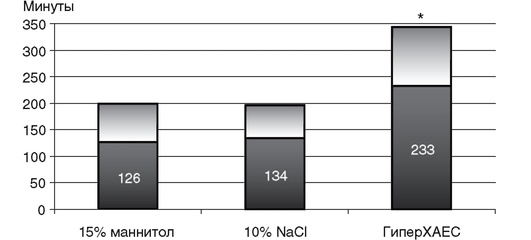
Рис. 7-6. Продолжительность эффекта различных гиперосмолярных растворов при коррекции внутричерепной гипертензии (время после окончания инфузии раствора, в течение которого ВЧД не превышало 20 мм рт.ст., М+σ); ♠ - p <0,05 по сравнению с 15% раствором маннитола и 10% раствором NaCl (по Полушину Ю.С. и соавт., 2009)
• Вводят барбитураты. Барбитураты вызывают снижение МК и угнетают церебральный метаболизм, а при использовании в высоких дозах могут уменьшать внутричерепной объем крови и снижать ВЧД. Однако применение барбитуратов может сопровождаться выраженной артериальной гипотензией и снижением ЦПД. Таким образом, при осуществлении данного вида терапии необходимо тщательно мониторировать гемодинамику и поддерживать ЦПД в необходимых пределах.
• Осуществляют управляемую гипотермию. Гипотермия - один из перспективных методов терапии внутричерепной гипертензии, рефрактерной к консервативным методам терапии. Умеренное снижение температуры головного мозга угнетает церебральный метаболизм, что, в свою очередь, может привести к уменьшению МК, внутричерепного объема крови и ВЧД. Нужно учитывать, что охлаждение больного до температуры 32-34 °С необходимо проводить очень быстро (в течение 30-60 мин), а согревание - очень медленно (0,2-0,3 °С/ч).
• Выполняют декомпрессивную краниотомию. Этот метод используют при неэффективности консервативных мероприятий в течение 6-12 ч с момента развития внутричерепной гипертензии. При выполнении декомпрессивной краниотомии необходимо стремиться к формированию достаточно большого костного дефекта и осуществлять свободную пластику твердой мозговой оболочки (рис. 7-7).
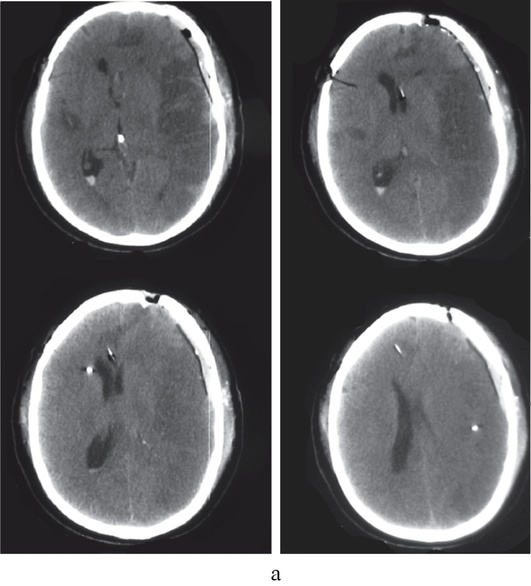
Рис. 7-7. КТ головного мозга больного с ангиоспазмом вследствие разрыва аневризмы левой внутренней сонной артерии: а - до выполнения декомпрессивной краниотомии (ВЧД - 28 мм рт.ст., отношение лактат/пируват в левом полушарии мозга - 250, в правом - 25); б - после проведения декомпрессивной краниотомии (ВЧД - 3 мм рт.ст., отношение лактат/пируват в левом полушарии мозга - 120, в правом -22)
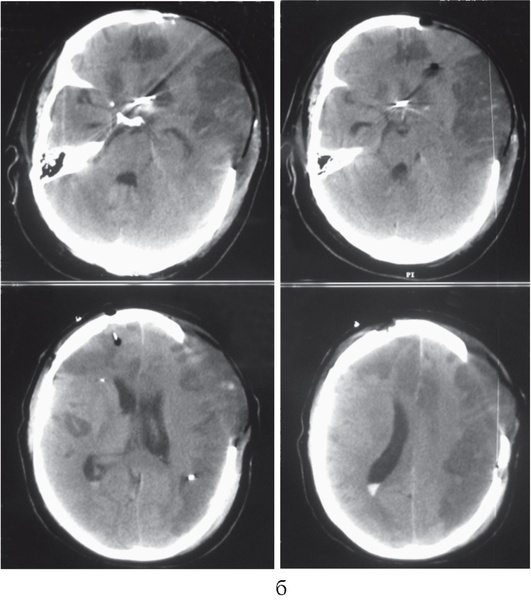
Рис. 7-7. Окончание
ИСПОЛЬЗОВАНИЕ ГЛЮКОКОРТИКОИДОВ ДЛЯ ЛЕЧЕНИЯ ОТЕКА ГОЛОВНОГО МОЗГА
В связи с недоказанностью эффекта глюкокортикоиды не используют в терапии внутричерепной гипертензии у больных с ОЦН.
Дата: 2018-12-21, просмотров: 429.