Правильное питание - одна из главных составляющих интенсивной терапии пострадавших с тяжелой ЧМТ и больных с нетравматическими внутричерепными кровоизлияниями. Основная цель нутритивной поддержки таких пациентов - обеспечение организма источниками энергии (углеводы и липиды) и пластического материала (аминокислоты) для компенсации гиперметаболических и гиперкатаболических расстройств. К дополнительным целям нутритивной поддержки относят:
• предотвращение образования стрессовых язв ЖКТ;
• профилактику бактериальной транслокации из кишечника;
• иммунокоррекцию.
У всех пациентов с внутричерепными кровоизлияниями, находящихся в критическом состоянии, возникает синдром гиперкатаболизма-гиперметаболизма, который характеризуется дисрегуляторными изменениями в системе анаболизм-катаболизм. Они выражаются в увеличении потребности в донаторах энергии и пластического материала, росте энергопотребности, развитии патологической толерантности тканей организма к обычным нутриентам. В результате у больных формируется белково-энергетическая недостаточность.
Важный показатель выраженности катаболической реакции - суточная экскреция азота с мочой:
• менее 5 г - незначительный катаболизм;
• 5-10 г - умеренно выраженный катаболизм;
• более 10 г - выраженный катаболизм.
К признакам синдрома гиперкатаболизма-гиперметаболизма также относят:
• гипераланинемию (более 150 мкмоль/л) и/или гиперглутаминемию (более 400 мкмоль/л);
• гиперлактатемию (более 2,5 ммоль/л) и/или гиперпируватемию (более 0,25 ммоль/л);
• увеличение отношения лактат/пируват до уровня более 10;
• гипергликемию у пациентов, не страдающих сахарным диабетом (7 ммоль/л и более).
Основной принцип нутритивной поддержки больных с ОЦН, находящихся в критическом состоянии, заключается в обеспечении раннего искусственного питания, соответствующего потребностям больного в белке и энергии. Поступление питательных субстратов в составе сбалансированных по калорийности и содержанию белка смесей позволяет предупредить развитие белково-энергетической недостаточности и ускорить реабилитацию пациентов.
Показаниями к проведению искусственного питания у пациентов с ОЦН считают:
• наличие синдрома гиперкатаболизма-гиперметаболизма;
• угнетение уровня бодрствования до 13 баллов и менее по шкале комы Глазго (ШКГ);
• необходимость осуществления искусственной вентиляции легких более 24 ч;
• наличие дисфагии;
• наличие качественных изменений сознания - психомоторное возбуждение, негативизм;
• вегетативное состояние, психоорганический синдром;
• наличие стойкой тошноты и рвоты;
• развитие выраженной астении, не позволяющей адекватно самостоятельно питаться;
• неадекватное самостоятельное питание - менее 30% от потребности в жидкости, энергии и белке;
• наличие гипопротеинемии менее 60 г/л и (или) гипоальбуминемии менее 30 г/л.
РАСЧЕТ ПОТРЕБНОСТИ В ЭНЕРГИИ И ПИТАТЕЛЬНЫХ ВЕЩЕСТВАХ
Энергетические потребности больных с ОЦН, находящихся в критическом состоянии, составляют 20-25 ккал/кг массы тела в сутки. Однако у части пациентов энергопотребность повышается и составляет 30-35 ккал/кг массы тела. Для точной оценки потребности больных в энергии используют метод непрямой калориметрии (рис. 8.1, см. цв. вклейку). Данная методика основана на оценке потребления кислорода и выделения углекислого газа. После определения этих параметров за известный отрезок времени проводят расчет реальной энергопотребности больного, а также определяют респираторный коэффициент:
Энергопотребность (ккал/сут) = = (3,78хХ)+(1,16хY)-(2,98хА),
где × - количество потребленного кислорода (л/сут); Y - количество выделенной углекислоты (л/сут); А - количество выделенного с мочой азота (г/сут).
Респираторный коэффициент представляет собой отношение количества выделенного углекислого газа к количеству потребленного кислорода и в норме составляет 0,75-0,85. По динамике данного показателя можно оценить, какой из субстратов (белки, жиры или углеводы) используется организмом в данный момент для обеспечения энергией. При преимущественном расходе углеводов респираторный коэффициент повышается, а жиров, наоборот, снижается. При отсутствии метаболографа энергетические потребности пациентов рассчитывают по различным формулам. Основная из них - уравнение Харриса- Бенедикта:
Для мужчин: энергопотребность (ккал/сут) = = 66,5+(13,8хМ)+(5хР)-(6,8хВ);
Для женщин: энергопотребность (ккал/сут) = = 655,1+(9,6хМ)+(1,8хР)-(4,7хВ),
где М - фактическая масса тела (кг); Р - рост (см); В - возраст (г).
Нужно отметить, что расчет энергопотребности по формулам часто не отражает реальной ситуации, так как масса тела пациентов варьирует в зависимости от объема жидкости в организме. В настоящее время для определения массы пациентов используют либо реанимационные кровати со встроенными весами, либо специальные потолочные весы (рис. 8-2, см. цв. вклейку).
У больных с ОЦН потребность в белке составляет 1-2 г/кг массы тела. Для точной оценки белкового обмена анализируют баланс азота и/ или концентрацию короткоживущих белков в плазме крови (транстиретин, ретиносвязывающий белок):
Баланс азота (г/сут) = = введенный белок (г) / 6,25 - азот мочевины (г) - 4 г (внепочечные потери азота);
Азот мочевины (г/сут) = мочевина (ммоль/сут) × 0,033.
1 г выделенного азота соответствует распаду 6,25 г белка и25 г мышечной массы. Необходимо стремиться к достижению нулевого или положительного баланса азота.
Максимальная скорость окисления глюкозы в организме не превышает 7 мг/кг/мин (0,5 г/кг/ч). В связи с этим скорость введения растворов глюкозы, используемых для искусственного питания, не должна превышать 5 мг/кг/мин. В нормальных условиях суточная потребность в углеводах составляет 5-6 г/кг/сут, а доля углеводов в структуре небелковых калорий - 50-70%.
Жиры должны составлять не менее 30% от общего количества небелковых калорий. Рекомендуемая дозировка - от 1 до 1,5 г/кг. В норме жиры составляют около 30-35% в структуре небелковых калорий. На фоне критического состояния и прогрессирования явлений гиперметаболизмагиперкатаболизма доля жиров в энергообмене может достигать 50-55%.
Расчет баланса азота позволяет выбирать смеси для энтерального питания согласно количеству содержащегося в них белка (табл. 8-1).
Питание можно осуществлять как энтерально, так и парентерально. Энтеральное питание имеет следующие преимущества:
• низкая стоимость препаратов;
• меньший риск развития гипергликемии и инфекционных осложнений;
• физиологичность (восстанавливает моторную функцию ЖКТ, нормализует микрофлору кишечника);
• восстановление кишечного барьера (предупреждение бактериальной транслокации из кишечника).
Таблица 8-1. Содержание белка в различных жидких смесях для энтерального питания
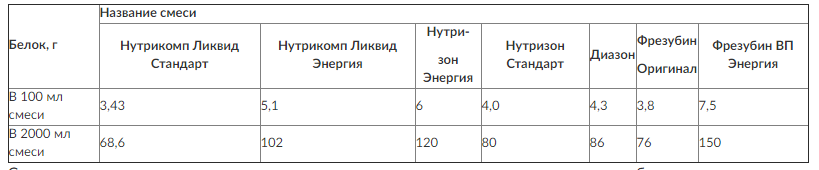
Современная смесь для энтерального питания должна удовлетворять следующим требованиям:
• легкая усвояемость в условиях нарушенного пищеварения;
• наличие всех необходимых питательных веществ;
• достаточная калорическая плотность (не менее 1 ккал/мл);
• отсутствие или низкое содержание лактозы;
• на 1 г азота должно приходиться 140-180 небелковых килокалорий;
• низкая вязкость (для удобства постоянного введения);
• слабый запах, бактериальная безопасность;
• низкая коммерческая стоимость;
• наличие в смеси пищевых волокон.
Для проведения энтерального питания устанавливают назоили орогастральный зонд. При неэффективности гастрального варианта питания в течение более 2 сут проводят установку тонкокишечного зонда.
8 этом случае для питания больных используют специальные полуэлементные смеси. При необходимости энтерального зондового питания более 4 нед возможно наложение гастростомы.
Раннее начало энтерального питания - надежная профилактика возникновения стресс-язв ЖКТ. Риск возникновения стресс-язв особенно велик у пациентов с угнетением уровня бодрствования до 9 баллов и менее по ШКГ.
Помимо раннего назначения энтерального питания эффективное средство профилактики стресс-язв ЖКТ - использование блокаторов Н2-рецепторов. Однако применение таких препаратов сопряжено с повышенным риском колонизации микроорганизмов в исходно стерильном желудке. В настоящее время помимо блокаторов Н2-рецепторов (ранитидин в дозе 150 мг внутривенно 2 раза в сутки или 300 мг 1 раз в сутки, фамотидин в дозе 40 мг 1 раз в сутки) используют ингибиторы протонной помпы (омепразол в дозе 20 мг 2 раза в сутки).
При невозможности осуществления или недостаточности энтерального питания проводят частичное или полное парентеральное питание. По современным представлениям парентеральное питание в обязательном порядке должно включать в себя комбинацию растворов глюкозы, аминокислот и жировую эмульсию (табл. 8-2). Важно помнить, что для усвоения 1 г азота необходимо в среднем 150 небелковых килокалорий.

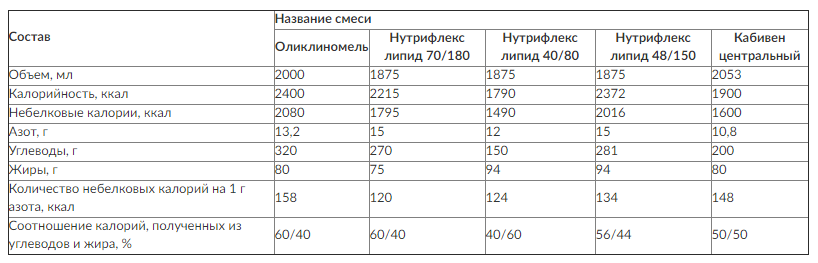
В настоящее время существуют специальные смеси «три в одном», в которых скомбинированы все эти компоненты в составе одного пакета (рис. 8-2, см. цв. вклейку).
При выборе смеси «три в одном» необходимо обращать внимание на ее состав. Желательно, чтобы в смеси содержалось достаточное количество небелковых калорий на 1 г азота, а соотношение калорий, полученных из углеводов и жира, в процентном соотношении составляло 40/60 или 50/50 (табл. 8-3).
Особое место в структуре лечебного питания больных, находящихся в критическом состоянии, занимают препараты, способные оказывать влияние на выраженность воспалительного процесса, - так называемое иммунное питание. К ним относят питательные смеси, содержащие ш-3 жирные кислоты и глутамин. Использование глутамина в составе парентерального питания способствует снижению летальности и количества инфекционных осложнений.
В настоящее время помимо внутривенной формы глутамина (дипептивен) существует специальная смесь для энтерального питания, содержащая значительное количество этого иммунонутрицевтика (интестамин).
Таблица 8-3. Состав некоторых смесей для парентерального питания «три в одном»
лутамин синтезируется в мышцах и легких и выполняет следующие функции:
• в печени - цитопротекторное действие, участие в синтезе мочевины, глюкозы, глутатиона;
• в иммунной системе - участие в образовании и восстановлении иммунокомпетентных клеток;
• в эритроцитах - участие в синтезе цитруллина и аргинина;
• в почках - поддержание кислотно-основного баланса, метаболизм NH3, глюконеогенез.
КОРРЕКЦИЯ ГИПЕРГЛИКЕМИИ У БОЛЬНЫХ С ОСТРОЙ ЦЕРЕБРАЛЬНОЙ НЕДОСТАТОЧНОСТЬЮ
Гипергликемия отмечается у большинства больных с ОЦН независимо от наличия предшествующего диабета. Этот феномен называют стрессовой гипергликемией. Частота развития гипергликемии у пострадавших с ЧМТ составляет 15-83,6%, у больных с разрывом церебральных аневризм и геморрагическим инсультом - 27-71%, у пациентов с ишемическим инсультом - 30-40%. Многочисленные исследования показали, что стойкая гипергликемия в остром периоде ОЦН напрямую связана с тяжестью состояния больного и указывает на неблагоприятный прогноз. Между тем сопоставление уровня глюкозы в межклеточной жидкости головного мозга и периферических тканях указывает на саногенетическую природу стрессовой гипергликемии. Так, по нашим данным, у больных с субарахноидальным кровоизлиянием вследствие разрыва артериальной аневризмы головного мозга и пострадавших с тяжелой ЧМТ определяется корреляционная зависимость между концентрацией глюкозы в артериальной крови и в интерстициальной жидкости головного мозга как в пораженных, так и условно «интактных» отделах головного мозга (рис. 8-4).
Следует отметить, что у некоторых больных при наличии умеренной гипергликемии на периферии в головном мозге регистрируется нормогликемическое состояние. У таких пациентов коррекцию гипергликемии следует осуществлять с большой осторожностью, так как «агрессивная» инсулинотерапия может привести к гипогликемии и ухудшить состояние головного мозга. При наличии возможности осуществления тканевого микродиализа коррекцию гипергликемии у пациентов с ОЦН, находящихся в критическом состоянии, следует осуществлять под контролем уровня глюкозы в интерстициальной жидкости головного мозга. 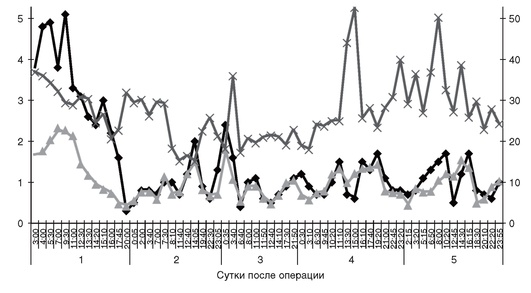
Рис. 8-4. Динамика концентрации глюкозы в артериальной крови (норма - 3,5-5,5 ммоль/л), содержания глюкозы (норма - 1,5-2 ммоль/л) и отношения лактат/пируват (норма - 20-25) в интерстициальной жидкости вещества мозга у больного с САК вследствие разрыва артериальной аневризмы головного мозга (аневризма клипирована). Наблюдается содружественное изменение концентрации глюкозы в артериальной крови и интерстициальной жидкости головного мозга. Снижение концентрации глюкозы в веществе мозга сопровождается нарастанием отношения лактат/пируват
Гипогликемия оказывает повреждающее действие главным образом на кору головного мозга, приводя в летальных случаях к некрозу. Стволовые отделы мозга при этом страдают в меньшей степени. При гипогликемии снижается уровень аденозинтрифосфорной кислоты и фосфокреатинина, мембраны утрачивают свои насосные механизмы, нейроны набухают и в какой-то момент теряют способность к восстановлению формы, объема и функций. По своим негативным последствиям гипогликемия превосходит выраженную гипоксию головного мозга. В связи с этим при неизвестном уровне гликемии и угнетенном сознании неизвестной этиологии следует a priori назначать 20-40 мл 40% раствора глюкозы болюсно внутривенно. У больных с внутричерепными кровоизлияниями следует стремиться к поддержанию уровня гликемии не выше 10 ммоль/л. Содержание глюкозы в плазме крови 10 ммоль/л и выше оправдывает немедленное введение инсулина 4-8 ЕД подкожно с последующим мониторингом уровня гликемии 4-6 раз в день в течение 2-3 сут. При персистирующей гипергликемии более 8-10 ммоль/л используют постоянное внутривенное введение инсулина. Инфузию инсулина начинают со скорости 2-4 ЕД/ч. В дальнейшем скорость и дозу вводимого инсулина подбирают индивидуально, ориентируясь на уровень гликемии. Для поддержания нормогликемии и максимально раннего отказа от применения инсулина следует ограничить экзогенное введение глюкозы и использовать специальные смеси для энтерального питания со сниженным содержанием глюкозы. У больных с сахарным диабетом типа 2 в острейшем периоде церебральной недостаточности целесообразно сразу перейти на простой инсулин до стабилизации уровня гликемии. У пациентов с сахарным диабетом возврат от инсулинотерапии к предшествующей плановой терапии сахароснижающими препаратами производят по мере стабилизации неврологического дефицита.
ТАКТИКА ИСКУССТВЕННОГО ПИТАНИЯ ПРИ НЕЙРОГЕННОЙ ДИСФАГИИ
Нарушение глотания (дисфагия) является одним из наиболее грозных осложнений церебральной недостаточности. Развитие дисфагии увеличивает риск медицинских осложнений и риск внезапной смерти. Голодание или недостаточное питание приводят к активизации катаболических процессов, отягчают течение ОЦН.
У пациентов с ОЦН нейрогенная (орофарингеальная) дисфагия развивается не только при поражении бульбарного отдела ствола или двустороннем поражении супрануклеарных структур головного мозга, но и приблизительно у 50% больных с полушарным ишемическим инсультом. При этом недостаточность питания больных с инсультом варьирует от 7 до 15% в остром периоде и от 22 до 35% спустя 2 нед от начала заболевания. А среди пациентов, требующих длительной реабилитации, частота недостаточности питания может достигать 50%.
Таким образом, оценка и коррекция расстройств глотания имеют важное значение для профилактики развития аспирационной пневмонии и асфиксии, а также позволяют определить стратегию искусственного питания.
При обследовании больного с нарушением глотания необходимо определить:
• этиологию и механизм нейрогенной дисфагии;
• индивидуальную стратегию питания больного (энтеральное или парентеральное питание).
О высокой вероятности дисфагии свидетельствуют следующие признаки, появляющиеся во время питья и приема пищи:
• кашель или покашливание до, во время или после глотка;
• изменение качества голоса во время или после глотания, например «влажный» голос, «булькающий» голос, хрипота, временная потеря голоса;
• затрудненное дыхание, прерывистое дыхание после глотания;
• затруднения при жевании;
• слюнотечение или неспособность сглатывать слюну;
• выпадение пищи изо рта во время еды (это может быть следствием того, что у больного плохо смыкаются губы или его язык давит вперед во время глотка вместо нормальных движений вверх и назад);
• срыгивание;
• «смазанная» речь.
План обследования больного с нарушением глотания включает в себя следующее.
• Сбор жалоб и анамнестических данных с обязательным уточнением информации о консистенции пищи, приводящей к дисфагии, условиях ее возникновения.
• Клинический осмотр пациента: оценка глотания по стандартизированным скрининговым шкалам, позволяющим определить способ безопасного кормления и избежать осложнений.
Основным осложнением нейрогенной дисфагии является аспирация содержимого ротоглотки в дыхательные пути. Риск развития аспирации оценивают по наличию следующих симптомов:
• дизартрия;
• дисфония;
• аномальный кашель;
• слабый рвотный рефлекс или полное его отсутствие;
• кашель сразу же после проглатывания воды;
• изменение голоса (в течение 1 мин после проглатывания воды просят сказать: «Ааа»).
Риск аспирации оценивают как высокий при наличии двух и более из перечисленных симптомов выше. Риск аспирации считают низким, если имеется один симптом или таковые отсутствуют. Если риск аспирации низкий, то необходимо решить вопрос о выборе метода искусственного питания. В том случае, если риск аспирации высокий, проводят тест оценки глотания с продуктами различной плотности.
ТЕСТ ОЦЕНКИ ГЛОТАНИЯ С ПРОДУКТАМИ РАЗЛИЧНОЙ ПЛОТНОСТИ И ОБЪЕМА [VOLUME-VISCOSITY SWALLOW TEST (V-VST)]
1. Нектар 5-10-20 мл (если глотание на этом этапе нарушено, то необходимо перейти к тесту с пудингом).
2. Жидкость 5-10-20 мл (если глотание на этом этапе нарушено, то необходимо перейти к тесту с пудингом).
3. Пудинг 5-10-20 мл.
Консистенция нектар - густой кисель, мед, густая сметана (медленно стекает с ложки или ножа).
Консистенция жидкость - вода, сок, чай, кофе.
Консистенция пудинг - пудинг, густой йогурт.
Критериями наличия дисфункции глотания при проведении теста считают (достаточно одного критерия):
• появление кашля;
• падение насыщения артериальной крови кислородом по данным пульсоксиметрии на 3% и более;
• изменение фонации.
При отсутствии нарушений глотания и питательной недостаточности больным назначают общебольничную диету. При наличии питательной недостаточности пациенту назначают общебольничную диету и дополнительное энтеральное питание через рот гиперкалорической полисубстратной смесью по 100 мл 3-4 раза в сутки в течение 14-21 сут.
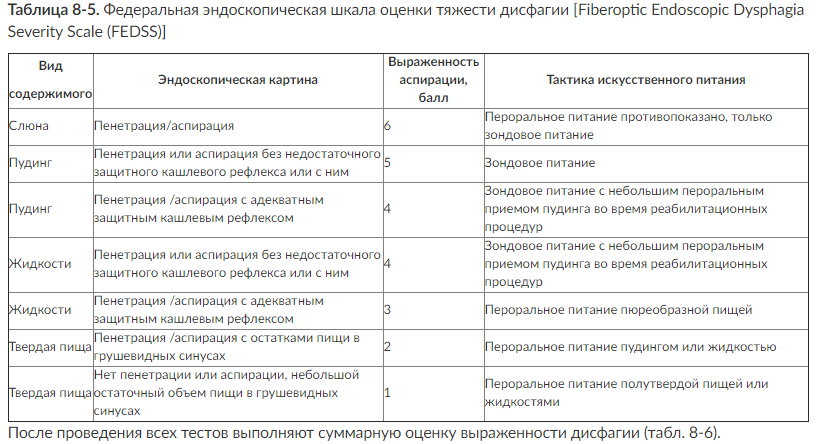
Если на каком-либо этапе определяют наличие нарушений глотания, то больного направляют на эндоскопическое исследование и рентгенологическое исследование с контрастом.
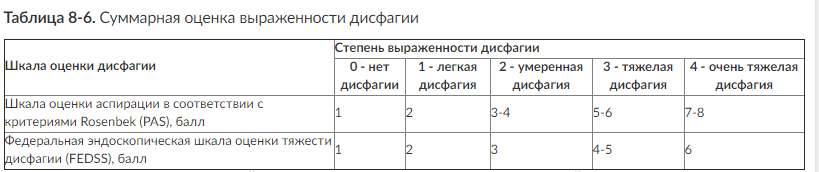
При проведении эндоскопического исследования проводят оценку по специальным шкалам (табл. 8-4, 8-5).

ВЫБОР МЕТОДА НУТРИТИВНОЙ ПОДДЕРЖКИ У БОЛЬНЫХ С ДИСФАГИЕЙ
Тактика искусственного питания зависит от выраженности дисфагии.
• Легкая дисфагия. Диета из натуральных продуктов без ограничений.
• Умеренная дисфагия. Еда должна очень легко раздавливаться языком: пюре или овощи, сваренные до очень мягкой консистенции; суппюре без добавления ингредиентов другой консистенции; картофельное пюре, картофельный суп; отварные и протертые овощи; кисель/ йогурт; мясное пюре, мясные муссы: телятина, свинина; филе рыбы (без костей); фрукты и фруктовые продукты (без кожи и семян: бананы, груши, тушеные яблоки, абрикосы, персики); молочные продукты: пудинг, мусс, мороженое; натуральный йогурт без кусочков; джемы из фруктов.
• Выраженная дисфагия (высокий риск пенетрации). Мелко протертые продукты питания: однородная, гладкая, мягкая, легко разжевываемая пища. Супы: крем-суп без добавления ингредиентов другой консистенции (например, гренки), фруктовые супы; молочные пудинги; жидкое картофельное пюре; очень мелко протертые овощи; кисель; очень мелко протертое мясо; очень мелко протертые фрукты; нектар; заварной крем; пудинг.
• Очень выраженная дисфагия (высокий риск аспирации). Энтеральное питание через зонд или гастростому.
При наличии питательной недостаточности к диете обязательно добавляют дополнительное искусственное пероральное питание гиперкалорической полисубстратной смесью по 100 мл 3-4 раза в сутки в течение 14-21 сут.
ЦЕНКА ЭФФЕКТИВНОСТИ ИСКУССТВЕННОГО ПИТАНИЯ У БОЛЬНЫХ С ДИСФАГИЕЙ
Оценка эффективности искусственного питания у больных с дисфагией должна проводиться лечащим врачом 1 раз в 5-7 сут с контролем следующих параметров:
• динамики массы тела;
• концентрации общего белка в сыворотке крови;
• концентрации альбумина в сыворотке крови;
• уровня лимфоцитов в периферической крови.
Прогрессирующее снижение массы тела, концентрации общего белка, альбумина и количества лимфоцитов требует коррекции программы искусственного питания. Оценку дисфагии проводят планово 1 раз в 5-7 сут или немедленно при появлении или прогрессировании клинических проявлений аспирации.
Дата: 2018-12-21, просмотров: 543.