I . Оксиды – соединения, состоящие из двух элементов, один из которых − кислород.
Классификации оксидов
1. По способности образовывать соли:
а) солеобразующие: Na2O, SO3, CO2;
б) несолеобразующие : CO, N2O, NO;
2. По характеру соответствующих гидроксидов
солеобразующие оксиды подразделяются на:
а) основные
(их гидраты являются основаниями: Na2O, CaO, CuO, MgO);
б) кислотные
(их гидраты являются кислотами: SO2, P2O5, SiO2, CO2);
в) амфотерные
(их гидраты способны реагировать как по типу кислоты, так и по типу основания: ZnO, PbO, Al2O3, Cr2O3).
Таблица 1Б – Характеристика класса оксидов
| Способы получения | Химические свойства |
1. Взаимодействие простых веществ с кислородом:
2Ca + O2 → 2CaO.
2. Разложение нерастворимых оснований:
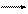 2Al(OH)3 t Al2O3 + 3H2O.
3. Разложение кислот:
H2CO3 → H2O + CO2 .
4. Разложение солей:
CaCO3 → CaO + CO2 .
5. Взаимодействие кислот, обладающих окислительными свойствами, с металлами и неметаллами:
Cu+4HNO3конц.→ Cu(NO3)2+2NO2+2H2O,
Cu + 2H2SO4конц.→ CuSO4 + SO2 +2H2O. 2Al(OH)3 t Al2O3 + 3H2O.
3. Разложение кислот:
H2CO3 → H2O + CO2 .
4. Разложение солей:
CaCO3 → CaO + CO2 .
5. Взаимодействие кислот, обладающих окислительными свойствами, с металлами и неметаллами:
Cu+4HNO3конц.→ Cu(NO3)2+2NO2+2H2O,
Cu + 2H2SO4конц.→ CuSO4 + SO2 +2H2O.
| 1. Взаимодействие с водой с образованием гидроксидов (оснований и кислот): Na2O + H2O → 2NaOH, P2O5 + 3H2O → 2H3PO4 . 2. Основные и амфотерные оксиды реагируют с кислотами: Na2O + H2SO4 → Na2SO4 + H2O, 2AI2O3 + 6H2SO4 →2AI2(SO4)3 + 6H2O. 3. Кислотные и амфотерные оксиды реагируют со щелочами: CO2 + NaOH → NaHCO3 , AI2O3 + 2NaOH → 2NaAIO2 + H2O. 4. Основные оксиды взаимодействуют с кислотными с образованием солей: 2MgO + P2O5 → Mg3(PO4)2 . |
II . Основания – это сложные вещества, молекулы которых состоят из ионов металла (или аммония) и одной или нескольких гидроксогрупп.
Классификации оснований
1. По способности к диссоциации:
а) сильные: NaOH, KOH;
б) слабые: NH4OH, Mg(OH)2.
2. По числу гидроксогрупп:
а) однокислотные: NaOH, KOH;
б) многокислотные: Mg(OH)2, Fe(OH)3.
3. По растворимости:
а) хорошо растворимые (щелочи): NaOH, KOH, Ba(OH)2;
б) малорастворимые: Fe(OH)3, Mg(OH)2
(все, кроме оснований
щелочных и
щелочноземельных элементов).
Таблица 2Б – Характеристика класса оснований
| Способ получения | Химические свойства |
| 1. Взаимодействие активных металлов с водой: 2Na + 2H2O → 2NaOH + H2 , Mg + 2H2O → Mg(OH)2 + H2 . 2. Взаимодействие оксидов щелочных и щелочно-земельных металлов с водой: CaO + H2O → Ca(OH)2 , Na2O + H2O → 2NaOH. 3. Взаимодействие солей со щелочами: Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3¯ , CuSO4 + 2NaOH → Cu(OH)2¯ + Na2SO4 . 4. Электролиз водных растворов солей (в катодном пространстве накапливается гидроксид): 2NaCI + 2H2O → H2 + CI2 +2NaOH. | 1. Диссоциация гидроксидов: а) однокислотных: NaOH ⇄ Na+ + OH− ; б) ступенчатая для многокислотных: Fe(OH)2 ⇄ FeOH+ + OH−, FeOH+ ⇄ Fe2+ + OH− ; в) амфотерных: 2H+ + ZnO2− ⇄ H2ZnO2 , Zn(OH)2 ⇄ Zn2+ + 2OH− . 2. Взаимодействие с кислотными оксидами с образованием солей: Mg(OH)2 + CO2 → MgCO3¯ + H2O. 3. Взаимодействие с кислотами (реакция нейтрализации): NaOH + HCI → NaCI + H2O. 4. Щелочи взаимодействуют с кремнием и металлами при сплавлении: 2NaOH + Si + H2O → Na2SiO3 + 2H2 ; 2NaOH + 2Al + 2H2O → 2NaAlO2 + 3H2 . |
III . Кислоты – это сложные вещества, содержащие ионы водорода, которые могут замещаться на ионы металла или ион аммония.
Классификации кислот
1. По способности к диссоциации:
а) сильные: HCI, HBr, HI, HNO3, H2SO4, HCIO4;
б) слабые: HNO2, H2S, H2SiO3.
2. По числу ионов водорода, возникающих при диссоциации (по основности):
а) одноосновные: HCI;
б) двухосновные: H2SO4, H2S;
в) трехосновные: H3PO4.
3. По наличию атомов кислорода в молекулах:
а) бескислородные: HCI, HBr, HI;
б) кислородосодержащие: H2SO4.
Таблица 3Б – Характеристика класса кислот
| Способы получения | Химические свойства |
1. Взаимодействие кислотных оксидов с водой:
P2O5 + H2O → 2HPO3 ,
SO3 + H2O → H2SO4 .
2. Окисление некоторых неметаллов азотной кислотой:
P + 5HNO3 + 2H2O → 3H3PO4 + 5NO,
S + 2HNO3 → H2SO4 + 2NO.
3. Взаимодействие солей с кислотами* (сильными или менее летучими, чем получаемые):
NaNO3 + H2SO4 → NaHSO4 + HNO3 .
4. Бескислородные кислоты могут быть получены непосредственно из водорода и неметалла
H2+ Cl2 → 2HCl,
H2 + S → H2S.
Водные растворы таких соединений являются кислотами
Условный ряд вытеснения кислот (слева направо сила кислот убывает):
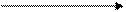 H2SO4 ® HCl, HNO3, H3 PO4 ® H2SO3 ® H2CO3 ® H2S ® Н2SiO3
H2SO4 ® HCl, HNO3, H3 PO4 ® H2SO3 ® H2CO3 ® H2S ® Н2SiO3
| 1. Диссоциация кислот: а) одноосновных: HCI ⇄ H+ + CI- ; б) по ступеням для многоосновных: H2SO3 ⇄ H+ + HSO3− − 1-я ступень, HSO3− ⇄ H+ + SO32− − 2-я ступень. 2. Взаимодействие с основными и амфотерными оксидами: CaO + 2HCl → CaCl2 + H2O, ZnO + 2HCl → ZnCl2 + H2O. 3. Кислоты, не обладающие окислительными свойствами, реагируют с металлами, стоящими в ряду напряжений до водорода, с образованием солей и выделением водорода: Mg + 2HCl → MgCl2 + H2 . 4. Кислоты, обладающие окислительными свойствами, при взаимодействии с металлами не образуют водород, так как окислителем в них выступает анион кислоты. Продуктами взаимодействия являются соль, вода и газ – продукт восстановления кислотообразующего элемента: Cu + 4HNO3конц, ®Cu(NO3)2 + 2NO2 + 2H2O, Cu + 2H2SO4конц. ® CuSO4 + SO2 + 2H2O, 4Zn + 5H2SO4конц. ® 4ZnSO4 + H2S + 4H2O. |
IV . Соли – это сложные вещества, которые состоят из ионов металлов или иона аммония и кислотных остатков.
Таблица 4Б – Характеристика класса солей
| Способы получения | Химические свойства |
| 1. Взаимодействие металлов с неметаллами: 2Na + Cl2 → 2NaCl. 2. Взаимодействие металлов с кислотами: Mg + H2SO4 → MgSO4 + H2 . 3. Взаимодействие кислот с основными оксидами: H2SO4 + CaO → CaSO4¯ + H2O. 4. Взаимодействие оснований с кислотными оксидами: Ca(OH)2 + CO2 → CaCO3¯ + H2O. 5. Взаимодействие кислот с основаниями: 3NaOH + H3PO4 → Na3PO4 + 3H2O. 6. Взаимодействие кислот с солями: H2SO4 + BaCI2 → BaSO4¯ + 2HCI. 7. Взаимодействие двух солей: K2SO4 + BaCI2 → BaSO4¯ + KCI. 8. Взаимодействие основных и кислотных оксидов: MgO + SiO2 → MgSiO3 . 9. Взаимодействие металлов с солями: Fe + CuSO4 → FeSO4 + Cu. 10. Взаимодействие щелочей с солями: FeCI3 + 3KOH → Fe(OH)3¯ + 3KCI. | 4. Диссоциация солей:
NаCl ⇄ Na+ + Cl− .
|
Классификация солей
1. Средние соли – продукты полного замещения ионов водорода в молекуле кислоты ионами металлов: Na2SO4, K3PO4, Ca3(PO4)2.
2. Кислые соли – продукты неполного замещения ионов водорода в молекулах многоосновных кислот на ионы металла: NaHCO3, KH2PO4.
3. Основные соли – продукты неполного замещения гидроксильных групп в молекулах многокислотных оснований кислотными остатками: FeOHCl2, (CuOH)2CO3.
Таблица Б5 – Генетическая связь между классами неорганических веществ
| Металл | Основный оксид | Основание | Соль | Вода | |
| Неметалл | Образуются различные продукты: а) соли бескислородных кислот; б) оксиды, в) гидриды; г) нитриды и др. t S+Fe → FeS | Неметаллы Н2, С, Si восстанавливают металлы из их оксидов t H2+СuО→Сu+H2О | Неметаллы Cl2, Br2, P, Si диспропорпионируют в растворах щелочей Cl2+2КОН→КСl+КС1O+Н2O | Более активные галогены вытесняют менее активные из их солей Сl2+2KI→I2+2КСl | Галогены обратимо взаимодействуют с водой Сl2+Н2О→НСl+НСlO |
| Кислотный оксид | Взаимодействуют в очень редких случаях t СO2+2Mg→2MgO+С | Образуется соль СО2+СаО→CaCO3 | Образуется соль и вода SiO2+2NaOH→Nа2SiO3+Н2O | Нелетучие оксиды вытесняют летучие из их солей SiO2+К2СО3→ СО2+К2SiO3 | Образуется кислота SO3+H2O→H2SO4 Исключение:SiO2 |
| Кислота | Образуется соль и продукт восстановления кислоты 2НС1+Fe→FeCl2+H2 2Н2SO4(конц.)+Сu→ CuSO4+SO2+2H2O | Образуется соль и вода 2HNO3+CaO→ Ca(NO3)2+Н2О | Образуется соль и вода (реакция нейтрализации) Н2SO4 + 2NaOH→ Na2SO4 + 2Н2O | Образуется новая соль и новая кислота Н2SO4+ВаСl2→ BaSO4¯+2HCl | — |
| Соль | Образуется новая соль и менее активный металл CuSO4+Zn→ZnSO4+Сu | — | При взаимодействии растворимой соли со щелочью образуется новая соль и новое основание FeSO4+2КОН→ Fe(ОН)2¯+K2SO4 | При взаимодействии растворимых солей образуются две новые соли AgNO3+NaBr→ AgBr¯+NaNO3 | Возможен гидролиз Nа2SiО3+Н2O→ NаНSiО3+NаОН |
| Вода | Щелочные и щелочноземельные металлы образуют щелочи 2Na+2H2O→2NaOH+H2 | Оксиды щелочных и щелочноземельных металлов образуют щелочи Na2O+H2O→2NaOH | — | Возможен гидролиз CuCl2+H2O→CuOHCl+HCl |
Дополнительная литература
1. Байрамов В.М. Основы электрохимии: учебн. пособие для студ. высш. учеб. заведений. – М.: Издательский центр «Академия», 2005. – 240 с.
2. Карапетянц М.Х., Дракин С.И. Общая и неорганическая химия: учебник для вузов. – М.: Химия, 2000. – 592 с.
3. Князев Д.А., Смарыгин С.Н. Неорганическая химия: учебник для вузов. – М.: Дрофа, 2004.– 591 с.
4. Коржуков Н.Г. Общая и неорганическая химия: учеб. пособие / под ред. В.И. Деляна. – М.: МИСИС: Инфра-М, 2004. – 512 с.
5. Коррозия и защита от коррозии / под. ред. И.В. Семеновой – М.: ФИЗМАТЛИТ, 2002. – 336 с.
6. Лидин Р.А. Справочник по общей и неорганической химии. – М.: Просвещение, 1997. – 254 c.
7. Лидин Р.А., Молочко В.А., Андреева Л.Л., Задачи по общей и неорганической химии. – М.: Владос, 2004. – 384 с.
8. Основы физической химии. Теория и задачи: учебн. пособие для вузов / В.В. Еремин и др. – М.: Издательство «Экзамен», 2005.– 478 с.
9. Хаускрофт К. Современный курс общей химии: в 2 т. / под. ред. В.П. Зломанова. – М.: Мир, 2002. – 544 с. – 1 т.
10. Хаускрофт К. Современный курс общей химии: в 2 т. / под. ред. В.П. Зломанова. – М.: Мир, 2002. – 526 с. – 2 т.
11. Химия: учебник для вузов / А.А. Гуров, Ф.З. Бадаев, Л.П. Овчаренко и др. – М.: Изд-во МГТУ им. Н.Э. Баумана, 2004. – 784 с.
Дата: 2018-11-18, просмотров: 697.