Активность ионов (активная концентрация ) ( а ) – формальная величина, введенная для количественной оценки содержания ионов, которая показывает, согласно какой концентрации ведут себя ионы в растворе:
а = f × С i, [моль/л]
где Сi - концентрация ионов, f < 1 – фактор (коэффициент) активности.
Водородный показатель среды рН – величина, введенная для удобства оценки кислотности среды, представляющая собой отрицательный десятичный логарифм активности (концентрации) ионов водорода: рН = - lg a(H+). рН чаще всего принимает значения от 0 до 14.
Шкала значений рН:
0 7 14 рН

среда кислая среда щелочная
среда нейтральная
Наряду с рН используют также гидроксильный показатель среды рОН:
рОН = -lg а(ОН-).
рН и рОН связаны друг с другом соотношением:
рН + рОН = рКw = 14.
Гидролиз – это реакция обменного взаимодействия между водой и ионами растворенной в ней соли, приводящая к образованию слабого электролита и изменению рН среды (hydor - вода, lysis – разложение). Это обратимый процесс, обратный реакции нейтрализации. Многие соли при растворении в воде подвергаются гидролизу, вследствие чего среда в их растворах становится щелочной или кислой. Различают следующие виды гидролиза: 1) соли, образованные сильным основанием и слабой кислотой, гидролизуются по аниону, и среда в их растворах щелочная; 2) соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону, в их растворах среда кислая; 3) соли, образованные слабым основанием и слабой кислотой, гидролизуются и по катиону и по аниону, а среда зависит от сравнительной силы образующихся слабых электролитов. Если ион, подвергающийся гидролизу, имеет заряд больше единицы, то гидролиз протекает ступенчато, причем степень гидролиза по I ступени максимальна.
Рассмотрим примеры гидролиза.
1. Гидролиз соли, образованной сильным основанием и слабой кислотой (гидролиз по аниону) – разберем на примере цианида калия. В растворе соль диссоциирует как сильный электролит: KCN ® K+ + CN-. С водой всегда взаимодействует ион слабого электролита, т.к. это приводит к образованию малодиссоциирующего вещества; этот процесс обратим. Сокращенное ионное уравнение:
СN- + HOH ⇄ НCN + OH-
Полное ионное уравнение:
K+ + СN- + HOH ⇄ НCN + K+ + OH-
Из обоих уравнений видно, что образуются ОН--ионы, обусловливающие появление щелочной среды в растворе KCN (рН > 7).
2. Гидролиз соли, образованной слабым основанием и сильной кислотой (гидролиз по катиону) – разберем на примере хлорида аммония. Уравнение его электролитической диссоциации: NH4Cl ® NH4+ + Cl-. Гидролизу подвергается ион слабого электролита – ион аммония:
NH4+ + HOH ⇄ NH4OH + H+
В результате высвобождаются ионы Н+, обусловливающие появление кислой среды (рН < 7).
3. Гидролиз соли, образованной слабым основанием и слабой кислотой (гидролиз по катиону и аниону) – рассмотрим на примере цианида аммония. Уравнение его электролитической диссоциации: NH4CN ® NH4+ + CN-. Оба образующихся иона являются ионами слабых электролитов, поэтому оба взаимодействуют с водой:
NH4+ + HOH ⇄ NH4OH + H+
CN- + HOH ⇄ HCN + OH-
Образующиеся ионы Н+ и ОН- объединяются друг с другом, образуя воду – один из самых слабых электролитов, поэтому равновесие процесса гидролиза смещается в сторону его усиления. Таким образом, в случае гидролиза по аниону и катиону процесс идет до конца и практически необратим.
На первый взгляд, из уравнений гидролиза кажется, что образуется равное количество ионов Н+ и ОН-, и среда в растворе соли должна быть нейтральной, но это не так. Образующиеся слабые электролиты подвергаются электролитической диссоциации, в результате которой также образуются ионы Н+ и ОН-:
NH4OH ⇄ NH4+ + OH-
HCN ⇄ H+ + CN-
Степень и константы диссоциации этих электролитов различны: Кд(NH4OH) = 1,8×10-5, Кд(HCN) = 6,2×10-10. Следовательно, гидроксид аммония является более сильным электролитом и посылает в раствор больше ионов ОН-, чем Н+, образующихся при диссоциации синильной кислоты. Значит, в данном случае среда в растворе будет слабощелочной.
4. Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются.
Закон разбавления Оствальда – выражение, отражающее зависимость степени электролитической диссоциации α от концентрации С (или разбавления V) раствора:
| Кд = | (Сa)2 | = | Сa2 | = | a2 | (8.2) |
| С - Сa | 1 - a | (1 - a)V |
Закон Оствальда можно применять для разбавленных растворов слабых электролитов. Так как для них a << 1 и (1-a) ® 1, то при расчетах можно пользоваться его сокращенной записью: Кд = Сa2
Ионная сила раствора – величина, представляющая собой полусумму произведений концентраций всех ионов, присутствующих в растворе, на квадраты их зарядов:
I = ½S(Ci × Zi2). (8.6)
Она является мерой интенсивности электрического поля, создаваемого ионами в растворе. Например, ионная сила 0,1 М раствора серной кислоты рассчитывается следующим образом. Уравнение диссоциации:
H2SO4 ® 2H+ + SO42-.
Так как электролит сильный и a = 1, то
Сраспавш.мол-л = Собщ.= См,
тогда
[H+] = 2Cм = 0,2 моль/л, [SO42-] = Cм = 0,1 моль/л.
Определим ионную силу раствора:
I = ½([H+]×Z2(H+) + [SO42-]×Z2(SO42-)) = ½(0,2×(+1)2 + 0,1×(–2)2) = 0,3.
Ионное произведение воды (К w ) – постоянная величина, равная произведению концентраций (активностей) ионов Н+ и ОН–. В воде и любых водных растворах при 295 К ионное произведение воды равно:
Кw = [H+][ОН-] = const = 10-14.
Для более точных расчетов, в особенности для растворов сильных электролитов, концентрации заменяют активностями:
Kw = a(H+)×a(OH-) = 10-14.
Константа гидролиза – представляет собой произведение константы равновесия процесса гидролиза на концентрацию воды (которая также является величиной постоянной, [Н2О] = const = 55,(5) моль/л). Например, для процесса гидролиза цианида калия, для которого сокращенное ионное уравнение выглядит так:
СN- + HOH ↔ НCN + OH- .
Выражение для константы гидролиза запишется следующим образом:
| Кг = | Кс[Н2О] = | [HCN][OH-] | . |
| [CN-] |
Константа гидролиза связана с константой диссоциации образующегося слабого электролита соотношением:
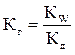 ,
,
где Кw – ионное произведение воды.
Связь константы и степени гидролиза выражается формулой:
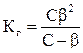 ,
,
где С – исходная концентрация электролита, подвергающегося гидролизу.
Чаще всего гидролизованная часть соли очень мала (b << 1), и можно пользоваться сокращенной формулой: Кг = С b2.
Константа диссоциации – константа равновесия процесса электролитической диссоциации (т.е. выражение закона действующих масс для реакции диссоциации). Она представляет собой отношение произведения концентраций ионов к концентрации недиссоциировавших молекул. Например, для синильной кислоты, диссоциирующей по уравнению HCN → H+ + CN– выражение для Кд будет выглядеть так:
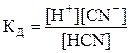 .
.
Наряду со степенью диссоциации константа диссоциации может служить для оценки силы электролита: чем меньше значение Кд, тем хуже электролит в данных условиях распадается на ионы (т. е. тем он слабее).
Коэффициент активности (фактор активности ) – табличная величина, учитывающая все виды взаимодействий между частицами раствора и показывающая, насколько формальная активность ионов отличается от их реальной концентрации. Коэффициент активности определяется экспериментально, он зависит от ионной силы раствора I.
Сила электролита – условная характеристика, отражающая способность вещества диссоциировать на ионы. Сила электролита определяется по степени диссоциации. Электролиты принято разделять на две группы – сильные электролиты, степень диссоциации которых больше 30% и почти не зависит от концентрации раствора, и слабые электролиты, степень диссоциации которых, как правило, значительно меньше 100% (α < 3%).
К сильным электролитам относятся подавляющее большинство солей, щелочи, сильные кислоты (серная, азотная, соляная, хлорная и др.).
К слабым электролитам относятся слабые неорганические кислоты (угольная, кремниевая, сернистая, азотистая и др.), большинство органических кислот, гидроксид аммония, гидроксиды d- и f -элементов, вода. Иногда выделяют группу электролитов средней силы. Резкой границы между всеми перечисленными группами нет.
Степень гидролиза ( b ) – отношение концентрации электролита, подвергшегося гидролизу, по отношению к общей числу молекул электролита:
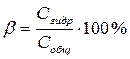 .
.
Степень диссоциации ( a ) – это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул вещества, измеряется в долях единицы или в %:
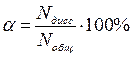 .
.
Степень диссоциации зависит от природы электролита, от температуры (при повышении температуры степень диссоциации в основном повышается), от концентрации раствора (чем меньше концентрация, тем больше степень диссоциации), от степени полярности молекул растворителя (чем больше полярность, тем выше степень диссоциации).

Образцы решения задач
Задача 1. Рассчитайте рН среды в децимолярном растворе уксусной кислоты. Укажите цвета основных индикаторов (лакмуса, метилового оранжевого и фенолфталеина) в этом растворе.
Решение : Уравнение электролитической диссоциации уксусной кислоты:
СН3СООН ⇄ СН3СОО– + Н+
Судя по тому, что при диссоциации высвобождаются катионы водорода, среда в растворе кислая.
Так как уксусная кислота – слабый электролит, концентрация ионов Н+ рассчитывается по формуле:
С i = С × a,
где С – концентрация раствора, a − степень диссоциации.
Децимолярный раствор – это раствор с молярной концентрацией 0,01 моль/л; С = 0,01 моль/л.
Степень диссоциации можно найти из закона разбавления Оствальда:
КД = a2 × С,
отсюда  .
.
Табличное значение константы диссоциации Кд(СН3СООН) = 1,75×10–5.
Находим степень диссоциации:
 .
.
Рассчитываем концентрацию Н+ по формуле, приведенной в п. 2:
[Н+] = 0,01×0,042 = 0,42×10–3 моль/л.
Находим рН среды:
рН = – lg a(Н+),
Так как в растворах слабых электролитов активность ионов можно считать равной их концентрации, то
рН = – lg [Н+] = –lg 0,42×10–3 = 3,38.
рН 3,38 < 7, следовательно, среда в растворе кислая. Лакмус и метиловый оранжевый в этом растворе будут иметь красный цвет, а фенолфталеин останется бесцветным.
Задача 2 . Рассчитайте рН среды в 0,1 М растворе гидроксида калия. Укажите цвета основных индикаторов (лакмуса, метилового оранжевого и фенолфталеина) в этом растворе.
Решение : Уравнение электролитической диссоциации гидроксида калия:
КОН ® К + + ОН–
Судя по тому, что при диссоциации высвобождаются гидроксид-ионы, среда в растворе должна быть щелочной (гидроксид калия – щелочь).
Так как КОН является сильным электролитом, он практически полностью распадается на ионы, причем из уравнения электролитической диссоциации видно, что
[К+] = [ОН–] = [КОН] = 0,1 моль/л.
Чтобы найти рН раствора сильного электролита, необходимо рассчитать активности ионов, используя коэффициент активности, а для этого предварительно рассчитаем ионную силу раствора:
I = ½åCi×Zi2 ;
I = ½([К+]×12 + [OН–]×(–1) 2 ) = ½(0,1×1 + 0,1×1) = 0,1 моль/л.
Из таблицы находим коэффициент активности: для ОН– (однозарядный ион) fа = 0,8. Активность ионов рассчитывается по формуле:
а(ОН–) = С × fа ;
а(ОН−) = 0,1×0,8 = 0,08 моль/л.
Из выражения для ионного произведения воды находим:
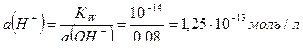 .
.
Рассчитываем водородный показатель среды:
рН = – lg a(Н+) = –lg 1,25×10-13 = 12,9.
рН 12,9 > 7, следовательно, среда щелочная. Лакмус в этом растворе будет окрашен в синий цвет, метиловый оранжевый – в желтый, фенолфталеин – в малиновый.
Задание 9 по теме «Растворы»
Дата: 2018-11-18, просмотров: 709.