Гальванический элемент – химический источник постоянного тока, состоящий из одной гальванической ячейки, в состав которой входят два электрода в разными потенциалами, соединенные металлическим проводником, и раствор электролита, содержащий реагенты, необходимые для протекания электродных реакций. В гальваническом элементе происходит превращение химической энергии окислительно-восстановительных реакций в электрическую энергию.
Схема гальванического элемента – условное отображение гальванического элемента, включающее его основные составляющие и основные процессы, происходящие при его работе.
Например, схема медно-цинкового гальванического элемента изображается так:

А К
(-) Zn/Zn2+ Сu2+/Cu (+)
Ann–
Двумя параллельными чертами (или пунктирной линией) обозначается полупроницаемая перегородка, через которую движутся анионы, замыкающие цепь, косыми чертами показана поверхность раздела фаз между металлом и раствором, содержащим ионы этого металла (потенциал-определяющие ионы). Также стрелками показано движение электронов от восстановителя (Zn) к окислителю (Cu2+), причем длинная стрелка означает перемещение электронов по внешней цепи (металлическому проводнику).
Токообразующая реакция (ТОР) – суммарная реакция, протекающая в гальваническом элементе, включающая процессы окисления и восстановления. Например, для медно-цинкового гальванического элемента ТОР выглядит так:
Znº + Cu2+ ⇄ Cuº + Zn2+
Токообразующая реакция требует расстановки коэффициентов, если в ней участвуют ионы с разным зарядом, например:
2Ag+ + Feº ⇄ 2Agº + Fe2+.
Зависимость электродных потенциалов от внешних условий отражается в уравнении Нернста:
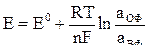 ,
,
где Еº – стандартный электродный потенциал, R – универсальная газовая постоянная, Т – абсолютная температура, К; n – число электронов, участвующих в электродном процессе (равно валентности катиона металла); F – постоянная Фарадея (96500 Кл/моль); аОФ и аВФ – активность окисленной и восстановленной формы вещества.
Для металлического электрода при нормальных условиях уравнение Нернста принимает вид:
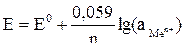 ,
,
где аMen+ – активная концентрация катионов металла в растворе, моль/л.
Для газовых электродов (водородного и кислородного) в уравнение Нернста входят парциальные давления газов:
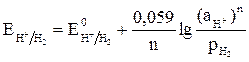 ,
,
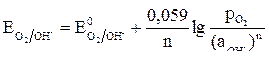 ,
,
где р – парциальное давление газа, а – активность ионов; для водородного электрода n = 2, для кислородного электрода n = 4.
Парциальные давления газов в гальванических элементах и при электролизе равны 1, при коррозионном процессе парциальное давление кислорода 0,21 атм., водорода 5·10–7 атм. (что соответствует содержанию этих газов в воздухе).
Электродвижущая сила (ЭДС ) – максимальная разность потенциалов элект-родов, которая может быть получена при работе гальванического элемента:
Еэ = Еркатода – Еранода
ЭДС связана с изменением энергии Гиббса токообразующей реакции соотношением:
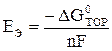 ,
,
где n – число электронов, обмениваемых в токообразующей реакции.

Образцы решения задач
Задача 1. Рассчитайте ЭДС цинково‑железного гальванического элемента при стандартных условиях (двумя способами) и при изменении активностей потенциалопределяющих ионов в результате работы в 10 раз. Приведите график поляризационных кривых для этого гальванического элемента.
Решение: Найдем в ряду стандартных электродных потенциалов потенциалы цинкового и железного электродов и составим схему гальванического элемента:
Е°(Zn2+/Zn) = –0,763 В – анод, Е°(Fe2+/Fe) = –0,44 В – катод.







 А К
А К
 (-) Zn/Zn2+ Fe2+/Fe (+)
(-) Zn/Zn2+ Fe2+/Fe (+)
Ann–
Уравнения электродных процессов и токообразующей реакции:
А(-): Zn° – 2ē ® Zn2+ (окисление)
К(+): Fe 2+ + 2ē ® Fe° (восстановление)
Т.О.Р.: Zn° + Fe 2+ ® Zn2+ + Fe°
Обратите внимание, что иногда токообразующая реакция требует расстановки коэффициентов, так как число отданных электронов должно быть равно числу принятых. Для данной реакции число обменных электронов равно 2, и расстановка коэффициентов не требуется.
Рассчитаем ЭДС при стандартных условиях:
1 способ: Е°г.э. = Е°к – Е°а = - 0,44 – (-0,763) = 0,323 В.
2 способ (с использованием табличных значений термодинамических констант для ионов):
DG°ТОР = SDG°прод. - SDG°исх. = DG°(Zn2+) - DG°(Fe2+),
DG°ТОР = (-147,21) - (-84,94) = -62,27 кДж/моль;
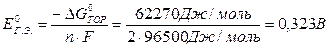
Рассчитаем равновесные потенциалы анода и катода при изменении активностей потенциалопределяющих ионов по уравнению Нернста:
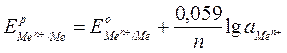
Из уравнений электродных реакций видно, что в процессе работы гальванического элемента активность ионов цинка увеличивается (металл анода разрушается, и ионы выходят в раствор), а активность ионов железа уменьшается (ионы из раствора, принимая электроны и восстанавливаясь, превращаются в атомы и осаждаются на катоде). Следовательно, при изменении активностей ПОИ в 10 раз по сравнению со стандартным значением (1 моль/л) активность ионов цинка станет равной 10 моль/л, а активность ионов железа – 0,1 моль/л. ЭДС в ходе работы элемента уменьшилась.
Рассчитаем новое значение ЭДС:

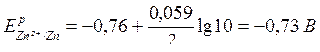 ,
, 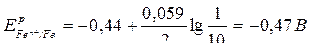 ,
,
Ег.э. = Ерк – Ера =
= -0,47 – (-0,73) = 0,26 В
График поляризационных кривых для этого гальванического элемента приводится на рисунке 2.2.1.
Задача 2. Составьте схему работы кислородно-водородного гальванического элемента и рассчитайте его ЭДС, если парциальные давления газов равны 1 атм, а рН = 12. Как изменяется рН среды в анодной и катодной зонах при работе этого гальванического элемента?
Решение: Так как при любом значении рН потенциал водородного электрода меньше потенциала кислородного электрода, схема гальванического элемента будет выглядеть следующим образом.
(Для работы газовых электродов необходима платиновая подкладка!)

А К
 (-) [Pt] H2/H+ ОH–/O2 [Pt] (+)
(-) [Pt] H2/H+ ОH–/O2 [Pt] (+)
Ann–
Уравнения электродных реакций:
А(-): Н2 – 2ē ® 2Н+ (окисление)
К(+): О2 + 4ē + 2Н2О ® 4ОН– (восстановление)
Т.О.Р.: 2Н2 + О2 + 2Н2О ® 4Н+ + 4ОН–
Рассчитаем активности ионов Н+ и ОН– при рН = 12:
рН = –lg a(Н+),
отсюда
a(Н+) = 10–рН = 10–12; 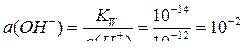 .
.
Рассчитаем равновесные потенциалы газовых электродов при заданном значении рН по уравнению Нернста:
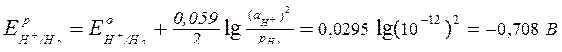 ,
,
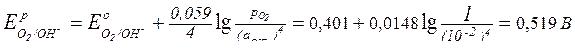 .
.
Найдем ЭДС:
Ег.э. = Ерк – Ера = 0,519 – (-0,708) = 1,227 В.
По уравнениям электродных реакций видно, что в анодной зоне возрастает содержание Н+-ионов, следовательно, среда становится более кислой, и рН уменьшается. В катодной зоне в результате восстановления молекулярного кислорода образуются гидроксид-ионы, значит, среда становится более щелочной, и рН увеличивается.
Задание 11 по теме «Электрохимические процессы»
Дата: 2018-11-18, просмотров: 1316.