Химическим равновесием называют состояние системы, подчиняющееся следующим закономерностям:
1) динамический характер: υпрямой реакции = υобратной реакции;
2) подвижность - самопроизвольное восстановление после прекращения внешнего воздействия (согласно принципу Ле-Шателье);
3) энергия Гиббса ΔG° = 0, энергия Гельмгольца ΔF° = 0, т. е. система не совершает полезной работы.
Константа равновесия – математическое выражение закона дейст-вующих масс для химического равновесия: при постоянной температуре отношение произведения равновесных концентраций продуктов реак-ции в степенях, равных стехиометрическим коэффициентам, к произве-дению равновесных концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам есть величина постоянная.
Для реакции aA + bB ⇄ cC + dD исходными веществами (реагентами) являются А и В, а продуктами реакции – С и D.
Выражение константы равновесия можно записывать через концентрацию растворов или газов:
Кс= 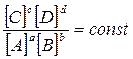 (при Т = const)
(при Т = const)
А также можно пользоваться парциальным давлением газов:
Кр= 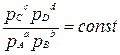 (при Т = const)
(при Т = const)
Кс и Кр связаны выражением Кр = Кс 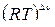 ,
,
где R - универсальная газовая постоянная, Т – температура, Δν – изменение количества вещества в ходе реакции; в рассматриваемом примере Δν = (c + d) - (a + b).
В выражение для константы равновесия входят только равновесные концентрации веществ.
Связь между Кр и энергией Гиббса выражается формулой:
D G° = - RT × lnKp = -2,3RT × lgKp,
отсюда 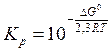 .
.
Если реакция гетерогенная, то концентрации (активности) твердых веществ и чистых жидкостей в выражение для Кс (Кр) не подставляют. Площадь поверхности раздела фаз также не учитывается, так как прямая и обратная реакции идут на одной поверхности.
Константа равновесия – функция состояния, зависящая лишь от температуры и не зависящая от концентрации (давления) веществ или объема системы.
При значении Кс(Кр) > 1 процесс протекает в прямом направлении, при Кс(Кр) < 1 – в обратном. Если Кс(Кр) > 104, процесс считается практически необратимым, Кс(Кр) < 10-4 – практически невозможным.
Принцип Ле-Шателье : если на систему в состоянии равновесия производить внешнее воздействие (изменять температуру, давление, концентрацию), то внутри системы возникнут процессы, противодействующие произведенному воздействию.
● Температура . - Изменение температуры смещает равновесие обратимой реакции следующим образом:
а) повышение (нагревание) смещает равновесие в сторону эндотермической реакции:
(↑Т): А ⇄ В (ΔH < 0) влево, Кс уменьшается;
В ⇄ А (ΔH > 0) вправо, Кс увеличивается;
б) понижение (охлаждение) смещает равновесие в сторону экзотермической реакции:
(↓Т): А ⇄ В (ΔH < 0) вправо, Кс увеличивается;
В ⇄ А (ΔH > 0) влево, Кс уменьшается.
● Давление . - Изменение в системе, включающей газообразные реагенты или продукты, компенсируется следующим образом:
а) повышение давления (сжатие) смещает равновесие в сторону реакции, приводящей к образованию меньшего числа молей продуктов:
(↑р): 2А(г) ⇄ В(г) ν(А) > ν(В) вправо Кс, Кр= const;
В(г) ⇄ 2А(г) ν(А) > ν(В) влево Кс, Кр= const;
А(г) ⇄ В(г) ν(А) = ν(В) равновесие не смещается Кс, Кр= const.
б) снижение давления (расширение) смещает равновесие в сторону реакции, приводящей к образованию большего числа молей продуктов:
(↓р): 2А(г) ⇄ В(г) ν(А) > ν(В) влево Кс, Кр= const;
В(г) ⇄ 2А(г) ν(А) > ν(В) вправо Кс, Кр= const;
А(г) ⇄ В(г) ν(А) = ν(В) равновесие не смещается Кс, Кр= const.
● Объем системы . - Изменение объема системы приводит к противоположным сдвигам, чем в случае с давлением, т. к. величины объема и давления обратно пропорциональны друг другу.
● Концентрация (парциальное давление). - Изменение концентраций (парциальных давлений) веществ также нарушает равновесие в системе:
а) увеличение концентрации (парциального давления) реагентов или снижение концентрации (парциального давления) продуктов ускоряет прямую реакцию;
б) снижение концентрации (парциального давления) реагентов или увеличение концентрации (парциального давления) продуктов ускоряет обратную реакцию.
На смещение гетерогенного равновесия не влияют изменения параметров твердых веществ.

Образцы решения задач
Задача 1. Начальные концентрации азота и водорода в системе N2(г) + 3H2(г) ⇄ 2NH3(г) равны соответственно 1 моль/л и 0,8 моль/л. Равновесие в системе установилось при концентрации аммиака, равной 0,2 моль/л. Рассчитайте величину константы равновесия.
Решение: Запишем выражение для константы равновесия данной системы:
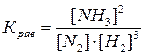
Зная, что равновесная концентрация аммиака [NH3] = 0,2 моль/л и принимая концентрацию аммиака (продукта реакции) в начальный момент времени равной 0, найдем изменение его концентрации: равновесная концентрация продуктов реакции: [прод] = Снач + DС (т.к. их концентрация в ходе реакции увеличивается), отсюда DС(NH3) = [NH3] = 0,2 моль/л.
Исходя из соотношений коэффициентов в уравнении реакции, найдем изменение концентраций остальных веществ:
DС(N2) = ½×DС(NH3) = 0,1 моль/л;
DС(H2) = 3/2×D[NH3] = 3×D[N2] = 0,3 моль/л.
Найдем равновесные концентрации азота и водорода:
для исходных веществ [исх] =Снач. – DС, так как их концентрации в ходе реакции уменьшаются.
[N2] = Снач.(N2). – DС(N2) = 1 моль/л – 0,1 моль/л = 0,9 моль/л.
[Н2] = Снач.(H2) – DС(H2) = 0,8 моль/л – 0,3 моль/л = 0,5 моль/л.
Рассчитаем значение константы равновесия:
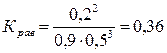 .
.
Исходные данные можно оформлять в виде таблицы, и поиск недостающих концентраций вести устно:
| Ур‑е реакции | N2 + 3H2 → 2NH3 | ||
| Снач, моль/л | 1 | 0,8 | 0 |
| DС, моль/л | 0,1 | 0,3 | 0,2 |
| Срав, моль/л | 0,9 | 0,5 | 0,2 |
Задача 2 . Рассчитайте равновесные концентрации веществ в системе
А + В ⇄ С + Д (все вещества – газы), если начальные концентрации А и В были равны соответственно 1 моль/л и 5 моль/л, а константа равновесия равна 1.
Решение: Пусть к моменту наступления равновесия прореагировало х моль/л вещества А. По уравнению реакции видно, что DСА = DСВ = DСС = DСД = х моль/л. Тогда равновесные концентрации исходных веществ будут равны:
[А] = Снач.(А) - DСА = (1-х) моль/л,
[В] = Снач.(В) - DСВ = (5-х) моль/л,
а равновесные концентрации продуктов реакции -
[С] = DСС = х моль/л,
[Д] = DСД = х моль/л.
Запишем выражение для константы равновесия и подставим в нее значения равновесных концентраций:
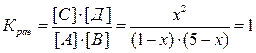 , х = 0,83.
, х = 0,83.
Отсюда [А] = 0,17 моль/л, [В] = 4,17 моль/л, [С] = [Д] = 0,83 моль/л.
Задача 3 . Куда сместится равновесие в системе
3А(г) + 2В(т) ⇄ 2С(г) + 2D(г), DН>0,
если: а) увеличить концентрацию вещества А; б) увеличить концентрацию вещества С; в) повысить давление в системе; г) уменьшить объем системы; д) повысить температуру; е) ввести катализатор? Как в этих случаях изменится величина константы равновесия?
Решение: Смещение равновесия определяется принципом Ле-Шателье.
а) Если ввести в равновесную систему дополнительное количество исходного вещества, равновесие сместится в сторону прямой реакции, т.е. вправо. Константа равновесия не изменится, так как она не зависит от концентраций, а только от температуры и природы реагирующих веществ.
б) Если увеличить концентрацию продукта реакции, равновесие сместится в сторону обратной реакции (влево). Крав. не изменится.
в) При повышении давления в системе равновесие смещается в сторону образования тех веществ, которые занимают меньший объем; в данном случае исходные вещества занимают 3 объема (учитываются только газообразные вещества!), а продукты – 4 объема, следовательно, равновесие сместится влево. Крав. не изменится.
г) При уменьшении объема в системе повышается давление, и равновесие смещается влево. Крав. не изменяется.
д) Так как прямая реакция сопровождается поглощением теплоты
(DН > 0), то при повышении температуры равновесие сместится в сторону прямой реакции. Крав. для эндотермических реакций при повышении температуры увеличивается.
е) Катализатор ускоряет не только прямую, но и обратную реакции, поэтому его введение не влияет на смещение химического равновесия. Крав. также не изменяется.
Задание 7 по теме «Химическое равновесие»
Дата: 2018-11-18, просмотров: 999.