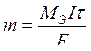 ,
,
где Мэ – молярная масса эквивалентов вещества (г/моль), выделяющегося на электроде, I – сила тока (А), τ – время (с), F – число Фарадея (96484,56 Кл/моль ≈ 96500 Кл/моль).
Для газов это выражение имеет вид:
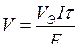 ,
,
где Vэ – эквивалентный объем газа (л/моль).
2. Массы (объемы) прореагировавших на аноде и катоде веществ относятся друг к другу как молярные массы их эквивалентов (их эквивалентные объемы):
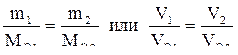 .
.
Выход по току – доля общего количества электричества, прошедшего через электролизер, которая расходуется на выделение одного вещества:
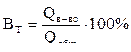 .
.
Расчет Qобщ. проводят относительно электрода, на котором протекает один процесс (Вт = 100%). Количества электричества, прошедшие через анод и катод, равны.
Выход по току также можно рассчитывать по формулам:
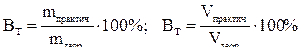 .
.
Как правило, выход по току на практике не бывает равен 100%, что связано, во-первых, с возможностью протекания нескольких процессов одновременно на одном электроде, а также с потерями на сопротивление проводников I и II рода.

Образцы решения задач
Задача 1. Запишите уравнения реакций, протекающих на угольном аноде и оловянном катоде при электролизе водного раствора сульфата олова (рН = 4). Рассчитайте выход по току вещества, в первую очередь выделяющегося на катоде, если при прохождении 0,5 F электричества масса катода изменилась на 22,24 г.
Решение: В данной задаче описывается случай электролиза с нерастворимым анодом. Составим схему электролиза и выясним ионный состав раствора в анодной и катодной зонах:

А SnSO4 ® Sn2+ + SO42- К
(+) Н2О ® Н+ + ОН- (-)
O42- Sn2+
Н2О H+
[C] рН = 4 [Sn]
Чтобы выяснить, какой процесс в первую очередь будет протекать на аноде, необходимо найти значения электродных потенциалов частиц, которые способны окисляться (SO42- и OH-):
Е°(S2O82-/SO42-) = + 2,01 В;
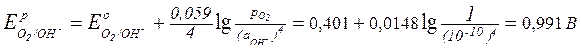 .
.
Так как потенциал разряда анионов кислородных кислот велик, на аноде будет протекать только процесс окисления воды:
2Н2О - 4ē ® О2 + 4Н+ .
Найдем потенциалы частиц, способных восстанавливаться на катоде:
Е°(Sn2+/Sn) = -0,136 В;
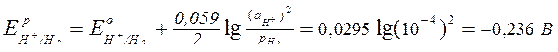 .
.
В первую очередь на отрицательно заряженном катоде восстанавливаются частицы с более положительным потенциалом (Sn2+), но так как значения потенциалов ионов олова и водорода близки (разница меньше 1 В), на катоде будут протекать два процесса:
1) Sn2+ + 2ē ® Sn°; 2) 2Н+ + 2ē ® Н2 .
Так как по условию масса катода изменилась на 22,24 г, то на катоде практически выделилось 22,24 г олова. Найдем массу олова, которая должна была теоретически выделиться на катоде при прохождении 0,5 F электричества:
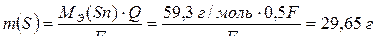 .
.
Найдем выход по току олова:
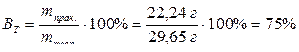 .
.
Задача 2 . Опишите процесс электролиза водного раствора сульфата цинка с цинковыми электродами (рН = 5).
Решение: В данной задаче описывается случай электролиза с растворимым анодом.
 Составим схему электролиза и выясним ионный состав раствора в анодной и катодной зонах:
Составим схему электролиза и выясним ионный состав раствора в анодной и катодной зонах:
А ZnSO4 ® Zn2+ + SO42- К
(+) Н2О ® Н+ + ОН- (-)
SO42- Zn2+
Н2О H+
[Zn] рН = 5 [Zn]
Найдем значения электродных потенциалов частиц, которые способны окисляться (SO42-, OH-, Zn):
Е°(S2O82-/SO42-) = + 2,01 В;
Е°(Zn2+/Zn) = -0,763 В;
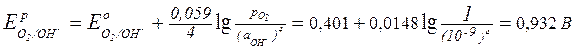 .
.
На положительно заряженном аноде в первую очередь окисляются частицы с минимальным потенциалом, в данном случае – атомы цинка:
Zn° – 2ē ® Zn2+ .
Разница в электродных потенциалах цинка и остальных частиц слишком велика, поэтому на аноде будет протекать только процесс окисления цинка.
Найдем потенциалы частиц, способных восстанавливаться на катоде:
Е°(Zn2+/Zn) = -0,763 В;
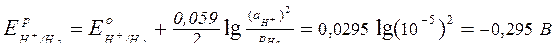 .
.
В первую очередь на отрицательно заряженном катоде восстанавливаются частицы с максимальным потенциалом (Н+); так как значения потенциалов ионов цинка и водорода близки (разница меньше 1 В), на катоде будут протекать два процесса:
1) 2Н+ + 2ē ® Н2; 2) Zn2+ + 2ē ® Zn°.
В этом случае выходы по току водорода и цинка будут меньше 100% (в сумме оба 100%).
Изобразим график поляризационных кривых для данных процессов:
 ε
ε
i
-0,295 Поляризационная кривая
окисления цинка на аноде
-0,763
Поляризационная кривая
восстановления цинка на катоде
Поляризационная кривая
восстановления водорода на
катоде
Задача 3 . Электролиз водного раствора хлорида натрия (рН = 8) проводили на угольных электродах в течение 6,7 ч. При этом на катоде выделилось 5,6 л газа. Определите, при какой силе тока проводили электролиз и сколько хлора выделилось за это время на аноде, если его выход по току 25%.
Решение: Схема электролиза:






А NaCl ® Na+ + Cl- К
(+) Н2О ® Н+ + ОН- (-)
Cl- Na+
ОН- Н2О
[C ] рН = 8 [C]
Выясним, какие процессы протекают в анодной зоне:
Е°(Сl2/Cl-) = 1,359 В;
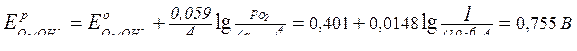 .
.
Из полученных значений видно, что на аноде протекают 2 процесса:
1) 4ОН- - 4ē ® О2 + 2Н2О; 2) 2Сl- - 2ē ® Cl2.
Как известно из условия, на выделение кислорода тратится 75% электричества, на выделение хлора – 25%.
В катодной зоне может протекать только восстановление ионов водорода, так как щелочные металлы из растворов при электролизе никогда не выделяются. Это можно подтвердить и значениями потенциалов:
ε°(Na+/Na) = -2,714 В;
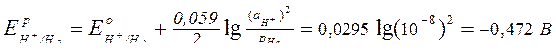 .
.
Е°(Na+/Na) << Ер (Н+/Н2), значит, восстановление натрия невозможно.
Катодный процесс: 2Н2О + 2ē ® Н2 + 2ОН–.
Выход по току водорода 100%.
Согласно закону Фарадея:
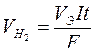 .
.
Отсюда сила тока равна:
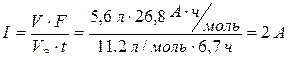 .
.
Рассчитаем количество электричества, затраченное на выделение хлора.
Количество электричества, прошедшее через электролизер (следова-тельно, и через анод):
Q = I × t = 2 A × 6,7 ч = 13,4 А ×ч.
По условию
Q(Cl2) = 0,25Q = 3,35 А ×ч.
Рассчитаем объем выделившегося хлора:
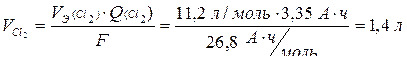 .
.
Задание 12 по теме «Электрохимические процессы»
Дата: 2018-11-18, просмотров: 713.