Концентрация раствора – это отношение количества вещества или массы растворенного вещества к объему или массе всего раствора (иногда растворителя). Существует несколько способов выражения концентрации.
Массовая доля вещества (w) представляет собой отношение массы растворенного вещества к массе раствора и выражается в долях единицы или в процентах. Массовая доля, выраженная в процентах, показывает, сколько граммов растворенного вещества содержится в 100 г раствора.
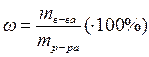
Молярная доля вещества в растворе (c) – это отношение количества вещества растворенного компонента к сумме количества растворенного вещества (веществ) и количества вещества растворителя. Молярная доля также выражается в долях единицы или в процентах.
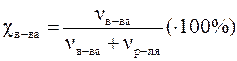
Молярная концентрация (молярность) (Cм) численно равна отношению количества растворенного вещества к объему раствора. Она измеряется в моль/л (М) и показывает, сколько молей растворенного вещества содержится в 1 л раствора.
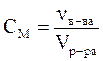
Раствор с молярной концентрацией 1 моль/л называют одномолярным раствором и обозначают 1 М; с молярной концентрацией 0,1 моль/л – децимолярным (0,1 М); с молярной концентрацией 0,01 моль/л – сантимолярным (0,01 М) и т.п.
Молярная концентрация эквивалентов (нормальная концентрация, нормальность) (Сн) – это отношение количества вещества эквивалентов растворенного вещества к объему раствора. Она показывает, сколько молей эквивалентов растворенного вещества содержится в 1 л раствора, и измеряется также в моль/л (моль экв./л) или сокращенно н.
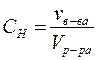
Аналогично, раствор с нормальной концентрацией 1 моль/л называют однонормальным и обозначают 1 н, и т.д.
Титр раствора (Т) показывает, сколько граммов растворенного вещества содержится в 1 мл раствора, и измеряется, соответственно, в г/мл.
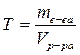
Моляльная концентрация (моляльность) – это отношение количества растворенного вещества к массе растворителя, выражается в моль/кг.

Образцы решения задач
Задача 1. Рассчитайте массы вещества, раствора, растворителя, мольную долю и моляльную концентрацию для заданного раствора с указанной массовой долей, плотностью и объемом: ω =12 % NaCl; ρ=1,086 г/cм3; V= 0,5л.
Решение: Найдем массу вещества, содержащегося в 500 мл 12%‑го раствора:
mв-ва = 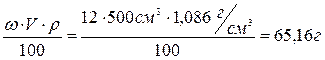 .
.
Найдем массу раствора:
mр-ра = V×r = 500 cм3×1,086 г/cм3 = 543 г.
Найдем массу растворителя:
mр-ля = mр-ра – mв-ва = 543 – 65,16 = 477,84 г.
Определим моляльную концентрацию:
Сm = 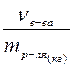 =
= 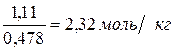 .
.
Первый способ расчета мольной доли
Рассчитаем мольную долю, предварительно переведя найденные массы компонентов в количества вещества компонентов:
n в-ва= 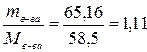 моль; n р-ля=
моль; n р-ля= 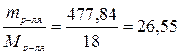 моль.
моль.
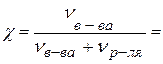
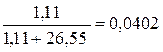 .
.
Дата: 2018-11-18, просмотров: 697.