1. Определите анодные и катодные участки. При необходимости подберите нужный металл согласно заданию.
2. Выясните наличие возможных окислителей и рассчитайте их потенциалы при данном значении рН.
3. Обоснуйте возможность протекания электродных процессов окисления металла и восстановления окислителей.
4. Составьте схему образующегося коррозионного элемента.
5. Запишите уравнения электродных процессов.
6. Покажите на графике примерный ход поляризационных кривых анодного и катодного процессов.
7. Дайте развернутый обоснованный ответ на дополнительный вопрос.
См. задания в таблице З13.
Таблица З13 - Задания
| № | Материал | рН | Дополнительный вопрос |
| 1 | 2 | 3 | 4 |
| 1 | Железное изделие + протектор | 4 | Почему меняется потенциал анодного процесса? |
| 2 | Никелевое изделие + анодное покрытие | 10 | Как и почему изменяется рН в катодной зоне при коррозионном процессе? |
| 3 | Медное изделие + анодное покрытие | 1 | Как повлияет на скорость коррозии добавление в коррозионную среду уротропина? |
| 4 | Железное изделие + катодное покрытие | 6 | В чем отличие метода катодной защиты от катодного покрытия? |
| 5 | Оловянное изделие + анодное покрытие | 5 | В чем отличие метода анодной защиты от анодного покрытия? |
| 6 | Лужёная медь | 7 | Как меняется энергия Гиббса при протекании коррозионного процесса? |
| 7 | Посеребренная медь | 8 | Как повлияет на скорость коррозии добавление в коррозионную среду раствора пероксида водорода? |
| 8 | Никелевое изделие + протектор | 9 | Как повлияет на скорость коррозии деаэрация коррозионной среды? |
| 9 | Железное изделие + анодное покрытие | 10 | В чем отличие анодного покрытия от анодной защиты? |
| 10 | Никелевое изделие + катодное покрытие | 5 | Как повлияет на скорость коррозии увеличение рН среды? |
Продолжение табл. З13
| 11 | Медное изделие + протектор | 12 | В чем отличие протекторной защиты от катодной? |
| 12 | Луженое железо | 13 | В чем отличие протекторной защиты от анодной? |
| 13 | Кадмий + анодное покрытие | 14 | Какую окраску приобретает раствор в области катодных участков при добавлении фенолфталеина? |
| 14 | Оцинкованное железо | 1 | Как и почему меняется потенциал катодного процесса? |
| 15 | Свинцовое изделие + катодное покрытие | 2 | Каким образом можно замедлить скорость коррозии путем изменения состава среды? |
| 16 | Медное изделие + катодное покрытие | 2 | Как изменится скорость коррозии при добавлении в коррозионную среду щелочи? |
| 17 | Посеребренное железо | 3 | Какая обработка среды будет способствовать замедлению коррозии? |
| 18 | Медь в контакте с цинком | 4 | Как влияют электродные процессы на изменение рН среды при коррозии? |
| 19 | Оловянное изделие + катодное покрытие | 7 | В чем отличие протекторной защиты от анодного покрытия? |
| 20 | Хромовое изделие + катодное покрытие | 6 | Как и почему изменяется скорость коррозии при повышении температуры? |
| 21 | Серебро в контакте со ртутью | 1 | Будет ли способствовать замедлению коррозии увеличение рН среды? |
| 22 | Хромированная медь | 7 | Как и почему меняется потенциал катодного процесса? |
| 23 | Высокоуглеродистая сталь | 8 | Какая обработка коррозионной среды способствует замедлению коррозии? |
| 24 | Оловянное изделие + протектор | 9 | Как изменяется скорость коррозии при поляризации и деполяризации? |
| 25 | Железо в контакте с медью | 10 | Какие существуют способы электрохимической защиты от коррозии? |
ПРИЛОЖЕНИЯ
Приложение А
СПРАВОЧНЫЕ ДАННЫЕ
Таблица А1 – Основные физико-химические постоянные
| Постоянная | Символ | Единицы СИ | Единицы СГС |
| Заряд электрона | ē | 1,602×10-19 Кл | 4,803×10-10 эл. ед. заряда |
| Масса электрона | mē | 9,109×10-31 кг | 9,109×10-28 г |
| Масса атома водорода | mh | 1,673×10-27 кг | 1,673×10-24 кг |
| Универсальная газовая постоянная | R | 8,314 Дж/(моль×К) | 8,314×107 эрг/(моль×К) |
| Число Авогадро | N | 6,022×1023 моль-1 | |
| Число Фарадея | F | 96485 Кл/моль | 96485 А×с/моль =26,8 А×ч/моль |
| Постоянная Планка | h | 6,626×10-34 Дж×с | |
| Постоянная Больцмана | KБ | 1,381×10-23 Дж/К | |
| Объем 1 моля газа при н.у. | V0 | 22,4×10-3 м3/моль | 22,4 л/моль |
| Постоянная Ридберга | Rн | 10973731,4 м-1 | 109737,3 см-1 |
| Радиус первой орбиты H2 | rн | 5,29×10-13 м | |
| Абсолютный нуль | Т° | 0 К | -273,15°С |
Таблица А2 – Приставки для дольных и кратных единиц СИ
| Приставка | Символ | Множитель | Приставка | Символ | Множитель |
| нано | н | 10-9 | деци | д | 10-1 |
| микро | мк | 10-6 | кило | к | 103 |
| милли | м | 10-3 | мега | М | 106 |
| санти | с | 10-2 | гига | Г | 109 |


Таблица А3 – Атомные радиусы элементов, А°
| Гр. Пер. | I | II | III | IV | V | VI | VII | |||
VIII
4
5
6
* A° (ангстрем) = 10-10 м
Таблица А4 – Важнейшие кислоты и их соли
| Название | Формула | Название солей |
| Азотная Азотистая Соляная (хлороводородая) Серная Сернистая Сероводородная Тиосерная Фосфорная (ортофосфорная) Угольная Кремниевая Борная (ортоборная) Синильная Роданистая (тиоцианатоводородная) Хромовая Дихромовая (двухромовая) Плавиковая (фтороводородная) Бромоводородная Йодоводородная Марганцовая Хлорная Хлорноватая Хлористая Хлорноватистая Метаалюминиевая Муравьиная Уксусная | HNO3 HNO2 HCl H2SO4 H2SO3 H2S H2S2O3 H3PO4 H2CO3 H2SiO3 H3BO3 HCN HNCS H2CrO4 H2Cr2O7 HF HBr HI HMnO4 HClO4 HClO3 HClO2 HClO HAlO2 HCOOH CH3COOH | Нитраты Нитриты Хлориды Сульфаты Сульфиты Сульфиды Тиосульфаты Фосфаты (ортофосфаты) Карбонаты Силикаты Бораты (ортобораты) Цианиды Роданиды (тиоцианаты) Хроматы Дихроматы (бихроматы) Фториды Бромиды Йодиды Перманганаты Перхлораты Хлораты Хлориты Гипохлориты Алюминаты Формиаты Ацетаты |
Таблица А5 – Кислоты галогенов
| Название | Формула | Название солей |
| Бромная | HВrO4 | Перброматы |
| Бромноватая | НBrО3 | Броматы |
| Бромноватистая | НBrО | Гипобромиты |
| Бромоводородная | HBr | Бромиды |
| Йодная | НIO4 | Перйодаты |
| Йодноватая | HIO3 | Йодаты |
| Йодноватистая | HIO | Гипойодиты |
| Йодоводородная | HI | Йодиды |
| Плавиковая (фтороводородная) | HF | Фториды |
| Соляная (хлороводородная) | HCl | Хлориды |
| Хлористая | HСlO2 | Хлориты |
| Хлорная | HClO4 | Перхлораты |
| Хлорноватая | HСlO3 | Хлораты |
| Хлорноватистая | HClO | Гипохлориты |
Таблица А6 – Кислоты серы
| Название | Формула | Название солей |
| Дитионовая | Н2S2O6 | Дитионаты |
| Пероксосерная (к-та Каро) | Н2SO5 | Пероксосульфаты (персульфаты) |
| Пероксодисерная (надсерная) | Н2S2O8 | Пероксодисульфаты (персульфаты) |
| Пиросерная (дисерная) | Н2S2O7 | Дисульфаты (пиросульфаты) |
| Серная | H2SO4 | Сульфаты |
| Сернистая | H2SO3 | Сульфиты |
| Сероводородная | H2S | Сульфиды |
| Тиосерная (серноватистая) | H2S2O3 | Тиосульфаты (гипосульфиты) |
| Тритионовая | Н2S3O6 | Тритионаты |
| Тетратионовая | Н2S2O6 | Тетратионаты |
Таблица А7 – Термодинамические константы веществ
| Вещество | D G ° 298 , кДж/моль | D H ° 298 , кДж/моль | S ° 298 , Дж/(моль × К) | D H ° 298 сгор , кДж/моль |
| Ag(к) | 0 | 0 | 42,69 | -30,56 |
| Ag2O(к) | -10,82 | -30,56 | 121,81 | |
| AgCl(к) | -109,7 | -127,07 | 96,07 | |
| AgBr(к) | -94,9 | -99,16 | 107,1 | |
| AgI(к) | -66,3 | -64,2 | 144,2 | |
| AgNO3(к) | -33 | -124 | 141 | |
| Ag2S(к) | -41 | -33 | 144 | |
| Ag2SO4(к) | -618 | -715 | 200 | |
| Al(к) | 0 | 0 | 28,31 | -1674 |
| Al2O3(к) | -1580 | -1674 | 50,94 | |
| Al(OH)3(к) | -1139,7 | -1605,5 | 85,35 | |
| AlCl3(к) | -629 | -704 | 111 | |
| Al2S3(к) | -492 | -509 | 96 | |
| AlPO4(к) | -1618 | -1734 | 91 | |
| Al2(SO4)3(к) | -3100 | -3434,0 | 239,2 | |
| Au(к) | 0 | 0 | 48 | |
| В(к) | 0 | 0 | 6 | |
| ВCl3(г) | -389 | -404 | 290 | |
| Ва(к) | 0 | 0 | 61 | |
| BaO(к) | -528,4 | -557,9 | 70,29 | |
| Ba(OH)2(к) | -854 | -946,1 | 103,8 | |
| ВаCl2(к) | -797 | -854 | 124 | |
| BaCO3(к) | -1139 | -1202 | 112,1 | |
| BaSO4(к) | -352 | -1465 | 131,8 | |
| Br2(г) | 3,14 | 30,92 | 245,35 | |
| Br2(ж) | 0 | 0 | 152,3 | |
| С(графит) | 0 | 0 | 5,74 | -396,3 |
| С(алмаз) | 2,866 | 1,897 | 2,38 | -394,1 |
| CO(г) | -138,1 | -110,5 | 197,4 | -364,6 |
| СO2(г) | -394,4 | -396,3 | 213,6 | |
| СОCl2(г) | -205,31 | -219,5 | 283,64 | |
| CH4(г) | -50,6 | -74,85 | 186,19 | -890,31 |
Продолжение таблицы А7
| Вещество | D G ° 298 , кДж/моль | D H ° 298 , кДж/моль | S ° 298 , Дж/(моль × К) | D H ° 298 сгор , кДж/моль |
| CCl4(г) | -63,95 | -106,7 | 309,7 | -156,1 |
| C2H2(г) | 209,2 | 226,75 | 200,8 | -1299,63 |
| C2H4(г) | 68,1 | 52,28 | 219,4 | -1410,97 |
| C2H6(г) | -32,9 | -84,67 | 229,5 | -1559,88 |
| C3H8(г) | -107,15 | -104 | 269,9 | -2220,0 |
| C3H6(г) | 62,7 | 20,42 | 226,9 | -1909,6 |
| C4H10(г) | -17,15 | -124,7 | 310,0 | 2878,4 |
| C4H8(г) | 71,5 | 1,17 | 307,4 | -2542,5 |
| C6H6(ж) | 124,5 | 49,0 | 173,2 | -3267,7 |
| CH3OH(ж) | -166,23 | -238,6 | 126,8 | -726,6 |
| C2H5OH(ж) | -174,8 | -277,7 | 160,7 | -1366,9 |
| СН3СООН(ж) | -389 | -484 | 160 | |
| CS2(г) | 65,06 | 115,3 | 237,8 | -1075 |
| Ca(к) | 0 | 0 | 41,62 | -635,1 |
| СаН2(т) | -136 | -175 | 42 | |
| CaO(к) | -604,2 | -635,1 | 39,70 | |
| Ca(OH)2(к) | -896,7 | -986,2 | 76,98 | |
| СаС2(к) | -67 | -62 | 70 | |
| CaCO3(к) | -1128,8 | -1206 | 92,90 | |
| CaCl2(к) | -750,2 | -785,8 | 113,8 | |
| CaSO4(к) | -1318,3 | -1424 | 106,7 | |
| СаSiO3(к) | -1550 | -1635 | 82 | |
| Cd(к) | 0 | 0 | 51,76 | -60,9 |
| CdO(к) | -225,0 | -256,1 | 54,80 | |
| Cd(OH)2(к) | -470,5 | -553,2 | 95,40 | |
| CdCl2(к) | -342,6 | -389,0 | 115,30 | |
| Cl2(г) | 0 | 0 | 223,0 | |
| Со(к) | 0 | 0 | 30,04 | |
| Cr(к) | 0 | 0 | 23,76 | -1141 |
| Cr2O3(к) | -1058 | -1141 | 81,1 | |
| CrO3(к) | -505,8 | -594,5 | 72 | |
| СrCl3(к) | -446 | -516 | 123 | |
| Cr(OH)3(к) | -902,5 | -1033,9 | 80,30 | |
| Cu(к) | 0 | 0 | 33,30 | -165,0 |
Продолжение таблицы А7
| Вещество | D G ° 298 , кДж/моль | D H ° 298 , кДж/моль | S ° 298 , Дж/(моль × К) | D H ° 298 сгор , кДж/моль |
| CuO(к) | -127,0 | -165,0 | 43 | |
| Cu(OH)2(к) | -359,4 | -448,5 | 42,64 | 79,50 |
| СuCl2(к) | -172 | -216 | 108 | |
| CuSO4(к) | -661,9 | -771,1 | 113,3 | |
| Сu(NO3)2(к) | -117 | -310 | 192 | |
| F2(г) | 0 | 0 | 202,9 | |
| Fe(к) | 0 | 0 | 27,15 | -821,3 |
| FeO(к) | -244,3 | -263,7 | 58,79 | |
| Fe2O3(к) | -741,5 | -821,32 | 89,96 | |
| Fe3O4(к) | -1015 | -824 | 146 | |
| Fe(OH)2(к) | -483,5 | -568,0 | 79,5 | |
| Fe(OH)3(к) | -699,6 | -824,2 | 96,2 | |
| FeCl2(к) | -303 | -342 | 118 | |
| FeCl3(к) | -332 | -397 | 142 | |
| FeS(к) | -101 | -101 | 60 | |
| FeS2(к) | -163 | -174 | 53 | |
| FeSO4(к) | -820 | -928 | 108 | |
| Н(г) | 203 | 218 | 115 | |
| H2(г) | 0 | 0 | 130,6 | -241,84 |
| H2O(к) | -291,85 | 44,1 | ||
| H2O(ж) | -237,2 | -285,84 | 70,1 | |
| H2O(г) | -228,4 | -241,84 | 188,8 | |
| H2O2(ж) | -120 | -187 | 110 | |
| H2S(г) | -33,3 | -20,15 | 205,64 | |
| HF(г) | -296,6 | -270,7 | 173,5 | |
| HCl(г) | -95,27 | -92,30 | 186,7 | |
| HBr(г) | -53,5 | -35,98 | 198,5 | |
| HI(г) | 1,3 | 25,4 | 206,3 | |
| HCN(г) | 126 | 110 | 113 | |
| HNO3(ж) | -110,4 | -173,2 | 156,16 | |
| H3PO4(к) | -1119 | -1283,6 | 176,15 | |
| H2SO4(ж) | -690,3 | -805,0 | 156,9 | |
| Hg(ж) Hg(г) | 0 31 | 0 61 | 76 175 | |
Продолжение таблицы А7
| Вещество | D G ° 298 , кДж/моль | D Н ° 298 , кДж/моль | S ° 298 , Дж/(моль × К) | D H ° 298 сгор , кДж/моль |
| HgO(к) | -58 | -90 | 70 | |
| I2(г) | 19,37 | 62,24 | 260,6 | |
| I2(к) | 0 | 0 | 116,7 | |
| К(к) | 0 | 0 | 65 | |
| KBr(к) | -380 | -393 | 96 | |
| KI(к) | -325 | -331 | 104 | |
| KOH(к) | -379 | -425,9 | 59,41 | |
| K2Cr2O7(к) | -1888 | -2068 | 291 | |
| KMnO4(к) | -729 | -829 | 172 | |
| LiOH(к) | -443,9 | -487,8 | 42,70 | |
| Mg(к) | 0 | 0 | 32,55 | -601,2 |
| MgO(к) | -569,4 | -601,2 | 26,94 | |
| Mg(OH)2(к) | -833,8 | -924,7 | 63,14 | |
| MgCO3(к) | -1029 | -1096 | 65,69 | |
| MgSO4(к) | -1173,7 | -1278 | 91,63 | |
| Mn(к) | 0 | 0 | 32,01 | |
| MnO2(к) | -466,1 | -519,4 | 53,14 | |
| Mn(OH)2(к) | -610,4 | -693,7 | 88,28 | |
| MnCl2(к) | -441,4 | -468,6 | 117,15 | |
| NH3(г) | -16,7 | -46,9 | 192,5 | |
| N2H4(ж) | 149,2 | 50,4 | 121,3 | |
| NH4OH(р) | -254,2 | -361,2 | 165,4 | |
| NH4Cl(к) | -203,9 | -315,4 | 94,56 | |
| (NH4)2SO4(к) | -900,3 | -1179,3 | 220,3 | |
| NO(г) | 86,7 | 90,37 | 210,6 | |
| NO2(г) | 51,8 | 33,50 | 240,45 | |
| N2O4(г) | 98,28 | 9,66 | 304,3 | |
| NaF(к) | -543,5 | -570,3 | 51,3 | |
| NaCl(к) | -384,9 | -410,9 | 72,8 | |
| NaBr(к) | -347,7 | -359,8 | 83,7 | |
| NaI(к) | -284,5 | -287,9 | 91,2 | |
| NaOH(к) | -381,1 | -427,8 | 64,18 | |
| Na2SO4(к) | -1267 | -1384 | 149,4 | |
| Na2CO3(к) | -1048 | -1129 | 136,0 |
Продолжение таблицы А7
| Вещество | D G ° 298 , кДж/моль | D H ° 298 , кДж/моль | S ° 298 , Дж/(моль × К) | D H ° 298 сгор , кДж/моль |
| Ni(к) | 0 | 0 | 29,86 | |
| NiO(к) | -216,5 | -239,5 | 38,0 | |
| Ni(OH)2(к) | -453,1 | -538 | 79,5 | |
| O2(г) | 0 | 0 | 205,0 | |
| O3(г) | 163,4 | 142,3 | 238,8 | |
| Р(к) | 0 | 0 | 41,1 | |
| РCl3(г) | -286,3 | -306,3 | 311,71 | |
| РCl5(г) | -545,2 | -592 | 324,6 | |
| Pb(к) | 0 | 0 | 64,9 | |
| PbBr2(к) | -260,4 | -277,0 | 161,4 | |
| PbCl2(к) | -314,0 | -359,1 | 136,4 | |
| PbI2(к) | -173,8 | -175,1 | 176,4 | |
| PbS(к) | -92,7 | -94,8 | 91,2 | |
| PbSO4(к) | -811,2 | -918,1 | 147,28 | |
| PbO(к) | -188,5 | -217,8 | 69,45 | |
| PbO2(к) | -219,0 | -276,6 | 76,44 | |
| S(к) | 0 | 0 | 31,88 | |
| SO2(г) | -300,4 | -296,9 | 248,1 | |
| SO3(г) | -370,4 | -395,2 | 256,23 | |
| SiO2(a-кварц) | -847,2 | -853,3 | 42,09 | |
| Zn(к) | 0 | 0 | 41,59 | |
| ZnO(к) | -318,2 | -349,0 | 43,5 | |
| Zn(OH)2(к) | -554,4 | -642,2 | 84,9 | |
| ZnS(к) | -239,8 | -201 | 57,7 | |
| ZnSO4(к) | -870,7 | -978,2 | 124,6 |
Таблица А8 – Коэффициенты активности ионов в водных растворах при 298 К
| Ионы | Ионная сила раствора, I | ||||||
| 0,001 | 0,005 | 0,01 | 0,02 | 0,05 | 0,1 | 0,5 | |
| Однозарядные | 0,98 | 0,95 | 0,92 | 0,89 | 0,85 | 0,8 | 0,84 |
| Двухзарядные | 0,77 | 0,80 | 0,58 | 0,50 | 0,40 | 0,3 | 0,5 |
| Трехзарядные | 0,73 | 0,62 | 0,48 | 0,37 | 0,28 | 0,21 | 0,21 |
Таблица А 9 – Константы диссоциации некоторых слабых электролитов при 25°C
| Вещество | Кдисс. | Вещество | Кдисс. |
| HCOOH | K = 1,77×10-4 | НBrO | K = 2,2×10-9 |
| CH3COOH | K = 1,75×10-5 | HIO | K = 2,3×10-11 |
| HCN | K = 7,9×10-10 | HClO | K = 2,95×10-8 |
| H2CO3 | K1 = 4,45×10-7 | HAlO2 | K = 6×10-13 |
| K2 = 4,8×10-11 | H2O | K = 1,8×10-16 | |
| HF | K = 6,61×10-4 | NH4OH | K = 1,79×10-5 |
| HNO2* | K = 4×10-4 | Al(OH)3 | K3 = 1,38×10-9 |
| H2SO3 | K1 = 1,7×10-2 | Zn(OH)2 | K1 = 4,4×10-5 |
| K2 = 6,3×10-8 | K2 = 1,5×10-9 | ||
| H2S | K1 = 1,1×10-7 | Cd(OH)2** | K2 = 5×10-3 |
| K2 = 1×10-14 | Fe(OH)2 | K2 = 1,3×10-4 | |
| H2SiO3 | K1 = 1,3×10-10 | Fe(OH)3 | K2 = 1,82×10-11 |
| K2 = 2×10-12 | K3 = 1,35×10-12 | ||
| H3PO4 | K1 = 7,5×10-3 | Cu(OH)2 | K2 = 3,4×10-7 |
| K2 = 6,31×10-8 | Ni(OH)2 | K2 = 2,5×10-5 | |
| K3 = 1,3×10-12 | Cr(OH)3 | K3 = 1×10-10 | |
| H3BO4 | K1 = 5,8×10-10 | AgOH | K = 1,1×10-4 |
| K2 = 1,8×10-13 | Pb(OH)2 | K1 = 9,6×10-4 | |
| K3 = 1,6×10-14 | K2 = 3×10-8 | ||
| Примечание. * Кд определены при 18°С. ** Кд определены при 30°С. | |||
Таблица А10 – Растворимость кислот, оснований и солей в воде
| OH - | Cl - | I - | Br - | F - | SO 4 2 - | SO 3 2 - | S 2 - | NO 3 - | CO 3 2 - | SiO 3 2 - | PO 4 3 - | ||
| H+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | H+ | |
| NH4+ | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | - | NH4+ |
| K + | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | K+ |
| Na + | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Na+ |
| Li+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | М | М | Н | Li + |
| Mg 2+ | Н | Р | Р | Р | М | Р | Н | - | Р | Н | Н | М | Mg 2+ |
| Ca 2+ | М | Р | Р | Р | Р | М | Н | М | Р | Н | Н | Н | Ca2+ |
| Sr2+ | M | Р | Р | Р | М | Н | Н | - | Р | Н | Н | Н | Sr2+ |
| Ba2+ | М | Р | Р | Р | Р | Н | Н | М | Р | Н | Н | Н | Ba2+ |
| Al 3+ | Н | Р | Р | - | Р | Р | - | - | Р | - | Н | Н | Al3+ |
| Ag + | - | Н | Н | Н | Р | М | М | Н | Р | Н | - | Н | Ag+ |
| Cu2+ | Н | Р | - | Р | Р | Р | Н | Н | Р | - | - | Н | Cu2+ |
| Hg2+ | - | Р | Н | - | - | - | Н | Н | Р | - | - | - | Hg 2+ |
| Zn 2+ | Н | Р | Р | Р | - | Р | Н | Н | Р | Н | Н | Н | Zn2+ |
| Pb2+ | Н | М | Н | М | М | Н | Н | Н | Р | Н | Н | Н | Pb2+ |
| Fe 2+ | Н | Р | Р | Р | М | Р | Н | Н | Р | Н | Н | Н | Fe2+ |
| Fe 3+ | Н | Р | - | Р | Р | Р | - | Н | Р | - | Н | Н | Fe3+ |
| Ni 2+ | Н | Р | Р | Р | Р | Р | - | Н | Р | - | - | Н | Ni2+ |
| Mn 2+ | Н | Р | Р | Р | - | Р | Н | Н | Р | Н | Н | Н | Mn2+ |
| Cr3+ | Н | Р | М | Р | М | Р | - | - | Р | - | - | Н | Cr3+ |
| OH - | Cl - | I - | Br - | F - | SO42 - | SO32 - | S2 - | NO3 - | CO32 - | SiO32 - | PO43 - |
Примечание. Р – хорошо растворимо (> 0,1 моль/л).
М – малорастворимо (0,1- 0,01 моль/л).
Н – практически нерастворимо (< 0,001 моль/л).
- - полностью разлагается водой или не существует.
Таблица А11 – Произведение растворимости при 20°С
| Вещество | ПР | Вещество | ПР |
| Al(OH)3 | 1,9×10-33 | Fe(OH)2* | 1,65×10-15 |
| AlPO4 | 5,75×10-19 | FePO4 | 1,3×10-22 |
| AgCl | 1,6×10-10 | FeS | 3,7×10-19 |
| AgI | 1,5×10-16 | Fe2S3 | 1,0×10-88 |
| AgBr | 3,4×10-13 | HgS | 4,0×10-53 |
| Ag2C2O4 | 1,1×10-11 | Hg2Cl2* | 2,0×10-18 |
| Ag2CO3 | 6,2×10-12 | H2SiO3* | 1,0×10-10 |
| Ag2CrO4* | 4,05×10-12 | Mg(OH)2 | 5,0×10-12 |
| Ag2Cr2O7 | 2,0×10-7 | MgS* | 2,0×10-15 |
| Ag2SO4 * | 7,7×10-5 | Mn(OH)2* | 4×10-14 |
| Ag2S * | 1,6×10-49 | MnS | 1,4×10-15 |
| AgCN* | 2,0·10-12 | MnCO3 | 1,8×10-11 |
| AgCNS* | 1,0×10-12 | Ni(OH)2* | 1,6×10-14 |
| Ba(OH)2 | 5,0×10-3 | NiS | 1,1×10-27 |
| BaCO3 | 8,0×10-9 | PbI2 | 8,7×10-9 |
| BaSO4 | 1,1×10-10 | PbBr2 | 7,9×10-5 |
| BaCrO4 | 2,3×10-10 | PbCl2 | 1,7×10-5 |
| Ca(OH)2 | 5,5×10-6 | PbCrO4 | 1,8×10-14 |
| CaCO3 | 4,8×10-9 | PbS | 1,1×10-29 |
| CaC2O4 | 2,6×10-9 | PbSO4 | 2,3×10-8 |
| Ca3(PO4)2 | 3,5×10-33 | Pb(OH)2* | 1,0×10-15 |
| CaCrO4 | 7,1×10-4 | PbCO3* | 1,5×10-13 |
| CaSO4 | 6,0×10-5 | Sb2S3* | 1,0×10-30 |
| CdS | 3,6×10-29 | Sb(OH)3 | 4,0×10-42 |
| Со(ОН)2* | 2,0×10-16 | SnS | 1,0×10-28 |
| CoCO3 | 1,05×10-10 | Sr(OH)2 | 3,2×10-4 |
| Cr(OH)3 | 5,4×10-31 | SrSO4* | 2,8×10-7 |
| CuS | 4,0×10-38 | SrCO3* | 1×10-9 |
| Cu2S* | 2,5×10-50 | ZnS | 1,2×10-23 |
| Cu(OH)2 | 5,0×10-19 | Zn(OH)2 | 1,0×10-17 |
| CuCO3 | 1,5×10-10 | ZnCO3 | 1,45×10-11 |
| Fe(OH)3 | 3,5×10-38 | Zn2(PO4)2 | 9,1×10-33 |
|
Примечание. Знаком «*» обозначены ПР, определенные при 25°С. | |||
Таблица А12 – Термодинамические константы некоторых ионов в водных растворах
| Ион | D G ° 298 , кДж/моль | D H ° 298 , кДж/моль | S ° 298 , Дж/(моль × К) |
| Ag+ | 77,11 | 105,90 | 73,93 |
| Al3+ | -481,20 | -524,70 | -313,40 |
| Ba2+ | -560,70 | -538,36 | 13,00 |
| Ca2+ | -553,04 | -542,96 | -55,20 |
| Cd2+ | -77,74 | -72,38 | -61,10 |
| Cl- | -131,17 | -167,46 | 55,10 |
| Co2+ | -51,50 | -67,40 | -111,70 |
| Cs+ | -282,04 | -247,70 | 133,10 |
| Cu+ | 50,20 | 71,50 | 39,30 |
| Cu2+ | 64,98 | 64,39 | -98,70 |
| F- | -276,48 | -329,11 | -9,60 |
| Fe2+ | -84,94 | -87,90 | -113,40 |
| Fe3+ | -10,54 | -47,70 | -293,30 |
| H+ | 0 | 0 | 0 |
| Hg2+ | 164,77 | 174,01 | -22,60 |
| I- | -51,67 | -55,94 | 109,37 |
| K+ | -282,28 | -251,21 | 102,50 |
| Li+ | -293,80 | -278,46 | 14,20 |
| Mg2+ | -456,01 | -461,96 | -118,00 |
| Mn2+ | -223,40 | -218,80 | -79,90 |
| Na+ | -261,87 | -239,66 | 60,20 |
| Ni2+ | -64,40 | -64,00 | -123,00 |
| OH- | -157,30 | -229,94 | -10,54 |
| Pb2+ | -24,30 | 1,63 | 21,30 |
| Rb+ | -282,21 | -246,40 | 124,30 |
| SO42- | -742,99 | -907,51 | 17,20 |
| Sr2+ | -557,30 | -545,51 | -26,40 |
| Zn2+ | -147,21 | -152,42 | -106,48 |
Таблица А 13 – Уравнение Нернста
| Условия | Вид уравнения |
| Общее уравнение | 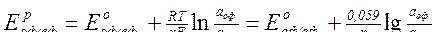
|
| Для металлических электродов | 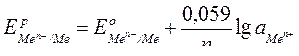
|
Для водородного электрода в н.у.
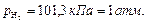
| 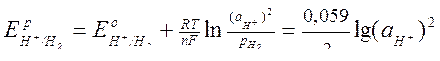 (сокращенная форма:
(сокращенная форма: 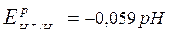 ) )
|
Для кислородного электрода в н.у.

| 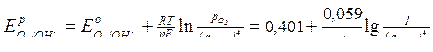 (сокращенная форма: (сокращенная форма: 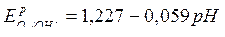 ) )
|
Для водородного электрода в коррозионном процессе

| 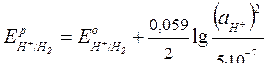 (сокращенная форма:
(сокращенная форма:  ) )
|
Для кислородного электрода в коррозионном процессе

| 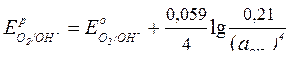 (сокращенная форма:
(сокращенная форма: 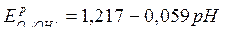 ) )
|
Таблица А 14 – Стандартные потенциалы металлических и газовых электродов
| Электрод | Электродная реакция | Е°, В |
| Li+/Li | Li+ + ē = Li | -3,045 |
| Rb+/Rb | Rb+ + ē = Rb | -2,925 |
| K+/K | K+ + ē = K | -2,925 |
| Cs+/Cs | Cs+ + ē = Cs | -2,923 |
| Ba2+/Ba | Ba2+ + 2ē = Ba | -2,906 |
| Ca2+/Ca | Ca2+ + 2ē = Ca | -2,866 |
| Na+/Na | Na+ + ē = Na | -2,714 |
| La3+/La | La3+ + 3ē = La | -2,522 |
| Mg2+/Mg | Mg2+ + 2ē = Mg | -2,363 |
| Be2+/Be | Be2+ + 2ē = Be | -1,847 |
| Al3+/Al | Al3+ + 3ē = Al | -1,662 |
| Ti2+/Ti | Ti2+ + 2ē = Ti | -1,628 |
| V2+/V | V2+ + 2ē = V | -1,186 |
| Mn2+/Mn | Mn2+ + 2ē = Mn | -1,180 |
| Cr2+/Cr | Cr2+ + 2ē = Cr | -0,913 |
| Zn2+/Zn | Zn2+ + 2ē = Zn | -0,763 |
| Cr3+/Cr | Cr3+ + 3ē = Cr | -0,744 |
| Fe2+/Fe | Fe2+ + 2ē = Fe | -0,440 |
| Cd2+/Cd | Cd2+ + 2ē = Cd | -0,403 |
| Co2+/Co | Co2+ + 2ē = Co | -0,277 |
| Ni2+/Ni | Ni2+ + 2ē = Ni | -0,250 |
| Sn2+/Sn | Sn2+ + 2ē = Sn | -0,136 |
| Pb2+/Pb | Pb2 + + 2ē = Pb | -0,126 |
| Fe3+/Fe | Fe3+ + 3ē = Fe | -0,036 |
| H+/H2 | 2H+ +2ē = H2 | +0,000 |
| Cu2+/Cu | Cu2+ + 2ē = Cu | +0,337 |
| O2/OH- | O2 + 2H2O + 4ē = 4OH- | +0,401 |
| Cu+/Cu | Cu+ + ē = Cu | +0,521 |
| Ag+/Ag | Ag+ + ē = Ag | +0,799 |
| Hg2+/Hg | Hg2+ + 2ē = Hg | +0,854 |
| Pd2+/Pd | Pd2+ + 2ē = Pd | +0,987 |
| Pt2+/Pt | Pt2+ + 2ē = Pt | +1,190 |
| Cl2/Cl- | 1/2Cl2 + ē = Cl- | +1,359 |
| Au3+/Au | Au3+ + 3ē = Au | +1,498 |
| Au+/Au | Au+ + ē = Au | +1,691 |
| F2/F- | F2 + 2ē = 2F- | +2,866 |
Таблица А 15 – Зависимость потенциалов водородного и кислородного электродов от рН при н.у. и в коррозионном процессе
| рН | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | |||||||||||||||||||||
| 1,227 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| 1,2 | |||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||||||||||||||||||
| 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| 1 | |||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||||||||||||||||||
| 0,8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| 0,8 | |||||||||||||||||||||
|
|
|
|
|
| р(О2) = 0,21 атм. |
|
|
|
|
| ||||||||||||||||||||||||||
| 0,6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| 0,6 | |||||||||||||||||||||
|
|
|
| р(О2) = 1 атм. |
|
|
|
|
|
|
| ||||||||||||||||||||||||||
| 0,4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| 0,4 | |||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||||||||||||||||||
|
0,2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| 0,2 | |||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||||||||||||||||||
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| 0 | |||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||||||||||||||||||
| -0,2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| -0,2 | |||||||||||||||||||||
|
|
|
|
|
| р(Н2) = 1 атм. |
|
|
|
|
| ||||||||||||||||||||||||||
| -0,4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| -0,4 | |||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||||||||||||||||||
| -0,6 |
| р(Н2) = 5×10-7 атм. |
|
|
|
|
|
|
|
| -0,6 | |||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||||||||||||||||||
| -0,8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| -0,8 | |||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||||||||||||||||||
| -1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| -1 | |||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||||||||||||||||||
| рН | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | |||||||||||||||||||||
Приложение Б
Б1. ОСНОВНЫЕ КЛАССЫ
Дата: 2018-11-18, просмотров: 889.
