Окислительно-восстановительный процесс (реакция) (ОВР) – процесс, сопровождающийся изменением степеней окисления участвующих в нем частиц в результате их окисления или восстановления.
С точки зрения изменения степени окисления химические реакции могут протекать двояко: либо степень окисления остается постоянной (обменные реакции), либо меняет свою величину (ОВР). Например:
+1 -1 +1 -2 +1 +1 -1 +1 -2
HCl +NaOH ® NaCl + H2O -
без изменения степени окисления;
0 0 +3 -1
2Al + 3Br2 ® 2AlBr3 –
Al и Br поменяли в результате реакции свои степени окисления
Степень окисления (с.о.) атома в соединении – это его условный заряд, возникающий в результате смещения общих электронных пар, если предположить, что все связи ионные и общие электронные пары полностью принадлежат более электроотрицательному атому. С.о. обозначается над атомом цифрой с соответствующим знаком. Эта величина может быть положительной, отрицательной, нулевой, дробной.
Степень окисления – еще одна характеристика атома наряду с электроотрицательностью, валентностью, сродством к электрону и т. п.
При определении степеней окисления следует помнить :
1) алгебраическая сумма степеней окисления атомов в молекуле равна нулю, в сложном ионе – заряду этого иона;
2) степень окисления элементов в простых веществах равна 0;
3) степень окисления водорода в соединениях с неметаллами равна +1, в соединениях с металлами (гидридах) - –1, например Са+2Н2-;
4) степень окисления кислорода во всех соединениях, кроме соединений со фтором, отрицательна и равна -2 (но в соединениях, содержащих пероксидную группу -О-О- степень окисления кислорода равна -1);
5) металлы в соединениях проявляют только положительные степени окисления; степени окисления металлов 1, 2 и 3 групп в соединениях равны номеру группы (исключения: Сu (+2 и +1), Au (+3 и +1), Hg (+2 и +1)); металлы побочных подгрупп имеют разнообразные положительные степени окисления, но не больше +8;
6) максимальная степень окисления обычно равна № группы, в которой расположен элемент, минимальная - № группы минус 8 (исключениями являются некоторые элементы 2 периода (F (-1), О (-2, -1, +2), N (-3, от +1 до +5), и ряд d-элементов (Fe, Cu, Ni, Au и т.д.);
7) элементы главных подгрупп четных групп обычно проявляют четные степени окисления, нечетных групп – нечетные степени окисления;
8) степень окисления и валентность элемента не всегда совпадают (О2 - валентность II, с.о. 0, Hg2Cl2 - валентность ртути II, с.о. +1, HNO3 - валентность азота IV, с.о. +5, C2Н2 - валентность углерода IV, с.о. -1 и т.п.).
Электронное уравнение – сокращенное уравнение, отражающее отдельно процесс окисления или восстановления, например:
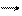 Cа° - 2ē ® Са2+ - уравнение окисления
Cа° - 2ē ® Са2+ - уравнение окисления
восстановитель
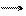 N+5 + 8ē ® N-3 - уравнение восстановления
N+5 + 8ē ® N-3 - уравнение восстановления
окислитель
Окисление – процесс повышения степени окисления реагирующей частицы в результате отдачи ею электронов, например:
C º – 4ē ® C+4; Fe +2 – 1ē ® Fe+3; N - 3 - 8 ē ® N+5 и т. п.
Частица, отдающая электроны, называется восстановителем (в данных примерах подчеркнут). Типичные восстановители – это металлы (Zn, Fe, Al и т. д.) водород, элементы в низших степенях окисления.
Восстановление – процесс понижения степени окисления реагирующей частицы в результате присоединения к ней электронов, например:
Cl +5 + 6 ē ® Cl-; Fe +2 + 2ē ® Feº и т. д.
Частица, принимающая электроны, называется окислителем (в данных примерах подчеркнут). Типичные окислители – это галогены, бихромат калия, хлорная вода, азотная кислота и ее соли, бертолетова соль, царская водка, перманганат калия и другие вещества, в состав которых входят атомы в высших степенях окисления.

1.2. Образцы решения задач
Задача 1 . Пользуясь методом электронного баланса, подберите коэффициенты в уравнении реакции:
FeSO4 + K2Cr2O7 + H2SO4 ® Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
Укажите окислитель и восстановитель.
Решение : Определим степени окисления всех элементов в соединениях.
+2 +6 –2 +1 +6 -2 +1 +6 –2 +3 +6 -2 +3 +6 -2 +1 +6 -2 +1 -2
FeSO4 + K2Cr2O7 + H2SO4 ® Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
Степени окисления меняют железо и хром.
Запишем уравнения процессов окисления и восстановления:
Окисление: Fe+2 – 1ē® Fe+3
Восстановление: 2Сr+6 + 6ē ® 2Сr+3
Окислителем является Сr +6 в дихромате калия K2Cr2O7,
восстановителем – Fe +2 в сульфате железа (II) FeSO4.
Число отданных электронов должно быть равно числу принятых.
Исходя из этого, составим схему электронного баланса и определим основные коэффициенты:
| 2 | 6 | 3 |
| 6 | 1 |
2Fe+2 – 2·1ē ® 2Fe+3 (основные
2Сr+6 + 6ē ® 2Сr+3 коэффициенты)
Подберем остальные коэффициенты в уравнении реакции:
6FeSO4 + K2Cr2O7 + 7H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
Задача 2 . Какие свойства (окислительные, восстановительные или двойственные) может проявлять в окислительно-восстановительных реакциях сера в следующих соединениях:
а) серная кислота Н2SO4, б) сероводород H2S, в) сернистый газ SO2.
Решение: а) Степень окисления серы в молекуле серной кислоты равна +6. Условно можно так записать электронно-графическую формулу серы в данной степени окисления:
| 3s | 3p | |||
S+6 …
Все валентные электроны серы участвуют в образовании связи с соседними атомами кислорода, причем электронная плотность смещена в сторону последнего. В данной степени окисления сера может только принимать электроны, заполняя свой пустой внешний уровень, т.е. проявляет только свойства окислителя. Действительно, сера находится в максимальной степени окисления (которая, как правило, равна номеру группы), а элементы в высших степенях окисления могут проявлять только окислительные свойства.
б) Степень окисления серы в сероводороде равна –2.
Условная электронно-графическая формула:
| 3s | 3p | |||
| ¯ | ¯ | ¯ | ¯ | |
S–2 …
Внешний уровень заполнен полностью, поэтому сера в степени окисления –2 не может больше принимать электроны, т.е. проявлять окислительные свойства. Следовательно, она может быть только восстановителем, как и все элементы, находящиеся в низшей степени окисления (которая, как правило, равна № группы минус 8).
в) Степень окисления серы в сернистом газе равна +4. Она является промежуточной между высшей (+6) и низшей (−2), следовательно, сера в данной степени окисления может как принимать, так и отдавать электроны, т.е. может проявлять свойства и окислителя, и восстановителя в зависимости от партнера по химической реакции.
Задание 10 по теме «Электрохимические процессы»
Методические указания к выполнению индивидуального задания
1. Проставьте степени окисления элементов в исходных веществах и продуктах реакции.
2. Укажите элементы, меняющие степень окисления в ходе реакции.
3. Составьте электронные уравнения реакций окисления и восстановления, укажите окислитель и восстановитель.
4. Проведите баланс электронов и найдите основные коэффициенты.
5. Проставьте найденные коэффициенты в уравнении реакции перед окислителем, восстановителем и продуктами их восстановления и окисления.
6. Исходя из баланса атомов, проставьте недостающие коэффициенты в левой и правой частях уравнения.
7. Докажите с точки зрения строения атома, какие свойства (окислительные, восстановительные или двойственные) может проявлять в реакциях указанный элемент в указанном веществе.
См. задания в таблице З10.
Таблица З10 - Задания
| № | Уравнение | Вещество | Элемент |
| 1 | 2 | 3 | 4 |
| 1 | KNO2 + KMnO4 + H2O = MnO2 + KNO3 + KOH | KMnO4 | Mn |
| 2 | Cr2O3 + Br2 + NaOH = Na2CrO4 + NaBr + H2O | Cr2O3 | Cr |
| 3 | Se + AuCl3 + H2O = Au + H2SeO3 + HCl | H2SeO3 | Se |
| 4 | K2S + KMnO4 + H2SO4 = S + MnSO4 + K2SO4 + H2O | K2S | S |
| 5 | HCl + KMnO4 = MnCl2 + Cl2 + KCl + H2O | MnCl2 | Mn |
| 6 | S + KClO3 + H2O = Cl2 + K2SO4 + H2SO4 | KClO3 | Cl |
| 7 | Na2SO3 + KIO3 + H2SO4 = I2 + Na2SO4 + K2SO4 + H2O | Na2SO3 | S |
| 8 | HI + KMnO4 + KOH = I2 + K2MnO4 + H2O | I2 | I |
Продолжение табл . З10
| 1 | 2 | 3 | 4 |
| 9 | Na2SO3 + KMnO4 + KOH = Na2SO4 + K2MnO4 + H2O | K2MnO4 | Mn |
| 10 | NO + KMnO4 + H2SO4 = MnSO4 + NO2 + K2SO4 + H2O | NO2 | N |
| 11 | NaI + NaIO3 + H2SO4 = I2 + Na2SO4 + H2O | NaIO3 | I |
| 12 | NH3 + KMnO4 + KOH = KNO3 + K2MnO4 + H2O | KNO3 | N |
| 13 | Fe(NO3)2 + MnO2 + HNO3 = Fe(NO3)3 + Mn(NO3)2 + H2O | MnO2 | Mn |
| 14 | MnSO4 + KClO3 + KOH = K2MnO4 + KCl + K2SO4 + H2O | KCl | Cl |
| 15 | KBr + KMnO4 + H2O = Br2 + MnO2 + KOH | KBr | Br |
| 16 | SO2 + HNO3 + H2O = H2SO4 + NO | NO | N |
| 17 | MnO2 + KClO3 + KOH = K2MnO4 + KCl + H2O | KOH | K |
| 18 | KBr + KMnO4 + H2SO4 = Br2 + MnSO4 + K2SO4 + H2O | MnSO4 | Mn |
| 19 | Cr2O3 + NaNO3 + KOH = К2CrO4 + NaNO2 + H2O | NaNO2 | N |
| 20 | KI + KBrO3 + HCl = I2 + KBr + KCl + H2O | H2O | O |
| 21 | H2S + Cl2 + H2O = H2SO4 + HCl | Cl2 | Cl |
| 22 | KI + KNO2 + H2SO4 = I2 + NO + K2SO4 + H2O | KNO2 | N |
| 23 | SO2 + NaIO3 + H2O = I2 + Na2SO4 + H2SO4 | NaIO3 | I |
| 24 | SnSO4 +KMnO4 +H2SO4 = Sn(SO4)2 +MnSO4 +K2SO4 +H2O | SnSO4 | Sn |
| 25 | Mg + HNO3 = Mg(NO3)2 + N2O + H2O | N2O | N |
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
Дата: 2018-11-18, просмотров: 744.