В каждых 100 г 12% раствора содержится 12 г растворенного вещества и (100 – 12) = 88 г растворителя (в данном случае – воды).
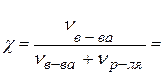
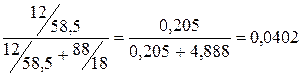 .
.
Задача 2. Выразить молярную концентрацию через массовую долю.
Решение: Записываем формулы указанных концентраций:
СМ= 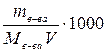 ; ω =
; ω = 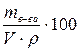 .
.
Выразим из каждой формулы значение массы вещества:
mв-ва = 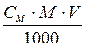 ; mв-ва =
; mв-ва = 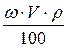 .
.  .
.
Приравняем полученные выражения, так как масса растворенного вещества одна и та же:
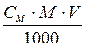 =
= 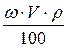 .
.
Получаем требуемое в условии выражение, сократив одинаковые величины в обеих частях равенства (объем, так как это один и тот же раствор, и число 100):
СМ = 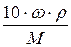 или ω =
или ω = 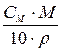 .
.
Задача 3. Сколько мл 30%-го раствора KOH плотностью 1,29 г/мл надо взять для приготовления 3,0 л 0,5 М раствора?
Решение: Для решения этой задачи используем соотношение между концентрациями, о которых речь идет в условии задачи. Исходные концентрации обозначим индексом «1», те, которые требуется приготовить – индексом «2».
1. Запишем формулы тех видов концентраций, о которых идет речь в условии:
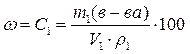 ,
, 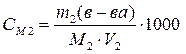 .
.
2. Выразим из каждой формулы значение для массы растворенного вещества:
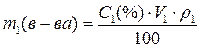 ,
, 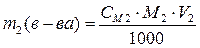 .
.
Приравняем полученные выражения для массы растворенного вещества, так как она не меняется при разбавлении:
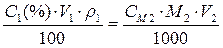 .
.
3. Определяем объем исходного раствора из полученного соотношения:
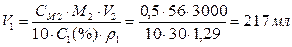 .
.
Задание 8 по теме «Растворы»
Методические указания к индивидуальному заданию
1. а) Рассчитайте массы вещества, раствора, растворителя, мольную долю и моляльную концентрацию для данного раствора указанной концентрации, плотности и объема;
б) выведите формулу, отражающую связь между заданными способами выражения концентрации.
2. Решите задачу на разбавление (концентрирование).
См. задания в таблице З8.
Таблица З8 - Задания
| № | ||
Задания
2
1
2
3
4
Продолжение табл. З8
| 1 | 2 | |
| 5 | 1 | а) ω =20% NaCl; ρ=1,086 г/cм3; V= 0,5л; б) СМ и ω |
| 2 | Сколько мл воды нужно прилить к 1200 мл 12 н раствора гидроксида аммония, чтобы приготовить 14%-ный раствор (плотность 0,946 г/мл)? | |
| 6 | 1 | а) ω =14% NaCl; ρ=1,110 г/cм3; V= 0,3л; б) Сн и ω |
| 2 | Сколько мл 10%-ного раствора гидроксида калия (ρ=1,1 г/мл) нужно для приготовления 500 мл раствора с титром 0,02852 г/мл? | |
| 7 | 1 | а) ω =12,5% HCl; ρ=1,060 г/cм3; V= 0,5л; б) СМ и Т |
| 2 | Какой концентрации получится раствор едкого натра, если к 500 мл 52%-ного раствора (плотность 1,560 г/мл) прилить 400 мл воды? | |
| 8 | 1 | а) ω =4% HNO3; ρ=1,020 г/cм3; V= 0,8л; б) СМ и CН |
| 2 | Сколько мл воды нужно прилить к 150 мл 24%-ного раствора гидроксида аммония, чтобы приготовить 5%-ный раствор (плотность 0,91 г/ cм3 и 0,97 г/cм3)? | |
| 9 | 1 | а) ω =22% NaCl; ρ=1,164 г/cм3; V= 0,4л; б) СМ и ω |
| 2 | Сколько мл воды надо прилить к 1,0 л 0,125 н раствора NаОН, чтобы приготовить 0,1%-ный раствор (плотность 1,0 г/cм3)? | |
| 10 | 1 | а) ω =20% NaOH; ρ=1,22 г/cм3; V= 0,4л; б) СН и ω |
| 2 | Сколько воды нужно прилить к 200 г 25%-ного раствора гидроксида аммония, чтобы приготовить 5%-ный раствор? | |
| 11 | 1 | а) ω =25,4% КOH; ρ=1,24 г/cм3; V= 0,8л; б) СН и ω |
| 2 | Сколько мл 10%-ного раствора гидроксида калия (ρ=1,1 г/ cм3) нужно для приготовления 600 мл раствора с титром 0,02852 г/мл. | |
| 12 | 1 | а) ω =32% CH3COOH; ρ=1,041 г/cм3; V= 0,6л; б) Т и ω |
| 2 | Сколько граммов 50%-ного раствора уксусной кислоты нужно прилить к 250 мл воды, чтобы приготовить 12%-ный раствор? | |
| 13 | 1 | а) ω =44% CH3COOH; ρ=1,053 г/cм3; V= 0,4л; б) Т и СМ |
| 2 | Сколько мл воды нужно прилить к 10,0 мл 12 н раствора соляной кислоты, чтобы приготовить 0,1 н раствор? | |
| 14 | 1 | а) ω =30,2% H2SO4; ρ=1,22 г/cм3; V= 0,5л; б) СН и ω |
| 2 | Сколько мл воды нужно прилить к 10мл 20,91% р-ра серной кислоты (ρ=1,15г/cм3), чтобы приготовить 0,1 М раствор? | |
| 15 | 1 | а) ω =16,5% HCl; ρ=1,08 г/cм3; V= 0,5л; б) СН и ω |
| 2 | Сколько мл 10%-ного раствора карбоната натрия (ρ=1,105г/cм3) нужно, чтобы приготовить 1л 2%-ного растора (ρ=1,020г/ cм3)? | |
| 16 | 1 | а) ω =24% NaCl; ρ=1,18 г/cм3; V= 0,5л; б) СН и ω |
| 2 | Сколько мл 70%-ного раствора нитрата калия (ρ=1,6 г/cм3) нужно для приготовления 0,5л 0,2н раствора? | |
| 17 | 1 | а) ω =26% NaCl; ρ=1,197 г/cм3; V= 0,4л; б) СM и ω |
| 2 | До какого объема нужно разбавить 0,5л 30,55%-ного раствора соляной кислоты (ρ=1,155 г/cм3), чтобы приготовить 12,18%-ный раствор (ρ=1,06 г/cм3)? | |
| 18 | 1 | а)ω =14,5% HCl; ρ=1,07 г/cм3; V= 0,5л; б)СM и CH |
| 2 | Сколько мл 96%-ного раствора серной кислоты (ρ=1,84 г/cм3) нужно для приготовления 1л 0,5 н раствора? | |
Продолжение табл. З8
| 1 | 2 | |
| 19 | 1 | а) ω =30,2% H2SO4; ρ=1,22 г/cм3; V= 0,6л; б) T и CH |
| 2 | Сколько мл воды надо прилить к 200 мл 68%-ного раствора азотной кислоты (ρ=1,4 г/cм3), чтобы приготовить 10%-ный раствор? | |
| 20 | 1 | а) ω =6,2% H2SO4; ρ=1,04 г/cм3; V= 0,9л; б) T и CM |
| 2 | Сколько мл 5%-ного раствора сульфата железа (II) (ρ=1,1 г/cм3) можно приготовить из 15 мл 5 М раствора? | |
| 21 | 1 | а) ω =48,4% HNO3; ρ=1,3 г/cм3; V= 0,5л; б) CH и CM |
| 2 | Какова процентная концентрация (массовая доля) раствора хлорида натрия, если к 40 г 15%-ного раствора прилили 10 г воды? | |
| 22 | 1 | а) ω =24% HNO3; ρ=1,14 г/cм3; V= 0,5л; б) ω и CM |
| 2 | До какого объема нужно разбавить 1,5 л 20%-ного раствора хлорида натрия (ρ=1,5 г/cм3), чтобы приготовить 0,2 М раствор? | |
| 23 | 1 | а) ω =16,4% NaOH3; ρ=1,18 г/cм3; V= 0,8л; б) ω и T |
| 2 | Какова массовая доля раствора, если к 200 г 50%-ного раствора прилили 300 г воды? | |
| 24 | 1 | а) ω =21,4% KOH3; ρ=1,2 г/cм3; V= 0,8л; б) CM и T |
| 2 | Сколько мл 15%-ной серной кислоты (ρ=1,105 г/cм3) нужно для приготовления 250 мл 0,15 н раствора (по реакции полной нейтрализации)? | |
| 25 | 1 | а) ω =26% NaCl; ρ=1,197 г/cм3; V= 0,4л; б) CM и ω |
| 2 | Сколько воды нужно прилить к 25 мл 2 М раствора хлорида натрия, чтобы приготовить раствор с массовой долей 2% (ρ=1,03 г/cм3)? | |
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Дата: 2018-11-18, просмотров: 800.