Коррозия металлов – процесс самопроизвольного разрушения металлов в результате их физико-химического взаимодействия с внешней средой. Коррозионный процесс сопровождается уменьшением свободной энергии Гиббса. При коррозии происходит гетерогенное окисление металла, сопровождающееся восстановлением одного или нескольких компонентов среды. Наиболее распространенные окислители – катион водорода Н+ и молекулярный кислород О2.
По механизму протекания коррозионного процесса выделяют коррозию химическую, электрохимическую и биохимическую. Химическая коррозия представляет собой обычную окислительно-восстановительную реакцию, протекающую в среде неэлектролитов и сопровождающуюся передачей электронов от металла непосредственно на частицу-окислитель. Биохимическая коррозия происходит под влиянием веществ, являющихся продуктами жизнедеятельности микроорганизмов. Электрохимическая коррозия происходит в среде электролитов и сопровождается возникновением микрогальванических коррозионных элементов и протеканием тока внутри корродирующего металла.
Деполяризация – уменьшение величины электродной поляризации при введении в электрохимическую систему какого-либо вещества (деполяризатора), способного окисляться или восстанавливаться. При коррозии с поглощением кислорода происходит кислородная деполяризация, выражающаяся уравнением:
О2 + 4ē + 2Н2О ® 4ОН– (в нейтральной и щелочной среде)
О2 + 4ē + 4Н+ ® 2Н2О (в кислой среде)
Коррозия с водородной деполяризацией протекает с выделением водорода: 2Н+ + 2ē ® Н2 (в кислой среде);
2Н2О+2ē →Н2+2ОН– (в нейтральной и щелочной среде)
Потенциалы окислителей рассчитывают по уравнению Нернста:
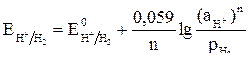 ,
, 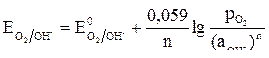

4.2. Образцы решения задач
Задача 1. Приведите обоснованную расчетом схему коррозии бронзы (сплав меди и олова) на воздухе при рН = 10.
Решение : Определим анодные и катодные участки:
Е°(Sn2+/Sn) = –0,136 В,
Е°(Cu2+/Cu) = 0,337 В;
Е°(Sn2+/Sn) < Е°(Cu2+/Cu),
следовательно, катодными участками будет медь, анодными - олово.
Прежде чем составлять схему микрогальванического коррозионного элемента, рассчитаем потенциалы окислителей и определим возможность водородной и кислородной деполяризации. Определим активности ионов Н+ и ОН- при рН = 10:
рН = –lg a(Н+); a(Н+) = 10–рН = 10–10;
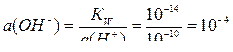 .
.
Рассчитаем потенциалы возможных окислителей (ими являются ионы водорода и молекулы кислорода):
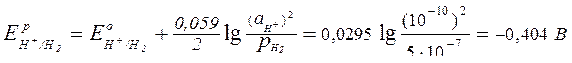 ;
;
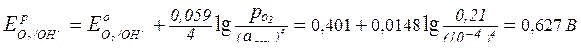 .
.
Равновесный потенциал корродирующего металла (олова) при данном значении рН больше равновесного потенциала водородного электрода, но меньше равновесного потенциала кислородного электрода, следовательно, окислителем в данном случае может быть только молекулярный кислород, т.е. будет протекать коррозия с кислородной деполяризацией.
Составим схему микрогальванического коррозионного элемента и запишем уравнения процессов, протекающих на анодных и катодных участках:
 А К
А К
(-) Sn/Sn2+ [Cu] (+)
Ann– O2/ОН–
А(-): Sn° – 2ē ® Sn2+ (разрушение металла)
К(+): О2 + 4ē + 2Н2О ® 4ОН– (восстановление кислорода)
Задача 2 . Какой металл можно использовать в качестве катодного покрытия изделия из цинка? Опишите, как будет происходить процесс коррозии в кислой среде (рН = 2) на воздухе при нарушения целостности этого покрытия.
Решение : В качестве катодного покрытия для цинкового изделия можно использовать металлы, потенциал которых более положителен, чем потенциал цинка:
Е°(Меn+/Ме) > -0,763 В.
Этому условию удовлетворяет, например, свинец:
Е°(Pb2+/Pb) = -0,126 В > Е°(Zn2+/Zn).
Свинцовое покрытие будет являться катодом, цинковое изделие – анодом.
Рассчитаем потенциалы окислителей при данном значении рН:
рН = –lg a(Н+); a(Н+) = 10–рН = 10–2 ;
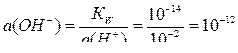 ;
;
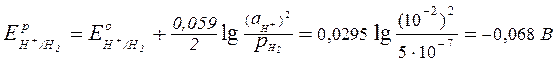 ;
;
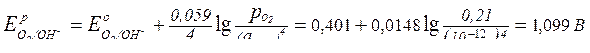 .
.
Так как при данных условиях
Еº(Zn2+/Zn) < Е(H+/H2) < Е(O2/ОН–),
то возможна коррозия с водородной и кислородной деполяризацией, причем разрушаться будет само изделие.
Составим схему микрогальванического коррозионного элемента:


 А К
А К



 (-) Zn/Zn2+ [Pb] (+)
(-) Zn/Zn2+ [Pb] (+)
 Ann– Н+/Н2 O2/ОН–
Ann– Н+/Н2 O2/ОН–
А(-): Zn° – 2ē ® Zn2+
К(+): 2Н+ + 2ē ® Н2 (водородная деполяризация)
О2 + 4ē + 4Н+ ® 2Н2О (кислородная деполяризация в кислой среде)
Задание 13 по теме «Электрохимические процессы»
Дата: 2018-11-18, просмотров: 693.