Химическая кинетика – раздел химии, изучающий скорость химических реакций, механизм и факторы, от которых зависит скорость.
Скорость реакции – изменение количества вещества в единицу времени. Для гомогенных реакций определяется формулой:
 , [моль/л·с],
, [моль/л·с],
где V - объем реакционной системы, n - количество вещества, t - время.
Скорость не может быть отрицательной величиной. Поэтому знак минус ставится перед выражением, если учитывается изменение концентрации реагентов, так как в ходе реакции их количество уменьшается, и Dν принимает отрицательное значение.
Для гетерогенных реакций, протекающих на поверхности твердого тела, скорость рассчитывается как изменение количества вещества на единице поверхности в единицу времени:
 , [моль/м2·с].
, [моль/м2·с].
В целом скорость химического взаимодействия зависит от природы реагирующих веществ, их концентрации, что отражено в законе действующих масс, наличия катализатора. Влияние температуры описывается правилом Вант-Гоффа и уравнением Аррениуса. Скорость гетерогенных взаимодействий с участием веществ в твердой фазе прямо пропорциональна площади реакционной поверхности. Скорость превращения газов зависит от величины давления в системе: при повышении давления скорость возрастает. Так как давление обратно пропорционально объему системы, то увеличение объема снижает скорость реакции газообразных веществ.
Закон действующих масс (закон действия масс): при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Авторы закона − Гульдберг и Вааге (1864−1867 гг.). Для реакции аА + bB ® cC + dD выражение закона действия масс (кинетическое уравнение) имеет вид:
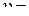 k
k 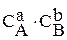 ,
,
где k – константа скорости реакции, CА и CB – концентрации реагентов, a и b – частные порядки реакции по веществам А и B (в простейших случаях равны стехиометрическим коэффициентам).
Правило Вант-Гоффа описывает влияние температуры на скорость реакции: при повышении температуры на каждые десять градусов скорость химической реакции возрастает в 2÷4 раза. Математически:
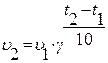 ,
,
где υ2 – скорость при температуре t2, υ1 – скорость при температуре t1, γ – температурный коэффициент.

Образцы решения задач
Задача 1 . Начальные концентрации веществ А и В в реакции 2А(г) + В(г) = 2С(г) равны соответственно 0,6 моль/л и 0,4 моль/л. Определите скорость реакции в начальный момент времени и в момент времени, когда концентрация вещества А изменилась на 0,2 моль/л. k = 0,2.
Решение: Запишем выражение закона действия масс: u = kСА2·СВ
Рассчитаем начальную скорость реакции:
uнач. = 0,2 × (0,6 моль/л)2 × 0,4 моль/л = 0,029 моль/л×с.
Чтобы найти скорость реакции в какой-то момент времени (uкон.), нужно предварительно рассчитать концентрации исходных веществ к этому моменту времени Скон.А и Скон.В. Следует учитывать, что концентрации исходных веществ в ходе реакции уменьшаются, а концентрации продуктов – увеличиваются, т.е. для исходных веществ Скон. = Снач. - DС.
Скон.А = Снач.А – DСА = 0,6 моль/л – 0,2 моль/л = 0,4 моль/л.
Чтобы найти изменение концентрации В, нужно учитывать, что вещества вступают в реакции в таких же количественных соотношениях, что и коэффициенты в уравнениях реакций, то есть изменения концентраций веществ пропорциональны коэффициентам.
По уравнению реакции 2 моль А реагируют с 1 моль В, тогда
0,2 моль/л А –"– х моль/л В,
отсюда х = DСВ = 0,2/2 = 0,1 моль/л.
Скон.В = Снач.В – DСВ = 0,4 моль/л – 0,1 моль/л = 0,3 моль/л.
Рассчитаем скорость реакции в заданный момент времени:
uкон. = k С2кон.А × Скон.В = 0,2×(0,4 моль/л)2×0,3 моль/л = 0,0096 моль/л×с.
Задачи такого типа можно решать с помощью таблицы:
| Ур‑е реакции | 2А + В = 2С | ||
| Сн, моль/л | 0,6 | 0,4 | 0 |
| DС, моль/л | 0,2 | ||
| Ск, моль/л | |||
Сначала в таблицу вносят данные задачи и начальные концентрации продуктов реакции, по умолчанию равные нулю:
| Ур‑е реакции | 2А + В = 2С | ||
| Сн, моль/л | 0,6 | 0,4 | 0 |
| DС, моль/л | 0,2 | 0,1 | - |
| Ск, моль/л | 0,4 | 0,3 | - |
Затем по известной величине изменения концентрации одного из веществ путем устных рассуждений находят изменение концентраций и конечные концентрации остальных веществ, необходимые для решения задачи:
Остальные расчеты производятся как обычно (см. выше)
Задача 2 . Как изменится скорость реакции 2А(т) + 3В(г) = С(т) :
а) при увеличении давления в системе в 2 раза;
б) при увеличении объема системы в 3 раза;
в) при повышении температуры на 30° (g = 2)?
Решение: Данная реакция является гетерогенной, и выражение закона действия масс для нее выглядит следующим образом:
u = kСВ3×S.
а) Для газообразных веществ давление прямо пропорционально концентрации, и при увеличении давления в 2 раза концентрация вещества В увеличится в 2 раза.
u¢ = k(2СВ)3×S = 8kСВ3×S = 8u,
т.е. скорость реакции увеличится в 8 раз.
б) Объем и давление обратно пропорциональны друг другу, и при увеличении объема в 3 раза давление уменьшится в 3 раза, и соответственно в 3 раза уменьшится концентрация газообразного вещества.
u¢ = k(⅓СВ)3×S = 1/27(kСВ3×S) = 1/27u,
т.е. скорость уменьшится в 27 раз.
в) Зависимость скорости реакции от температуры выражается правилом Вант‑Гоффа:
 ;
;  ,
,
т.е. скорость реакции увеличится в 8 раз.
Задание 6 по теме «Химическая кинетика»
Дата: 2018-11-18, просмотров: 726.