Первый закон термодинамики : изменение внутренней энергии системы равно количеству теплоты, сообщенной системе, за вычетом работы, совершенной системой. Установлен как постулат, является одной из формулировок закона сохранения энергии. Математически I закон термодинамики можно выразить:
ΔU = Q − А,
где ΔU – изменение внутренней энергии, Q − теплота, А – работа.
Второй закон термодинамики позволяет ответить на вопросы, возможен ли тот или иной процесс, в каком направлении он осущест-вляется, до какого предела протекает. Установлен экспериментально.
Закон имеет несколько формулировок.
§ По Р.Ю. Клаузиусу (1850): теплота сама собой не может переходить от более холодного тела к более нагретому.
§ По У. Томсону : невозможно превратить какое-либо количество теплоты в работу без того, чтобы часть тепла не была растрачена при более низкой температуре.
А = q2 − q1 ~ T2 − T1,
где q2 > q1, T2 > T1.
Закон Гесса – установлен экспериментально Германом Гессе (1836): тепловой эффект реакции, протекающей при р, Т = const или V, Т = const, не зависит от пути реакции и ее механизмов, а лишь от начального и конечного состояния реагирующей системы.
Следствия из закона Гесса:
А) Изменение энтальпии химической реакции не зависит от числа и вида промежуточных стадий.
Например, углекислый газ можно получить прямым взаимодействием либо через промежуточную реакцию. Образование каждого продукта (основного и промежуточного) сопровождается изменением энтальпии:
ΔH1
 С + О2 С + О2  СО2
+½О2 +½О2
ΔH2 ΔH3
СО СО2
+½О2 +½О2
ΔH2 ΔH3
СО
|
Энтальпия первого процесса равна сумме энтальпий второго и третьего:
ΔH1 = ΔH2 + ΔH3
Б) Энтальпия прямой химической реакции равна взятой с противоположным знаком энтальпии обратной реакции:
ΔHпр. = −ΔHобр.
Например, СаСО3(к) ⇄ СаО(к)+СО2(г), ΔHº298 = +178 кДж;
СаО(к)+СО2(г) ⇄ СаСО3(к), ΔHº298 = −178 кДж.
В) Энтальпия химической реакции равна сумме энтальпий образования продуктов реакции минус сумма энтальпий образования исходных веществ.
Так как в термохимических таблицах приведены величины образования 1 моль вещества, а в химическом взаимодействии количества веществ нередко больше, то при расчетах учитывают стехиометрические коэффициенты:
ΔHºх.р. = ∑(ν ∙ΔHº298 продуктов) − ∑ (ν ∙ΔH0298 реагентов),
где ν – стехиометрический коэффициент при веществе в уравнении реакции.
Подобная разность справедлива для вычисления и других термодинамических функций:
ΔGºх.р. = ∑(ν ∙ΔGº298 продуктов) − ∑(ν ∙ΔGº298 реагентов),
ΔSºх.р. = ∑(ν ∙Sº298 продуктов) − ∑(ν ∙Sº298 реагентов)
Таким образом, пользуясь следствием из закона Гесса, можно проводить основные термохимические расчеты.
Критерий самопроизвольного протекания процесса : по II закону термодинамики самопроизвольно протекают процессы в изолированных системах с увеличением энтропии. Однако системы, в которых идут химические реакции, сопровождающиеся тепловым эффектом, не могут быть изолированными из-за теплообмена с внешней средой.
Самопроизвольно способны протекать процессы с уменьшением свободной энергии (энергии Гиббса − ∆G < 0 (при р, Т = const) или энергии Гельмгольца − ∆F < 0 (при V, Т = const)). Согласно объединенному закон у знак ∆G (∆F) зависит от величины ΔH и ΔS. Таким образом, самопроизвольно могут идти реакции:
§ экзотермические (ΔH < 0) ∆G < 0:
если ΔS > 0 − при любых Т,
если ΔS < 0 − при Т < Тр ;
§ эндотермические (ΔH > 0) ∆G < 0:
если ΔS > 0 − при Т > Тр,
если ΔS < 0 − невозможно при любых Т.
Реакция экзотермическая – химическая реакция, протекающая с выделением тепла (+Qр, ∆H < 0 или +Qv, ΔU < 0).
Реакция эндотермическая − химическая реакция, протекающая с поглощением тепла (−Qр, ∆H > 0 или −Qv, ΔU > 0).
Температура равновесия – температура системы, при которой установилось равновесие. Так как в равновесном состоянии изменение энергии Гиббса равно нулю (ΔG = 0), то энтропийный и энтальпийный факторы равны между собой: ТΔS = ΔН. Отсюда можно определить температуру, при которой возможно данное состояние (т.е. температуру равновесия):
Тр = 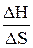 .
.
Тепловой эффект реакции (Q) – теплота, поглощаемая или выделяемая в ходе реакции и отнесенная к одному молю вещества, при условии, что температура начальных и конечных продуктов одинакова и единственной работой является работа расширения. Единица измерения – Дж, кДж. Любая химическая реакция сводится к разрыву связей в реагирующих веществах и образованию новых в продуктах реакции, поэтому знак теплового эффекта будет определяться соотношением величин энергии, необходимой на разрыв (Есв1) и выделяющейся при образовании связи (Есв2). При эндотермической реакции (с поглощением теплоты) Есв1 > Есв2, при экзотермической (с выделением теплоты) Есв1 < Есв2.
Энергия Гиббса (изобарно-изотермический потенциал) (ΔG) – часть энергетического эффекта реакции, которую можно превратить в работу, характеризующая возможность самопроизвольного протекания изобарно-изотермического процесса. Является функцией состояния, т. е. не зависит от пути процесса, а только от начального и конечного состояния системы. Величину энергии Гиббса в стандартных условиях можно рассчитать по закону Гесса, а в условиях, отличных от стандартных – по объединенному закону термодинамики:
ΔGº = ΔHº298 - TΔSº298.
Энтальпия (теплосодержание ) (ΔH) – функция состояния, определяющая тепловой эффект процесса в изобарно-изотермических системах.
Энтропия (S) – функция состояния, характеризующая степень неупорядоченности системы, ее молекулярного беспорядка из-за броуновского движения частиц. Изменение энтропии связано с переходом из одного агрегатного состояния в другое, т. к. по мере повышения температуры системы растет скорость движения частиц, растет число микросостояний, увеличивается термодинамическая вероятность, а, значит, и энтропия.
 1.2. Образцы решения задач
1.2. Образцы решения задач
Задача 1 . Процесс C(т) + Н2О(г) = СО(г) + Н2(г) сопровождается поглощением тепла. Как меняется энтропия в ходе прямой реакции, и при каких температурах относительно температуры равновесия возможно самопроизвольное протекание процесса в прямом направлении?
Решение: Из условия задачи известно, что реакция эндотермическая (DН > 0). Максимальные значения энтропии присущи веществам в газообразном состоянии; по уравнению реакции видно, что среди исходных веществ 1 моль газа, а среди продуктов реакции – 2 моль газов, т.е. в ходе реакции термодинамическая вероятность системы увеличивается, и упорядоченность системы уменьшается. Следовательно, данный процесс сопровождается увеличением энтропии: (DS > 0). Если DНх.р .> 0 и DSх.р. > 0, то самопроизвольное протекание процесса возможно (т.е. DGх.р.< 0) при температурах, больших температуры равновесия: Т > Тр.
Задача 2 . Определите температуру, при которой наступает равновесие в системе 2А(г) + В(т) = 3С(г), если стандартные энтальпии образования веществ А, В и С равны соответственно -5 кДж/моль, -20 кДж/моль и 10 кДж/моль, а изменение энтропии в ходе прямой реакции составляет 100 Дж/моль×К. В каком направлении протекает данный процесс при 200 К?
Решение: Рассчитаем изменение энтальпии в ходе реакции по закону Гесса:
DН°х.р. = SDН°пр.- SDН°исх. = 3×DН°(С) - (2×DН°(A) + DН°(В)) = 3×10 - (2×(-5) - -20) = 60 кДж/моль.
| Тр = | DН | = | 60000 Дж/моль | = 600 К. |
| DS | 100 Дж/моль×К |
В состоянии равновесия DG = 0, следовательно, из объединенного закона можно выразить:
Рассчитаем изменение энергии Гиббса в ходе реакции при 200 К:
DGх.р.=DН°х.р.- TDS°х.р.= 60×103 Дж/моль - 200 К×100 Дж/моль×К = 40 кДж/моль
DGх.р. > 0, следовательно, самопроизвольное протекание прямой реакции невозможно. При данной температуре процесс идет в обратном направлении.
Задание 5 по теме «Химическая термодинамика»
Дата: 2018-11-18, просмотров: 687.