Химическая связь − это сила сцепления атомов, которая обусловливает существование сложных ионов, молекул и макротел. Раздел химии, изучающий химическую связь, формирует понятия о закономерностях ее образования и особенностях строения молекул.
Все химические процессы происходят в результате перегруппировок атомов, сопровождающихся разрывом старых связей между ними и образованием новых. Химическая связь может возникать как между отдельными атомами, так и между сложными химическими частицами: молекулами, ионами, радикалами. Во всех случаях ответственными за ее образование являются электронные оболочки атомов, вступивших в контакт друг с другом. Соприкосновение взаимодействующих атомов, сопровожда-ющееся частичным перекрыванием электронных оболочек валентных электронов (электронов внешнего уровня) и соответственно уменьшение общей энергии системы, является необходимым условием возникновения химической связи.
Основные типы химической связи: ионная, ковалентная (неполярная, полярная, донорно-акцепторная), металлическая, водородная.
Валентность – это способность атомов образовывать химические связи. Электроны, которые участвуют в образовании этих связей, называются валентными. В образовании связи могут участвовать:
а) орбиталь с неспаренным электроном;
б) орбиталь с парой электронов;
в) вакантная (пустая) орбиталь.
Валентность атома определяется числом внешних орбиталей. Следует помнить, что максимальная валентность у элементов проявляется не всегда. Валентности больше VIII не существует.
Ковалентная связь – химическая связь, которая возникает за счет одной или нескольких общих электронных пар между ядрами взаимодействующих атомов. Свойства ковалентной связи:
− энергия связи от 100 до 1000 кДж/моль;
− насыщенность (насыщаемость) обусловлена антипараллельной ориентацией спинов связующей электронной пары и проявляющаяся в способности атомов образовывать ограниченное число ковалентных связей;
− кратность – т. е. число общих электронных пар между взиамодействвующими атомами; связь может быть одинарной, двойной, тройной;
− направленность, которая предопределена тем, что молекулы имеют определенное пространственное строение, потому что локализованные молекулярные орбитали должны располагаться по принципу наименьшего взаимного отталкивания. Это подчеркнуто реализуется в концепции гибридных орбиталей, имеющих строго определенное направление в пространстве;
− полярность, обусловленная смещением электронной плотности химической связи к более электоотрицательному атому. Различают неполярную и полярную ковалентную связь. В первом случае разность электроотрицательностей (DЭО) равна нулю (молекулы H2, N2), а во втором она больше нуля (H2O, HCl). Дипольный момент (μ) является количественной характеристикой полярности связи. Он представляет собой произведение величины заряда на расстояние между точечными зарядами, измеряется в Дебаях. Векторная сумма дипольных моментов всех связей определяет полярность молекулы в целом.
− поляризуемость, т. е. способность связи увеличивать свой дипольный момент под действием внешних электрических сил; иными словами, она выражается в усилении смещения общей электронной пары к одному из атомов, т. е. увеличении степени полярности связи.
Метод валентных связей (МВС). Основные положения:
1. Химическую связь образуют два электрона с антипараллельными спинами.
2. При образовании химической связи происходит перекрывание волновых функций электронов (изображают волнистой линией), и между взаимодействующими атомами увеличивается электронная плотность, что приводит к уменьшению энергии системы.
3. Химическая связь направлена в сторону максимального перекрывания электронных облаков взаимодействующих атомов.

Образцы решения задач
Задача 1. Определить характер связи в молекуле KHSO4 и тип гибридизации иона SO42–
Решение : Необходимо изобразить структурные формулы кислоты и, заменив один из атомов водорода на металл, получим формулу соли:
серная кислота калиевая соль серной кислоты
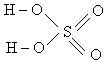
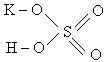
При рассмотрении всех связей в этой соли для каждой рассчитаем разность электроотрицательностей (Δ ЭО), и, сопоставив ее с величиной 1,8, укажем вид связи, кратность и полярность, указав значение дипольного момента: µ=0 или µ≠0.
Если ΔЭО ≥ 1,8 – связь ионная,
ΔЭО = 0 – ковалентная неполярная,
0 < ΔЭО < 1,8 – ковалентная полярная.
Если в молекуле имеется возможность образовать несколько связей между двумя атомами, то в первую очередь реализуется σ-связь.
| Связь: | К−О | H−O | O–S (2 связи) | S=O (2 связи) |
| Δ ЭО: | 3,5−0,91=2,59 | 3,5−2,1=1,4 | 3,5−2,6=0,9 | 3,5−2,6=0,9 |
| Вид связи: | ионная | ковалентная полярная, µ ≠0 | ковалентная полярная, µ ≠0 | ковалентная полярная, µ ≠0 |
| Кратность: | − | одинарная | одинарная | двойная |
| Вид ковалентной связи с учетом направленности | − | σ-связь | σ-связь | σ-связь и π-связь |
Для иона SO42− характерна sp3-гибридизация, так как атом серы образует 4σ-связи, что видно из графической формулы.
Задача 2. Объясните образование молекулы метана по методу валентных связей.
Решение: В молекуле метана СН4 у атома углерода реализуется четыре связи. Очевидно, сначала имеет место возбуждение и, как следствие его, возникновение четырех неспаренных электронов, затем происходит выравнивание электронных облаков по форме и по энергии, т. е. гибридизация. В данном случае sp3-гибридизация. Связи образуются вдоль осей, по которым направлены sp-гибридные облака углерода при перекрывании их с s-электронами атома водорода. Это будут четыре σ-связи. Форма молекулы − тетраэдр.
H H H H
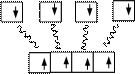 n = 1
n = 1

 hn hn
hn hn

 n = 2 n = 2
n = 2 n = 2
С С* С
основное возбужденное гибридизованное
 состояние состояние состояние
состояние состояние состояние
- тетраэдр
Задача 3. Составьте формулу по названию комплексного соединения: тетрагидроксобериллат (II) калия, запишите выражение для его константы нестойкости.
Решение : Комплексным называют соединение, у которого хотя бы одна связь образована по донорно-акцепторному мехнизму. В нем выделяют внешнюю и внутреннюю сферу. Внутренняя сфера заключена в квадратные скобки. В состав внутренней сферы входят: комплексообразователь и лиганды – полярные молекулы или отрицательнозаряженные ионы, которые координируются вокруг комплексообразователя. Число лигандов − координационное число (КЧ). Из названия следует, что комплексо-образователь заданном соединении ион бериллия с зарядом +2, число лигандов (гидроксогрупп) равно 4, а значит, комплексообразователь находится в sp3-гибридизации, образуя четыре одинаковых связи.
Формула комплексного соединения:

 K2[ Be (OH)4] лиганды
K2[ Be (OH)4] лиганды
внешняя сфера внутренняя сфера
комплексообразователь КЧ = 4
У комплексообразователя с лигандами ковалентная связь по донорно-акцепторному механизму.
Запишем уравнения диссоциации. Комплексные соединения легко диссоциируют на внешнюю и внутреннюю сферу, так как между ними существует в основном ионная связь.
K2[Be(OH)4]⇄2K++[Be(OH)4]2- .
Далее имеет место диссоциация внутренней сферы, которая происходит по ступеням, число которых равно координационному числу. Иногда указывают суммарное уравнение. Для нашего соединения:
Be (OH)42-⇄Be2++4OHˉ .
Прочность внутренней сферы характеризуется величиной константы нестойкости:
Кнестойкости = [Be2+]∙[OH-]4/[Be(OH)4]2- = 10-13 .
Чем константа нестойкости меньше, тем прочнее комплексное соединение.
Задание 4 по теме «Химическая связь»
Дата: 2018-11-18, просмотров: 686.