Атом – наименьшая нейтрально заряженная частица химического элемента, сохраняющая все его свойства. Это сложная микросистема, состоящая из находящихся в движении элементарных частиц. Атом состоит из положительно заряженного ядра, расположенного в центре атома, и отрицательно заряженных электронов. В состав ядра входят протоны и нейтроны. Линейные размеры атома в среднем достигают 10−8 см, а ядра – 10−12 см. Средний объем ядра (10−36см3) незначителен по сравнению с объемом всего атома (10−24 см3). Заряд ядра обозначают буквой Z и указывают в левом нижнем углу рядом с символом элемента, масса указывается в левом верхнем углу, например: 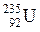 .
.
Квантовые числа. Состояние электрона в атоме характеризуется набором квантовых чисел: n, l, ml, ms. Три первых числа были получены при решении уравнения Шредингера. Они могут быть только целочисленными, что обусловливает дискретность энергетических уровней, на которых располагаются электроны.
а) главное квантовое число ( n ) характеризует энергетическое состояние атома. Энергия атома, прежде всего, зависит от расстояния электрона от ядра. Величина n теоретически может принимать значения от 1 до бесконечности. Она показывает, дальше или ближе расположен электрон от ядра. Если n = 1, значит, электрон находится на возможно ближайшем расстоянии от ядра (на первом энергетическом уровне). Правильнее говорить о вероятности нахождения электрона или о плотности электронного облака, но для простоты часто употребляют понятие «атомная орбиталь (АО)».
Может быть несколько состояний электрона с одинаковой энергией. Чем больше электронов в атоме, тем сложнее структура его спектра. Теория Бора не смогла объяснить расщепление спектральных линий, т. е. тонкой структуры линий. Следовательно, движение электрона в атоме гораздо сложнее и энергия электрона будет зависеть не только от значения главного квантового числа «n».
б) побочное (орбитальное) квантовое число ( l ) характеризует момент количества движения электрона в пространстве. Момент количества движения может принимать лишь дискретные квантовые значения и в зависимости от главного квантового числа орбитальное квантовое число l меняется от 0 до (n−1). Влияние квантового числа l на энергию атома сказывается на атомах, имеющих более 1 электрона.
Движение электрона можно рассматривать как замкнутый электрический ток. Как всякий ток, он взаимодействует с магнитным полем и обладает определенным магнитным моментом. Для характеристики поведения атома в магнитном поле вводится третье квантовое число.
в) магнитное квантовое число ( m l ) определяет значение проекции момента количества движения на направление магнитного поля. Принимает целые значения от –l до +l. Энергия электрона, движущегося в магнитном поле при одних и тех же значениях n и l будет отличаться в зависимости от значения магнитного квантового числа ml, в результате чего уровень энергии расщепляется на подуровни и каждая спектральная линия расщепляется на несколько. Было обнаружено, что спектральные линии оказываются расщепленными и при отсутствии магнитного поля. Существование этих тонких линий, мало отличающихся по длине волны, объясняется небольшим различием в энергии электронов с одинаковым квантовым числом «ml». Таким образом, ml характеризует пространственную ориентацию орбитали. Число значений магнитного квантового числа равно (2l+1).
Электрон вращается вокруг собственной оси и обладает собственным механическим и магнитным моментом количества движения. Это свойство электрона называется «спином».
г) спиновое квантовое число ( m s ) − соответствует механическому моменту вращения электрона вокруг собственной оси. Оно может быть равно или +½ или −½ (в единицах момента количества движения). Спин электрона квантован, и возможны только две ориентации по отношению к моменту количества движения электрона в пространстве. Если у каждого из двух электронов ms = +½, то говорят, что спины электронов параллельны, что обозначается стрелками, направленными в одну сторону: . Если у одного электрона ms = +½, а у другого ms = −½, то такие электроны называются электронами с антипараллельными спинами, и они обозначаются так: ¯.
Правила заполнения электронами уровней и подуровней атомных орбиталей:
1. Принцип наименьшей энергии (принцип минимума энергии): в невозбужденном атоме электроны размещаются в первую очередь на орбиталях с наименьшей энергией.
2. Принцип Паули : в атоме не может быть электронов с одинаковым набором четырех квантовых чисел.
Следствия из принципа Паули:
а) число электронов на орбитали равно двум, т. е. N орбитали = 2;
б) число электронов на уровне равно удвоенному квадрату главного квантового числа, т. е. N уровня = 2 n 2;
в) число электронов на подуровне равно удвоенному числу орбиталей подуровня, т. е. N подуровня = 2(2 l +1):
для s -подуровня при l = 0 N = 2(2∙0 + 1) = 2;
для p -подуровня при l = 1 N = 2(2∙1 + 1) = 6;
для d -подуровня при l = 2 N = 2(2∙2 + 1) = 10;
для f -подуровня при l = 3 N = 2(2∙3 + 1) = 14.
3. Правило Хунда (Гунда) : в невозбужденном атоме электроны в пределах подуровня размещаются таким образом, чтобы суммарный спин был максимальным. Это значит, что сначала все орбитали данного подуровня заполняются по одному электрону с одинаковым спином, а затем идет заполнение вторым электроном.
4. Правила Клечковского : 1) заполнение электронами атомных орбиталей идет в порядке возрастания суммы (n+l) − главного и орбитального квантовых чисел; 2) в случае равенства сумм первой заполняется орбиталь с меньшим значением главного квантового числа.
Электроотрицательность ЭО (æ) − величина, характеризующая способность атома элемента притягивать к себе общие (связевые) электроны в молекуле. Полингом составлена шкала относительных значений электроотрицательности. По ней за единицу принята электроотрицательность лития, т. е. æ (Li) = 1, тогда с учетом того, что по группе уменьшается, наименьшее значение этой величины будет у цезия − æ(Cs) = 0,7, наибольшее − у фтора æ(F) = 4,0.

Образцы решения задач
Задача 1. Указать строение изотопов хлора: 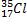 и
и 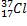
Решение : Ядро каждого атома состоит главным образом из протонов и нейтронов, вокруг которого движутся электроны.
| Частица | Масса, а.е.м. | Заряд в единицах заряда электрона |
| Протон р | 1 | +1 |
| Нейтрон n | 1 | 0 |
| Электрон e | 1/1837 | -1 |
| а.е.м. − атомная единица массы, равная 1/12 массы изотопа 12С (1 а.е.м = 1,66∙10-27 кг) | ||
Почти вся масса атома сосредоточена в ядре. Заряд ядра определяется числом находящихся в нем протонов и равен Z. Сумма числа протонов и нейтронов дает массовое число (M) Совокупность атомов с одинаковым зарядом ядра называется химическим элементом. Разновидности элементов, атомы которых имеют одинаковый заряд ядра, но разные массовые числа, называют изотопами.
| Вид атомов | Состав ядра | Электронная оболочка |
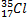
| 17p + 18n | 17e |
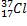
| 17p + 20n | 17e |
Задача 2. Указать квантовые числа для формирующего электрона азота и хрома.
Решение : Азот: символ N, порядковый номер 7, что равно заряду ядра и общему числу электронов.
7N 1s22s22p3 − полная электронная формула,
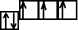 [He]2s22p3 – сокращенная электронная формула
[He]2s22p3 – сокращенная электронная формула
Электронно-графическая формула: n=2
Энергетически выгодное состояние, так как один из подуровней заполнен наполовину, другой – полностью.
Чтобы указать квантовые числа формирующего электрона, нужна электронно-графическая формула:
Формирующий электрон: n = 2; l = 1; ml = +1; ms = ½
Хром: 24Cr
1s22s22p33s23p64s13d5 − полная электронная формула;
[Ar]4s13d5 – сокращенная электронная формула;
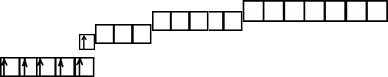 Электронно-графическая формула:
Электронно-графическая формула:
n =4
n =3
Формирующий электрон: n = 3; l = 2; ml = +2; ms = ½
Задача 3. Указать электронные формулы ионов: а) Mg2+; б) S2-.
Решение : Ион – частица, заряд которой определяется присоединением или отдачей электронов.
А. Указываем сокращенную формулу Mg0: [Ne]3s2. Возникновение иона происходит по уравнению: Mg0 − 2e = Mg2+; электроны «уходят» с 3s-подуровня.
Ион Mg2+ получает электронную конфигурацию благородного газа неона − [Ne]. Это устойчивая конфигурация, и поэтому магний в природе находится в виде ионов.
Б. Указываем формулу S0: [Ne]3s23p4.
Возникновение иона происходит при присоединении двух электронов на внешний 3р-подуровень по уравнению: S0 + 2e = S2-. Частица приобретает устойчивую электронную конфигурацию благородного газа аргона:
[Ar] − 3s23p6.
Задача 4. Определите элемент по формуле: а) [ ] 5s1; б) [ ] 4s23d2.
Решение : Существуют три способа:
1. По сумме электронов = Z (порядковому номеру).
2. Координатный – определяем период и группу и на пересечении в периодической системе находится элемент.
3. По принадлежности к семейству или по формирующему электрону.
 Первый способ. Запишем все электроны, которые будут находиться на уровнях и подуровнях до 5s1: 1s22s22p63s23p63d104s24p65s1
Первый способ. Запишем все электроны, которые будут находиться на уровнях и подуровнях до 5s1: 1s22s22p63s23p63d104s24p65s1
36 электронов
[Kr]5s1, тогда Z = 37, т.е. это Rb.
Второй способ: 5s1, n = 5, V период, сумма внешних электронов = 1.
(I группа, A подгруппа) − это Rb.
Третий способ. Из формулы видно, что формирующим электроном является s -электрон. В стадии заполнения находится s -подуровень, т.е. элемент семейства «s» (причем в пятом периоде), поэтому это Rb .
Первый способ: запишем все электроны, которые будут находиться на уровнях и подуровнях до предлагаемой конфигурации: 1s22s22p63s23p64s23d2, т. е. Σ электронов = 22 = Z – порядковому номеру. Это элемент – титан Ti.
Второй способ: из формулы [ ] 4s23d2 видно, что nmax= 4, т.е. 4 период,
Σ электронов = 4, но они на разных уровнях, значит элемент в 4 группе побочной подгруппе. Это Ti.
Третий способ: в стадии заполнения находится 3d-подуровень, и по счету это второй элемент этого семейства, т.е. это титан.
Задача 5. Объясните периодичность изменения радиуса атома.
Радиус атома по Ван-дер-Ваальсу – это половина кратчайшего расстояния, на которое могут сблизиться ядра двух одинаковых атомов, если они принадлежат разным молекулам.
Радиусы уменьшаются по периоду слева направо из-за увеличения притяжения внешних электронов с ростом заряда и увеличиваются по группе из-за увеличения из-за числа электронных уровней.
Задание 3 по теме «Строение атома»
Дата: 2018-11-18, просмотров: 740.