Без лабораторного подтверждения диагноз ВИЧ-инфекции не устанавливается.
Формулировка диагноза у больного ВИЧ-инфекцией включает:
- название нозологической формы (ВИЧ-инфекция);
- клиническую стадию (Российская классификация 2006 г.) с указанием фазы (для 4 стадии) и факта проведения противовирусной терапии;
-наличие клинических признаков СПИД (с указанием СПИД-ассоциированных заболеваний);
- сопутствующие заболевания.
Например:
1. ВИЧ-инфекция, стадия 4В прогрессирование на терапии, СПИД (кандидозный эзофагит). Хронический вирусный гепатит С.
2. ВИЧ-инфекция стадия 4Б, спонтанная ремиссия.
3. ВИЧ-инфекция, стадия 2Б (синдром острой сероконверсии).
В зависимости от наличия положительной динамики может изменяться фаза 4 стадии заболевания (прогрессирование на ремиссию). Изменение самой стадии заболевания не предусмотрено.
В Российской Федерации регистрация ВИЧ-инфекции без положительных результатов лабораторных методов исследования практически не производится.
При выявлении ВИЧ-инфекции пациент ставится на учет в территориальном центре по профилактике и борьбе со СПИД и официально предупреждается об уголовной ответственности по ст. 122 УК РФ (об умышленном заражении или поставлении в опасность заражения ВИЧ-инфекцией других лиц (оформляется документально). По каждому зарегистрированному случаю ВИЧ-инфекции проводится эпидемиологическое расследование. Конфиденциальность информации о ВИЧ-статусе пациента охраняется правовыми нормами.
Лабораторная диагностика. Обязательному медицинскому освидетельствованию подлежат доноры крови, биологических жидкостей, органов и тканей, сотрудники лабораторий по диагностике и изучению ВИЧ-инфекции, осужденные в пенитенциарных учреждениях и задержанные в следственных изоляторах, беспризорные дети, иностранные граждане и лица без гражданства, прибывающие в Российскую Федерацию на срок свыше трех месяцев.
Выдача официального документа о наличии или об отсутствии ВИЧ-инфекции у обследуемого лица осуществляется только учреждениями государственной или муниципальной системы здравоохранения. Существует система бесплатного анонимного обследования на ВИЧ-инфекцию.
Наиболее технологичным и специфичным методом выявления антигена р24 и антител к ВИЧ является метод иммуноферментного анализа (ИФА). Его модификация – иммунный блотинг (ИБ) позволяет определить спектр антител к отдельным белкам ВИЧ. ИФА высоко специфичен (99-100%) и чувствителен (99,1-99,9%). Длительность серонегативного периода («серологического окна») после инфицирования составляет для большинства инфицированных 2,5-3 недели. Через 6 месяцев антитела выявляются более чем у 95-99% больных. Уровень антител может снижаться ниже определяемого в терминальной стадии ВИЧ-инфекции при резком угнетении гуморального иммунитета.
Используемые в ИФА тест-системы четвертого поколения позволяют выявлять одновременно специфические антитела и антиген р24 ВИЧ (комбинированные Аг/Ат), при этом период «серологического окна» составляет 12-14 дней.
Внедрены иммунохроматографические и другие безаппаратные экспресс-тесты, позволяющие выявить антитела (и антиген р24) к ВИЧ за 5-40 минут. Эти простые быстрые тесты нашли применение в ургентных ситуациях, при тестировании беременных в предродовом периоде, инъекционных наркопотребителей и работниц коммерческого секса, доноров при экстренных гемотрансфузиях. Выпускаемые тест-системы для экспресс-диагностики имеют чувствительность от 99,6 до 100% и специфичность от 99,1 до 99,8%. Результаты экспресс-тестов обязательно подтверждаются рутинным алгоритмом (ИФА+ИБ).
Алгоритм лабораторной диагностики включает три этапа:
– серологический скрининг (ИФА);
– референс-исследования (при положительном ИФА-скрининге);
– экспертный (выявление антител к отдельным белкам ВИЧ (ИБ).
В России положительными (позитивными ИБ) считаются пробы, в которых обнаруживаются антитела к двум из трех гликопротеинов ВИЧ (env, gag, pol). Отрицательными (негативными) считаются сыворотки, в которых не обнаруживается антитела ни к одному из антигенов (белков) ВИЧ или имеется слабое реагирование с белком р18. Неопределенными (сомнительными) считаются сыворотки, в которых обнаруживаются антитела к одному гликопротеину ВИЧ и/или каким-либо протеинам ВИЧ.
Метод ПЦР при ВИЧ-инфекции не включен в алгоритм лабораторного подтверждения диагноза у взрослых из-за низких специфичности и порога чувствительности в сравнении с ИФА. Двухкратный положительный результат ПЦР на РНК ВИЧ у детей, рожденных ВИЧ-позитивными матерями, является подтверждением диагноза и поводом для начала терапии инфицированного ребенка. Количественная ПЦР является критерием оценки эффективности высокоактивной антиретровирусной терапии (ВААРТ).
Основным лабораторным критерием оценки выраженности иммунодефицита является определение количества CD4+-лимфоцитов в периферической крови. Для этого используется метод проточной цитофлуюориметрии с моноклональными антителами к CD4+-лимфоцитам. Метод позволяет определять количество и долю CD4+-лимфоцитов как основных клеток-мишеней цитопатического действия ВИЧ.
Метод имеет прогностическое значение: уменьшение количества CD4+-лимфоцитов ниже 200 клеток/мм3 является признаком выраженного иммунодефицита и абсолютным показанием к началу ВААРТ.
Динамика основных лабораторных маркеров ВИЧ-инфекции при естественном течении заболевания (отсутствии антиретровирусной терапии) представлена на рис. 14.
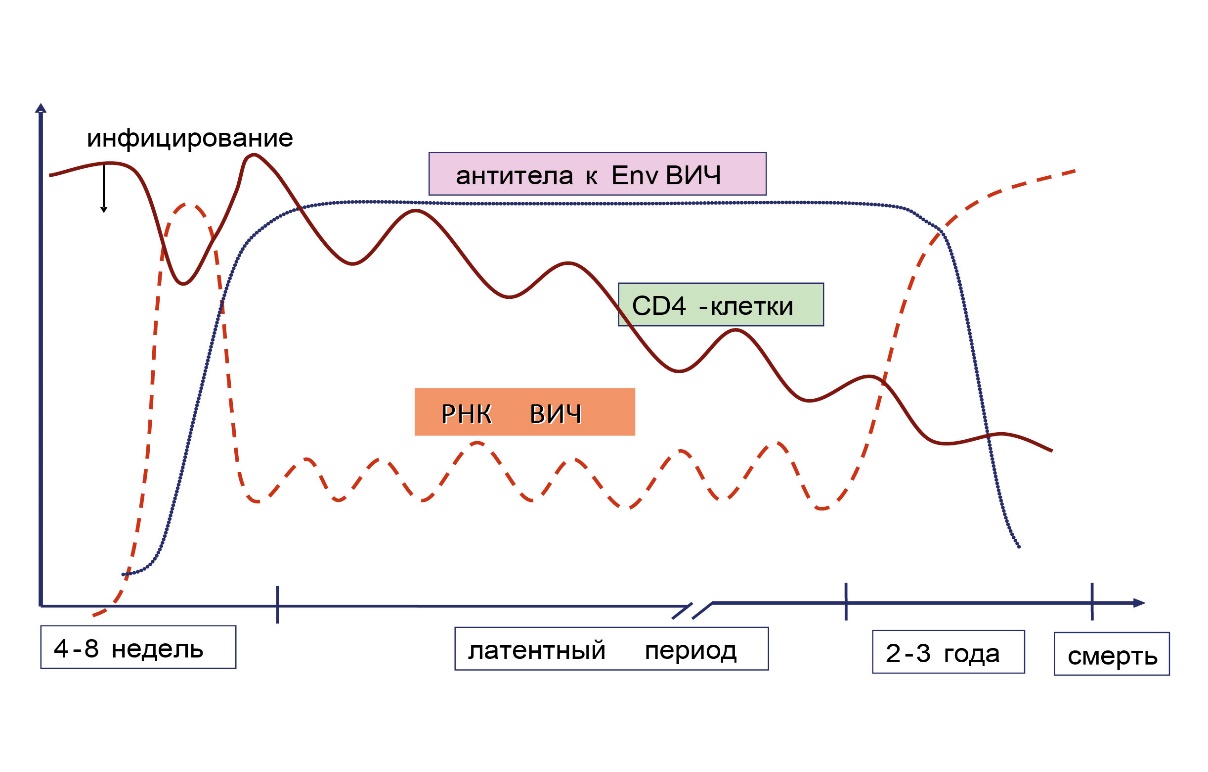
Рисунок 14. Динамика основных лабораторных маркеров ВИЧ-инфекции при естественном течении.
Лабораторный мониторинг эффективности ВААРТ включает определение РНК ВИЧ методом ПЦР через 4, 12 недель и далее каждые 3-4 месяца. В процессе мониторинга возникает необходимость выявления признаков развивающейся резистентности вируса. Для этого используются методики выявления генетической резистентности методом ПЦР.
Лечение. Этиотропная терапия основана на фармакологическом ингибировании известных механизмов репликации вируса. С 1996 г. в практику введена ВААРТ. Основными ее целями на современном этапе являются: продление жизни больного, поддержание ее качества, предупреждение развития тяжёлых, угрожающих жизни вторичных заболеваний профилактика распространения ВИЧ-инфекции. Внедрение методики оценки вирусной нагрузки на плазму (количество копий РНК-ВИЧ в 1 мм3 плазмы крови методом ПЦР) позволило сформулировать еще одну задачу антиретровирусной терапии ― снижение вирусной нагрузки до неопределяемого с помощью ПЦР уровня, т.е. ниже 20-50 копий/мл, так как при такой нагрузке замедляется разрушение иммунной системы, значительно падает угроза формирования резистентных штаммов вируса, угроза передачи инфекции здоровому человеку.
Для проведения ВААРТ используются порядка 30 препаратов пяти основных групп.
Современная ВААРТ включает одновременное назначение 3-4 препаратов различных механизмов противовирусного действия и фармакологических групп и предполагает комбинацию двух нуклеотидных ингибиторов обратной транскриптазы с одним из ингибиторов протеазы (или ненуклеотидным ингибитором обратной транскриптазы). Разработанные препараты других групп пока относятся к препаратам резерва. Существующие рекомендации проведения ВААРТ предусматривают пожизненный прием препаратов. Предсказать переносимость комплексной терапии сложно, поскольку на этот процесс влияют индивидуальные особенности организма человека, наличие сопутствующих соматических заболеваний.
Основной проблемой организации ВААРТ в Российской Федерации является приверженность больных к соблюдению режима и схем терапии (почти половина нуждающихся инфицированы в результате наркопотребления). Кроме того, 10-30% больных отказываются от ВААРТ в результате осложнений и плохой переносимости препаратов. Снижение уровня приверженности к терапии ниже 95-98% создает предпосылки формирования резистентных штаммов вируса и сокращению числа возможных для дальнейшего использования комбинаций препаратов.
Показания для начала ВААРТ:
- абсолютные:
а) стадия 2В, 4Б, 4В в фазе прогрессирования или
б) CD4+ - менее 0,2 × 109/л (200 в мм3);
- относительные:
а) желание и готовность пациента независимо от уровня CD4+
б) уровень CD4+ - от 0,2 до 0,35 × 109/л или
в) РНК ВИЧ более 100 000 копий в мл.
Для проведения лечения разработаны стандартные схемы антиретровирусной терапии.
Профилактика вторичных заболеваний. Эффективная ВААРТ – основной компонент профилактики вторичных ВИЧ-ассоциированных заболеваний. Основным предиктором их появления является снижение уровня CD4+-лимфоцитов.
Больные ВИЧ-инфекцией в стадии СПИД нуждаются в проведении химиопрофилактики вторичных инфекционных заболеваний. Выделяют первичную и вторичную профилактику.
Первичная профилактика проводится у пациентов, имеющих риск развития острого заболевания на фоне выраженного иммунодефицита (CD4+-лимфоцитов ниже 0,1-0,2 × 109/л).
Вторичная профилактика проводится больным, уже перенесшим заболевание, которое успешно лечилось (поддерживающая терапия умеренными дозами эффективных препаратов для профилактики рецидива).
Первичной профилактике подлежат: болезни герпесвирусной группы (простой и опоясывающий герпес, ЦМВИ), микозы (кандидоз, аспергиллез, криптококкоз), микобактериозы (туберкулез, атипичные микобактериозы), токсоплазмоз, пневмоцистоз. Для этого используют противовирусные (герпесвирусы), сульфаниламиды (токсоплазмоз, пневмоцистоз), противогрибковые и туберкулостатические препараты (соответственно).
При длительном (несколько месяцев) отсутствии клинических проявлений заболевания и значительном увеличении уровня CD4+-лимфоцитов на фоне эффективной ВААРТ профилактический профилактический прием препаратов может быть прекращен. При отсутствии иммунологического ответа на ВААРТ профилактика проводится пожизненно.
Прогноз и исходы заболевания. В среднем от момента инфицирования до развития стадии СПИД проходит около 10 лет, до терминальной стадии – 10-15 лет. Появление ВААРТ, постоянное расширение числа препаратов для ее проведения, перспектива создания протективной вакцины делают перспективу перевода ВИЧ-инфекции в разряд «управляемых» вероятной. При этом продолжительность жизни с инфекцией может превысить 25-30 лет.
Реабилитация предусматривает охранительный режим в виде исключения вредных химических (токсических), физических, эмоциональных воздействий на организм. Полноценный пищевой рацион, режим труда и отдыха.
Диспансерное наблюдение. Пожизненное. Оно включает периодическое (1 раз в 3-6 месяцев комплексное лабораторное, инструментальное и физикальное обследование специалистами). Задачами диспансерного наблюдения являются: своевременное выявление признаков прогрессии ВИЧ-инфекции, принятие решения о проведении ВААРТ, оценка ее эффективности и наличия осложнений, принятие решений о необходимости оценки работоспособности и профессиональной пригодности. Организуется специалистами территориальных специализированных учреждений (центры СПИД) и подготовленными врачами-инфекционистами поликлиник.
Профилактика и противоэпидемические мероприятия осуществляются в соответствии с санитарно-эпидемиологическими правилами «Профилактика ВИЧ-инфекции» (СП. 3.1.5.2826-10) и Федеральным законом от 30.03.1995 г. РФ 38-ФЗ «О противодействии распространению на территории Российской Федерации заболевания, вызванного вирусом иммунодефицита человека (ВИЧ-инфекции)».
Осуществляется комплекс мероприятий по выявлению источника инфекции, установлению возможных механизмов и путей передачи, определению контактных лиц с риском инфицирования, их лабораторное обследование (добровольное) и постановка на диспансерный учет, проведение профилактической беседы и дотестового консультирования. Основой профилактики ВИЧ-инфекции является гигиеническое воспитание и обучение населения с целью формирования приверженности нормам здорового образа жизни и нравственного поведения. В медицинских учреждениях осуществляется постоянный надзор за соблюдением правил санитарно-противоэпидемического режима, снижение уровня профессионального травматизма, обязательное лабораторное обследование донорских материалов на антитела и антиген р24 ВИЧ.
Трудности разработки вакцины для профилактики ВИЧ-инфекции обусловлены гипервариабельностью ВИЧ, при которой изменение генетического состава вируса опережает развитие защитной иммунной реакции, а также самой тропностью вируса к иммунокомпетентным клеткам, определяющим развитие специфического иммунитета. Теоретические предпосылки разработки вакцины есть, но несколько образцов, дошедших по результатам международных мультицентровых исследований до стадии клинических испытаний достоверной эффективности не показали.
Военно-врачебная экспертиза. Наличие установленного диагноза ВИЧ-инфекция является поводом для отказа от призыва и приема на контрактную военную службу. Все военнослужащие с установленным диагнозом ВИЧ-инфекция подлежат обязательному освидетельствованию ВВК. Военнослужащие по призыву признаются не годными к военной службе и увольняются из Вооруженных Сил. Военнослужащие по контракту, изъявившие желание продолжить службу проходят ВВЭ в специализированном инфекционном отделении военного госпиталя, где освидетельствуются ВВК в соответствии со стадией заболевания. При отсутствии клинических признаков вторичных заболеваний (стадия ВИЧ-инфекции 2-3) они могут продолжить службу с незначительными ограничениями.
Бешенство
Бешенство — острое инфекционное заболевание вирусной природы, передающееся человеку через укус инфицированного животного, характеризующееся острым энцефалитом, протекающим с тяжелым поражением нервной системы и заканчивающимся всегда летальным исходом.
Шифр по МКБ-10
Исторические сведения. Бешенство на латыни, – rabies, – означает «безумие», происходит от rabere (бредить). Греческий термин для бешенства, lyssa, также означает безумие, и это легло в основу названия рода вирусов (Lyssavirus). Первое упоминание о бешенстве содержится в тексте из Месопотамии, и относится к XXIII веку до н. э. Демокриту принадлежит описание бешенства у животного (собаки) в V в. до н. э. Цельсий (I в. н. э.) описал заболевание, как у животных, так и у людей, описав при этом гидрофобию. Он указал на передачу бешенства от животного к человеку и рекомендовал прижигание раны, полученной вследствие укуса бешенным животным, раскаленным железом. Прижигание железом было единственной реальной терапией укусов бешенным животным до тех пор, когда Луи Пастер предложил вакцину на основе ослабленного вируса бешенства в 1885 г. Вирусная природа болезни была доказана в 1903 г. П. Ремленже.
Этиология. Этиологическая структура. Вирус бешенства, которому присвоен I серотип, является типичным представителем рода Lyssavirus семейства Rhabdoviridae. Имеет форму винтовочной пули, размеры от 90–170 до 110–200 нм, содержит однонитевую РНК. Вирус патогенен для большинства теплокровных животных и птиц. Существуют уличный (циркулирующий в природе) и фиксированный вирус бешенства, поддерживаемый в лабораториях. Фиксированный вирус не выделяется со слюной и не может быть передан во время укуса.
Вирус устойчив к фенолу, замораживанию, антибиотикам. Разрушается кислотами, щелочами, нагреванием (при кипячении инактивируется за 2 мин.). Чувствителен к ультрафиолетовым и прямым солнечным лучам, этанолу, высушиванию. Быстро инактивируется стандартными дезинфицирующими средствами.
Культуральные свойства. Размножается в тканевых культурах (первично трипсинизированных и перевиваемых, в культурах диплоидных клеток человека или фибробластов эмбриона хомячка), а после адаптации — на куриных и утиных эмбрионах, что используют при получении антирабических вакцин.
Механизм вирусной персистенции в клеточных культурах обусловлен образованием и накоплением ди-частиц. Проникновение вируса в клетки происходит путем адсорбционного эндоцитоза — вирионы выявляются в виде включений, окруженных мембраной, адсорбированных на микротрубочках и в составе лизосом.
Эпидемиология. Бешенство распространенно практически повсеместно, за исключением Антарктиды и нескольких островных государств. По данным ВОЗ в мире ежегодно от этого заболевания погибает от 55 тыс. до 100 тыс. человек, с непропорционально большой долей детей в возрасте до 15 лет. Около 10 млн. человек получают постконтактную профилактику. В США ежегодно число регистрируемых случаев бешенства составляет от одного до четырех, в России за период 2008-2012 гг.. – 57 заболевших. Во время эпидемической вспышки бешенства в 2009-2011 гг.. на о. Бали (Индонезия) погибло не менее 120 человек. В некоторых странах Африки ежегодно регистрируется более 100 случаев заболевания.
Резервуары и источники возбудителя – инфицированные животные (лисы, волки, собаки, кошки, летучие мыши, грызуны, мелкий и крупный рогатый скот и др. млекопитающие). В мире, собаки являются источником бешенства в 54%, дикие животные – 42%, и летучие мыши – 4%. У редких диких видов животных (например, пятнистые гиены), заражение бешенством может не приводить к развитию клинически выраженного заболевания. По крайней мере, у одного вида летучих мышей (Eptesicus serotinus), образцы слюны могут содержать РНК вируса без обнаружения РНК в образцах мозга. Вирус выделяется во внешнюю среду со слюной инфицированного животного или человека. Пути передачи – контактный и аэрогенный. Заражение человека происходит при укусе или ослюнении больным животным поврежденной кожи или слизистой оболочки. Возможно инфицирование при вдыхании контаминированной аэрозоли в местах обитания летучих мышей (пещеры) или в лабораторных условиях. Описаны немногочисленные казуистические случаи заражения людей при трансплантации органов от доноров, у которых прижизненно бешенство не было диагностировано (почки, печень, роговица).
Вероятность заражения зависит от нескольких факторов. Укус с видимым ослюнением раны (например, открытых участков кожи), более вероятно приведет к развитию бешенства, чем укус через толстую одежду, которая препятствует попаданию слюны с зубов животного. Множественные укусы более опасны в сравнении с единственным. Расположение укушенной раны также влияет на риск развития бешенства: укусы на лице (голове, шее) скорее приведут к болезни, чем повреждения дистальных участков конечностей. Попадание слюны на уже существующую рану может передавать вирус, как и экспозиция на слизистую или проникновение вируса в дыхательные пути аэрозольным путем.
Патогенез и патологическая анатомия. После внедрения через поврежденную кожу вирус бешенства распространяется ретроградно посредством аксонального транспорта, достигает центральной нервной системы, реплицируется в нейронах с транссинаптическим проникновением в ацинарные клетки, откуда он проникает в слюнные железы и другие органы. Скорость распространения вируса по нервным стволам составляет 8-22 мм/сут. (при перевязке нервных стволов болезнь не развивается).
Размножаясь в нервной ткани (головной и спинной мозг, симпатические ганглии, нервные узлы надпочечников и слюнных желез), вирус вызывает в ней отек, кровоизлияния, дегенеративные и некротические изменения нервных клеток. В коре большого мозга и мозжечка, зрительном бугре, подбугорной области, в черном веществе, ядрах черепных нервов, в среднем мозге, базальных ганглиях, мосту мозга, максимально – в продолговатом мозге, особенно в области дна IV желудочка, наблюдается разрушение нейронов. Вокруг участков пораженных клеток появляются лимфоцитарные инфильтраты (рабические узелки). В цитоплазме клеток (чаще в нейронах аммонова рога) образуются оксифильные включения (тельца Бабеша–Негри), представляющие собой места продукции и накопления вирионов бешенства.
Симптомы и течение заболевания. Инкубационный период у большинства продолжается от 1 до 3 мес. (возможны колебания от 12 дней до нескольких лет). Наиболее короткая инкубация – при укусе лица, головы, верхних конечностей, наиболее длинная — при укусе в нижние конечности.
Бешенство у человека описано в виде двух «классических» клинических форм: энцефалитической (или «буйной») и паралитической (или «немой»). Энцефалитическая форма протекает с гидрофобией, нарушением сознания (делирием) и ажитацией, которые и формируют общую картину заболевания.
Стадии болезни: I — начальная (депрессии), II — возбуждения, III — параличей.
I стадия. Заболевание начинается с появления неприятных ощущений в области укуса (жжение, тянущие боли с иррадиацией к центру, зуд, гиперестезия кожи), хотя рана уже может полностью зарубцеваться. Иногда вновь появляются местные воспалительные явления, рубец становится красным и припухает. При укусах в лицо возникают обонятельные и зрительные галлюцинации. Температура тела становится субфебрильной — чаще 37,2–37,3°С. Одновременно появляются первые симптомы нарушения психики: необъяснимый страх, тоска, тревога, депрессия, реже — повышенная раздражительность. Больной замкнут, апатичен, отказывается от еды, плохо спит, сон сопровождается устрашающими сновидениями. Затем апатия и депрессия сменяются беспокойством, учащаются пульс и дыхание, возникает чувство стеснения в груди. Начальная стадия длится от нескольких часов нескольких дней (чаще 2–3 дня).
II стадия — возбуждения — характеризуется повышенной рефлекторной возбудимостью и развертыванием полной клинической картины заболевания. Наиболее ярким симптомом бешенства является водобоязнь (гидрофобия): при попытках пить возникают болезненные спастические сокращения глотательных мышц и вспомогательной дыхательной мускулатуры. Эти явления нарастают в своей интенсивности так, что одно напоминание о воде или звук льющейся жидкости вызывает спазмы мышц глотки и гортани. Гидрофобия представляет собой чрезмерный рефлекс раздражения дыхательных путей, связанный с nucleus ambiguus. У большинства наблюдается гипервентиляция. Нарушения сердечного ритма проявляются преимущественно наджелудочковой тахикардией или брадикардией, и отражают либо дисфункцию ядер ствола мозга либо миокардит.
В это время резко обостряются реакции на любые раздражители. Приступ судорог может быть спровоцирован дуновением в лицо струи воздуха (аэрофобия), ярким светом (фотофобия) или громким звуком (акустикофобия). Зрачки больного сильно расширены, возникает экзофтальм, взгляд устремляется в одну точку. Пульс резко ускорен, появляется обильное мучительное слюнотечение (сиалорея), потоотделение. Наблюдаются также анизокория, пилоэрекция («гусиная кожа») и редко, приапизм или спонтанная эякуляция. На высоте приступа возникает бурное психомоторное возбуждение (приступы буйства, бешенства) с яростными и агрессивными действиями. Больные могут ударить, укусить окружающих, плюются, рвут на себе одежду. Сознание помрачается, развиваются слуховые и зрительные галлюцинации устрашающего характера. Возможна остановка сердца и дыхания.
В межприступный промежуток сознание обычно проясняется, больные могут правильно оценивать обстановку и разумно отвечать на вопросы. Через 2–3 дня возбуждение, если не наступила смерть на высоте одного из приступов, сменяется параличами мышц конечностей, языка, лица.
III стадия — параличей — связана с выпадением деятельности коры мозга и подкорковых образований, отличается выраженным снижением двигательной и чувствительной функций. Судороги и приступы гидрофобии прекращаются (признаки близкой смерти). Температура тела повышается до 40–42°С, нарастает тахикардия, гипотония. Гипервентиляция сменяется периодическим и атаксическим типами нарушения дыхания, и, в конце концов, за этим следует апноэ. Смерть наступает через 12–20 ч.
Общая продолжительность болезни от 2-х до 14 дней
Иногда заболевание без предвестников сразу начинается со стадии возбуждения.
Примерно у пятой части больных заболевание протекает в паралитической форме. Спинной мозг и ствол мозга в этих случаях несут на себе основную тяжесть болезни. В этих случаях гидрофобия, аэрофобия, возбуждение и судороги отсутствуют.
У детей бешенство характеризуется более коротким инкубационным периодом. Приступы гидрофобии и резкого возбуждения могут отсутствовать. Заболевание проявляется депрессией, сонливостью, развитием параличей и коллапса. Смерть может наступить через сутки после начала болезни.
Осложнения и критические состояния. Сходны с таковыми при других крайне тяжело протекающих заболеваниях. Часто отмечаются нарушения сердечного ритма. Нарушения со стороны ЖКТ включают кровотечение, рвоту, диарею и непроходимость кишечника. Смерть обычно наступает от отека мозга или миокардита, в последнем случае – из-за нарушения сердечного ритма или развития застойной сердечной недостаточности.
Диагноз и дифференциальный диагноз. Диагноз бешенства не представляет большой трудности у непривитых пациентов с развившимся заболеванием после укуса известным бешеным животным. Для предварительного диагноза имеют значение эпидемиологические предпосылки (укус или ослюнение кожи, слизистых оболочек заболевшего человека подозрительными на бешенство животными) и клинические данные (характерные признаки начального периода, сменяющиеся возбуждением с такими симптомами, как гидрофобия, аэрофобия, слюнотечение, бред и галлюцинации). В общем анализе крови отмечается лимфоцитарный лейкоцитоз при анэозинофилии.
Прижизненно окончательный диагноз формулируется при обнаружении антигена вируса бешенства (иммунофлюоресцентный анализ; кожный биоптат), а также выявлении специфических антител к вирусу бешенства в сыворотке крови, если пациент ранее не прививался и не вводился специфический иммуноглобулин.
Посмертно при гистологическом и иммунофлюоресцентном исследовании аммонова рога обнаруживают тельца Бабеша–Негри.
Дифференциальная диагностика проводится с другими вирусными энцефалитами, столбняком, истероневрозом, отравлением стрихнином. Диагноз бешенства следует учитывать для любого необъяснимого прогрессирующего энцефалита.
Столбняк характеризуется тетаническими судорогами, тризмом, «сардонической улыбкой», отсутствием нарушений сознания и нормальной психикой больных.
При вирусных энцефалитах (вызванным вирусом герпеса I и II типов, полиомиелите и др.) до развития паралитической фазы отсутствует стадия возбуждения, сочетающаяся с гидрофобией и аэрофобией. В то же время, сходные изменения на ЭЭГ и в СМЖ при бешенстве и герпетическом энцефалите, затрудняют проведение дифференциальной диагностики. Обнаружение вируса простого герпеса в СМЖ методом ПЦР позволяет уточнить диагноз.
Картина ложного бешенства при истероневрозе отличается путаным анамнезом (часто укусившие животные здоровы), обилием субъективных жалоб, отсутствием объективных признаков (нет расстройств дыхания, тахикардии, расширения зрачков) и длительным течением.
Отравление стрихнином исключают на основании соответствующего лабораторного исследованиятщательно собранного анамнеза и отсутствия характерной цикличности болезни.
Паралитическая форма бешенства может напоминать острую воспалительную полинейропатию, поперечный миелит или полиомиелит.
Острую воспалительную полинейропатию (синдром Гийена-Барре) следует дифференцировать на основании электромиографического исследования.
При поперечном миелите боль на уровне поражения помогает в проведении диагностики. Кроме того, для поперечного миелита характерны сенсорные нарушения нервной системы, тогда как при бешенстве сенсорная функция, как правило, нормальная.
Лихорадка обычно предшествует развитию слабости при полиомиелите, а разрешение лихорадки с наступлением неврологических симптомов помогает в диагностике. Анамнез вакцинации против полиомиелита также следует учитывать.
Лечение. Эффективных методов лечения не существует. Единственный доказанный случай выздоровления от бешенства (США, 2004) был связан с длительной управляемой медикаментозной комой и массивным пролонгированным применением рибаверина и амантадина (т. н. «Висконсинский протокол»). Все немногочисленные повторные случаи терапии согласно рекомендаций этого протокола были безуспешны. Проводится симптоматическая терапия для уменьшения страданий больного. Больного помещают в затемненную, изолированную от шума, теплую палату, погружают в медикаментозный сон. Реанимационные мероприятия при бешенстве не проводят.
Прогноз и исходы заболевания всегда неблагоприятный.
Профилактика и противоэпидемические мероприятия в очаге. Осуществляются в соответствии с санитарно-эпидемиологическими правилами «Профилактика бешенства среди людей. СП 3.1.7.2627-10» (2010).
При нападении животного дефекты кожи следует промыть струёй воды с мылом (моющими средствами), обработать 70° спиртом или йодной настойкой. Края раны в течение трех дней не иссекать и не зашивать (кроме ургентных ситуаций – обильное кровотечение, обширные раны). Проводится профилактика столбняка. Пострадавшие направляются в травматологический (хирургический) антирабический пункт для проведения специфической профилактики бешенства.
Госпитализация пострадавших для антирабической вакцинации:
1. Лица с тяжёлыми поражениями и укусами опасной локализации (голова, шея, грудь, верхние конечности),
2. Проживающие в сельской местности,
3. Прививающиеся повторно,
4. Лица с отягощённым фоном (неврологический, аллергологический и проч.).
Осуществляется информирование территориальной службы по борьбе с болезнями животных об известных напавших на пострадавшего животных для установления за ними 10-дневного наблюдения / карантинизации.
Антирабический иммуноглобулин (АИГ) назначают как можно раньше после контакта с бешеным, подозрительным на бешенство или неизвестным животным, но не позднее трех суток после контакта. АИГ не применяется после введения антирабической вакцины. Перед введением гетерологичного антирабического иммуноглобулина необходимо проверить индивидуальную чувствительность пациента к лошадиному белку.
Гетерологичный (лошадиный) АИГ назначается в дозе 40 МЕ/кг массы тела; гомологичный (человеческий) АИГ назначается в дозе 20 МЕ/кг массы тела.
Максимально возможная часть АИГ должна быть инфильтрирована в ткани вокруг ран и в глубине ран. Если анатомическое расположение повреждения (кончики пальцев и др.) не позволяет ввести всю дозу АИГ в ткани вокруг ран, то остаток АИГ вводят внутримышечно (мышцы ягодицы, верхняя часть бедра, плеча). Вакцину необходимо вводить в другое место (другая конечность, как правило).
Для вакцинопрофилактики используют антирабические вакцины: «КОКАВ» – культуральную очищенную концентрированную антирабическую вакцину III поколения из аттенуированного штамма фиксированного вируса бешенства «Внуково-32» и «Рабивак-Внуково-32» – вакцину антирабическую культуральную инактивированную для иммунизации человека.
Лечение/профилактика назначается в соответствии с критериями ВОЗ: «категория повреждения» (с I по III), «характер контакта», «сведения о животном». К I категории повреждений относятся ситуации, когда прямой контакт с больным бешенством животным отсутствует, нет укусов, ослюнения. В этой ситуации АИГ и/или антирабические вакцины не назначают, показана консультация психотерапевта.
Вторая категория включает ослюнение неповрежденных кожных покровов, ссадины, одиночные поверхностные укусы или царапины туловища, верхних и нижних конечностей (кроме головы, лица, шеи, кисти, пальцев рук и ног, гениталий), нанесенные домашними и сельскохозяйственными животными. В этом случае необходимо немедленно начать лечение: вводится «КОКАВ» по 1 мл в 0, 3, 7, 14, 30 и 90 день внутримышечно. При этом учитываются сведения о животном – если в течение 10 сут. наблюдения оно остается здоровым, то лечение прекращают (т.е. после третьей инъекции). Если наблюдение за животным невозможно, лечение продолжается по указанной схеме.
Третья категория – любые ослюнения слизистых оболочек, любые укусы головы, лица, шеи, кисти, пальцев рук и ног, гениталий; множественные укусы и глубокие одиночные укусы любой локализации, нанесенные домашними и сельскохозяйственными животными, а также любые ослюнения и повреждения, нанесенные дикими плотоядными животными, летучими мышами и грызунами. Пострадавшим необходимо немедленно назначить комбинированное лечение: АИГ по схеме, приведенной ранее, в сочетании с введением «КОКАВ» по 1 мл в 0, 3, 7, 14, 30 и 90 день внутримышечно. В случаях, когда имеется возможность наблюдения за животным, и оно в течение 10 сут. остается здоровым, лечение прекращают (после третьей инъекции). Во всех остальных случаях, когда невозможно наблюдение за животным, лечение продолжается.
Военно-врачебная экспертиза. Не проводится.
Натуральная оспа
Натуральная оспа — острое вирусное заболевание, которое в типичных случаях характеризуется общей интоксикацией, лихорадкой, своеобразными высыпаниями на коже и слизистых оболочках, последовательно проходящими стадии пятна, пузырька, пустулы, корочки и рубца.
Шифр по МКБ-10 – B03.
Исторические сведения. Натуральная оспа (Variola, variola vera, variola major — лат. Smallpox — англ.) была широко распространена в Азии и Африке. В 60-х гг.. XIX в. оспа ежегодно поражала 10-15 млн. непривитых людей. В конце XVIII в. английский врач Эдвард Дженнер создал вакцину на основе вируса коровьей оспы, этой вакциной было массово привито население Европы. В 1967 г. ВОЗ приняла решение об эрадикации натуральной оспы. И в 1977 г. оспа была повсеместно ликвидирована. Официально об искоренении оспы было объявлено в 1980 г. на Ассамблее ВОЗ. Прививки против оспы в СССР прекратились в 1978-1980 гг.. прошлого века. Коллекции штаммов натуральной оспы продолжают храниться в лабораториях России и США.
Этиология. Возбудитель оспы относится к вирусам семейства Poxviridae, подсемейства Chordopoxviridae, рода Orthopoxvirus; содержит ДНК, имеет размеры 200–350 ммк, размножается в цитоплазме с образованием включений. Вирус кирпичеобразной формы с закругленными углами. Наружная оболочка вириона содержит липиды и трубчатые белковые структуры, образующие характерные выступы. ДНК представлена двунитевой нефрагментированной молекулой, содержащей десятки генов. Свыше 10 вирусных белков являются ферментами, катализирующими преимущественно нуклеиновый синтез: ДНК-зависимая РНК-полимераза, ДНК-аза и др.
Имеет четыре основных антигена: нуклеопротеиновый антиген NP, общий для всего семейства, располагается в сердцевине вириона; ранний антиген ES, формирующийся до начала синтеза вирусной ДНК; родоспецифический антиген LS; видоспецифический гемагглютинин.
Вирус культивируется в куриных эмбрионах, в первичных и перевиваемых культурах клеток человека и животных. Он устойчив к воздействию внешней среды, особенно к высушиванию и низким температурам, в течение нескольких месяцев сохраняется в корочках и чешуйках, взятых с оспин на коже больных, в замороженном и лиофилизированном состоянии остается жизнеспособным несколько лет.
Формирование вирионов происходит в цитоплазме клетки хозяина. Зрелые вирионы доставляются через аппарат Гольджи к клеточной оболочке и при выходе из клетки приобретают двухслойную внешнюю оболочку из компонентов клетки хозяина.
Эпидемиология. Натуральная оспа – высококонтагиозный антропоноз. К оспе восприимчивы все люди, если у них нет иммунитета, полученного в результате перенесенного ранее заболевания или вакцинации.
Механизмы передачи – воздушно-капельный, контактный (при непосредственном соприкосновении с пораженной кожей больного или инфицированными им предметами). Больной заразен от последних дней инкубации до отторжения корочек, трупы умерших от оспы также сохраняют высокую способность к инфицированию.
Патогенез и патологическая анатомия. При вдыхании зараженного воздуха вирусы попадают в респираторный тракт. Возможно заражение через кожу и трансплацентарно. Вирус поступает в ближайшие лимфатические узлы, размножается, далее попадает в лимфатические и кровеносные пути, что приводит к первичной виремии. В результате ее вирус проникает в селезенку, печень и макрофаги, в которых происходит его накопление. Вторичная виремия развивается через 10 дней, в результате которой инфицируются клетки кожи, почек, ЦНС, других внутренних органов и начинают развиваться первые признаки болезни. Тропизм вируса к клеткам эпителия приводит к появлению энантемы и экзантемы. Ослабление иммунитета ведет к активации вторичной флоры и превращению везикул в пустулы. Вследствие гибели росткового слоя эпидермиса, глубоких нагноительных и деструктивных процессов формируются рубцы. Может развиться ИТШ. Для тяжелых форм характерно развитие ДВС-синдрома.
Симптомы и течение и заболевание. При типичном течении оспы инкубационный период длится в среднем 8–12 дней (от 5 до 24 дней). Выделяют две основных формы течения заболевания – «Большая оспа» (variola major), имеющую наиболее тяжелое течение, и Алястрим или т.н. «белая оспа» (Alastrim), протекающую без формирования типичных пустул и имеющую характерные изменения кожи, напоминающие известковый налет (табл. 23).
Начальный период характеризуется ознобом, повышением температуры тела, сильными рвущими болями в пояснице, крестце и конечностях, сильной жаждой, головокружением, головной болью, рвотой. На 2–4-й день на высоте лихорадки появляется инициальная сыпь на коже (кореподобная, розеолезная, эритематозная), либо геморрагическая сыпь по обеим сторонам грудной клетки в области грудных мышц до подмышечных впадин, а также ниже пупка в области паховых складок и внутренних поверхностей бедер («треугольник Симона»); кровоизлияния выглядят как пурпура и даже как экхимозы. Пятнистая сыпь держится несколько часов, геморрагическая — более продолжительное время.
На 4-й день наблюдается снижение температуры тела, ослабляются клинические симптомы начального периода, но появляется истинная сыпь. Сыпь распространяется центробежно: лицо→туловище→конечности. Элементы сыпи проходят эволюцию: макула→папула→везикула (многокамерные пузырьки с пупковидным втяженением в центре, окруженные зоной гиперемии)→пустула→корки. На лице и конечностях, включая ладонные и подошвенные поверхности, элементов экзантемы больше. Одновременно появляется энантема на слизистой оболочке носа, ротоглотки, гортани, трахеи, бронхов, конъюнктивы, прямой кишки, женских половых органов, мочеиспускательного канала. Они вскоре превращаются в эрозии и язвы.
Таблица 23
Классификация по степени тяжести клинических форм натуральной оспы с основными особенностями течения (Ющук Н.Д., Венгеров Ю.Я., Архипов Г.С., 2009)
| Форма | Степень тяжести | Клинические особенности |
| «Большая оспа» (variola major) | ||
| Геморрагическая (Variola haemorrhagica s. Nigra) | Тяжелая | 1. Оспенная пурпура (Purpura variolosa): геморрагии отмечаются уже в продромальном периоде. Возможен летальный исход до возникновения сыпи. 2. Геморрагическая пустулезная сыпь – «черная оспа» (Variola haemorrhagica pustulosa - Variola Nigra):явления геморрагического диатеза возникают в период нагноения пустул |
| Сливная (Variola confluens) | Тяжелая | Элементы сыпи сливаются с образованием сплошных пузырей, наполненных гноем |
| Обычная (Variola ver) | Среднетяжелая | Классическое течение |
| Вариолоид – оспа у привитых (Variolosis) | Легкая | В продромальном периоде симптомы выражены слабо. Субфибрильная лихорадка длится 3-5 сут. Период высыпаний наступает на 2-4 сут. болезни: макулы превращаются в папулы и везикулы без образования пустул |
| Оспа без сыпи (Variola sine exanthemate) | Легкая | Общая интоксикация, головная боль, миалгии и боль в крестце слабо выражены. Температура тела субфебрильная. Диагноз подтверждается серологически |
| Оспа без температуры (Variola afebris) | Легкая | Симптомы интоксикации отсутствуют. Ускоренное течение |
| «Малая оспа» (Variola minor) | ||
| Алястрим – «белая оспа» (Alastrim) | Легкая | В продромальный период выражены все симптомы, но на 3-и сут. от начала заболевания температура нормализуется и возникает пузырчатая сыпь, придающая коже вид «покрытой брызгами известкового раствора». Пустулы не образуются. Вторая лихорадочная волна отсутствует. |
На 8–9-й дни болезни в стадии нагноения пузырьков вновь ухудшается самочувствие больных, возникают признаки токсической энцефалопатии (нарушение сознания, бред, возбуждение, у детей — судороги). Период подсыхания и отпадения корок занимает около 1–2 нед. На лице и волосистой части головы образуются многочисленные рубцы.
Изменение крови характеризуется лейкоцитозом, при тяжелых формах имеется резкий сдвиг влево с выходом в кровь миелоцитов и юных клеток.
Осложнения и критические состояния. Первичные осложнения: ИТШ, энцефалит, менингоэнцефалит, панофтальмит. Вторичные (связанные с присоединением вторичной инфекции): кератит, ирит, сепсис, пневмония, эндокардит, флегмоны, абсцессы и др.
Диагноз и дифференциальный диагноз. Клинические проявления болезни являются основанием для специфических исследований. Для анализа берут содержимое везикулы, пустулы, корочки, мазки слизи из полости рта, кровь. Присутствие вируса в образцах определяют с помощью электронной микроскопии, микропреципитации в агаре иммунофлюоресцентным методом, реакцией нейтрализации. Предварительный результат получают через 24 ч, после дальнейшего исследования — выделение и идентификация вируса. Для выявления антител в крови используют ИФА.
Дифференциальный диагноз. Отличительной особенностью оспы обезьян является увеличение лимфатических узлов, нередко определяемых до высыпаний на коже. Вирус оспы коров может вызвать заболевание, напоминающее легкое течение натуральной оспы (недомогание, умеренное повышение температуры тела, оспины). Во время появления инициальной сыпи дифференциальная диагностика проводится с корью и скарлатиной, позже — с ветряной оспой, осповакциной (генерализованной вакциной), менингококкемией, лептоспирозом, геморрагической лихорадкой, оспоподобным (везикулезным) или гамазовым риккетсиозом.
Лечение. Госпитализация в бокс. Диета – механически и химически щадящая (диета №4). Назначают метисазон (внутрь по 0,6 г 2 раза в день в течение 4–6 сут.). При наслоении гнойной инфекции – антибиотики широкого спектра действия (цефалоспорины, макролиды, полусинтетические пенициллины), дезинтоксикационную терапию, при тяжелых формах проводят коррекцию водно-электролитного баланса, кислотно-основной системы, факторов свертывающей и противосвертывающей системы крови, применяются ГКС, сердечно-сосудистые средства.
Прогноз и исходы заболевания. Зависит от клинической формы болезни, возраста и преморбидного состояния. Летальность колеблется от 2% до 100%. При легком течении и у привитых прогноз благоприятный.
Профилактика и мероприятия в очаге. Реконвалесценты выписываются после полного клинического выздоровления, но не раньше чем через 40 дней от начала заболевания. Люди, выживающие после оспы, могут частично или полностью терять зрение, и практически всегда на коже остаются многочисленные рубцы в местах бывших язв.
Натуральная оспа ранее относилась к заболеваниям, на которые распространяются Международные медико-санитарные правила. Но, ввиду ее полной эрадикации, была исключена из них в 1981 г. Однако, в случае появления больных и подозрительных на эту инфекцию лиц, они подлежат строгой изоляции, клиническому обследованию и лечению в специальных стационарах. Медицинский персонал в них должен работать в защитной одежде (противочумная одежда III типа с маской, костюм «Кварц» и др.). Проводят тщательную текущую и заключительную дезинфекцию помещения, где находится (находился) больной, предметов обихода и мест общего пользования.
Карантин для лиц, находившихся в контакте с больным (подозрительным) натуральной оспой, устанавливают на 17 дней. Все они вакцинируются против оспы, независимо от срока предыдущей прививки. Им назначают внутрь метисазон: взрослым по 0,6 г 2 раза в сутки, детям — разовая доза из расчета 10 мг на 1 кг массы тела ребенка 4–6 дней подряд.
Военно-врачебная экспертиза. Проводится при наличии резидуальных явлений.
Корь
Корь – острое вирусное высококонтагиозное заболевание преимущественно детского возраста, характеризующееся фебрильной лихорадкой, синдромом общей инфекционной интоксикации, поражением верхних отделов респираторного тракта и поэтапным появлением пятнисто-папулезной сыпи, зачастую сливного характера с последующей пигментацией.
Шифр по МКБ-10 – В05.
Историческая справка. Первое сообщение о кори известно с IX в., когда персидский врач Абу Бакр Мухаммед ибн Закария Ар-Рази дал ей название «hasbah» («извержение» – араб.) и считал болезнь видоизмененной оспой. В европейской литературе болезнь получила название morbilli . Значительный вклад в изучении кори сделал П. Панум (P. Panum, 1846) во время эпидемии кори на Фаррерских островах, когда заболело более 7500 человек. Ему же принадлежит характеристика подробной клинической картины болезни и особенностей ее течения. Г. Корней (G. Korney, 1875) описал эпидемию кори на островах Фиджи, где погибло около 20 тыс. человек, что составило 20–25 % населения. Аналогичные эпидемии отмечались и в других станах, в том числе – в России (в 1901 г. была эпидемия кори на Колыме). Вирусная этиология кори была установлена Т. Андерсоном (T. Anderson, 1911) и Дж. Гольдбергером (J. Goldberger, 1911), но сам вирус кори (Polinosa morbillarum) был выделен только в 1954 г. Дж. Эндерсом (J. Enders) и Т. Пиблcом (T. Peebles). В 1958 г. группа ученых под руководством А.А. Смородинцева выделила вирус кори от больных, что создало условия для изучения вируса и разработки вакцины. В 1963 г. в США, а затем в СССР (1967) и других странах стала проводиться массовая вакцинация населения против кори, которая привела к резкому уменьшению заболеваемости и практически полной ликвидации летальности среди привитых.
Этиология. Этиологическая структура. Возбудитель кори относится к парамиксовирусам (семейство Paramyxoviridae, род Morbillivirus).
Морфология. Морфологически вирус кори сходен с другими парамиксовирусами, диаметр его вириона 100–250 нм. Оболочка содержит три слоя – белковую мембрану, липидный слой и наружные гликопротеидные выступы. Обладает особым сродством к мукополисахаридам и гликопротеинам, в частности, к клеточным рецепторам, содержащим сиаловую кислоту. Вирус кори содержит РНК, кодирующую восемь структурных белков, обладает гемагглютинирующей и гемолизирующей активностью. Наиболее значимыми антигенами являются: нуклеопротеин, мембранный белок (М-протеин), белок слияния (F-протеин, гемолизин) и гемагглютинин. Гемолизирует и агглютинирует только эритроциты обезьян.
Культуральные свойства. Культивируется на клетках почек человека и обезьян. Во внешней среде сохраняется не более 30 мин., но в высушенном состоянии при температуре до –70°С не теряет своих свойств в течение года. При температуре 60°С гибнет мгновенно. Вирус кори быстро инактивируется при нагревании, УФО, под влиянием дезинфицирующих средств. Получены аттенуированные штаммы вирусов кори, которые используются в качестве живой противокоревой вакцины.
Эпидемиология. В довакцинальный период корь имела повсеместное распространение с преобладанием зимне-весенней заболеваемости. По данным ВОЗ, в 2014 г. от кори умерло 114 900 человек, большинство из которых дети в возрасте до 5 лет. В начале 2000-х гг. ВОЗ была объявлена стратегия ликвидации кори в различных регионах мира. За период с 2000 по 2014 гг.. противокоревая вакцинация привела к снижению глобальной смертности от кори на 79%. На фоне широкого применения противокоревых вакцин заболеваемость корью значительно снизилась в США, Японии и некоторых странах Западной Европы.
Тем не менее, корь до сих пор является одной из основных причин смерти в мире среди детей раннего возраста, даже несмотря на наличие современных безопасных и эффективных вакцин. В виде вспышечной заболеваемости наиболее часто корь регистрируется на территории стран Африки, Азии, Ближнего Востока. Крупные вспышки заболевания регистрируются, как правило, в дошкольных детских учреждениях и школах.
В последние годы даже в относительно благополучных по кори странах Европы, в том числе и в России, наблюдается тенденция к росту заболеваемости. Нестабильность эпидемиологической ситуации в значительной мере связана с упущениями в стратегии вакцинопрофилактики, а также по причине широких международных контактов, частых «завозных» случаев заболевания из эпидемически неблагополучных по кори регионов мира в результате трудовой миграции, миграции беженцев, вынужденных переселенцев из зон военных конфликтов и социальных катастроф. В последнее десятилетие на территории Российской Федерации регистрируется до нескольких тысяч случаев кори в год. Отмечается неравномерное распределение заболеваемости: до 90% заболевших выявляется на территории Северо-Кавказского, Центрального и Южного федерального округов. Так по данным Роспотребнадзора, в 2014 г. в Российской Федерации зарегистрировано 4711 случаев кори. Показатель заболеваемости составил 3,28 на 100 тыс. населения. При этом сохраняется тенденция к увеличению удельного веса взрослых (2014 г. – 52%) в структуре заболеваемости корью.
В связи с нестабильной ситуацией по кори в мире, в 2012 г. Инициативная группа ВОЗ по борьбе с корью и краснухой представила новый Глобальный стратегический план. В соответствии с ним планируется к 2020 г. ликвидировать корь и краснуху, по меньшей мере, в пяти регионах ВОЗ.
Резервуары и источники возбудителя. Источником инфекции является только больной человек, который выделяет вирус кори во внешнюю среду с последних двух дней инкубационного периода до 7–8 дня болезни.
Механизм передачи возбудителя – аэрозольный, путь передачи – воздушно-капельный. В виде мельчайших капелек слизи вирус выделяется из организма при кашле, чихании, разговоре и даже при дыхании. В связи с высокой летучестью вируса потоком воздуха может разноситься на значительное расстояние по воздуховодам внутри помещений. Заражение происходит при вдыхании воздуха в помещении, где незадолго до этого находился больной корью. Вследствие низкой устойчивости во внешней среде передача вируса кори контактным путем невозможна. При возникновении кори в период беременности возможен вертикальный путь передачи инфекции, что наблюдается крайне редко в связи с единичными случаями заболевания корью среди беременных.
Естественная восприимчивость людей к заболеванию высокая. Лица, не болевшие корью и не привитые против нее, остаются высоко восприимчивыми к кори в течение всей жизни и могут заболеть в любом возрасте.
Патогенез и патологическая анатомия. Воротами инфекции служит слизистая оболочка верхних дыхательных путей. Вирус размножается в эпителии респираторного тракта, а также в других эпителиальных клетках. При электронной микроскопии материала, взятого из пятен Бельского–Филатова–Коплика и кожных элементов сыпи, обнаруживаются скопления вируса кори. С последних дней инкубации в течение 1–2 дней после появления сыпи вирус можно выделить из крови. Возбудитель гематогенно разносится по всему организму, фиксируется преимущественно в органах ретикулоэндотелиальной системы, где размножается и накапливается. В конце инкубационного периода наблюдается вторая, более напряженная волна вирусемии. Возбудитель обладает выраженной эпителиотропностью и поражает кожные покровы, конъюнктивы, слизистые оболочки респираторного тракта и ротовой полости (пятна Бельского–Филатова–Коплика), а также эндотелиальные клетки и моноциты крови. В основе поражения кожи и слизистых лежит специфический воспалительный очаговый процесс с аллергической реакцией, дистрофией эпителия, увеличением проницаемости сосудов, периваскулярной инфильтрацией и отёком. Вирус можно обнаружить также в слизистой оболочке трахеи, бронхов, иногда в моче. В отдельных случаях вирус может заноситься в головной мозг, обусловливая развитие специфического коревого энцефалита. В гиперплазированных лимфоидных тканях, в частности в лимфатических узлах, миндалинах, селезенке, вилочковой железе, можно обнаружить гигантские ретикулоэндотелиоциты (клетки Уортина-Финкельдея). Во многих лейкоцитах выявляются разрушенные хромосомы. Эпителий дыхательных путей может некротизироваться, что способствует наслоению вторичной бактериальной инфекции. С третьего дня появления высыпаний вирусемия резко снижается, а с четвертого дня вирус обычно не обнаруживается. В ответ на вирусную коревую инфекцию в организме срабатывает комплексный иммунный ответ, включающий в себя неспецифические факторы защиты, клеточный и гуморальный иммунитет. Специфические антитела класса IgM начинают обнаруживаться в крови к пятому дню болезни.
При кори развивается специфическая аллергическая перестройка организма, сохраняющаяся длительное время. У привитых со временем резко снижаются титры антител к вирусу кори, тогда как аллергизация сохраняется длительно. Это обусловливает атипичное течение кори у привитых, заболевших спустя 5–7 лет после прививки.
Установлена связь вируса кори с развитием подострого склерозирующего панэнцефалита, который наблюдается у больных перенесших корь спустя семь и более лет. Методом генотипирования показано, что выделенные штаммы вируса кори от больных подострым склерозирующим панэнцефалитом по своей антигенной структуре соответствуют «диким» штаммам вируса кори, циркулирующим в человеческой популяции. В основе патогенеза заболевания лежит длительная персистенция вируса кори с его высокой репликативной активностью на фоне неполноценного иммунного ответа. Также не исключено присоединение аутоиммунного компонента в поражении ЦНС.
Корь приводит к состоянию анергии, что проявляется в исчезновении аллергических реакций (на туберкулин, токсоплазмин и др.) у инфицированных лиц, а также в обострении хронических заболеваний (туберкулез и др.). Иммунодепрессия сохраняется несколько месяцев. С другой стороны, преморбидное состояние иммунной системы сказывается на клинической симптоматике и течении кори. Актуальна проблема кори у ВИЧ-инфицированных лиц. Иммунитет после перенесенной естественной коревой инфекции стойкий. Повторные заболевания корью встречаются редко. Иммунитет после прививок более кратковременный (через 10 лет после прививки лишь у 36% вакцинированных сохраняются защитные титры антител).
Патологическая анатомия. При исследовании слизистых верхних дыхательных путей, трахеи, бронхов выявляются гиперемия, местами язвенно-некротические поражения. Отмечается увеличение и полнокровие печени и селезенки. При коревых менингоэнцефалитах наблюдается выраженное воспаление мозговых оболочек, отек и полнокровие коры и белого вещества головного мозга.
Симптомы и течение заболевания. Существующие клинические классификации выделяют типичную форму кори различных степеней тяжести (легкая, средняя, тяжелая степени тяжести) и атипичные формы (митигированная и абортивная). При типичной форме кори выделяют три последовательных периода клинических проявлений болезни: катаральный период, период высыпания (экзантемный) и период пигментации (реконвалесценции).
Инкубационный период длится 9–11 дней. При профилактическом введении иммуноглобулина он может удлиняться до 15–21 дня, реже – дольше. Отдельные проявления болезни отмечаются со второй половины инкубационного периода (снижение массы тела ребенка, отечность нижнего века и гиперемия конъюнктив, субфебрилитет по вечерам, кашель, небольшой насморк). Начальный, или продромальный период характеризуется повышением температуры тела до 38–39°С, разбитостью, общим недомоганием, понижением аппетита. Усиливается насморк, появляется грубый «лающий» кашель, резко выражена гиперемия конъюнктив. Появляется коревая энантема в виде мелких красных пятен, расположенных на слизистой оболочке мягкого и твердого неба. Патогномоничные для кори пятна Бельского–Филатова-Коплика (А.П. Бельский, Н.Ф. Филатов, 1895; H. Koplik, 1896) локализуются на слизистой оболочке щек. Они представляют собой мелкие белесоватые, слегка возвышающиеся над уровнем слизистой оболочки пятнышки, окруженные узкой красноватой каемкой, и прочно сидят на слизистой оболочке. По внешнему виду напоминают манную крупу или отруби. С появлением экзантемы они исчезают. В конце начального периода (3–4-й день) температура тела понижается, затем с появлением коревой сыпи вновь повышается до более высоких цифр. Усиливается выраженность синдрома общей инфекционной интоксикации и поражения верхних дыхательных путей.
Коревая экзантема характеризуется этапностью высыпания: в 1-й день элементы сыпи появляются на лице, шее; на 2-й день – на туловище, руках и бедрах; на 3-й день сыпь захватывает голени и стопы, а на лице начинает бледнеть. Наиболее густо элементы сыпи расположены на лице, шее и верхней части туловища. Высыпания состоят из небольших папул (около 2 мм), окружены неправильной формы пятном, диаметр пятна, как правило, более 10 мм. Элементы сыпи склонны к слиянию, образуя сложные фигуры с фестончатыми краями. Однако даже при самой густой сыпи можно обнаружить участки совершенно нормальной кожи. В некоторых случаях на фоне коревой экзантемы можно заметить кровоизлияния (петехии). Через 3–4 дня элементы сыпи бледнеют, на их месте остаются буроватые пятна – пигментация, особенно выраженная и длительная при наличии геморрагических превращений сыпи. На месте сыпи в дальнейшем наблюдается отрубевидное шелушение (на лице и туловище).
Характерен выраженный конъюнктивит, иногда с гнойным отделяемым, склеивающим ресницы по утрам. Периферические лимфатические узлы (заднешейные, затылочные, подмышечные) увеличены, иногда чувствительны при пальпации. Со стороны сердечно-сосудистой системы отмечаются аритмии, приглушение тонов сердца, артериальная гипотония. Над легкими выслушиваются рассеянные сухие хрипы, иногда среднепузырчатые влажные хрипы. В случае присоединения пневмонии появляется одышка, при перкуссии отмечаются отдельные участки укорочения перкуторного звука, выслушиваются звучные мелкопузырчатые влажные хрипы. У некоторых больных отмечаются боли в животе, жидкий стул. Появление диареи обусловлено другими патогенными агентами (кампилобактер, ротавирусы, лямблии др.), наслаивающимися на коревую инфекцию.
Легкая степень тяжести кори характеризуются незначительно выраженными респираторными синдромами, лихорадкой не выше 37,9°С и продолжительностью не более 3–4 дней, экзантемным периодом в течение 2–3 дней.
При средней степени тяжести кори отмечается умеренно выраженный синдром общей инфекционной интоксикации с развернутыми типичными проявлениями заболевания. Лихорадка достигает 38–39°С и продолжается в течение 4–5 дней. Период высыпаний длится не более 5 дней.
Тяжелая степень тяжести заболевания характеризуется выраженным синдромом общей инфекционной интоксикации и усилением респираторных синдромов со стороны дыхательных путей, сливным характером сыпи с появлением геморрагических элементов у 25% больных. Часто наблюдаются носовые кровотечения. Наблюдаются нарушения со стороны нервной системы в виде психомоторного возбуждения, угнетения или изменения сознания, бред, галлюцинации, адинамия. Отмечается высокий риск развития осложнений и критических состояний.
Митигированная корь. Атипичная форма, развивающаяся у инфицированных лиц, которым во время инкубационного периода вводили профилактически иммуноглобулин или переливали кровь или плазму. Эта форма кори протекает легко. Она отличается увеличенным инкубационным периодом (до 21 дня), обычно протекает при субфебрильной температуре, респираторные синдромы со стороны дыхательных путей выражены слабо, пятен Бельского-Филатова-Коплика нет, экзантема в виде единичных элементов без характерной для кори этапности. Осложнений не дает.
Абортивная корь также относится к атипичным формам заболевания. Начинается как типичная форма, но прерывается через 1–2 дня от начала болезни. Сыпь появляется только на лице и туловище, повышение температуры тела наблюдают обычно только в первый день высыпаний.
Реакция на прививку. При введении живой противокоревой вакцины у 25–50% привитых появляется разной выраженности реакция. В некоторых случаях она напоминает митигированную корь. Однако инкубационный период укорочен до 9–10 дней. Отмечается повышение температуры тела (иногда значительное), респираторные проявления со стороны верхних дыхательных путей, скудная макулопапулезная сыпь. У отдельных детей могут быть судороги и рвота. Лица с вакцинальной реакцией для окружающих не опасны. У лиц с иммунодефицитом, обусловленным рядом заболеваний (ВИЧ-инфекция, лица после трансплантации, онкологические больные), введение живой противокоревой вакцины может вызвать очень тяжелую реакцию. Введении живой противокоревой вакцины таким людям противопоказано! При высоком риске заражения корью вышеуказанной группе лиц (в основном детям) рекомендована пассивная иммунизация противокоревым иммуноглобулином, которая эффективна при ее проведении в первые 5–6 дней после контакта.
Течение кори у лиц с нарушенной иммунной системой. У ВИЧ-инфицированных и онкологических больных корь протекает крайне тяжело (у 80%). Летальные исходы наблюдаются у 70% заболевших корью онкологических больных и у 40% ВИЧ-инфицированных в IV стадии заболевания. Иммунизированные ранее (до заражения ВИЧ) погибают от кори реже. Несмотря на очень тяжелое течение, у 30% больных корью отсутствует экзантема, у 60% больных отмечается атипичная сыпь. Часто выявляются тяжелые осложнения в виде энцефалита (20%), пневмонии (80%) и др.
Осложнения и критические состояния. Осложнения могут быть обусловлены непосредственным воздействием вируса, а также за счет присоединения вторичной бактериальной флоры. Выделяют осложнения со стороны органов дыхания (пневмонии, ларинготрахеиты, бронхиты, бронхиолиты, плевриты, стеноз гортани), пищеварительной системы (стоматиты, энтериты, колиты, гепатиты), нервной системы (энцефалиты, менингиты, менингоэнцефалиты, полирадикулоневриты, подострый склерозирующий панэнцефалит и др.), сердца (миокардиты), органов зрения (конъюнктивиты, блефариты, кератиты, кератоконъюнктивиты), ЛОР-органов (отиты, синуситы, мастоидиты), мочевыделительной системы (циститы, гломерулонефриты, пиелонефриты) и кожи (пиодермии, абсцессы, флегмоны).
Поражение вирусом кори слизистой оболочки респираторного тракта может приводить к развитию пневмонии, которая чаще всего является вирусно-бактериальной и наблюдается примерно у 3% больных. Пневмония носит преимущественно интерстициальный характер, протекает тяжело, сопровождается одышкой, в мокроте можно обнаружить многоядерные гигантские клетки.
Наиболее тяжелым и грозным осложнением является коревой энцефалит, который наблюдается с частотой 1 случай на 1000 больных. Симптомы энцефалита чаще развиваются через неделю после появления экзантемы, хотя могут быть и позднее (через 2–3 нед). Вновь повышается температура тела, появляются признаки общей интоксикации, сонливость, заторможенность, иногда потеря сознания, амимия, отсутствие брюшных рефлексов, нистагм, поражение лицевого нерва, парезы и параличи конечностей. При вовлечении в процесс спинного мозга (миелит) могут быть тазовые расстройства.
Критические состояния могут быть обусловлены острой дыхательной и сердечно-сосудистой недостаточностью, психомоторным возбуждением, синдромом внутричерепной (церебральной) гипертензии, ИТЭ.
Диагноз и дифференциальный диагноз. В период разгара болезни диагноз типичной кори трудностей не представляет. В начальном периоде до появления коревой экзантемы диагноз основывается на выраженном конъюнктивите с отеком нижнего века, респираторных проявлениях со стороны верхних дыхательных путей (трахеобронхит), энантеме и особенно на выявлении пятен Бельского-Филатова-Коплика. Наиболее сложно диагностировать атипичные формы кори.
Лабораторные методы. В клиническом анализе крови у больного с типичной формой кори отмечают лейкопению или нормоцитоз, сдвиг лейкоцитарной формулы влево, лимфоцитоз, появление плазматических клеток, увеличение СОЭ. В начальном периоде и в первые два дня после появления сыпи в окрашенных мазках мокроты, носовой слизи или мочи можно обнаружить многоядерные гигантские клетки.
Для подтверждения диагноза в качестве скринингового исследования используют РПГА. Серологические реакции ставят с парными сыворотками с интервалом 10–14 дней. Диагностическим является нарастание титра антител в 4 раза и более. Более широкое применение нашел метод ИФА с определением антител класса IgM, свидетельствующих об остром заболевании. Кроме того, используется ПЦР-диагностика, позволяющая обнаружить РНК вируса кори в назофарингеальных аспиратах, мокроте, соскобе с конъюнктив, крови и других материалах взятых от больного.
Дифференциальный диагноз следует проводить с краснухой, псевдотуберкулезом, скарлатиной, энтеровирусной экзантемой, инфекционным мононуклеозом, некоторыми риккетсиозами, различными токсическими эритемами.
Лечение. Больных корью лечат дома. Госпитализации подлежат больные с тяжелой и осложненной формами кори, а также по эпидемиологическим показаниям (из организованых коллективов). Для создания оптимального противоэпидемического режима больных с корью размещают в индивидуальных (мельцеровских) боксах инфекционных стационаров. Во время лихорадочного периода рекомендуется постельный режим. Исключают раздражающее воздействие прямого солнечного и яркого искусственного света. В период разгара болезни пациентам с корью назначается лечебная диета № 2 с последующим переходом на общую диету № 15 в периоде раненней реконвалесценции. В рационе преобладают молочные и овощные блюда, кефир, творог, овощные супы, торе, тертые яблоки, фруктовые соки. Больному дают большое количество жидкости, фруктовых соков.
Этиотропного лечения нет. Эффективно применение внутривенной формы рибавирина при тяжелых формах кори. Противокоревой иммуноглобулин обладает лишь профилактическим действием. При появлении клинических симптомов болезни терапевтического эффекта он не оказывает.
При пневмонии, обусловленной наслоением вторичной бактериальной микрофлоры, назначают, с учетом возраста пациента, антибиотики – цефалоспорины III, IV поколений, респираторные фторхинолоны (левофлоксоцин, моксифлоксацин), макролиды (азитромицин, джозамицин). При наличии явлений острого трахеобронхита с выраженным сухим кашлем целесообразно назначение комбинированных противокашлевых препаратов, а в период ранней реконвалесценции – ингаляций с щелочными растворами или муколитиками.
При тяжелых формах болезни, а также в случае развития энцефалита целесообразно применение препаратов группы интерферона (в частности, применяется лейкинферон); ГКС под прикрытием антибиотиков; управляемой гемодилюции с целью дезинтоксикации и профилактики отека-набухания головного мозга; препаратов для коррекции гомеостаза; использование метода гипербарической оксигенации.
Прогноз и исходы заболевания. При неосложненных формах кори прогноз благоприятный. В случаях развития коревого энцефалита прогноз серьезный.
Правила выписки. Больные выписываются из стационара после клинического выздоровления и нормализации лабораторных показателей крови и мочи.
Реабилитация. Реабилитационные мероприятия включают диету, с учетом преимущественного поражения органов, лечебную физкультуру, физиотерапию, фармакологическую терапию препаратами, которые способствуют восстановлению нарушенных функций у переболевших.
Диспансерное наблюдение. После неосложненной кори реконвалесценты наблюдаются инфекционистом в течение 1 мес. При благоприятном исходе тяжелых осложнений кори (энцефалит) требуется более длительное наблюдение (до 1–2 лет) с привлечением врачей других специальностей (невролог и др.).
Профилактика и противоэпидемические мероприятия в очаге осуществляется в соответствии с санитарно-эпидемиологическими правилами «Профилактика кори, краснухи и эпидемического паротита» (СП 3.1.2952-11). Надежным методом предупреждения кори является вакцинация. В соответствии с национальным календарем профилактических прививок отработана и применяется схема иммунизации с двукратным введением вакцины. Первую вакцинацию проводят детям в возрасте 12 мес., вторую прививку делают детям в возрасте 6 лет. Вакцинация проводится одновременно против кори, краснухи и паротита. В целях максимального охвата прививками против кори в субъектах Российской Федерации проводится работа по выявлению лиц, не болевших и не привитых против этих инфекций среди труднодоступных слоев населения (мигрантов, беженцев, вынужденных переселенцев и т.д.) и их иммунизации в соответствии с национальным календарем профилактических прививок. Для обеспечения популяционного иммунитета к кори, достаточного для предупреждения распространения инфекции среди населения, охват прививками должен составлять не менее 95% детей и не менее 90% взрослых в возрасте 18–35 лет.
Иммунизации против кори по эпидемическим показаниям (проводится в течение первых 3-х суток с момента выявления больного) подлежат лица, имевшие контакт с больным (при подозрении на заболевание), не болевшие корью ранее, не привитые, не имеющие сведений о прививках против кори, а также лица, привитые против кори однократно – без ограничения возраста. Наибольший защитный эффект вакцина обеспечивает при использовании ее до контакта или в течение двух суток после контакта с больным корью. Если вакцинация не проводилась, корь можно предупредить пассивной иммунизацией (однократное введение противокоревого иммуноглобулина или иммуноглобулина человека нормального в соответствии с инструкциями по применению иммунобиологических препаратов в первые 5 дней после контакта с коревым больным). Пассивная иммунизация показана детям до 3 лет, беременным женщинам, больным туберкулезом и лицам с ослабленной иммунной системой.
Военно-врачебная экспертиза. Военнослужащие после тяжелых осложненных форм кори нуждаются в отпуске по болезни и решении вопроса о категории годности к военной службе.
Краснуха
Краснуха – острая вирусная контагиозная болезнь преимущественно детей, характеризующаяся мелкопятнистой экзантемой, генерализованной лимфаденопатией с преобладающим поражением затылочных и заднешейных лимфатических узлов, умеренно выраженной кратковременной лихорадкой и высоким риском поражения плода у беременных.
Шифр по МКБ-10 – В06.
Исторические сведения. Первые сообщения о краснухе появились в работах французского врача Ж. де Байю (J. de Bailloy) в XVI в. Несколько позже наиболее подробное описание болезни сделал Г. Вейль (G. Weill, 1866). Он же предложил дать название болезни «rubeola» – краснуха. Длительное время болезнь считали видоизмененной формой кори или скарлатины. В 1881 г. на международном конгрессе в Лондоне она выделена в самостоятельную нозологическую форму, но официальное название – «краснуха» введено ВОЗ лишь в 1972 г. Вирусная этиология краснухи была установленав 1938 г. Дж. Хиро (J. Hiro) и С. Тасака (S. Tasaka), проводившими опыты заражения краснухой волонтеров. В 1962 г. П. Паркманом, (P.D. Parkman), Т. Уэллером (T.N. Weller) и Ф.А. Нева (F.A. Neva) был открыт возбудитель заболевания, отнесенный к роду Rubivirus. Тератогенные свойства вируса краснухи были установлены австралийским врачом Н. Греггом (N. Gregg, 1941), Р. А. Канторовичем (1973), О.Г. Анджапаридзе и Т.И. Червонским (1975). В России официальная регистрация краснухи началась с 1970 г.
Этиология. Вирус краснухи относится к тогавирусам (семейство Togaviridae, род Rubivirus). Все известные штаммы вируса краснухи относятся к одному серотипу. Описано 13 генотипов вируса.
Морфология. Вирионы представляют собой сферические частицы диаметром 60–70 нм, на поверхности которых расположены редкие ворсинки длиной 8 нм. Содержит однонитчатую РНК, кодирующую 3 структурных и 2 неструктурных белка. Структурные белки Е1, Е2 располагающиеся на поверхности липидной оболочки вируса краснухи выполняют функцию поверхностных рецепторов при контакте с клетками хозяина. Вирус краснухи имеет гемагглютинин, а также нейраминидазу – в отличии от других тогавирусов. Патогенен для некоторых видов обезьян.
Культуральные свойства. Вирус краснухи способен размножаться на многих клеточных культурах, но цитопатическое действие оказывает лишь на немногих, в частности на культуре клеток ВНК-21 (перевиваемая монослойно-суспензионная сублиния клеток почки новорожденного сирийского хомячка). Вирус краснухи агглютинирует эритроциты голубей, гусей, обладает гемолитическими свойствами. Во внешней среде вирус нестоек, быстро погибает при высушивании, при изменениях рН (ниже 6,8 и выше 8,1), под влиянием УФО и дезинфицирующих веществ. При низких температурах до –180°С долго не теряет своих биологических свойств. При температуре 100°С погибает через 2 мин.
Эпидемиология. Согласно программе ВОЗ краснуха должна быть ликвидирована в ближайшем будущем. Введение прививок проявилось резким снижением заболеваемости. В США, Западной Европе и ряде других государств краснуха выявляется на крайне низком уровне. Программа иммунизации в России позволила снизить заболеваемость. Начиная с 2010 г. заболеваемость краснухой на территории Российской Федерации не превышает 1 случая на 100 тыс. населения.
До введения в практику вакцинации краснуха встречалась в виде эпидемических вспышек с интервалом 6–9 лет. В межэпидемическое время наблюдаются спорадические случаи. Максимальное число заболеваний регистрируется в апреле-июне. Во время эпидемической вспышки в последние годы заболевают преимущественно взрослые (95%), особенно в организованных коллективах (учащиеся средних и высших учебных заведений, военнослужащие и др.).
Резервуары и источники возбудителя. Источником инфекции является только человек. Это или больные клинически выраженной формой краснухи, или лица, у которых краснуха протекает атипично, без сыпи, а также дети с врожденной краснухой, в организме которых вирус может сохраняться в течение многих месяцев (до 1,5 лет и более). Особую опасность краснуха представляет для беременных вследствие внутриутробной инфекции плода с последующим развитием врождённых пороков.
Механизм передачи возбудителя – аэрозольный, путь передачи – воздушно-капельный. Вирус краснухи выделяется во внешнюю среду за неделю до появления сыпи и в течение 10–15 дней с момента появления экзантемы. Для заражения необходимо более длительное и тесное общение с больным, чем при кори и ветряной оспе. Существует также вертикальный путь передачи (трансплацентарный), приводящий к инфекции плода, частота поражения которого зависит от срока беременности. Контактный путь не имеет эпидемиологического значения.
Естественная восприимчивость к инфекции высокая.
Патогенез и патологическая анатомия. В случае приобретенной краснухи вирус проникает в организм через слизистые оболочки дыхательных путей, хотя в эксперименте на добровольцах удавалось вызвать заболевание и при интрадермальном введении вируса. В дальнейшем наступает вирусемия. Гематогенно вирус разносится по всему организму, проникает в лимфатические узлы, где репродуцируется и накапливается, вызывая лимфаденопатию. Возбудитель обладает дерматотропными свойствами, поражая эпителий кожи. В конце инкубационного периода вирус краснухи можно выделить из эпителиальных клеток носоглотки. С появлением сыпи вирус в крови и в эпителии носоглотки, как правило, не обнаруживается, но в некоторых случаях выделение его продолжается 1–2 нед. после появления экзантемы. Антитела в сыворотке крови появляются через 1–2 дня после высыпания с дальнейшим нарастанием их титра. После перенесенного заболевания антитела сохраняются в течение всей жизни, но титр антител постепенно снижается. Иммунитет стойкий пожизненный.
При возникновении заболевания у беременных в период вирусемии возбудитель краснухи преодолевает плацентарный барьер и поражает плод. Вследствие поражения эндотелия кровеносных сосудов плаценты и эпителия ворсинок хориона вирусом краснухи нарушается питание плода. Вызывая хромосомные нарушения, вирус избирательно подавляет митотическую активность отдельных клеточных популяций эмбриона, а такжеоказывает на них прямое цитопатогенное действие. Это приводит к замедлению роста и нарушению нормального формирования органов плода с последующим развитием врождённых пороков. При врожденной краснухе, несмотря на наличие в сыворотке крови антител к вирусу краснухи, возбудитель длительное время (до 1,5 лет) сохраняется в организме ребенка. Ребенок в течение всего этого времени может быть источником инфекции для других детей.
Патологическая анатомия. При исследовании слизистых глотки, трахеи и бронхов выявляется их гиперемия, могут наблюдаться очаги кровоизлияний. Отмечается увеличение и полнокровие печени и селезенки. При краснушных менингоэнцефалитах наблюдается различной степени выраженности воспаление мозговых оболочек, отек и полнокровие серого и белого вещества головного мозга.
Симптомы и течение заболевания. Общепринятой классификации клинических форм краснухи нет. А.П. Казанцев (1970) выделял следующие клинические формы краснухи:
А. Приобретенная краснуха: 1. Типичная форма различных степеней тяжести (легкая, средняя, тяжелая степени тяжести). 2. Атипичная форма (без сыпи). 3. Инаппарантная форма (субклиническая).
Б. Врожденная краснуха: 1. Поражение нервной системы. 2. Врожденные пороки сердца. 3. Форма с поражением слуха. 4. Форма с поражением глаз. 5. Смешанные формы. 6. Резидуальные явления врожденной краснухи.
Типичные формы могут быть неосложненными и осложненными (артрит, энцефалит, тромбоцитопеническая пурпура, акушерская патология).
Инкубационный период длится от 12 до 23 дней (чаще 16–20). Общее состояние больных краснухой страдает мало, поэтому часто первым симптомом, обращающим на себя внимание, является экзантема. Больные отмечают небольшую общую слабость, недомогание, умеренную головную боль, иногда боли в мышцах и суставах. Температура тела чаще остается субфебрильной, хотя иногда достигает 38–39°С и держится 1–3 дня. При объективном обследовании отмечаются слабо выраженные респираторные синдромы со стороны верхних дыхательных путей, небольшая гиперемия слизистых ротоглотки, инъекция сосудов конъюнктивы. С первых дней болезни появляется генерализованная лимфаденопатия, преимущественно за счет увеличенных и болезненных заднешейных и затылочных лимфатических узлов. Зачастую симптомы общей инфекционной интоксикации и лимфаденопатии выражены слабо, отмечается лишь появление сыпи.
Заболевание может протекать в разных формах. Неосложненные формы типичной приобретенной краснухи протекают легко или в средней степени тяжести заболевания, симптомы общей инфекционной интоксикации выражены слабо. Температура тела может оставаться нормальной на всем протяжении болезни (у 22%) или повышаться до субфебрильной (48%), у остальных больных температура колеблется в пределах 38–39°С. Лихорадка чаще всего длится от 2 до 4 дней и лишь у отдельных больных (10%) дольше 5 дней. Очень частым проявлением краснухи является воспаление верхних дыхательных путей в виде синдромов ринита (у 70%) и фарингита (у 90%). Больные жалуются на умеренно выраженный сухой кашель, неприятные ощущения в горле (саднение, першение, сухость). На мягком небе иногда можно увидеть мелкие красные элементы (пятна Форхгеймера). У большинства больных (около 70%) наблюдается конъюнктивит, но менее выраженный, чем у больных корью.
Характерным проявлением краснухи является экзантема. Часто сыпь появляется уже в первый день болезни (40%), но может появиться на второй (35%), третий (15%) и даже на четвертый день (у 10% больных). Чаще сыпь вначале замечают на лице, а затем в течение суток она появляется на туловище и на конечностях. В отличие от кори отсутствует этапность высыпания. Сыпь более обильна на разгибательных поверхностях конечностей, на спине, пояснице, ягодицах. На лице сыпь менее выражена, чем на туловище (при кори наоборот). В отличие от скарлатины элементы сыпи расположены на фоне нормальной (не гиперемированной) кожи. Основным элементом сыпи является маленькое пятно (диаметром 5–7 мм), не возвышающееся над уровнем кожи, исчезающее при надавливании на кожу или при растягивании ее. Типичной является мелкопятнистая сыпь (у 95%), хотя у отдельных больных она может быть и крупнопятнистой (диаметр пятен 10 мм и более). Наряду с пятнами могут встречаться плоские розеолы диаметром 2–4 мм, реже наблюдаются папулы. Элементы сыпи, как правило, раздельные, однако некоторые из них могут сливаться, образуя более крупные пятна с фестончатыми краями, очень редко выявляются единичные петехии (у 5% больных). При слабо выраженной сыпи обнаружить ее иногда помогает прием провокации сыпи, для чего создается венозный застой на руке путем легкого перетягивания ее с помощью манжетки от тонометра, жгута или просто руками, при этом пульс должен прощупываться. Через 1–2 мин сыпь, если она есть, будет более заметной. Иногда в области элементов сыпи отмечается легкий зуд, но, как правило, никаких субъективных ощущений в области элементов сыпи не бывает. Элементы сыпи держатся чаще 2–3 дня.
У части больных в первые дни болезни выявляется небольшая гипотензия, отмечается увеличение печени (у 10%), селезенки (у 30% больных). Для периферической крови характерна умеренная лейкопения, лимфоцитоз и увеличение числа плазматических клеток (до 10–20%). Иногда наблюдаются моноцитоз и ускорение СОЭ.
Легкая степень тяжести краснухи наблюдается наиболее часто у детей (у взрослых заболевание протекает тяжелее) и характеризуется отсутствием или незначительными синдромом общей инфекционной интоксикации и респираторными проявлениями. Продолжительность лихорадка не превышает 2–3 дней, а ее выраженность не более 37,9°С. Период высыпания не превышает 1–2 дня, экзантема наблюдается в виде отдельных элементов сыпи. Может протекать без явлений лимфаденопатии.
При краснухе протекающей в средней степени тяжести отмечаются умеренно выраженные респираторные синдромы со стороны верхних дыхательных путей и синдром общей инфекционной интоксикации. Лихорадка достигает 38–39°С и продолжается в течение 3–4 дней. Период высыпаний длится до 5 дней, экзантема носит интенсивный характер. Может выявляться увеличение печени и селезенки. Часто наблюдается генерализованная лимфаденопатия с преимущественным увеличением затылочных, околоушных и заднешейных лимфатических узлов.
Тяжелая степень тяжести заболевания характеризуется выраженным синдромом общей инфекционной интоксикации с интенсивной головной болью, суставными и мышечными болями на фоне умеренных респираторных проявлений со стороны дыхательных путей, обильной, сливной и продолжительной сыпью с появлением геморрагических элементов в виде петехий. Отмечается высокая лихорадка (39–40°С) с продолжительностью пять и более дней. Наблюдаются генерализованная лимфаденопатия и гепатоспленомегалия. Могут развиваться различные осложнения.
Атипичная форма краснухи протекает легко, без экзантемы, она характеризуется незначительными респираторными синдромами со стороны верхних дыхательных путей и умеренно выраженной лимфаденопатией. Если больной отмечает контакт с краснухой, то в таких случаях можно подумать о данном заболевании. Это особенно важно при диагностике краснухи у беременных.
Еще более сложной задачей является распознавание инаппарантной формы краснухи. Частота этих форм остается неясной. Считается, что инаппарантное течение краснухи наблюдается в 5–6 раз чаще, чем клинически выраженное. Единственным способом выявления бессимптомных форм является обнаружение нарастания титра антител в парных сыворотках или обнаружение антител класса IgM в сыворотке крови обследуемых.
Врожденная краснуха. Течение болезни при внутриутробном заражении значительно отличается от обычной краснухи. Существует понятие «триада врожденной краснухи» (синдром врожденной краснухи), которая включает в себя пороки развития сердца – незаращение артериального протока, дефекты межжелудочковой и межпредсердной перегородок, стеноз легочного ствола, коарктация аорты, тетрада Фалло, транспозиция крупных сосудов; поражение глаз – помутнение роговицы, катаракты, хориоретинит, глаукома, микрофтальмия и поражение ЦНС в виде микроцефалии, умственной отсталости, глухоты. Дополнительными проявлениями этой триады дополнительно считают также тромбоцитопеническую пурпуру, увеличение печени и селезенки, задержку внутриутробного развития, интерстициальную пневмонию, миокардит или некроз миокарда и поражение костей в области метафиза. Перечень этих проявлений стали именовать расширенным синдромом врожденной краснухи.
Наиболее опасно инфицирование эмбриона вирусом краснухи в первые три месяца беременности. После рождения у ребенка могут выявляться и другие варианты пороков развития: «малый» краснушный синдром (триада Грегга) – поражение глаз, органа слуха, сердца; «большой» краснушный синдром – поражение ЦНС, костной системы, органов кроветворения, печени, селезенки и легких.
У некоторых детей выявлялись признаки гуморального и клеточного иммунодефицита, в дальнейшем у лиц с врожденной краснухой развивался сахарный диабет или прогрессирующий подострый панэнцефалит. Следует отметить, что врожденная краснуха наблюдается, в т. ч., после перенесенной бессимптомной (инаппарантной) краснухи в период беременности.
Осложнения и критические состояния. При приобретенной краснухе наиболее частым осложнением являются артриты с преимущественным поражением мелких суставов кистей рук, коленных и локтевых суставов. У взрослых больных (в большинстве случаев у женщин) они наблюдаются чаще, чем у детей. Могут развиваться другие более редкие осложнения: тромбоцитопеническая пурпура, невриты, полиневриты, пневмонии, отиты, синуситы, перикардиты.
Наиболее тяжелое осложнение – краснушный энцефалит , частота которого составляет один случай на 5000–7000 заболеваний краснухой. Признаки энцефалита появляются вскоре после исчезновения сыпи или на фоне экзантемы. Больные отмечают усиление головной боли, ухудшение общего самочувствия, в дальнейшем развиваются судороги, коматозное состояние, гемипарезы. Иногда возможны и менингеальные симптомы. Летальность при краснушных энцефалитах достигает 50%.
При заболевании беременной женщины краснухой плод подвергается большому риску, поскольку возможно формирование разнообразных пороков его развития и внутриутробных заболеваний. Частота поражения плода зависит от срока беременности. Заболевание краснухой на 3–4-й неделе беременности обусловливает врожденные уродства в 65–85% случаев, на 9–12-й неделе – в 30–35% и на 13–16-й неделе – в 10% случаев.
Критические состояния могут быть обусловлены, синдромом внутричерепной (церебральной) гипертензии, ОДН, ИТЭ.
Диагноз и дифференциальный диагноз. Распознавание типичных случаев заболевания во время эпидемической вспышки в коллективе не представляет трудностей. Диагноз спорадических случаев, особенно при атипичном течении, довольно сложен.
В лабораторной диагностике помогает характерная картина периферической крови (лейкопения, относительный лимфоцитоз, увеличение числа плазматических клеток).
Для этиологического подтверждения диагноза используют методы ИФА, реакция иммунофлюоресценции. При использовании ИФА в сыворотке крови определяют специфические антитела классов IgM и IgG. Кроме того, в некоторых случаях используется метод ПЦР, позволяющий обнаружить РНК вируса краснухи в назофаригеальных аспиратах, крови, синовиальной жидкости и других материалах выделенных от больного.
У беременных ИФА выполняют для установления инфицированности и возможности передачи вируса плоду. Первое исследование сыворотки крови беременной, контактировавшей с больным краснухой, проводят как можно раньше, но не позднее 12-го дня после контакта. Двукратное выявление антител класса IgG свидетельствует о перенесенном ранее заболевании и возможности сохранения беременности. В случае отсутствия специфических антител к краснухе в первой сыворотке крови и появление при повторном исследовании через 10–14 дней антител класса IgM при отсутствии антител класса IgG – это свидетельствует об активной инфекции с опасностью поражения плода. Через 10–14 дней проводят следующее (третье) серологическое обследование, продолжая медицинское наблюдение за беременной. При выявлении в сыворотке крови антител класса IgM и IgG женщину предупреждают о риске развития синдрома врожденной краснухи с соответствующей записью в медицинской документации. Решение о прерывании беременности женщина принимает самостоятельно.
Диагноз заболевания можно подтвердить посредством выделения вируса краснухи на культуре клеток, но данный метод довольно сложен и в практической работе не используется.
Дифференциальный диагноз проводят с заболеваниями, протекающими с мелкопятнистой экзантемой (аденовирусные и энтеровирусные заболевания, скарлатина, корь, инфекционный мононуклеоз, розовый лишай, токсические эритемы и др.).
Лечение. Заболевшие изолируются в домашних условиях, а в случаях осложнений, тяжелого течения заболевания или отсутствия условий для разобщения (организованные коллективы) – немедленно изолируются с последующей госпитализацией. Во время лихорадочного периода рекомендуется постельный или палатный режим. В период разгара болезни пациентам с краснухой, протекающей в средней и тяжелой степени тяжести назначается лечебная диета № 2 с последующим переходом на общую диету № 15.
Этиотропная терапия не разработана и не применяется по причине преимущественно легкого течения заболевания и небольшой частоты осложнений при приобретенной краснухе. При неосложненной краснухе используется патогенетическая и симптоматическая терапия. При краснушных артритах назначают НПВС и антигистаминные препараты. При появлении геморрагического синдрома назначают глюкокортикоиды (преднизолон в суточной дозе 90–120 мг внутривенно с постепенным снижением дозы, продолжительность общего курса 7–10 дней), гепарин по 20–30 тыс. ЕД в сутки (или антикоагулянты пролонгированного действия – фраксипарин, эноксапарин натрия). При развитии краснушного энцефалита применяют соответсвующую терапию.
Прогноз и исходы заболевания. Прогноз при краснухе благоприятный, за исключением краснушного энцефалита, при котором отмечается высокая летальность. При заболевании женщин в первые три месяца беременности рекомендуют ее прерывание. При врожденной краснухе некоторые дефекты развития (например, глухота) могут развиться позднее (спустя год).
Правила выписки. Переболевшие выписываются после клинического выздоровления, но не ранее 7 дней от начала высыпаний. Сроки выписки при осложнениях определяются их характером и продолжительностью.
Реабилитация. Реабилитационные мероприятия включают диету, с учетом преимущественного поражения органов или систем, лечебную физкультуру, физиотерапию, фармакологическую терапию препаратами, которые способствуют восстановлению нарушенных функций после перенесенных осложнений.
Диспансерное наблюдение. Диспансерному наблюдению у соответствующих специалистов подлежат переболевшие осложненными формами краснухи. При врожденной краснухе некоторые дефекты развития могут появиться через три месяца и более. Наблюдение включает регулярные серологические и вирусологические исследования.
Профилактика и противоэпидемические мероприятия в очаге осуществляются в соответствии с санитарно-эпидемиологическими правилами «Профилактика кори, краснухи и эпидемического паротита» (СП 3.1.2952-11, 2011).
Надежным методом предупреждения краснухи является вакцинация. В соответствии с национальным календарем профилактических прививок применяется схема иммунизации с двукратным введением вакцины. Первую вакцинацию проводят детям в возрасте 12 мес., вторую прививку делают детям в возрасте 6 лет. Вакцинация проводится одновременно против кори, краснухи и паротита.
Заболевшие краснухой подлежат изоляции до 7-го дня с момента появления сыпи. В отношении контактных лиц никаких ограничительных мероприятий не предусмотрено. В Российской Федерации экстренная профилактика краснухи в очагах не проводится.
Военно-врачебная экспертиза. Военнослужащие после тяжелых форм заболевания представляются на ВВК для предоставления отпуска по болезни и решения вопроса о категории годности к военной службе.
Эпидемический паротит
Эпидемический паротит — острая вирусная болезнь, характеризующаясяся лихорадкой, общей интоксикацией, болезненным увеличением одной или нескольких слюнных желез, нередко поражением других железистых органов (орхоэпидемит, панкреатит, оофорит) и центральной нервной системы (менингит).
Шифр по МКБ-10 – В26.
Исторические сведения. Заболевание было описано в первой книге «Epidemics» Гиппократа еще в V в. до н.э (эпидемическая вспышка на острове Фасос Греция). В 1790 г. Р. Гамильтон (R. Hamilton) выделил симптомы поражения ЦНС и орхит как частые проявления заболевания. В XIX в. возникло название «эпидемический паротит», которое отражало представление о болезни как о поражении околоушных слюнных желез. Отечественные врачи А.Д. Романовский, изучавший в г. Ново-Архангельском на Алеутских островах эпидемию паротита в 1843-1844 гг.., и И.В. Троицкий в доктрской диссертации «Материалы к учению об эпидемическом перипаротите» (1883), а также Н.Ф. Филатов (1891) описали эпидемический паротит как заболевание, поражающее не только слюнные железы, но и организм в целом. В начале XX в. эти научные воззрения в своих трудах поддержал профессор Военно-медицинской академии Н.Я. Чистович. В 1934 г. К. Джонсон и Э. Гудпасчер путем заражения макак-резус через стенонов проток доказали инфекционную природу этого заболевания. У зараженных животных развились клинические симптомы, сходные с эпидемическим паротитом у людей, сопровождавшиеся выработкой специфических антител в крови. В дальнейшем вирус, изолированный на обезьянах, был адаптирован к развивающимся куриным эмбрионам, а затем выделен на эмбрионах и непосредственно от больных людей.
В 1954 г А.А. Смородинцев и Н.С. Клячко разработали живую аттенуированную вакцину и в 1956-1957 гг. ей было привито свыше 30000 детей в Ленинграде. В результате ее широкого применения удалось резко снизить заболеваемость эпидемическим паротитом. В монографии профессора кафедры инфекционных болезней Военно-медицинской академии А.П. Казанцева А.П. «Эпидемический паротит» (1988) были раскрыты звенья патогенеза заболевания, предложена оптимальная для практического применения классификация клинических форм, показана решающая роль ГКС в купировании орхитов.
Этиология. Вирус эпидемического паротита отнесен к семейству Paramyxoviridae, роду Rubulavirus, виду Mumps virus.
Морфология. Для вируса паротита характерен полиморфизм. Вирионы могут иметь округлую форму, наряду с которой встречаются грушевидные, отросчатые и гигантские формы. Диаметр округлых вирионов колеблется от 120 до 300 нм. Выделяют 12 генетических групп вируса, обозначенных буквами от A до L. На территории России регистрируются два генотипа вируса паротита — С (А20, А22, A23) и Н (А21, А24).
Вирус эпидемического паротита содержит одноцепочечную (-)онРНК окруженную белковой оболочкой (нуклеокапсид). Вирус обладает гемагглютинирующей, нейраминидазной, гемолитической и симпластобразующей активностью. Культивируется на 7-8-дневных куриных эмбрионах и клеточных культурах. При размножении вызывает образование многоядерных гигантских клеток-симпластов и эозинофильных включений. Лабораторные животные малочувствительны к вирусу паротита, только у обезьян удаётся воспроизвести заболевание, сходное с паротитом человека.
Антигенная структура вируса стабильна. Содержит антигены, способные вызвать образование нейтрализующих и комплементсвязывающих антител, а также аллерген, который можно использовать для постановки внутрикожной пробы. Аттенуированный штамм вируса (Л-3) используется в качестве живой вакцины.
Нестоек, инактивируется при нагревании, УФО, воздействии поверхностно-активных веществ. При 20˚С сохраняет инфекционность в течение 4–6 дней, при 4°С – до 1 мес., при – 2°С – до 3 мес.
Эпидемиология. До начала вакцинации и в первые годы после ее введения (до 1984 г.) заболеваемость в России составляла в среднем 412,8 на 100 тыс. населения. В последующие годы она значительно снизилась – от 13,9 на 100 тыс. населения в 2001 г. до 0,18 – 0,13 на 100 тыс. в 2014 – 2015 гг., сооответственно. За 2015 г. в РФ зарегистрировано всего 193 случаев паротита, в том числе 83 у детей до 14 лет.
Восприимчивость к инфекции высокая и зависит от протективного уровня антител. Чаще болеют дети. Лица мужского пола болеют паротитом в 1,5 раза чаще, чем женщины.
Резервуары и источники возбудителя. Источником инфекции является только человек (больные манифестными, стертыми, атипичными и инаппарантными формами паротита). Больной становится заразным за 1-2 дня до появления клинических симптомов и в первые 5 дней болезни.
Механизм передачи возбудителя. Механизм передачи инфекции – воздушно-капельный. Вирус выделяется во внешнюю среду со слюной и передаётся воздушно-капельным путём. Нельзя полностью исключить возможность передачи через загрязнённые предметы (например, игрушки).
До введения в практику вакцинации заболеваемость характеризовалась выраженной сезонностью. Максимум заболеваемости приходился на март-апрель, минимум – на август-сентябрь. Через 1-2 года наблюдались периодические подъёмы заболеваемости, как в виде спорадических заболеваний, так и эпидемических вспышек. Для эпидемического паротита характерна очаговость: почти в четверти детских дошкольных учреждениях регистрировались очаги с 15 и больше случаями заболевания. Вспышки эпидемического паротита характеризуется длительным и вялым течением.
Патогенез и патологическая анатомия. Воротами инфекции служит слизистая оболочка верхних дыхательных путей (возможно, миндалины), где происходит внедрение, репродукция и накопление вируса. В дальнейшем в результате первичной вирусемии происходит проникновение вируса в разные органы. Наибольшее значение для размножения вируса имеют слюнные железы, затем поджелудочная железа, яички и их придатки, яичники, менингеальные оболочки и СМЖ. Поскольку интенсивность размножения вируса в других органах, кроме слюнных желез, мала, то клинически выраженных изменений в деятельности этих органов зачастую не наблюдается. Однако поражение нервной системы, а также и других железистых органов может наступать не только после поражения слюнных желёз, но и одновременно, раньше и даже без поражения их (редко). После первичной вирусемии, фиксации и накопления вируса паротита в околоушных слюнных железах, наступает новая фаза – вторичная вирусемия. Количество циркулирующих в крови вирусов значительно увеличивается, происходит гематогенное обсеменение массивными дозами возбудителя различных органов. Появляются клинические признаки поражения этих органов. В зависимости от локализации возбудителя и выраженности того или иного органа клинические проявления заболевания могут быть разнообразными. После 10-15-го дня от начала болезни развитие новых органных поражений наблюдается очень редко, так как начинают активно действовать различные компоненты иммунной защиты.
В ходе репродукции вируса в клетках хозяина можно выделить ряд стадий: 1) адсорбция вирионов на клетках; 2) проникновение их в клетку и «раздевание»; 3) биосинтез вирусных макромолекул; 4) сборка субвирусных частиц и дочерних вирусных частиц; 5) высвобождение дочерних вирионов.
В органах-мишенях вирус вызывает картину серозного воспаления. В слюнной железе отмечаются отек и лимфогистиоцитарная инфильтрация соединительнотканной стромы, иногда определяются кровоизлияния. Эти изменения сопровождаются повреждением паренхиматозных элементов. Они локализуются главным образом вокруг выводных протоков и кровеносных сосудов. Протоки желез расширены и заполнены белковой массой с примесью клеток, что затрудняет эвакуацию содержимого, приводит к дегенерации эпителия канальцев и повреждению железистых клеток. Сходный процесс наблюдается нередко в яичках, ЦНС, реже в щитовидной, поджелудочной, молочной железах и в других органах. Воспалительный процесс в поджелудочной железе может соответствовать развитию некротического панкреатита с поражением как эндокринной, так и экзокринной ткани железы, что в тяжелых случаях приводит к ее атрофии с развитием диабета.
При орхите выявляются отек яичек, периваскулярная лимфоидная инфильтрация, очаговые кровоизлияния и разрушение герминального эпителия, в семенных канальцах скапливается клеточный детрит, фибрин и нейтрофильные лейкоциты. Дегенеративные изменения сперматогенного эпителия выявляют и у мужчин без клинических признаков орхита. В тяжелых случаях, чаще при двусторонних поражениях, результатом воспаления может наступить атрофия яичек различной степени выраженности. В придатках яичек воспаляется соединительная ткань, эпителий остается неповрежденным. Эпидидимит всегда сочетается с орхитом. Воспалительно-дегенеративные процессы могут быть в яичниках с возможной их последующей атрофией. У женщин может развиться острый вульвовагинит, бартолинит и специфический мастит.
Менингиты имеют серозный характер. Для раннего паротитного энцефалита (возникающего на фоне увеличения околоушной железы на 1-й неделе болезни) характерен лизис нейронов без демиелинизации, возникающий в результате прямого повреждающегося действия вирусов. Поздние энцефалиты (2-я неделя и позже) обусловлены преимущественно аутоиммунными реакциями и сопровождаются процессами демиелинизации.
Поражение периферических нервов, миокарда, почек, суставов встречается редко. Повреждение лицевого нерва чаще носит механический характер за счет его сдавления увеличенной околоушной железы. Поражение периферических нервов выявляется на 2-3-ой неделе, развитие их обусловлено аутоиммунными механизмами. Очень редко возможно развитие синдрома Гийена–Барре, который может протекать по типу восходящего паралича Ландри, приводящего к летальному исходу. Вследствие поражения вирусом кортиевого органа наступает потеря слуха.
Миокардит наблюдается у менее чем у 1% больных, чаще появляется на 2-й неделе от начала болезни.
Паротитный нефрит протекает по типу острого гломерулонефрита с умеренно-выраженными мочевым синдромом, гематурией и артериальной гипертензией, реже развивается интерстициальный нефрит. Хронических форм не наблюдается.
Артриты наблюдаются преимущественно у больных старше 10 лет. Они развиваются обычно у больных с двусторонним поражением околоушных слюнных желез, часто с другими осложнениями. Вирус поражает синовиальные клетки, вызывая серозное воспаление суставов, не исключена роль и иммунопатологических механизмов.
Симптомы и течение заболевания. Для понимания клинических проявлений эпидемического паротита наиболее ценной является классификация, разработанная на кафедре инфекционных болезней Военно-медицинской академии профессором А.П. Казанцевым (1988). Эта классификация предполагает выделение следующих форм:
A. Манифестные формы:
1. Неосложнённые: поражение только слюнных желёз, одной или нескольких.
2. Осложнённые: поражение слюнных желёз и других органов (менингит, менингоэнцефалит, панкреатит, орхит, мастит, миокардит, артриты, нефрит).
По тяжести течения: лёгкие (в том числе стёртые и атипичные); среднетяжёлые; тяжёлые.
Б. Инаппарантная форма инфекции.
В. Резидуальные явления эпидемического паротита: атрофия яичек; бесплодие; диабет; глухота; нарушение функций ЦНС.
Принимая во внимание патогенез заболевания с учетом современных представлений осложненные формы паротита (панкреатит, орхоэпидемит, менингит и др.) следует расценивать как проявление основного заболевания.
В классификации манифестных форм эпидемического паротита использовано два критерия: наличие или отсутствие осложнений и тяжесть заболевания. Далее указана возможность инаппарантного (бессимптомного) течения инфекции и выделены в классификации резидуальные явления, которые длительно (часто пожизненно) сохраняются после элиминации вируса паротита из организма больного. Необходимость этого раздела определяется тяжестью последствий инфекции (бесплодие, снижение слуха и др.).
К неосложнённым формам традиционно относят те случаи болезни, когда поражены только слюнные железы (одна или несколько). При осложненных формах поражение слюнных желёз является обязательным компонентом клинической картины, но, кроме того, развивается поражение других органов, чаще желёз (половых, поджелудочной, молочных и др.), а также нервной системы (менингит, энцефалит, синдром Гийена–Барре), миокарда, суставов, почек.
Инкубационный период продолжается от 11 до 23 дней (чаще 15-19 дней). Начало заболевания острое, лишь у некоторых больных за 1-2 дня до развития типичной картины болезни наблюдаются продромальные явления в виде разбитости, недомогания, болей в мышцах, головной боли, познабливания, нарушения сна и аппетита. С развитием воспалительных изменений слюнной железы все симптомы интоксикации становятся более выраженными, отмечаются сухость во рту, боли в области уха, усиливающиеся при жевании, разговоре.
К лёгким формам паротита относятся заболевания, протекающие с субфебрильной температурой тела, с отсутствием или слабо выраженными признаками интоксикации, без осложнений.
Среднетяжёлые формы эпидемического паротита характеризуются фебрильной температурой (38-39,9○С), длительной лихорадкой и выраженными симптомами общей интоксикации (озноб, головная боль, артралгия и миалгия), значительным увеличением слюнных желёз, чаще двусторонним паротитом, наличием поражения одного из органов (напр., орхоэпидемит или менингит).
Тяжёлые формы эпидемического паротита характеризуются высокой температурой тела (40○С и выше), длительным её повышением (до двух недель и более), резко выраженными признаками общей интоксикации: астенизация, резкая слабость, отмечается тахикардия, снижение АД, нарушение сна, анорексия и др. Паротит почти всегда двухсторонний, поражение других органов, как правило, множественные. Токсикоз и лихорадка протекают в виде волн, каждая волна связана с проявлением поражения очередного органа. Иногда тяжёлое течение наблюдается не с первых дней болезни. В начале болезни течение среднетяжелое, а иногда и легкое, но с присоединением поражения других органов состояние резко меняется, становится тяжелым. К этому времени изменения слюнных желез могут быть уже менее выраженными. Прямой связи между выраженностью воспаления и количеством пораженных слюнных желез с одной стороны, и тяжестью течения болезни с другой, нет. Таким образом, окончательно тяжесть течения болезни можно определить лишь в конце болезни при оценке всех ее периодов.
К стертым формам относятся заболевания с нормальной температурой тела и слабо выраженными признаками воспаления околоушных желез. При атипичных формах признаков паротита может не быть, а выявляются лишь симптомы субмаксиллита.
Инаппарантные (бессимптомные) формы эпидемического паротита выявляются на основании специфических лабораторных исследований, чаще всего методом ИФА. В практической работе выявление инаппарантного течения инфекции важно при контакте с больным паротитом беременных женщин, ранее им не болевших.
Необходимо так же помнить о возможности резидуальных явлений, которые могут проявляться через много лет после перенесенного паротита. Например, атрофия яичек и бесплодие чаще наблюдается у больных паротитом, осложненным орхитом, особенно двусторонним, хотя описаны случаи паротитного бесплодия у мужчин и без выраженного орхита в острую фазу болезни.
В типичных случаях лихорадка достигает максимальной выраженности на 1-2 день болезни и продолжается 4-7 дней, снижение температуры чаще происходит литически. При неосложненных формах эпидемического паротита максимальная температура тела отмечается в первые дни от начала заболевания. Наиболее характерной для эпидемического паротита у взрослых является одноволновая лихорадка (70%), реже наблюдается двухволновая (около 24%), и еще реже три волны (6%). При наличии же осложнений повторное повышение температуры тела нередко превышает уровень первоначальной гипертермии. Характерной особенностью температурной кривой при паротите является тенденция к волнообразности. Обычно наблюдается одна волна температурной кривой, если появляется поражение другого органа или в процесс вовлекается другая слюнная железа, то часто появляется вторая волна лихорадки; если же они наслаиваются друг на друга в первые дни, то это приводит лишь к некоторому удлинению температурной кривой. При множественных последовательно развивающихся поражениях органов может наблюдаться и третья волна лихорадки. Более трех волн лихорадки при паротите не наблюдается, так как к этому времени уже наступает иммунная перестройка, и даже появление новых органных поражений (обычно слабо выраженных) не ведет к повышению температуры тела.
Большое диагностическое значение имеет симптом Мурсу (Moursou) – воспалительная реакция слизистой оболочки в области выводного протока поражённой околоушной железы. Он появляется рано, иногда в конце инкубационного периода. Частота его выявления варьирует от 50% до 90%. Симптом Мурсу считают патогномоничным для эпидемического паротита.
Характерный симптом болезни – поражение слюнных желёз. У взрослых преимущественно определяется двустороннее увеличение околоушных слюнных желез (72%), реже одностороннее увеличение околоушной слюнной железы (28%) и двустороннее увеличение околоушных желез в сочетании с субмаксиллитом – (24%), крайне редко встречается поражение подъязычной слюнной железы. Для оценки выраженности припухлости различают три степени увеличения слюнных желез. I степень характеризуется небольшим увеличением слюнной железы или обеих слюнных желез. При этом изменения железы выявляются лишь пальпаторно. II степень увеличения околоушной слюнной железы может быть выявлена уже при осмотре больного.. III степень увеличения околоушной слюнной железы характеризуется значительной припухлостью области околоушной слюнной железы, хорошо заметной при осмотре в любом ракурсе. Характерно для эпидемического паротита отсутствие реакции регионарных лимфатических узлов. Не бывает также и гнойного расплавления слюнной железы. Увеличение слюнной железы быстро прогрессирует и в течении трех дней достигает максимума. На этом уровне припухлость сохраняется 2-3 дня и затем постепенно (в течении 7-10 дней) уменьшается.
В клинической картине эпидемического паротита большое значение придают болевым точкам. Впервые эти точки описал Н.Ф. Филатов (симптом Филатова). В основном практическое значение имеют три болевые точки: впереди мочки уха (наблюдается у 25%), в области верхушки сосцевидного отростка (25-30%) и в области вырезки нижней челюсти (около 40%) на стороне поражения. Для диагностики эпидемического паротита важнее выявить увеличение и болезненность околоушных слюнных желез, а не только болезненность в определенных точках.
На паротитный менингит приходится около 80% всех серозных менингитов детей. У лиц мужского пола менингит выявляется в три раза чаще, чем у женщин. Как правило, симптомы поражения ЦНС появляются после воспаления слюнных желёз, но может быть и одномоментное поражение (у 25-30%). У 10% больных менингит развивается раньше воспаления слюнных желёз, а у отдельных больных паротитом менингеальные знаки не сопровождаются выраженными изменениями слюнных желёз. Менингит начинается остро, нередко бурно (чаще на 4-7 день болезни): появляется озноб, вновь повышается температура тела, беспокоит сильная головная боль, рвота не приносящая облегчения, вскоре развивается менингеальный синдром (ригидность затылочных мышц, симптомы Кернига, Брудзинского). Симптомы менингита и лихорадки исчезают через 10-12 дней. У некоторых больных, помимо менингеальных симптомов, развиваются признаки энцефалита (менингоэнцефалит) или энцефаломиелита (1 из 6000 случаев паротита). Отмечается нарушение сознания, вялость, сонливость, неравномерность сухожильных и периостальных рефлексов, парезы лицевого нерва, вялость зрачковых рефлексов, пирамидные знаки, гемипарезы.
Орхиты и орхоэпидимиты наблюдаются у подростков и взрослых мужчин. Частота их зависит от тяжести болезни (при среднетяжёлых и тяжёлых формах орхиты возникают примерно у половины больных). Признаки орхита отмечаются на 5-7 день от начала заболевания, и характеризуются новой волной лихорадки (до 39-40○С), появлением сильных болей в области мошонки и яичка, иногда иррадиирущих в нижние отделы живота. Яичко увеличивается, достигая размеров гусиного яйца, иногда увеличивается придаток (эпидидимит) . При осмотре мошонка растянута, при одностороннем орхите – асимметрична. Кожа мошонки гиперемирована, иногда с цианотичным оттенком, гладкая, блестящая; сосуды на ней расширены, вены набухшие. Пораженное яичко становится напряженным, уплотненным, размеры его увеличены, что связано с отеком белочной оболочки и перегородок яичка. Поверхность яичка ровная, пальпация резко болезненна; боли иррадиируют по семенному канатику, может отмечаться иррадиация в пояснично-крестцовую область. Лихорадка сохраняется 3-7 дней. Увеличение яичка прогрессирует в течение 2-3 суток, затем без особой динамики в размерах максимальное увеличение сохраняется в течение 1-3 дней, после чего начинается медленное уменьшение его размеров, проходят боли. В дальнейшем (через 1-2 мес) могут появиться признаки атрофии яичка, которые отмечаются у 50% больных, перенесших орхит и не получавших ГКС в начале развития осложнения. При паротитном орхите в качестве редкого осложнения наблюдался инфаркт лёгкого, как следствие тромбоза вен простаты и тазовых органов. Ещё более редким, но крайне неприятным осложнением паротитного орхита является преапизм (длительная болезненная эрекция полового члена, не связанная с половым возбуждением).
Острый панкреатит развивается обычно на 4-7 день болезни без каких-либо предвестников. Появляются резкие боли в эпигастральной области (основная жалоба), тошнота, многократная рвота, метеоризм (триада Мондора – боль, рвота, метеоризм) лихорадка, при осмотре у некоторых больных отмечается напряжение мышц живота и симптомы раздражения брюшины. Могут определяться симптомы Мейо-Робсона (выраженная болезненность реберно-позвоночного угла особенно слева), Керте (поперечная болезненная резистентность передней брюшной стенки в проекции поджелудочной железы), Воскресенского (феномен отсутствия пульсации брюшного отдела аорты вследствие увеличения в размерах поджелудочной железы и отека забрюшинной клетчатки). Характерно повышение активности амилазы мочи, которое сохраняется до месяца, тогда как другие симптомы панкреатита наблюдаются 7-10 дней.
Осложнения и критические состояния. Наблюдаются в основном со стороны нервной системы (энцефалит, синдром Гийена–Барре, лабиринтит), а также миокардит, нефриты, артриты.
Поражение органа слуха иногда приводит к полной глухоте. Первым признаком служит появление шума и звона в ушах. О лабиринтите свидетельствует головокружение, рвота, нарушение координации движений. Обычно глухота бывает односторонней (на стороне поражения слюнной железы). В период реконвалесценции слух не восстанавливается.
Артриты развиваются примерно у 0,5% заболевших, чаще у взрослых, причём у мужчин чаще, чем у женщин. Наблюдаются они впервые 1-2 недели после поражения слюнных желёз, хотя возможно их появление и до изменения желёз. Поражаются чаще крупные суставы (лучезапястные, локтевые, плечевые, коленные и голеностопные). Суставы опухают, становятся болезненные, в них может развиться серозный выпот. Артриты могут сохраняться до 2 мес.
Вирус паротита у беременных может обусловливать поражение плода. У детей отмечается своеобразное изменение сердца – так называемый первичный фиброэластоз миокарда.
Другие осложнения (простатиты, оофариты, маститы, тиреоидиты, бартонилиты, синдром Гийена–Баре, невриты, полиневриты, нефриты, миокардиты, тромбоцитопеническая пурпура) наблюдаются редко.
Диагноз и дифференциальный диагноз. В типичных случаях распознавание эпидемического паротита трудности не представляет. Стертые, атипичные и инаппарантные (бессимптомные) формы эпидемического паротита остаются нераспознанными. Они представляют наибольшую опасность для коллективов как источники инфекции.
В начальный период болезни характерна лейкопения и очень редко наблюдается лейкоцитоз. При исследовании мочи имеет значение определение активности амилазы мочи (диастазы). Диагностическое значение имеет не столько абсолютный показатель, а его динамика в ходе заболевания. Для неосложненного эпидемического паротита характерно нарастание амилазы мочи через 3-5 дней, затем ее нормализация примерно к 10 дню болезни.
При эпидемическом паротите так же происходит повышение амилазы крови, однако информативность ее меньше, чем амилазы мочи. Повышение амилазы при паротитном панкреатите может сохраняться более месяца и не коррелирует с тяжестью панкреатита. Для диагностики панкреатита наряду с исследованием амилазы крови, диастазы мочи необходимо определять уровень в крови липазы, трипсина и его ингибиторов, а также использовать инструментальные методы исследования поджелудочной железы и гепатобилиарной системы (УЗИ, КТ, МРТ). Только сочетание явных клинических признаков панкреатита, подтвержденных лабораторными и инстументальными методами исследования позволяет установить диагноз острого панкреатита, осложнившего эпидемический паротит.
Из специфических методов лабораторной диагностики используется метод ИФА. Маркером текущей инфекции являются обнаруженные вирусспецифические антитела (IgM). Острую инфекцию дифференцируют от перенесённой в прошлом по определению авидности специфических IgG на 15-45-й день от начала инфицирования.
Дифференциальный диагноз. Неосложненный эпидемический паротит приходится дифференцировать с терапевтическими заболеваниями: рецидивирующий аллергический паротит, болезнь Микулича, синдром Микулича, болезнь Предтеченского-Гужеро-Шегрена; а также с хирургическими: гнойный паротит, гнойный лимфаденит, флегмоны челюстно-лицевой области, камни протоков слюнных желез, опухоли околоушной слюнной железы.
Паротитный серозный менингит следует дифференцировать от серозных менингитов другой этиологии. Основа диагностики – определение РНК вируса эпидемического паротита в СМЖ методом ПЦР.
Острый панкреатит приходится дифференцировать от острых хирургических заболеваний брюшной полости (острый холецистит, аппендицит и др.), в ряде случаев от абдоминальной формы инфаркта миокарда.
Орхиты при эпидемическом паротите дифференцируют от туберкулёзного, бруцеллезного, гонорейного и травматического орхита.
Лечение. Госпитализации в инфекционный стационар подлежат больные тяжелыми формами паротита, пациенты из учреждений с круглосуточным пребыванием детей и взрослых, общежитий, проживающие в неблагоприятных бытовых условиях (коммунальные квартиры, наличие декретированных контингентов в семье и т.д.).
Этиотропного лечения нет.
Основной задачей лечения больных эпидемическим паротитом является предупреждение возможных поражений органов и систем. Важно соблюдение постельного режима не менее 10 дней. У мужчин, не соблюдавших постельный режим в течении 1-й недели, орхит развивался в три раза чаще (у 75%), чем у лиц, госпитализированных в первые три дня болезни (у 26%).
Питание пациентов соответствует диете №2. При развитии острого панкреатита необходима соответствующая коррекция диеты.
При неосложненном эпидемическом паротите в ряде случаев назначаются инфузионная терапия, антигистаминные препараты и НПВС. Для очищения ротовой полости предпочтительней использовать 2% раствор гидрокарбоната натрия, который способствует лучшему удалению слизи.
При орхитах как можно раньше назначают ГКС. В зависимости от выраженности орхита начинают терапию с 40-60 мг преднизолона внутрь в течении нескольких дней, после разрешение орхита дозу уменьшают каждый день на 5 мг (снижение начинают с вечерней дозы). Курс лечения составляет 5-7 дней. Возможно использование других ГКС в эквивалентных дозах. Таким больным рекомендуют ношение до купирования острых явлений орхита суспензория или плавок.
При среднетяжелом и тяжелом течении менингита применяют короткий курс парантерального введения ГКС. Патогенетическая терапия при менигите направлена на устранение церебральной гипертензии, предупреждение развития отека-набухания головного мозга и описана в разделе лечения менингококковой инфекции.
При развитии острого панкреатита может потребоваться перевод больного в хирургический стационар.
Прогноз и исходы заболевания. Прогноз благоприятный, летальные исходы бывают очень редко (1 на 100 000 заболевших); однако следует учитывать возможность глухоты и атрофии яичек с последующей азоспермией. После паротитных менингитов и менингоэнцефалитов длительное время наблюдается астенизация.
Правила выписки. Больные неосложненными формами эпидемического паротита выписываются после полного выздоровления не ранее 9-го дня госпитализации.
Реабилитация. Реконвалесцентам с выраженной постинфекционной астенией амбулаторно проводится терапия общеукрепляющими и адаптогенными препаратами. Больным перенесшим осложнения проводятся реабилитационные мероприятия в зависимости от нарушения функции пораженного органа или системы по рекомендациям профильных врачей специалистов.
Диспансерное наблюдение. Длительность диспансерного наблюдения и периодичность обследования определяется в зависимости от состояние пораженного органа или системы после тяжелой формы заболевания, осложнения, наличие резидуальных явлений врачом специалистом: гастроэнтерологом, невропатологом, ЛОР-врачом, сурдологом, урологом, андрологом и др.
Профилактика и противоэпидемические мероприятия в очаге осуществляются в соответствии с санитарными правилами «Профилактика кори, краснухи и эпидемического паротита» (СП 3.1.2952-11). За лицами, общавшимися с больными эпидемическим паротитом, устанавливается медицинское наблюдение в течение 21 дня с момента выявления последнего случая заболевания в очаге. Дезинфекции в очагах паротита не проводится. Иммунизации против эпидемического паротита по эпидемическим показаниям подлежат лица, имевшие контакт с больным (при подозрении на заболевание), не болевшие эпидемическим паротитом ранее, не привитые или не имеющие сведений о прививках против эпидемического паротита. Она проводится в течение 7 дней с момента выявления первого больного в очаге.
Для специфической профилактики используется живая паротитная вакцина.
Согласно Национальному календарю профилактических прививок первую плановую вакцинацию от эпидемического паротита проводят в 12 месяцев, вторую в 6 лет. Профилактическим прививкам против эпидемического паротита в плановом порядке подлежат дети в возрасте от 15 мес. до 7 лет, не болевшие ранее паротитом. Вакцина обеспечивает защитный уровень антипаротитных антител через 6-7 недель.
Военно-врачебная экспертиза. Необходимость экспертизы возникает у реконвалесцентов после перенесения тяжелых форм болезни, после осложнений, при развитии резидуальных последствий эпидемического паротита (глухота, диабет, остаточные явления менингита и др.).
Герпесвирусные инфекции
Заболевания, обусловленные вирусами семейства Herpesviridae, называются герпесвирусными инфекциями. Семейство герпесвирусов объединяет тропность к органам и тканям, пожизненная персистенция в организме человека и способность вызывать многообразные манифестные формы заболевания при возникновении иммунодефицита.
Вирусы семейства Herpesviridae широко распространены в природе. Выделено и классифицировано свыше 100 представителей этого семейства, вызывающих заболевания у человека, диких и домашних животных, земноводных и пресмыкающихся. Из них 8 антигенных серотипов вирусов герпеса выделены от человека: вирус простого герпеса 1-го и 2-го типов (ВПГ-1 и ВПГ-2), вирус ветряной оспы – опоясывающего герпеса (ВВО-ОГ), или вирус герпеса человека 3-го типа (ВГЧ-3), ВГЧ 4-го типа – вирус Эпштейна-Барр (ВЭБ). Вирус назван в честь английского вирусолога профессора М. Эпштейна и его аспирантки Ивонны Барр (M. A. Epstein, Y. Barr, 1964). ВГЧ 5-го типа – цитомегаловирус (ЦМВ), вирус герпеса человека 6-го типа, который в настоящее время подразделяют на два подтипа: А и В (ВГЧ-6А и ВГЧ-6В), вирус герпеса 7-го типа (ВГЧ-7) и, наконец, вирус герпеса человека 8-го типа (ВГЧ-8), ассоциированный с саркомой Капоши.
Все герпесвирусы являются ДНК-содержащими, сложноустроенными вирусами (есть суперкапсид). Они обладают большим сходством геномов, морфологии, репродукции. Также их объединяет способность вызывать латентную, острую и хроническую инфекции у человека.
Разработана и принята классификация герпес-вирусов, в которой семейство герпесвирусов подразделяют на три подсемейства — α, β и γ (табл. 24).
Таблица 24
Классификация вирусов герпеса
| Подсемейство | Род | Вирус |
| A-герпесвирусы (A lhpagerpesvirinae) | Вирус простого герпеса (Simplexvirus) | Вирус простого герпеса 1-го типа (НSV-1) Вирус простого герпеса 2-го типа (НSV-2) |
| Ветряной оспы — опоясывающего герпеса (Varicellovirus) | Вирус ветряной оспы (VZV, ВВО-ОГ) | |
| B-герпесвирусы ( Ве ta herpesvirinae) | Цитомегаловирус (Cytomegalovirus) | Цитомегаловирус (CMV) |
| Вирусы, образующие розеолы ( Roseolavirirus) | Вирус герпеса человека 6А типа (HHV – 6A) | |
| Вирус герпеса человека 6В типа (HHV – 6В) | ||
| Вирус герпеса человека 7А типа (HHV – 7) | ||
| Γ-герпесвирусы (Gammaherpesvirinae) | Лимфотропные вирусы ( Lymphocryptovirus) | Вирус Эпштэйна – Барр (EBV) |
| Вирус, ассоциированный с саркомой Капоши (Rhadinovirus) | Вирус герпеса человека 8-го типа (HHV – 8) |
Α-герпесвирусы (Alphagerpesvirinae) — характеризуются коротким циклом репродукции с цитопатическим эффектом в клетках инфицированных культур, патогенны для большинства хозяев. Эти возбудители обычно персистируют в ЦНС — в сенсорных ганглиях, поддерживая латентную инфекцию, которая нередко проявляется как периодически обостряющееся заболевание. К подсемейству Alphaherpesvirinae принадлежит род Simplexvirus (HSV), в который включены патогенные для человека HSV-1 (вирус простого герпеса 1-го типа) и HSV-2 (вирус простого герпеса 2-го типа), а также род Varicellovirus, относящийся к нему вирус герпеса человека 3-го типа — вирус ветряной оспы — опоясывающего герпеса ( varizella- zoster virus, VZV). Таким образом, типичными представителями подсемейства α-герпесвирусов являются ВПГ-1, ВПГ-2, ВВО-ОГ (табл. 24, 25).
Β-герпесвирусы (Betaherpesvirinae) отличаются ярко выраженной патогенностью для более узкого круга хозяев, менее выраженной цитопатичностью клеток, длительным циклом репликации; вызывают возникновение манифестной и латентной инфекции в слюнных железах, почках и других органах; могут быть причиной генерализованных поражений у новорожденных детей и взрослых при иммунодефицитных состояниях. К подсемейству Betaherpesvirпае принадлежит высоко патогенный для человека род Cytomegalovirus (ЦМВ, CMV — цитомегаловирус), а также род Roseolovirus, в который включены ВГЧ-6А, ВГЧ-6В, ВГЧ-7 (HHV-6, HHV-7) (табл. 35, 36). Их связывают с внезапной экзантемой у детей и взрослых и, возможно, синдромом хронической усталости.
Γ-герпесвирусы (Gammaherpesvirinae) характеризуются тропизмом к В- или Т-лимфоцитам (но репродуцируются в основном в В-клетках), лимфоидным клеткам, в которых они способны размножаться и длительно персистировать. Эти вирусы нередко являются причинами тяжелых, смертельных лимфом и лейкемий, развитию которых способствуют дополнительные факторы — экзогенные, генетические и другие. Патогенные для человека вирусы отнесены к роду Lymphocryptovirus. Это вирус Эпштэйна-Барр (EBV, ВГЧ-4) — возбудитель инфекционного мононуклеоза, который также может вызывать развитие назофарингиальной карциномы, волосатой лейкоплакии и лимфомы Беркитта (D.P. Burkitt, 1958).
ВГЧ-8 ассоциирован с саркомой Капоши, относится к роду радиновирусов.
Даже схематичное изложение сущности герпесвирусных инфекций показывает, какую серьёзную медико-социальную проблему она представляет для современного здравоохранения. Это обусловлено многими факторами: значительным антигенным многообразием и пантропностью вирусов семейства герпеса, выраженным клиническим полиморфизмом вызываемых ими заболеваний, длительной персистенцией с поражением различных органов и систем, в том числе и клеток иммунной системы.
Таблица 25
Характеристика герпесвирусов человека и основных клинических форм инфекции
| Герпесвирус человека | Обозначения | Основные заболевания, ассоциированные с данным типом герпесвирусов |
| Вирус простого герпеса 1-го типа | ВПГ-1 | Лабиальный герпес. Герпес кожи и слизистых. Офтальмогерпес. Генитальный герпес. Герпетический энцефалит. Пневмонит. |
| Вирус простого герпеса 2-го типа | ВПГ-2 | Генитальный герпес. Неонатальный герпес. |
| Вирус ветряной оспы- опоясывающего герпеса | ВВО-ОГ-3 | Ветряная оспа. Опоясывающий герпес. |
| Вирус Эпстайна — Барр | ВЭБ-4 | Инфекционный мононуклеоз Назофарингиальная карцинома. Лимфома Беркитта. Волосатая лейкоплакия. |
| Цитомегаловирус | ЦМВ-5 | Врожденные поражения ЦНС. Ретинопатия. Пневмония. Гепатит. Сиаладенит. |
| Вирус герпеса человека 6-го и 7-го типов | ВГЧ-6, ВГЧ-6А, ВГЧ-6В, ВГЧ-7 | Лимфотропные вирусы (ВГЧ-6В причина внезапной экзантемы) |
| Вирус герпеса человека 8-го типа | ВГЧ-8 | Фактор риска развития саркомы Капоши. Первичные лимфомы. Болезнь Кастлемана (злокачественное лимфопролиферативное заболевание). |
Дата: 2018-11-18, просмотров: 561.