Японский энцефалит
Японский энцефалит – острое инфекционное заболевание, вызываемое вирусом японского энцефалита, в большинстве случаев протекающее субклинически или в виде лихорадочного заболевания, но у 1% инфицированных клинически проявляющееся тяжелым энцефаломенингомиелитом.
Шифр по МКБ-10: А83.0.
Исторические сведения. Эпидемические вспышки летнего энцефалита в странах Дальнего Востока (Япония, Китай, Корейский полуостров) были известны давно. Вирус японского энцефалита был выделен от умершей женщины в Японии в период эпидемии, охватившей семь тысяч человек и ставшей национальным бедствием (Takaki, 1926; Hayashi, 1934; Kaneko et ab., 1936). В российском Приморье этиология, пути передачи, резервуар инфекции при вспышках осенне-летних энцефалитов были расшифрованы в 1938-1940 гг. Е.Н. Павловским, А.А. Смородинцевым, А.К.Шубладзе, В.Д.Неустроевым, клинические проявления описаны А.Г. Пановым, П.М. Альперовичем, И.С. Глазуновым.
Этиология. Возбудитель японского энцефалита относится к роду Flavivirus (комплекс японского энцефалита, куда также входят вирусы лихорадки Западного Нила, энцефалита Сэнт Луис и энцефалита долины Мюррей). Морфологически все эти вирусы сходны как и другие флавивирусы. Его размеры не превышают 15 - 22 нм. Вирус японского энцефалита весьма устойчив во внешней среде. Кипячением убивается в течение двух часов. Спирт, эфир и ацетон оказывают угнетающее действие на активность вируса лишь спустя три дня. При отрицательных температурах может сохраняться до 395 дней.
Эпидемиология. Заболевание распространено от Пакистана на западе до Приморского края России на востоке, включая страны Дальнего Востока (Япония, Китай, Корейский полуостров), Юго-Восточной Азии (Таиланд, Вьетнам, и др.), Индии и Австралии. Начиная с 1970-х годов заболеваемость японским энцефалитом увеличилась в странах Юго-Восточной Азии, Индии, Непале и Шри-Ланке, что связывают с освоением лесных и заболоченных местностей и улучшением диагностики заболевания. По оценкам, от 35 000 до 50 000 случаев заболеваний и от 10 000 до 15 000 летальных исходов ежегодно регистрируется, что делает вирус японского энцефалита наиболее значимой причиной эпидемий вирусного энцефалита в мире. В районах с эндемической передачей вируса, заболеваемость составляет 2,5 на 10 000 детей в возрасте моложе 15 лет.
Японский энцефалит – природно-очаговое заболевание. Природные очаги заболевания расположены в луговых, низинных, болотистых местностях и на скалистых побережьях моря. Исследования, проведенные в Японии, установили сложную экосистему циркуляции данного вируса среди мигрирующих птиц, комаров Culex и Aedes, местной популяции свиней и человека в конечном итоге как случайного хозяина. Резервуаром вируса являются птицы и дикие животные, в антропургических очагах – домашние животные (прежде всего свиньи). Переносчики – кровососущие комары Culex trithaeniorhynchus, C.pipiens pallens, Aedes togoi, Aedes japonicus и др. Заражение людей происходит в период массового выплода и кровососания комаров, в регионах с умеренным климатом – с июля по сентябрь. Глобальное изменение климата приводит к расширению ареала обитания кровососущих комаров – переносчиков вируса японского энцефалита и распространению инфекции в новые регионы, в том числе и более северные.
Использование с 1960-х годов вакцин против японского энцефалита существенно уменьшило заболеваемость в эндемичных регионах. Так, в Китае ежегодная заболеваемость уменьшилась в 10 раз. Однако в отдаленных сельских и лесных районах стран с эндемичным распространением заболевания вакцинацией охвачены далеко не все жители, в том числе и дети.
Патогенез и патологическая анатомия. Развитие заболевания зависит от количества и вирулентности штамма вируса и естественной резистентности и иммунных показателей зараженного организма. В благоприятных случаях вирус гибнет уже в месте инокуляции или крови человека, поэтому в эпидемических очагах инфекции значительная часть населения имеет приобретенный иммунитет. В неблагоприятных случаях происходит вирусемия, затем вирус гематогенным и невральным путем попадает в паренхиму головного и спинного мозга, где происходит его размножение. Это приводит к генерализованному капилляротоксикозу с небольшими кровоизлияниями в серозных и слизистых оболочках (эпикарда, желудочно-кишечного тракта и др.), но наиболее тяжело поражается нервная система – кора больших полушарий, подкорковые отделы, базальные ганглии и вегетативные центры. Развиваются экссудативно-пролиферативный процесс, дегенерация нервных клеток с гибелью нейронов, отек и набухание головного мозга.
Cимптомы и течение заболевания. Клинически выраженная картина заболевания развивается только у 1% инфицированных вирусом японского энцефалита. Но при развитии, болезнь, как правило, протекает с развитием тяжелого энцефалита, часто приводит к коме и к летальному исходу в 25% случаев. Инкубационный период продолжается 5–14 дней. Болезнь начинается остро с появлением синдрома общей интоксикации и быстрым развитием синдромов тяжелого диффузного менингоэнцефалита, реже - менингоэнцефаломиелита.
Продромальные явления не часты, за 1–2 дня до острого начала могут отмечаться общая слабость, разбитость, снижение работоспособности, головные боли и т.п.
Синдром общей интоксикации. В первый день болезни возникает фебрильная лихорадка (39–41оС), достигающая максимума ко второму дню и продолжающаяся в течение 7 – 12 дней, а при осложнениях – больше месяца. Это сопровождается ощущением жара или озноба, резкой слабостью, разбитостью, головной болью в лобной и височной областях, миалгиями (особенно поясничных и икроножных мышц). Возможны боль в животе, тошнота и рвота. При осмотре больного отмечаются интенсивная гиперемия кожи лица и видимых слизистых, конъюнктивит, нередко розеолезная или петехиальная сыпь, вегетативные расстройства (общий и регионарный гипергидроз, усиление саливации и др.), брадикардия или тахикардия (лабильность ритма пульса, артериальное давление обычно нормальное, но с уменьшением пульсового давления). Характерно тахипноэ (до 30 и более дыханий в мин), в легких могут выслушиваться сухие хрипы. Могут выявляться признаки токсического поражения печени и почек: иктеричность склер, болезненность при пальпации в правом подреберье, потемнение мочи за счет уробилина, в моче – белок до 0,99%, эритроциты, зернистые цилиндры. Упорные запоры. В периферической крови: нейтрофильный лейкоцитоз (до 10–15–30 тыс.) с резким сдвигом влево, лимфопения, анэозинофилия, повышение СОЭ до 15–30 мм/ч, увеличение уровня эритроцитов и гемоглобина (за счет сгущения крови).
Менингеальный синдром развивается в 1–2-й день болезни. Характерны сильная головная боль, тошнота и рвота, головокружения, общая гиперестезия (в том числе светобоязнь), снижение сухожильных рефлексов. Менингеальные симптомы наблюдаются у 30-60% больных. Также выявляются поражения лицевого, отводящего и подъязычного нервов. Давление СМЖ повышено до 250 мм водного столба, ликвор прозрачный, плеоцитоз от 10 до нескольких тысяч клеток в 1 мкл, в среднем несколько сотен клеток; преимущественно лимфоцитарного состава, белок в норме или слегка повышен (до 100 мг/дл).
Синдром энцефалита появляется и нарастает с первых суток болезни. Характерна общемозговая симптоматика в виде нарушения сознания: с первого дня болезни резкая оглушеность, а при тяжелом течении уже на второй – третий день развиваются сопор и кома. Сопорозное состояние перемежается с психомоторным возбуждением, бредом, психозами (делириозно-аментивными, галлюцинаторно-параноидными, шизоформными и др.). Отмечаются повышение и ассиметрия сухожильных рефлексов, патологические пирамидные знаки (Бабинского, Оппенгейма, Гордона и др.). Развиваются двигательные нарушения, спастические (реже вялые) парезы, параличи и судорожные состояния. Неравномерная ригидность всех мышц (наиболее выраженная в мышцах верхних конечностей) приводит к причудливым положениям и позам. Отмечаются подергивания мимических мышц лица, языка, губ, рук, миоклонические подергивания различных мышечных групп, затем – эпилептические и эпилептиформные припадки, тонико-клонические судороги. Серийные припадки или развитие эпилептического статуса прогностически неблагоприятно.
Наиболее тяжелое течение имеет место при появлении бульбарных расстройств, которые могут появиться с первого дня болезни и через 2 – 3 дня привести к летальному исходу. Вначале появляются расстройства глотания, фонации, артикуляции, дизартрия. Одновременно развивается тахикардия (до 120 ударов в мин), снижение артериального давления (систолическое – менее 80 мм рт.ст.), нарастает одышка (до 40 – 60 в мин), затем дыхание принимает форму Чейн-Стокса. Больные погибают при остановке дыхания и сердечной деятельности.
При благоприятных исходах на 7–10–12 день температура тела литически снижается, сознание проясняется и больные переходят в стадию реконвалесценции. Длительно сохраняются астения, сонливость, резкое похудание и истощение, из резидуальных явлений наиболее стойкими являются снижение памяти, параличи и парезы конечностей, поражение черепных нервов.
Наряду с клинически выраженными формами японского энцефалита отмечается значительное число легких (стертых, атипичных, абортивных) заболеваний, характеризующихся субфебрильной лихорадкой, слабыми менингеальными симптомами, очаговой микросимптоматикой и длительным астеническим состоянием. Подобные больные в большинстве случаев за медицинской помощью не обращаются, а ЯЭ остается недиагностируемым.
Осложнения и критические состояния. В остром периоде – отек мозга и оболочек, расстройства глотания и дыхания при бульбарном синдроме, мозговая кома с нарушением витальных функций, отек легких, в конце острого периода – пневмонии, ухудшающие прогноз заболевания.
Летальные исходы в среднем у 25% больных. Инвалидность у 40% выживших.
Диагноз и дифференциальный диагноз. В период эпидемических вспышек японского энцефалита, которые в Приморском крае могут наблюдаться с июля до середины октября, распознование клинически очерченных форм заболевания сомнений не вызывает. Диагностика основывается на эпидемиологическом анамнезе (пребывание в природных очагах японского энцефалита), сезонности, клинических особенностях (острое, бурное начало с глубоким помрачением сознания, постоянство менингеальных явлений, на фоне которых появляются очаговые симптомы), а также на результатах лабораторных исследований.
Вирус японского энцефалита можно выделить в раннем периоде болезни из крови и СМЖ, так как в это время у больных имеется высокий уровень виремии. Методом выбора в этих случаях является ОТ-ПЦР, который позволяет определить и вирусную нагрузку. Существует и тест-системы, применяющие иммуноблоттинг. При этом результаты исследования крови в целом существенно выше, чем СМЖ.
Начиная со средины второй недели вирусемия уменьшает вплоть до неопределяемой, и основой лабораторной диагностики становится выявление IgM и IgG в ИФА (метод выбора, начиная с 4-5-го дней болкезни, 100% чувствительность), реакции иммунофлуоресценции и в иммунохроматографических экспресс-тестах. РТГА и РСК применяются нечасто из-за низкой чувствительности и специфичности.
При аутопсии вирус можно выделить также из мозга умерших.
Дифференциальная диагностика проводится, в первую очередь, с клещевым энцефалитом, тяжелыми формами гриппа, серозными менингитами и энцефалитами другой этиологии, острыми нарушениями мозгового кровообращения. От клещевого энцефалита данное заболевание отличается иной сезонностью, отсутствием вялых дегенеративно-атрофических параличей мышц верхних конечностей и шеи, значительными изменениями психики и мышечного тонуса в остром периоде, а также преобладанием более тяжелых форм заболевания. При проведении дифференциальной диагностики в пользу японского энцефалита свидетельствуют эпидпредпосылки, преобладание глубоких расстройств сознания, гиперкинезы.
Лечение. Больные должны госпитализироваться в инфекционные стационары, имеющие реанимационные отделения, а при отсутствии таковых – в общереанимационные отделения.
Этиотропной терапии нет. Определенные надежды возлагают на терапию с использованием моноклональных антител против вируса японского энцефалита, но накопленный опыт слишком мал. Рибавирин и интерфероны оказались неэффективными. Патогенетическая терапия, в том числе и интенсивная, проводится по общим принципам лечения больных с вирусным менингоэнцефалитм (см. раздел клещевой энцефалит).
Интенсивная терапия должна быть направлена на предотвращение и купирование судорожных приступов, обеспечения респираторной поддержки при дыхательной недостаточности, а также профилактике и уменьшении отека мозга. Применяются противотечные препараты (маннит) и кортикостероиды. Необходима профилактика вторичных инфекций, и соответствующий внимательный уход как профилактика таких осложнений, как пролежни и контрактуры.
Прогноз и исходы заболевания. Высокая летальность (до 25%), особенно в первую неделю болезни, обусловливает серьезный прогноз. В ходе болезни развивается снижение интеллекта, органические неврологические симптомы, которые сохраняются длительно, но с течением времени могут уменьшаться.
Правила выписки. При определении сроков выписки учитывается тяжесть заболевания и тот факт, что клинические показатели выздоровления опережают угасание очагов воспаления в ткани мозга. Поэтому ориентировочные сроки стационарного лечения легких форм - до 1 мес., среднетяжелых - до 2 мес., тяжелых - до 3 мес. Выписка производится при наличии у больного удовлетворительного самочувствия, стойкой (более 10 дней) нормальной температуры тела, нормализации показателей крови, снижение числа лимфоцитов в спинномозговой жидкости до 10 и менее клеток в 1 мкл.
Реабилитация. Длительная и серьезная, обычно проводится невропатологом, в том числе и в неврологических стационарах.
Диспансеризация. Лица с остаточными изменениями поражения нервной системы состоят на диспансерном наблюдении с участием невропатолога в течение года. Гражданским лицам, в зависимости от состояния больного, для проведения реабилитационных мероприятий пребывание на больничном листе может быть продлено до 1 - 2 мес. Военнослужащим срочной службы восстановительное лечение проводится в реабилитационных отделениях.
Профилактика и противоэпидемические мероприятия в очаге. В очагах японского энцефалита должен проводиться комплекс противокомариных мероприятий, направленный на уничтожение личинок комаров и окрыленных особей (в естественных заболоченностях, районах рисовых посевов, населенных пунктах) и защиту человека от нападения комаров (защитные и отпугивающие сетки, репелленты, засетчивание окон, инсектицидные аэрозоли.
Начиная с 1960-х годов доступны вакцины против клещевого энцефалита, показавшие высокую эффективность. В ряде стран с эндемичным распространением японского энцефалита эта вакцина включена в национальный календарь вакцинации детей.
Применительно к Российской Федерации вакцинация может быть рекомендована лицам, выезжающим в вышеуказанные регионы Азии, в случаях если путешественники:
- планируют провести в районах распространения японского энцефалита не менее месяца;
- будут находиться в данных районах менее месяца, но планируют посещение сельской местности или участие в мероприятиях на открытом воздухе;
- собираются посетить районы, в которых зарегистрирована вспышка японского энцефалита;
- не имеют точного маршрута путешествия.
Военно-врачебная экспертиза. Военнослужащие с выраженными остаточными изменениями нервной системы решением ВВК признаются негодными к военной службе, к проходящим военную службу по контракту подход индивидуальный. При наличии нерезких остаточных изменений нервной системы и сохранении трудоспособности военнослужащие летного, плавсостава и операторского профиля переводятся на работу по другой специальности.
Клещевой энцефалит
Клещевой энцефалит – вирусное заболевание, характеризующееся развитием различных клинических форм болезни: от легких инаппаратных и лихорадочных до крайне тяжелых поражений головного и спинного мозга, приводящая к развитию парезов и параличей.
Шифр по МКБ-10: А84.
Исторические сведения. В 1894-1895 гг. опубликованы А.Я. Кожевниковым и С.Б. Орлеанским сообщения о заболеваниях, которые значительно позже были расценены как клещевой энцефалит и его последствия. На широкое распространение в Сибири и восточных районах Европейской части России сходных по клинике паралитических заболеваний неизвестной этиологии обратили внимание также неврологи В.П. Первушин, Л.И. Оморонов, Н.В. Шубин, М. Г. Полыновский в конце XIX — начале XX в.
В 1904 г. в летнее время на Дальнем Востоке возникла крупная вспышка энцефаломиелита преимущественно среди лесорубов и школьников, находившихся в лесу, а также жителей таежных поселков.
Как самостоятельная нозологическая форма клещевой энцефалит известен с 1937 г. Первые клинические описания болезни дали в 1936–1940 гг.. А.Г. Панов, А.Н. Шаповал, М.Б. Кроль, И.С. Глазунов. Возбудитель клещевого энцефалита — фильтрующийся вирус — был открыт экспедицией под руководством Л.А. Зильбера в 1937 г. на Дальнем Востоке, направленной для изучения нового заболевания.
Этиология. Этиологическая структура. Возбудителем заболевания является РНК содержащий вирус, относящийся к семейству Flaviviridae, роду Flavivirus (группа В).
На территории России обнаружено пять антигенных вариантов (подтипов) вируса клещевого энцефалита: дальневосточный; западный (центрально-европейский); Вергина; восточно-сибирский; урало-сибирский. Возбудитель инфекции независимо от варианта (подтипа) принадлежит к единому комплексу вирусов клещевого энцефалита.. Пул вируса на каждой эндемичной территории состоит из смеси штаммов, различающихся генетически и серологически, а также отличающихся между собой степенью вирулентности.
Морфология. Вирионы вируса клещевого энцефалита имеют сферическую форму с диаметром 40–50 нм. Внутренним компонентом является нуклеокапсид. Он окружен наружной липопротеидной оболочкой, в которую погружены шипы, состоящие из гликопротеида, обладающего гемагглютинирующими свойствами. Нуклеокапсид содержит однонитчатую РНК.
Культуральные свойства. Вирус длительное время сохраняется при низких температурах (оптимальный режим – 60°С и ниже), хорошо переносит лиофилизацию, в высушенном состоянии сохраняется много лет, но быстро инактивируется при комнатной температуре. Кипячение инактивирует его через 2 мин, а в горячем молоке при 60°С вирус погибает через 20 мин. Инактивирующим действием обладают также формалин, фенол, спирт и другие дезинфицирующие вещества, а также УФО.
Эпидемиология. Заболевание распространено на всей лесной и лесостепной климатической зоне Евроазиатского континента. Клещевой энцефалит регистрируется практически во всех европейских странах и в четырех странах Азии.
Острые случаи клещевого энцефалита регистрируются с апреля по сентябрь (в западных регионах России присасывание клещей может наблюдаться в октябре), с максимальным подъемом заболеваемости в мае-июне, что связано с периодом активности клещей. Уровень заболеваемости клещевым энцефалитом на эндемичной территории определяется рядом преимущественных факторов: вирусоформностью и численностью клещей, плотностью населения и контактами людей с природными очагами инфекции. Заболеваемость в Российской Федерации колеблется от 2 до 8 случаев на 100 тыс. населения, но распределяется неравномерно. На территории Уральского, Сибирского и Дальневосточного регионов приходится более 90% всех случаев клещевого энцефалита, регистрируемых в России.
Резервуары и источники возбудителя. Основными переносчиками и резервуаром вируса клещевого энцефалита в природе являются преимущественно иксодовые клещи: Ixodes ricinus, Ixodes persulcatus, реже другие клещи: Dermacentor marginalis, D. silvarum, Haemophysalis punctata, H. с occinna и др. Считается, что еще до 14 видов клещей являются носителями вируса в природе, но их эпидемическая роль невелика. Дополнительным резервуаром вируса в природе являются дикие и домашние животные (козы), птицы, поддерживающие циркуляцию вируса в природе.
Механизм передачи возбудителя. Вирус передается человеку преимущественно при присасывании самки клеща (трансмиссивно), реже – алиментарно, при употреблении в пищу сырого козьего молока или продуктов из него, не подвергшихся термической обработке. Цикл насасывания крови самкой клеща у животных может длиться до 7-8 суток, у человека обычно присосавшегося клеща к коже обнаруживают на 2-3 сутки. Самцы клеща присасываются на короткое время и обычно факт присасывания в этом случае остается незамеченным.
Возможен и алиментарный путь инфицирования, что, как правило, приводит к развитию вспышки клещевого энцефалита среди лиц, употреблявших один пищевой продукт приготовленный на основе козьего молока, часто в этих случаях вспышки носят семейный характер..
Крайне редко инфицирование может происходить контактным путем (при раздавливании клеща) и воздушно-капельным путем (при нарушении техники безопасности и режима работы в лаборатории).
Патогенез и патологическая анатомия. Клинически клещевой энцефалит развивается в острой циклической форме с выздоровлением, однако, иногда может трансформироваться в хроническую инфекцию. Возможны летальные случаи.
Стадия вирусемии. В зависимости от механизма инфицирования размножение и первичное накопление вируса происходит в коже и подкожной клетчатке (место присасывания клеща – первичный аффект) или в эпителиальных клетках верхних отделов ЖКТ (при алиментарном пути заражения). Распространение возбудителя из первичного аффекта происходит гематогенно, лимфогенно и периневрально. При гематогенном и лимфогенном пути распространения в стадии вирусемии наблюдается размножение вируса в эндотелии сосудов, в органах ретикулоэндотелиальной системы. Вирусемия при клещевом энцефалите имеет двухволновый характер: кратковременная первичная вирусемия, а затем повторная (в конце инкубационного периода), совпадающая по времени с размножением вируса во внутренних органах и появлением его в ЦНС.
Невральная стадия. При развитии следующей – невральной стадии, вирус попадает в ЦНС, вызывая серозный менингит или менингоэнцефалит (менингоэнцефаломиелит). При периневральном пути распространения вирус непосредственно попадает в клетки ЦНС, совпадая по времени со стадией вирусемии. Патологический процесс при клещевом энцефалите характеризуется преобладанием явлений экссудации над пролиферативными изменениями. Он выражается поражением как серого, так и белого вещества головного и спинного мозга с развитием периваскулярных инфильтратов, состоящих преимущественно из лимфоидных элементов, возникновением некротических очагов.
В ЦНС вирус поражает преимущественно моторные клетки различных отделов головного и спинного мозга: таламуса, базальных ганглиев, передних рогов спинного мозга, ствола, коры полушарий большого мозга и мозжечка. При остром течении в ЦНС преобладают процессы альтерации и ишемические нарушения. Известна роль генетической предрасположенности и наследственных особенностей иммуногенеза в развитии тяжелых форм заболевания.
Хроническая стадия. Возможно длительное вирусоносительство, которое в зависимости от его проявления характеризует инфекционный процесс как: латентная инфекция (вирус интегрирован с клеткой и нет клинических проявлений); персистентная инфекция (вирус репродуцирует, но не обуславливает развитие клинических проявлений, имеется антительный ответ организма на наличие вируса). В ряде случаев может формироваться хроническое течение инфекционного процесса с преобладанием дегенеративно-пролиферативных изменений нервной системы, сопровождающихся апоптозом нейронов и развитием прогрессирующего атрофического процесса с рецидивирующим, прогрессирующим или регрессирующим течением. Вариант хронического инфекционного процесса, который можно рассматривать как медленная инфекция, характеризуется наличием клинических проявлений с постоянным прогрессированием и с исходом в смерть. Хроническая инфекция клещевого энцефалита с поражениями мозга протекает годами или пожизненно.
Симптомы и течение заболевания. Заболевание характеризуется острым началом, развивающимся после инкубационного периода, составляющего в среднем 7–14 дней (с колебаниями от 1 до 30, крайне редко – до 60 суток).
Клиническая классификация. Инфекционный процесс при клещевом энцефалите может иметь острое, подострое и хроническое течение.
При остром и подостром течении выделяют неочаговые и очаговые формы инфекции. К неочаговым формам относится бессимптомная или инаппарантная, характеризующаяся наличием лабораторных признаков состоявшегося инфицирования (серологические, вирусологические) при отсутствии клинической картины, а также манифестные формы –лихорадочная и менингеальная.
Очаговые формы: менингоэнцефалитическая (или энцефалитическая) форма, полиоэнцефаломиелитическая форма, полиоэнцефалитическая (стволовая) и полиомиелитическая (спинальная) формы.
Лихорадочная форма, частота которой составляет 45–60%, характеризуется лихорадкой, чаще фебрильной (38–40°С) продолжительностью 3–7 дней, интоксикационным синдромом, реже развивается субфебрилитет. При менингеальной форме, составляющей 25–40% заболеваний, на 2-3 сутки заболевания возникают общемозговые симптомы, такие как головная боль, светобоязнь и рвота, а также собственно менингеальные симптомы. При алиментарном пути инфицирования характерно развитие двухволновой лихорадки, при которой на первой волне длительность лихорадки составляет 2–4 суток, затем следует период апирексии продолжительностью 3–10 дней, а в дальнейшем возникает вторая волна с развитием общей инфекционной интоксикации, общемозговой и менингеальной симптоматики. Изменения в ЦСЖ характеризуются серозным воспалением сопровождающимся лимфоцитарным или смешанным характером цитоза, который колеблется от нескольких десятков до нескольких сотен клеток, редко достигает 1000 клеток в 1 мкл. Содержание белка – нормальное или умеренно повышено до 0,7–1,5 г/л. Длительность менингеальной формы три – четыре недели.
Очаговые формы составляют 10–15% в структуре заболевания, а на Дальнем Востоке их частота может достигать 25–40%. Наиболее частой среди очаговых форм клещевого энцефалита является менингоэнцефалитическая (или энцефалитическая) форма, для которой характерно поражения подкорковых образований и коры. Клиническая картина характеризуется развитием нарушения сознания до сопора или комы, а также судорожного синдрома в виде фокальных и генерализованных приступов, гемипарезов, атаксии и гиперкинезов чаще миоклонического характера. Развитие локальных корковых расстройств: афазии, дизграфии, акалькулии в остром периоде встречается у 20-30% больных и имеет обратимый характер. Более редкой среди очаговых форм является полиоэнцефаломиелитическая форма (стволово-спинальная), характеризующаяся развитием параличей мышц шеи, плечевого пояса, рук, реже – ног, а также нарушением функции черепных нервов. Параличи имеют вялый и смешанный характер, отличаются мозаичностью поражения отдельных мышечных групп и превалированием проксимальных расстройств над дистальными, а также сопровождаются мышечными атрофиями. При тяжелом поражении мышц плечевого пояса больные не могут удерживать голову в вертикальном положении, осуществлять повороты головой, что является типичным симптомом при данном заболевании. Характерна наибольшая выраженность неврологических расстройств в близлежащих к месту присасывания клеща сегментах спинного мозга. Параллельно развиваются поражения двигательных ядер ствола мозга с развитием паралитического косоглазия, паралича горизонтального и вертикального взора, а также бульбарного синдрома в виде дизартрии, нарушения глотания и жевания, пареза мягкого неба, атрофии языка. В тяжелых случаях возникает вовлечение в процесс дыхательной мускулатуры. Характерной особенностью неврологической симптоматики при очаговых формах клещевого энцефалита является отсутствие чувствительных нарушений, поскольку поражаются ядра моторных клеток при сохранности чувствительных, что наблюдается даже при поражении смешанных нервов. Редкими являются полиоэнцефалитическая (стволовая) и полиомиелитическая (спинальная) формы. Длительность очаговых форм составляет от двух до трех месяцев.
К редким формам острого течения клещевого энцефалита относится стертая форма, составляющая 3-6%, характеризующаяся кратковременной лихорадкой или её отсутствием, а также минимально выраженными неврологическими симптомами (анизорефлексией, атаксией и т.д.).
Хроническое течение клещевого энцефалита может развиться после любого варианта острого течения заболевания. Частота развития хронизации зависит от адекватности и своевременности терапии острого периода. Применение эффективной терапии в остром течении заболевания позволяет существенно уменьшить частоту развития хронического течения. Чаще регистрируется вторично-хроническое течение клещевого энцефалита, по сравнению с первично-хроническим. При вторично-хроническом течении прогрессирование заболевания возникает обычно через 3-6 месяцев после острого периода и характеризуется развитием новых неврологических симптомов или утяжелением имеющейся симптоматики при положительных результатах лабораторных исследований, подтверждающих персистенцию вируса. Наиболее часто хроническое течение клещевого энцефалита проявляется эпилепсией Кожевникова, протекающей в виде фокальных моторных и вторично-генерализованных приступов, гемипарезами и гиперкинезами миоклонического или реже – хореоатетоидного характера. Прогрессирование симптоматической эпилепсии сопровождается при хроническом течении клещевого энцефалита утяжелением двигательного дефицита и интеллектуально-мнестическими расстройствами. Реже хроническое течение характеризуется развитием синдрома бокового амиотрофического синдрома, отличающегося прогрессированием вялых и смешанных параличей, атрофиями преимущественно мышц шеи и верхних конечностей. Возможно сочетание двух синдромов. При первично-хроническом течении острый период заболевания отсутствует или его трудно установить.
Осложнения и критические состояния. При вышеописанных клинических формах клещевого энцефалита (кроме инаппарантной и лихорадочной форм) могут наблюдаться эпилептиформный, гиперкинетический синдромы и некоторые другие признаки поражения нервной системы. Гиперкинетический синдром регистрируется сравнительно часто (у 1/4 больных), причем преимущественно у лиц до 16 лет. Синдром характеризуется появлением спонтанных ритмических сокращений (миоклоний) в отдельных мышечных группах паретических конечностей уже в остром периоде болезни.
К осложнениям острого периода относятся: отек и набухание головного мозга, дислокационный синдром, эпилептический статус, дыхательная недостаточность при парезе дыхательной мускулатуры.
Отек-набухание головного мозга с дальнейшим развитием мозговой комы, нарушение дыхания и сердечной деятельности вследствие поражения ствола мозга и пареза не только мышц плечевого пояса, но и грудной клетки могут приводить к смерти больных уже на 4 - 7-е сутки болезни, а при молниеносном варианте течения летальный исход может наступить и в первые сутки.
В острый период может развиться инфекционно-токсический миокардит (обычно с 4-5-го дня болезни), частота его возникновения коррелирует с тяжестью течения клещевого энцефалита.
К неспецифическим осложнениям следует отнести присоединение бактериальной микрофлоры, что наиболее часто приводит к развитию тяжелых пневмоний, которые иногда заканчиваются дыхательной недостаточностью (тотальное поражение, отек легких), реже — возникают отиты, синуситы, пиелонефрит, сепсис).
К осложнениям отдаленного периода относятся сколиоз позвоночника, укорочение и деформация конечностей, когнитивный дефицит.
Диагностика и дифференциальный диагноз. Диагноз основывается на клинико-эпидемиологических данных: факт присасывания клеща или употребление сырого козьего молока и молочных продуктов, посещение природных очагов инфекции в течение 1-4 недель до появления симптомов болезни, а также при развитии клинической картины заболевания в виде одной из форм инфекции. Окончательная диагностика проводится после оценки результатов лабораторных исследований.
Молекулярно-биологическая диагностика. Методом ПЦР в крови и ликворе определяется РНК вируса. Для «ориентировочной» диагностики могут учитываться данные исследования клеща, снятого с пострадавшего. Клещ исследуется на наличие антигена или РНК вируса соответственно методами ИФА и ПЦР.
Серологическая диагностика. У больного исследуется кровь на антитела класса IgМ к вирусу клещевого энцефалита, при отрицательном результате проводят повторные исследования с интервалом 7-10 дней, через 3-4 недели и через 2-3 месяца от начала болезни. Также лабораторным подтверждением диагноза служит наличие и нарастание в динамике титра специфических антител.
Культуральный метод. Выделение вируса из крови (ликвора) на культуре тканей возможно в первые семь дней болезни. При летальном исходе исследованию подлежат суспензия мозговой ткани из различных отделов головного и спинного мозга. В этих случаях проводится выделение вируса клещевого энцефалита путем заражения белых мышей и на клеточных культурах.
Специальные методы. Для диагностики локализации процесса в пределах ЦНС и мониторинга эффективности лечения применяется игольчатая ЭНМГ, выявляющая при клещевом энцефалите поражение передних рогов спинного мозга, чаще на уровне шейного отдела спинного мозга.
Типичными для клещевого энцефалита при МРТ головного мозга являются очаги сосудистого генеза, имеющие гиперинтенсивный сигнал на Т2 и FLAIR-ИП в базальных ганглиях и таламусах в остром периоде инфекции, сохраняющиеся до 3–9 месяцев. Во всех случаях очаги имеют обратное развитие с последующим расширением боковых желудочков, в 12–15% с формированием ликворных кист. При хроническом течении клещевого энцефалита при МРТ выявляется прогрессирующий атрофический процесс, захватывающий структуры задней черепной ямки, кору больших полушарий и шейный отдел спинного мозга.
Дифференциальный диагноз проводится с другими вирусными заболеваниями, характеризующимися развитием лихорадки, менингита и энцефалита; с другими инфекциями, передающимися клещами: иксодовыми клещевыми боррелиозами, эрлихиозом, анаплазмозом, риккетсиозами, бабезиозом. Очаговые формы заболевания дифференцируются с энцефалитами, вызванными вирусом простого герпеса 1–2 типа, ветряной оспы, вирусом Эпштейна-Барр, вирусом герпеса человека 6 типа, парвовирусом В19, бешенства, а также абсцессами головного мозга и неинфекционными поражениями ЦНС – объемными образованиями, сосудистыми мальформациями, нейродегенеративными болезными. Полиомиелитические формы заболевания дифференцируются с полио- и другими энтеровирусными заболеваниями, ботулизмом, сирингомиелией, боковым амиотрофическим склерозом, энцефалитом Расмуссена и др.
Лечение. Лечение больных клещевым энцефалитом осуществляется по единым принципам вне зависимости от ранее проводимых прививок или применения противоклещевого иммуноглобулина с профилактической целью после присасывания клеща. Больным с острым и подострым течением лечение проводят в условиях стационара, при хроническом течении условия оказания медицинской помощи определяются в зависимости от тяжести поражения ЦНС и выраженности нарушений функций органов и систем органов. Режим и диета назначается в зависимости от тяжести течения заболевания и характера нарушения функций органов и систем органов.
Этиотропная терапия. Специфической противовирусной терапии клещевого энцефалита не существует. Применяются препараты, обладающие противовирусным действием (препараты интерферона) и иммуномодулирующие препараты. При лихорадочных формах достаточно использовать препараты интерферон-α2 парентерально в соответствии с инструкцией по применению препаратов. При очаговых формах возможно введение препаратов интерферона эндолюмбально либо эндолимфатически. Сроки назначения определяются средними сроками персистенции вируса клещевого энцефалита при разных формах, а также сроками сохранения в крови IgМ до сероконверсии в IgG, выявляемой в динамике заболевания.
Сывороточный противоклещевой иммуноглобулин, полученный из плазмы доноров, проживающих на эндемичных территориях по клещевому энцефалиту, вводится по 3–6–12 мл в сутки в зависимости от степени тяжести заболевания, в течение 3 суток.
Патогенетическая терапия. При лихорадочной и менингеальной формах клещевого энцефалита патогенетическая терапия ограничивается проведением мероприятий, направленных на уменьшение интоксикации. С этой целью производится пероральное и парентеральное введение жидкости с учетом водно-электролитного баланса и кислотно-щелочного состояния.
При менингеальной форме общий объем вводимой внутривенно жидкости не должен превышать 40 мл/кг массы больного в сутки. Обязательным является одновременное применение средств дегидратации головного мозга и форсирования диуреза – фуросемид по 2–4 мл 1% раствора 2–3 раза в сутки. При сильных головных болях используют анальгетики. При тяжелой менингеальной форме усиливаются инфузионно-дезинтоксикационные мероприятия (количество диуретиков увеличивается в 2–2,5 раза).
При менингоэнцефалитической, полиомиелитической и полирадикулоневритической формах болезни на фоне дезинтоксикационной терапии назначение глюкокортикоидов является обязательным.
При бульбарных нарушениях (с расстройством глотания и дыхания) с момента появления первых признаков дыхательной недостаточности больной переводится на ИВЛ. Люмбальная пункция при этом противопоказана и может быть произведена только после устранения бульбарных расстройств. Для борьбы с гипоксией целесообразно систематическое введение увлажненного кислорода через носовые катетеры (по 20–30 мин каждый час), использование нейроплегиков и антигипоксантов, в дальнейшем проведение гипербарической оксигенации (10 сеансов по 1,5 ата).
При менингоэнцефалитической форме клещевого энцефалита целесообразно применять ноотропные препараты для уменьшения возможного неврологического дефекта. Детям в период поздней реконвалесценции при нейроформах клещевого энцефалита (менингеальной и очаговой) назначается курс нейропептидов (церебролизин) в сочетании с нейровитаминами.
Полирадикулоневратические синдромы в острой стадии характеризуются выраженными корешковыми болями, невралгиями и миалгиями. Для купирования болевого синдрома используются седативные (показаны анксиолитики с седативным эффектом, например, буспирон), нейролептические препараты (хлорпромазин, промазин) и ненаркотические аналгетики.
Прогноз и исходы заболевания. Прогноз определяется клинической формой, а также своевременностью и адекватностью лечебных мероприятий. В исходе лихорадочной формы клещевого энцефалита в большинстве случаев наблюдается выздоровление. Результатом менингеальной формы частым является церебрастенический синдром, сохраняющийся до 3–6 месяцев. При очаговых формах заболевания возможно как полное выздоровление, так и развитие остаточного неврологического дефицита различной степени выраженности в виде вялых параличей, атаксии, нарушении функции черепных нервов, эпилепсии или развитие хронического течения болезни. Имеются особенности исходов в зависимости от формы. В исходе менингоэнцефалитической формы наиболее часто возникает симптоматическая эпилепсия, а в исходе полиоэнцефаломиелитической – вялые парезы. К неблагоприятным факторам для развития прогредиентного течения болезни является очаговые формы с развитием в остром периоде синдрома эпилепсии Кожевникова.
Летальность обусловлена только очаговыми формами клещевого энцефалита, составляет 5–12% и преобладает среди взрослых.
Правила выписки. Выписка проводится в зависимости от формы заболевания по результатам клинического выздоровления (улучшения состояния, не требующее лечения в условиях стационара): после лихорадочной формы – через 2 недели; после менингеальной - через 3 недели; после очаговой (в зависимости от наличия характера неврологических нарушений) – через 2–3 месяца (долечивание проводится в неврологическом стационаре).
Реабилитация. Реабилитационные мероприятия направлены на уменьшение или ликвидацию остаточных явлений и нарушений функций, обусловленных поражением нервной системы. В период реконвалесценции длительно (свыше 1–3 мес.) сохраняются астенизация, вегетативные нарушения. Постепенно восстанавливаются сон, память, почерк, интеллект. Двигательные функции, нарушенные вследствие поражений головного мозга и проводящих путей, восстанавливаются в течение 2–3 мес., но не у всех больных.
Диспансерное наблюдение. Длительность диспансерного наблюдения составляет 1 год после лихорадочной формы клещевого энцефалита, три года – после менингеальной, не менее 5 лет – после очаговой формы. При хроническом течении и остаточном неврологическом дефиците диспансеризация проводится длительно, с целью определения возможности прогредиентного течения инфекции вирусологические исследования проводятся каждые 6 месяцев в течение срока наблюдения; МРТ головного и спинного мозга проводится 1 раз в год при наличии признаков прогрессирования заболевания.
Профилактика и противоэпидемические мероприятия в очаге. Осуществляются в соответствии с санитарно-эпидемиологическими правилами «Профилактика клещевого вирусного энцефалита» (СП 3.1.3.2352-08, 2008) и «Профилактика инфекций, передающихся иксодовыми клещами» (СП 3.1.3310-15, 2015).
Профилактика включает специфические и неспецифические меры защиты. Специфическая профилактика включает вакцинацию и применение противоклещевого иммуноглобулина. Вакцинация осуществляется инактивированными вакцинами. Принципиально все вакцины для профилактики клещевого энцефалита зарегистрированные для применения на территории России представляют собой выращенные на куриных эмбрионах инактивированные формалином вирусы. Все вакцины обладают высокой иммуногенной активностью. Для выработки адекватного иммунитета важно соблюдать режим вакцинации и ревакцинации. Через две недели после введения последней дозы первичного курса вакцинации иммунитетом обладают от 90 до 97% привитых. При отсутствии или неполном графике вакцинации после проведения обследования клеща и обнаружении антигена вируса клещевого энцефалита методом ИФА назначается противоклещевой иммуноглобулин. Препарат вводят внутримышечно в течение первых 96 ч после присасывания клеща в дозе 0,1 мл/кг массы тела, но не более 8 мл.
Неспецифическая профилактика включает применение и использование методов и способов, предотвращающих присасывание клещей:
- ношение в лесу специальной одежды – сапоги, куртки с плотно застегнутыми рукавами, платок или сетка, закрывающая шею, головной убор, закрывающий волосы;
- само- и взаимоосмотры на выходе из леса и на привалах;
- скашивание травы и низкорослого кустарника, рубка сухостоя, освобождение от завалов и пней;
- применение жидких и аэрозольных репеллентов и акарицидных средств;
- кипячение сырого козьего и коровьего молока на территориях, где регистрируется клещевой энцефалит.
Требуют эпидемиологического расследования случаи заболевания с алиментарным путем инфицирования с целью выявление лиц, употреблявших молоко, для их обследования и проведения профилактики с назначением противовирусных препаратов.
Военно-врачебная экспертиза. Необходимость экспертизы может возникнуть у реконвалесцентов после перенесения тяжелых форм болезни при наличии каких-либо резидуальных явлений или развития хронического течения инфекции.
Лихорадка Западного Нила
Лихорадка Западного Нила – острая инфекция, протекающая в виде острого лихорадочного заболевания с симптомами общей интоксикации; в тяжелых случаях – с поражением ЦНС (серозным менингитом, реже – менингоэнцефалитом и острым вялым параличом, которые часто наблюдаются в комбинации).
Исторические сведения. Впервые вирус Западного Нила (ВЗН) был выделен из крови больного человека в 1937 г. в Уганде. В последующем появились указания на широкое распространение заболевания в Африке, Азии, Индии, Индонезии. Крупные вспышки лихорадки Западного Нила (ЛЗН) с начала XXI в. регистрировались в США. Наиболее часто ЛЗН встречается в странах Средиземноморья, особенно в Израиле, Египте, на юге Франции и на Корсике. Наблюдались вспышки этой инфекции в России и на Украине (Астраханская, Волгоградская, Одесская области и др.), а также в Румынии. Доказано существование природных очагов ЛЗН в Молдавии, Армении, Азербайджане, Казахстане, Таджикистане, Турмении. По состоянию на конец 2012 г насчитывалось 48 государств, в которых была выявлена ЛЗН у людей, птиц, или комаров, в общей сложности 5674 случаев заболевания у людей и 286 летальных исходов, вызванных этим заболеванием.
Этиология. Возбудитель – ВЗН относится к семейству Flaviviridae, роду Flavivirus и входит в антигенный комплекс японского энцефалита (см. Главу Японский энцефалит). В соответствии с классификацией патогенных для человека микроорганизмов данный вирус относится ко II группе патогенности. Размеры вириона – 20-30 нм, содержит однонитевую РНК, имеет сферическую форму. На основании различия нуклеотидных и аминокислотных последовательностей различают не менее пяти генотипов ВЗН. Хорошо сохраняется в замороженном и высушенном состоянии. Погибает при температуре выше 56°С в течение 30 мин.
Эпидемиология. ВЗН является одним из наиболее широко распространенных арбовирусов, он был выявлен в большей части Африки, Южной Европы, Ближнего Востока, Азии, Австралии, Северной и Южной Америке. Недавние эпидемические вспышки включают почти 400 подтвержденных случаев заболевания в Румынии в 1996 г, около 200 случаев в Волгоградской области России в 1999 г и более 200 случаев в Израиле в 2000 г.
ВЗН передается в энзоотическом цикле между птицами и комарами. Исследования в США выявили ВЗН по крайней мере у 300 различных видов птиц (резервуар инфекции) и у 62 видов комаров (переносчики вируса), в первую очередь представители рода Culex. Кроме того, не менее 30 видов позвоночных животных заражены, но у них выявляется низкий уровень виремии, чтобы инфицировать комаров при кровососании, и поэтому эти животные считаются «тупиковыми» хозяевами. Тем не менее, у некоторы из животных может развиваться клинически выраженная инфекция (например, у человека). Птицы порядка воробьиных (сойки, дрозды, зяблики, пеночки, воробьи и вороны), как представляется, играют важную роль в передаче вируса в природе. Семья врановых (ворон и сойка синяя) особенно восприимчивы к инфекции ВЗН. Считается, что увеличение гибели птиц может быть предвестником распростанения ВЗН.
Главный механизм передачи возбудителя – транссмиссивный, дополнительными являются переливание инфицированной крови, трансплантация органов, при грудном вскармливании и внутриутробно. Описаны случаи лабораторного заражения.
Патогенез. Патогенез ЛЗН сходен с другими инфекционными заболеваниями, вызываемыми флавивирусами весьма сходен. Из места инокуляции после локальной репликации вирус попадает в кровь человека. Развивающаяся вирусемия чаще протекает в форме латентной инфекции, но в ряде случаев приводит к поражению нервной ткани. Реализация патогенетических механизмов и возникшие типовые патологические изменения формируют клиническую форму заболевания и в меньшей степени зависят от конкретного вируса. Возбудитель тропен не только к клеткам ЦНС, но и к эндотелию сосудов; возможно персистирование вируса в организме человека в течение относительно длительного времени (более 1 – 2 мес.).
Механизмы проникновения вируса в нервную систему остаются не полностью поняты. Исследования на грызунах выявили генетические маркеры, определяющие предрасположенность к развитию поражения ЦНС флавивирусами в целом и ВЗН в частности. В экспериментальных моделях энцефалита на животных показано, что ВЗН проникает в ЦНС путем инвазии через эндотелий сосудов или через обонятельный эпителий, где гематоэнцефалический барьер наиболее тонкий. Полученные данные свидетельствуют, что в организме человека ВЗН проникает через сосудистый эндотелий либо путем пассивного переноса, либо путем репликации в эндотелиальных клетках. Инфицированные моноциты также могут переносить ВЗН через гематоэнцефалический барьер.
В ЦНС вирионы передаются от клетки к клетке. Патологические изменения состоят из воспаления менингеальных оболочек, отека мозга, и собственно энцефалита с вовлечением преимущественно гиппокампа, височной области коры, таламуса, черной субстанции, мозжечка, перивентрикулярных областей ствола головного мозга и передних рогов спинного мозга. Фокальная дегенерация нейронов и их некроз с нейронофагией приводит к образованию глиальных узелков и, при наступлении процессов репарации, спонгиоформных (губчатых) изменений в ткани мозга. Вирусный антиген появляется в телах нейронов и их отростках, а затем и в фагоцитах. Периваскулярный воспалительный инфильтрат состоит из активированных CD4+ и CD8+ Т-клеток, макрофагов и В-клеток. Активированные Т-клетки преобладают в СМЖ.
Гибель нейронов осуществляется посредством нескольких различных механизмов, – апоптоза, цитоплазматического отека, вакуолизации и повреждения клеточной мембраны. Редкое выделение вируса из СМЖ, которое наблюдается, как правило, только у пациентов с молниеносным и смертельным заболеванием, связано с отсутствием интратекальных антител, что указывает на важную роль нейтрализации вируса в выздоровлении. С другой стороны, интратекальные иммунные комплексы и образование антител к нейрофиламентам и антимиелиновых антител были зарегистрированы в случаях со смертельным исходом, что предполагает иммунопатологический механизм повреждения ткани головного мозга. Иммунопатологические реакции также установлены при энцефалите, вызванном ВЗН, в экспериментах на животных. Это подтверждается наблюдением, что у некоторых пациентов с ослабленным иммунитетом, инфицированных ВЗН, существует задержка начала клинических признаков заболевания несмотря на высокий уровень виремии. Регуляторные Т-клетки могут играть важную роль в борьбе с этой реакцией для защиты от тяжелого заболевания.
Пожилой возраст является ведущим фактором риска развития данной нейроинфекции. Биологическая основа для этой возрастной восприимчивости полностью не определена. Хотя иммунологические нарушения врожденного и / или приобретенного иммунного ответа являются вероятной причиной, другие наблюдения указывают на значение функциональных или структурных изменений ЦНС, которые способствуют нейроинвазии. В некоторых исследованиях тяжелый энцефалит был связан с артериальной гипертонией и сопутствующими вирусными, бактериальными или паразитарными инфекциями.
Симптомы и течение заболевания. В большинстве случаев у человека инфицирование ВЗН протекает бессимптомно. В Северной Америке и Средиземноморье лихорадочная форма ЛЗН проявляется примерно у 20% инфицированных лиц. И только в менее 1% (у 1 из 150) развивается поражение нервной системы. В то же время в Африке лихорадочная форма ЛЗН у зараженных лиц наблюдается гораздо реже. Так, в Южной Африке во время крупной эпидемии, с количеством зараженных около 18 тысяч человек, только в одном случае развился энцефалит, вызванный ВЗН. Данное обстоятельство объясняют наличием приобретенного иммунитета у жителей Африки.
Тяжелые формы заболевания с поражением ЦНС наблюдаются практически исключительно у лиц старшего возраста.
Инкубационный период колеблется от 2 дней до 6 дней, возможно удлинение до 14 суток и более у людей с ослабленным иммунитетом.
Заболевание начинается остро с быстрого повышения температуры тела до 38–40°С, сопровождающегося гриппоподобным заболеванием с ознобом, недомоганием, головной болью, болями в спине, артралгиями, миалгиями и болями при движении глазных яблок, без явных неврологических симптомов. Лихорадочный период колеблется от 1 -2-х дней до нескольких недель (в среднем 5–7 дней). Температурная кривая в типичных случаях носит ремиттирующий характер с периодическими ознобами и повышенной потливостью, не приносящей больным улучшения самочувствия. Симптомы общей интоксикации выражены резко. Беспокоит сильная мучительна головная боль с преимущественной локализацией в области лба и глазниц, боли в глазных яблоках, тошнота и рвота, не связанная с приемом пищи, до 3–5 раз в сутки. Возникают генерализованные миалгии, особенно сильные боли отмечаются в мышцах шеи и поясницы. У некоторых больных наблюдаются артралгии, чаще в виде умеренных болей в суставах конечностей, однако припухлости суставов не отмечается.
Другие неспецифические симптомы включают анорексию, тошноту, рвоту, понос, кашель и боль в горле. Во время некоторых эпидемических вспышек, у большинства наблюдались гиперемия кожи лица, инъекция конъюнктивы и генерализованная лимфаденопатия. Макулопапулезная или бледно-розеолезная сыпь наблюдается примерно у 50% заболевших, чаще у детей. Гепатомегалия выявляется у 20% больных с ЛЗН, а спленомегалия – у 10%. Редко регистрируются миокардит, панкреатит, гепатит и другие проявления при тяжелой ЛЗН.
Кожа гиперемирована, иногда может наблюдаться макуло-папулезная сыпь (3–5% случаев), при длительной и волнообразной лихорадке, сыпь может приобретать геморрагический характер. Выявляются выраженная гиперемия конъюнктив век и равномерная инъекция сосудов конъюнктив глазных яблок. Надавливание на глазные яблоки болезненно. У большинства больных определяются гиперемия и зернистость слизистых оболочек мягкого и твердого неба. Наблюдается увеличение периферических лимфатических узлов (обычно подчелюстных, углочелюстных, боковых шейных, подмышечных и кубитальных). Лимфатические узлы чувствительны, либо слабо болезненны при пальпации (полилимфаденит).
Язык обычно обложен густым сероватым белым налетом, суховат. При пальпации живота часто определяются различные боли в мышцах передней брюшной стенки. Отмечается наклонность к задержке стула. Примерно в половине случаев выявляются умеренное увеличение и чувствительность при пальпации печени и селезенки. Могут наблюдаться желудочно-кишечные расстройства (чаще поносы по типу энтерита без болей в животе).
Поражение нервной систему при ЛЗН наблюдается у 1% больных. Развитию неврологических проявлений предшествует лихорадочный период длительностью от 1 до 7 дней. Серозный менингит (у 30% больных с поражением ЦНС) развивается на фоне описанных клинических проявлений. Усиливаются головная боль, рвота, общая гиперестезия. Характерна диссоциация между слабо выраженными оболочечными симптомами (ригидность мышц, затылка, симптом Кернига, реже симптомы Брудзинского) и отчетливыми воспалительными изменениями в ликворе (плеоцитоз до 100–200 клеток в 1 мкл, 70–90% лимфоциты; возможно небольшое повышение содержания белка). Присуща рассеянная очаговая неврологическая микросимптоматика (горизонтальный нистагм, хоботковый рефлекс, симптом Маринеску–Радовичи, легкая асимметрия глазных щелей, снижение сухожильных рефлексов, отсутствие брюшных рефлексов, диффузное снижение тонуса мышц. У части больных выявляются симптомы радикулоалгии без признаков выпадения.
Энцефалит наблюдается у 2/3 больных ЛЗН с поражением нервной системы. Выявляются психомоторное возбуждение, неадекватность поведения, галлюцинации, тремор, очаговая симптоматика, но длительно сохраняются признаки смешанной сомато-цереброгенной астении (общая слабость, подавленность психики, потливость, бессонница, ослабление памяти).
Также наблюдается вялый паралич, обусловленный поражением ВЗН переднего рога спинного мозга (миелит). Другие неврологические поражения включают невриты черепно-мозговых нервов, включая неврит зрительного нерва, и атаксию. Судорожные припадки, мышечная ригидность, брадикинезия также недавно были выявлены при ЛЗН.
Заболевание имеет склонность к волнообразному течению. Могут наблюдаться 1–2 рецидива болезни (с интервалом в несколько дней). Часто первая волна характеризуется серозным воспалением оболочек мозга, вторая и третья – катаральными явлениями и поражением сердца. По степени преобладания того или иного синдрома различают нейроинфекционные, гриппоподобные и экзантематозные клинические формы заболевания.
Осложнения и критические состояния. При менингоэнцефалите – отек и набухание головного мозга, нарушения мозгового кровообращения. Редко выявляются миокардит, пневмония, панкреатит и др. поражения органов.
Диагноз и дифференциальный диагноз. Основывается на клинических, эпидемиологических и лабораторных данных. Основными клиническими признаками являются: острое начало заболевания, нередко короткий лихорадочный период, серозный менингит, системное поражение слизистых оболочек, лимфатических узлов, мышц (реже – суставов), органов ретикулоэндотелиальной системы и сердца, реже – экзантема. Эпидемиологическими предпосылками могут являться пребывание в эндемичной по лихорадке Западного Нила местности в эпидемический сезон (лето – осень), сведения об укусах комаров или клещей в указанных регионах.
В периферической крови у 50% наблюдается лейкоцитоз, у 15% – лейкопения с количеством лейкоцитов менее 4×109/л. Исследование СМЖ обычно показывает умеренный лимфоцитарный плеоцитоз, хотя иногда ликвор в норме или нейтрофилы преобладают. Белок умеренно повышенный, отношение его к глюкозе нормальное.
Современным является обнаружение ВЗН методом ПЦР. Также применяется ИФА с целью обнаружения IgM-антител. Последний метод является предпочтительным способом диагностики ЛЗН (чувствительность 95%). В случаях энцефалита при одновременном исследовании крови и СМЖ на 10-й день болезни подтверждение диагноза удается получить почти у 100% больных. Также успешно обнаруживают IgM и IgG антитела методом непрямой реакции иммунофлюоресценции.
РНГА и РСК используются нечасто, но они все еще могут быть полезными при некоторых обстоятельствах.
Выделение вируса возможно при аутопсии умерших от ЛЗН. Напротив, у больных редко удается выделить вирус из крови или СМЖ из-за низкого уровня виремии на момент госпитализации.
Дифференциальную диагностику следует проводить с другими арбовирусными инфекциями, микоплазмозом, орнитозом, листериозом, токсоплазмозом, туберкулезом, риккетсиозом, сифилисом, гриппом и другими острыми респираторными заболеваниями, энтеровирусной инфекцией, острым лимфоцитарным хориоменингитом.
Лечение. Проводится в инфекционном стационаре. В остром периоде заболевания больные нуждаются в постельном режиме. Этиотропного противовирусного лечения нет. Рибавирин оказался не эффективным. Имееется ограниченный опыт применения гипериммунного гамма-глобулина. Надежды возлагаются на терапию моноклональными антителами, но данный метод находится на стадии испытаний.
Патогенетическая терапия проводиится как и при других вирусных менингоэнцефалитах (см. Клещевой энцефалит).
Прогноз и исходы заболевания. Прогноз зависит от формы заболевания. Несмотря на длительную астению в периоде реконвалесценции, при лихорадочной форме выздоровление полное, остаточных явлений и летальных исходов не наблюдается.
При менингоэнцефалите – прогноз серьезный. Во время недавних вспышек ЛЗН летальность у госпитализированных пациентов составляла от 4% до 14%, но была выше у пациентов пожилого возраста. Неврологические осложнения распространены среди выживших. Половина госпитализированных пациентов имели дефицит еврологических функций при выписке и только одна треть из этих пациентов полностью восстановилась через 1 год.
Другие факторы риска летального исхода включают выраженную слабость, глубокую кому, неспособность вырабатывать антитела IgM, нарушение иммунитета и интеркуррентных заболеваний, таких как артериальная гипертония или сахарный диабет.
Правила выписки. Больные выписываются после полного клинического выздоровления и нормализации показателей СМЖ.
Реабилитация. После заболевания ЛЗН с поражением нервной системы комплекс реабилитационных мероприятий проводится аналогично таковым вирусных менингоэнцефалитах другой этиологии (см. главу Колещевой энцефалит).
Диспансерное наблюдение. Лица, перенесшие тяжелые формы менингоэнцефалита и серозного менингита с остаточными изменениями поражения нервной системы, состоят на диспансерном наблюдении с участием невропатолога в течение года. Гражданским лицам, в зависимости от состояния, для проведения реабилитационных мероприятий пребывание на больничном листе может быть продлено до 1 мес. Военнослужащим срочной службы восстановительное лечение проводится в реабилитационных отделениях военных госпиталей. Проходящие службу по контракту могут быть переведены для реабилитации в военные санатории.
Профилактика и противоэпидемические мероприятия в очаге. Осуществляются в соответствии с санитарно-эпидемиологическими правилами «Профилактика лихорадки Западного Нила» (СП 3.1.7.3107-13). Предупредительные мероприятия в очаге основываются на борьбе с комарами, клещами и защите от их укусов. Специфическая профилактика не разработана.
Военно-врачебная экспертиза. Перенесшие менингоэнцефалит с выраженными остаточными изменениями нервной системы военнослужащие срочной службы решением ВВК признаются негодными к военной службы; к проходящим военную службу по контракту подход индивидуальный.
ВИЧ-инфекция (инфекция вирусом иммунодефицита человека)
ВИЧ-инфекция – медленно прогрессирующее инфекционное заболевание, возникающее вследствие заражения вирусом иммунодефицита человека (ВИЧ), поражающего иммунную систему, в результате чего в организме развиваются оппортунистические инфекции и опухоли, которые в конечном итоге приводят к гибели больного.
Шифр по МКБ: В20-В24.
Исторические сведения. По данным ретроспективного анализа, выявившего антитела к ВИЧ-1 в сохранившихся сыворотках крови больных, первые случаи ВИЧ-инфекции наблюдались в Африке в 1959 г., в США – с 1977 г. В 1981 г. в США отметили большое число случаев саркомы Капоши у молодых мужчин, практикующих секс с мужчинами; это редкое заболевание первоначально назвали «рак гомосексуалистов». В 1982 г. М.С. Готтлиб (англ. M.S.Gottlib) ввёл понятие СПИД (синдром приобретенного иммунодефицита – англ. Aquired Immune Deficiency Syndrom, AIDS). В начале 1983 г. группа учёных во главе с Л. Монтанье из Института Пастера (Франция) выделила вирус – ВИЧ. В конце того же года об открытии вируса СПИДа объявил Р. Галло (США). В 2008 г. Люк Монтанье и Франсуаза Барре-Синусси стали лауреатами Нобелевской премии за открытие возбудителя ВИЧ-инфекции.
Этиология. ВИЧ – представитель семейства ретровирусов, относится к подсемейству лентивирусов (медленных вирусов). В мире циркулирует два типа вирусов иммунодефицита человека: ВИЧ-1 и ВИЧ-2, отличающихся структурой, антигенным составом и эпидемиологической характеристикой.
Наиболее распространен ВИЧ-1, который включает 3 группы (M,N,0). Группа М наиболее распространена и включает от 14 до 18 подтипов (А,В,С, и т.д.). По распространенности в мире лидирует подтип С (Африка), в развитых странах – подтип В, а в Российской Федерации и постсоветском пространстве – подтип А.
Морфология. Вирион имеет диаметр 100-140 нм. ВИЧ-1 представлен (рис. 12) оболочкой, матриксным слоем, оболочкой нуклеотида, геномной РНК, в которую включены фрагмент комплекса интеграции и нуклеопротеиды, а также латеральные тельца. Наружная мембрана вируса пронизана собственными белками (оболочечные белки) gp41 и gp120 (от «glicоprotein») c молекулярной массой 41 и 120 kD. Эти белки образуют 72 отростка на поверхности мембраны вируса, каждый состоит из 3 молекул gp120. Молекулы gp120 могут отрываться от вирусной частицы и с током крови поступать в ткани, что имеет существенное значение в патогенезе ВИЧ-инфекции. Стержневая («коровая») оболочка состоит из белка p17, оформленного в виде двенадцатигранника и расположена на небольшом расстоянии от внешней оболочки. Внутренний нуклеотид состоит из белка p24, имеет форму полого конуса с открытым верхом и зазубренной нижней частью.
Внутри нуклеоида, оболочка которого построена из молекул белка р24, заключены геном вируса (две молекулы РНК), белок с молекулярной массой 7 килодальтон и комплекс ферментов: обратная транскриптаза, РНК-аза, протеаза.
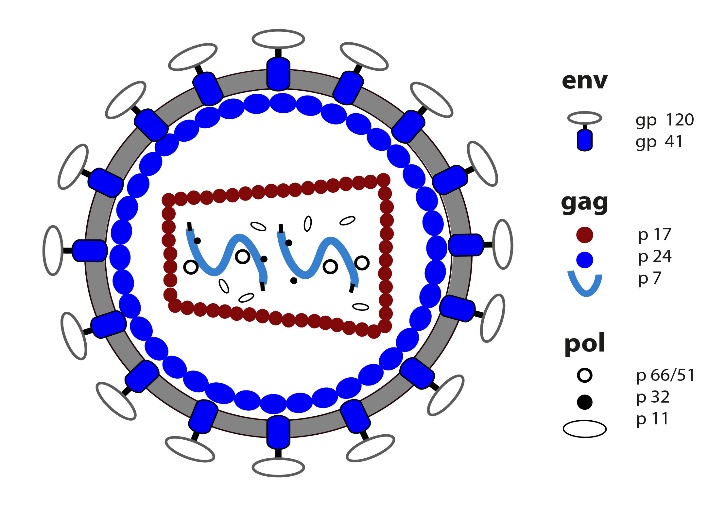
Рисунок 12. Структура вириона ВИЧ1
ВИЧ отличает исключительно высокая генетическая изменчивость, частота генетических ошибок при репликации составляет 10-4-10-5 ошибок/на ген/на цикл репликации. Доказано, что в каждом геноме ВИЧ при каждой репликации есть хотя бы одна генетическая ошибка, т.е. ни один дочерний вирион не воспроизводит родительский клон в точности. ВИЧ существует не иначе как только в качестве множества квази-видов.
По репликативной активности выделяют а) rapid/high – высокоинфекционные, эффективно реплицирующие изоляты и б) slow/low – низкоинфекционные, слабо реплицирующие изоляты.
Культуральные свойства. Культивирование ВИЧ удается в культурах мононуклеаров крови доноров, которые предварительно стимулируют к размножению митогенами, после чего к ним добавляют клинический материал пациента для дальнейшего совместного культивирования при стимуляции интерлейкином-2. В качестве материала для культивирования обычно используют лимфоциты периферической крови, ликвор, амниотическую жидкость, биопсийный материал мозга, лимфатических узлов и пр. Могут использоваться и другие клеточные культуры. Из животных к ВИЧ-1 восприимчивы шимпанзе и некоторые другие виды обезьян. У них ВИЧ не вызывает летальной инфекции.
ВИЧ нестоек во внешней среде. Он инактивируется при температуре 56°С за 30 мин., при кипячении – через одну минуту, погибает под воздействием химических агентов, допущенных для проведения дезинфекции. Вирус относительно устойчив к ионизирующей радиации, ультрафиолетовому облучению и замораживанию при 70°С. Однако имеются данные о возможности возбудителя сохраняться во внешней среде в течение нескольких дней в высушенном состоянии, особенно в крови и сперме.
Эпидемиология. ВИЧ-инфекция распространена во всем мире. С начала эпидемии ВИЧ заразились около 80 млн. человек и 39 млн. человек из них умерло. В 2014 г. 1,2 миллиона людей в мире умерли от причин, связанных с ВИЧ. В конце 2014 г. в мире насчитывалось примерно 37 млн. людей с ВИЧ-инфекцией, а два млн. человек в мире приобрели ВИЧ-инфекцию в 2014 г. Наиболее пораженным регионом является Африка к югу от Сахары — здесь в 2014 г. проживало 26 млн. человек с ВИЧ. На этот регион приходится также почти 70% глобального общего числа новых ВИЧ-инфекций.
На 1.01.2016 г. в России выявлено 986657 больных ВИЧ-инфекцией, в том числе 10215 детей. За время регистрации в стране умерло 164878 больных, среди них 722 детей.
Резервуары и источники возбудителя. Единственным источником инфекции является ВИЧ-инфицированный человек и его биологические материалы.
Механизмы передачи возбудителя. В распространении ВИЧ-инфекции задействованы два механизма передачи.
Контактный (пути передачи: половой (незащиненный гетеро- и гомосексуальный контакт) и гемоконтактный (трансфузии, трансплантации инфицированных крови и тканей, инъекции, медицинские травмы).
Вертикальный (пути передачи: трансплацентарный (поврежденная плацента), контактный (контакт с кровью и секретами родовых путей в родах), алиментарный (грудное вскармливание).
В России среди ВИЧ-инфицированных за последние три года более 50% от общего числа употребляли инъекционно наркотики.
Биологические жидкости, при контакте с которыми возможно заражение ВИЧ:
– кровь (компоненты, препараты);
– сперма;
– влагалищные выделения;
– грудное молоко;
– содержащие ВИЧ культуры и культуральные среды;
– синовиальная жидкость;
– цереброспинальная жидкость;
– плевральная, перикардиальная, асцитическая жидкость;
– амниотическая жидкость;
– биологические жидкости с видимой примесью крови.
Первые четыре имеют значение для эпидемического распространения ВИЧ-инфекции, остальные являются факторами риска профессионального инфицирования медицинских работников.
В наибольших концентрациях ВИЧ содержится в крови, сперме, влагалищном секрете, женском молоке и спинномозговой жидкости (табл. 20). Инфицирующая доза биологического материала для ВИЧ-инфекции в 100-1000 раз больше, чем для заражения вирусным гепатитом В.
Сперма является основным транспортёром вируса при естественном распространении инфекции. Влагалищное и цервикальное отделяемое и менструальная кровь также содержат вирус, что определяет передачу его от женщины мужчине при половом контакте.
Трансплантация органов от ВИЧ-инфицированного всегда имеет высокий риск передачи вируса реципиенту. Не исключен риск инфицирования и при искусственном оплодотворении.
Таблица 20
Вероятность передачи ВИЧ-инфекции при однократном контакте
| № п/п | Факторы риска заражения | Вероятность заражения,% | |
| Мин. | Макс. | ||
| 1 | Переливание инфицированной крови | 95 | 100 |
| 2 | Переливание непроверенной крови | 0,1 | 1 |
| 3 | Переливание проверенной крови | 1:45000 | 1:5500 |
| 4 | Трансплацентарный и при родах | 20 | 50-90 |
| 5 | Гомосексуальные контакты* | 0,5-3,0 | 10-20 |
| 6 | Гетеросексуальные контакты* | 0,1 | 0,2 |
| 7 | Внутривенное введение наркотиков | 0,5 | 1 |
| 8 | Прокол кожи инфицированной иглой | 0,37-0,5 | 1 |
| 9 | При оперативных вмешательствах | 0,00076 | 0,02 |
| 10 | Попадание инфицир. крови на слизистые | 0,32 | >0,32 |
* – Незащищенный половой контакт – контакт без презерватива
ВИЧ не передается насекомыми, эктопаразитами, при бытовых контактах.
Наличие инфекций, передающихся половым путем (ИППП), увеличивает вероятность половой передачи ВИЧ до 20 раз. Это обусловлено тем, что при многих венерических заболеваниях имеются язвенные поражения гениталий, которые облегчают проникновение вируса, к очагу воспаления мигрируют макрофаги. Кроме того, у больных ИППП формируется иммуносупрессия, способствующая инфицированию ВИЧ.
Группу риска по ВИЧ-инфицированности составляют лица с множественными незащищенными сексуальными контактами с разными партнерами.
При интенсивной виремии у ВИЧ-инфицирования риск передачи инфекции выше. При половом пути передачи ВИЧ больные в первые три месяца после инфицирования в 50-2000 раз опаснее для своих половых партнёров, чем после появления в крови антител. Практически все мужья ВИЧ-инфицированных женщин (дискордантная пара) в случае отказа от обязательного использования презерватива заражаются в течение 2-3 лет.
При отсутствии антиретровирусной профилактики во время беременности, в родах и ранний неонатальный период риск инфицирования ВИЧ ребенка составляет 20-40%. До 90% инфицированных детей заражаются вертикальным путем во время беременности, родов или вскармливании грудным молоком. Только 5-10% детей инфицируются половым или инъекционным путем (старший возраст – 14-18 лет), в 3-5% через кровь и её препараты (медицинское заражение).
Трансплацентарно заразились только 10-15% детей из числа инфицированных при наличии воспалительных заболеваний плаценты или инвазивных манипуляций, нарушающих плацентарный барьер. 70-80% детей инфицировались в родах при контакте с кровью и секретами родовых путей матери. Сохранение грудного вскармливания увеличивает частоту инфицировании детей на 10-15%. Лечение матери антиретровирусными препаратами в период беременности, назначение препаратов ребёнку в течение 6 недель после рождения и отказ от грудного вскармливания (трехкомпонентная профилактика перинатальной передачи ВИЧ от матери ребенку) снижает риск инфицирования новорожденного до 1-2%. В развитых странах рекомендуется прекратить грудное вскармливание для предотвращения ВИЧ.
Описаны единичные случаи инфицирования кормящей матери ребенком, который был инфицирован внутрибольнично (переливание инфицированной крови) предположительно через трещины соска.
Медицинские работники, особенно имеющие постоянный контакт с больными ВИЧ-инфекцией или кровью, также составляют группу риска.
Инфицирование потребителей парентеральных наркотиков происходит при использовании контаминированных инфицированной кровью инъекционных инструментов, общих емкостей для приготовления и хранения наркотиков. Установлена возможность временного сохранения ВИЧ в растворах готовых психоактивных веществ (наркотиков).
Патогенез и патологическая анатомия. Рецептором для ВИЧ является дифференцировочный антиген CD4, гликопротеид, расположенный в большей степени на мембране Т-лимфоцитов (хелперов). Рецептор CD4 выполняет функцию распознавания (в комплексе с белками HLA II класса) антигенов. Фиксация вируса с помощью gp120 ВИЧ-1 (или gp105 в случае инфицирования ВИЧ-2) с мембранным рецептором CD4 клеток хозяина ведет к блокированию восприятия сигналов от антигенпрезентирующих клеток и нарушению каскада реакций специфического иммунитета. Последующая репликация вируса ведёт к гибели этих клеток, выпадению их функции, что и определяет развитие иммунодефицита.
Процесс репликации при заражении ВИЧ носит последовательный характер: а) проникновение вируса через слизистую оболочку половых путей или непосредственное поступление в кровоток; б) связывание вириона с поверхностью клетки, слияние мембраны клетки и вириона; в) высвобождение нуклеоида и геномной РНК вируса; г) интеграция генома вируса в геном инфицированной клетки; д) латентная фаза; е) активация транскрипции с ДНК провируса и последующая трансляция белков вируса, наработка его компонентов и формирование новых (дочерних) вирионов; ж) их высвобождение из клетки, сопровождающееся цитопатическим эффектом для инфицированной клетки.
Цитопатическое действие ВИЧ проявляется в прямой деструкции и цитолизе инфицированной клетки, синцитиеобразовании, хронической инфекцией без выраженного цитолиза (дендритные лимфоциты, моноциты/макрофаги, нейроны, инактивации иммунокомпетентных клеток (около половины гликопротеина gp120, синтезируемого в клетке проникают во внеклеточную среду, связываются с CD4+, преимущественно неинфицированных ВИЧ клеток).
Взаимодействие gp120 ВИЧ-1 с мембраной CD4+-лимфоцитов определяет не только патологические реакции в инфицированных клетках, но и приводит к программированной клеточной гибели (апоптозу) зрелых CD4+-лимфоцитов или CD34+-гемопоэтических клеток-предшественников даже при отсутствии их инфицирования вирусом.
Т-лимфоциты с хелперным фенотипом являются не единственными клетками со встроенным в мембрану рецептором CD4. Не менее 40% моноцитов периферической крови (предшественники макрофагов и дендритных клеток) и некоторые клетки в лимфатических узлах, коже и других органах, а также примерно 5% всех В-клеток организма имеют рецептор CD4 и могут быть инфицированы ВИЧ.
ВИЧ-инфекция характеризуется также нарушением гуморального иммунитета. Вирус влияет на CD19-лимфоцитцы (В-клетки), обусловливая гиперпродукцию IgG, причем специфические к ВИЧ антитела составляют лишь 5% от общего числа иммуноглобулинов. Постоянная антигенная активация В-лимфоцитов предрасполагает к онкогенезу В-лимфоцитов, увеличивает их чувствительность к апоптозу.
В патологический процесс вовлекается и кроветворная ткань. Поэтому для заболевания характерны лейкопения, анемия, тромбоцитопения. Угнетается функциональная активность гранулоцитов.
Патогенез ВИЧ-инфекции носит фазовый характер, условно можно выделить шесть стадий: а) инкубационный период или первичная латентная ― серонегативная, продолжительностью до 3-х мес. и больше; б) 1-я стадия ― выраженной вирусной репродукции и первичного иммунноо ответа ― серопозитивная, продолжительностью до 6-12 мес.; в) 2-я стадия ― гиперреактивности гуморального иммунитета, продолжительностью до 3-5 лет; г) 3-я стадия ― компенсированного иммунодефицита (число CD4+-лимфоцитов не менее 400 в 1 мкл; д) 4-я стадия ― выраженного угнетения клеточного иммунитета и начала декомпенсации гуморального иммунитета с угасанием трех из четырех кожно-аллергических реакций; е) 5-я стадия ― полного отсутствия реакций гиперчувствительности замедленного типа и развития локальных вторичных, преимущественно оппортунистических инфекций и ж) 6-я стадия ― терминальная, характеризуется глубокими нарушениями клеточного и гуморального иммунитета и генерализованными вторичными инфекциями. Первые 4 стадии патогенеза условно называют «пре-СПИД», остальные ―«СПИД».
Специфическими патоморфологическими изменениями для ВИЧ-инфекции являются прежде всего гиперплазии лимфоидной ткани (периферических, мезентериальных, паратрахеальных лимфоузлов, лимфоидных образований кишечника). Остальные проявления обусловлены вторичными заболеваниями, развивающимися по мере прогрессирования иммунодефицита.
Классификация ВИЧ-инфекции. Существует несколько классификаций ВИЧ-инфекции (табл. 21).
Таблица 21
Классификация стадий ВИЧ-инфекции CDC (1993), взрослые и подростки > 13 лет
| Число (%) CD4+ Т-лимфоцитов в мкл | Клинические категории | ||
| А | В | С | |
| Бессимптомная, острая (первичная) или ПГЛ | Манифестная, но не А и не С | СПИД-индикаторные заболевания | |
| > 500 (> 29%) | А1 | В1 | С1 |
| 499-200 (14-28%) | А2 | В2 | С2* |
| < 200 (< 14%) = индикатор СПИДа | АЗ* | ВЗ* | СЗ* |
* высокая вероятность СПИДа.
По клиническим признакам разграничиваются три категории, обозначаемые как А, В, С.
Клиническая категория А включает в себя одну из следующих форм:
• бессимптомную серопозитивную ВИЧ-инфекцию;
• острую (первичную) ВИЧ-инфекцию;
• персистирующую генерализованную лимфаденопатию у лиц с инфицированностью.
Клиническая категория В выделена как промежуточная. В эту категорию включают различные синдромы. Важнейшими из них являются:
• бациллярный ангиоматоз;
• орофарингеальный кандидоз;
• рецидивирующий кандидозный вульвовагинит (трудно поддающийся терапии);
• цервикальная дисплазия;
• цервикальная карцинома;
• общеинфекционные симптомы (лихорадка 38,5 °С или диарея более месяца);
• волосатая лейкоплакия языка;
• опоясывающий герпес (один или два эпизода);
• идиопатическая тромбоцитопеническая пурпура;
• листериоз;
• воспалительные заболевания органов малого таза, вплоть до тубоовариального абсцесса;
• периферическая нейропатия.
При установлении диагноза ВИЧ-инфекции категории В ее рекомендуется сохранить, даже если достигнуты успехи в лечении.
Клиническая категория С - стадия вторичных заболеваний, т.е. стадия развития СПИДа. Предусмотрено, что если признаки категории С выявлялись у больного хотя бы один раз, этот больной должен относиться к категории С.
В качестве контроля взят количественный учет содержания СD4-лимфоцитов с выделением трех градаций:
1) иммунодефицит отсутствует;
2) иммунодефицит умеренный;
3) иммунодефицит выраженный.
В соответствии с таким комплексным подходом выявление глубокой иммуносупрессии (содержание СD4-лимфоцитов менее 200 кл/мкл) и при отсутствии выраженных клинических признаков (категория АЗ и ВЗ) отнесены к СПИДу.
В России используется классификация, предложенная В.И. Покровским (табл. 22).
Таблица 22
Дата: 2018-11-18, просмотров: 520.