Хроническая HDV-инфекция подтверждается выявлением в крови анти-HDV IgG, РНК HDV наряду с HBsAg. HDAg в сыворотке крови обнаруживается редко и клинического значения не имеет. Клинико-лабораторная и инструментальная характеристика ХГD в целом соответствует таковой при ХГВ. В связи с тем, что хроническая HDV-инфекция протекает наиболее тяжело среди всех вирусных гепатитов и характеризуется быстрым развитием ЦП и его декомпенсацией, всем больным с впервые выявленным HBsAg необходимо проводить обследование с целью исключения ХГD.
Лечение. В терапии больных ХГD применяются пегилированные интерфероны α-2а (180 мкг 1 раз в неделю) и α-2b (15 мкг/кг/нед.). Длительность терапии составляет 48 нед. Как правило на фоне противовирусной терапии появляется репликация ВГВ, что требует добавления к лечению аналогов нуклеоз(т)идов. Эффективность терапии на современном этапе не превышает 40%.
Профилактические мероприятия, диспансеризация и экспертиза проводятся как при ХГВ.
Гепатит С
Гепатит С (ГС, НСV-инфекция, острый гепатит С– ОГС, хронический гепатит С– ХГС) – заболевание, сходное по многим признакам с ГВ, однако его острые формы протекают легко и редко сопровождаются манифестной клинической картиной. Чаще встречаются безжелтушные, субклинические и инаппарантные формы ОГС, которые редко попадают в поле зрения медицинских работников, и в 75-80 % случаев переходят в хронический гепатит. При этом у 15-20% больных ОГС наблюдается спонтанная элиминация вируса.
В связи с тем, что ОГС редко наблюдается в реальной клинической практике, основное изложение учебного материала представлено в разделе «хронические гепатиты».
Этиология. ВГС представляет собой мелкий вирус, имеющий размеры в диаметре около 50 нм, относится к роду Hepacivirus семейства Flaviviridae. HCV содержит однонитевую линейную РНК (длиной примерно 9400-9600 нуклеотидов), нуклеокапсид и покрыт белково-липидной оболочкой.
Геном имеет одну открытую рамку считывания, по краям которой расположены 5’- и 3’-концы нетранслируемого региона. Открытая рамка считывания вируса кодирует один полипротеин, длина которого варьирует от 3008 до 3037 нуклеотидов. Образовавшийся полипротеин расщепляется вирусными клеточными сигнальными протеиназами на структурные и неструктурные белки (рис. 10). К структурным белкам относят сердцевинный (С-core protein) и два гликопротеина оболочки (Е1-и Е2- envelope protein). Неструктурную область представляют шесть белков с ферментативной активностью, участвующих в репликации вируса (NS2, NS3, NS4A, NS4B, NS5A, NS5B).
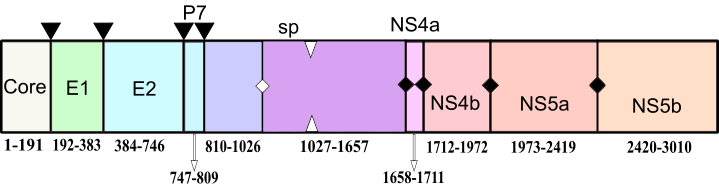
Рисунок 10. Схема организации вирусного генома HCV
Существенной особенностью генома HCV является его генетическая неоднородность, соответствующая особенно быстрой замещаемости нуклеотидов. Благодаря этому, вирус существует у инфицированных лиц как комплекс популяции генетически близких, но иммунологически разграничиваемых вариантов. Эти варианты получили название “quasispecies” (квазивидов), т.е. как бы кажущихся разновидностей.
Установлены шесть генотипов вируса (1-6), которые в свою очередь подразделяются на субтипы. С позиций клинической целесообразности различают пять основных генотипов HCV: 1а, 1b, 2a, 2b, 4 и 3а. Анализ географического распространения генотипов вируса показал, что в Европе чаще регистрируется1b, в странах Северной Америки – 1а, в Юго-Восточной Азии – 1b, 2a и 2b. В России также преобладают генотипы 1b и 3а.
Высокая изменчивость ВГС, приводящая к постоянному обновлению антигенной структуры и тем самым к одновременному существованию множественных вариантов вируса с частично измененным геномом, способствует тому, что иммунная система не успевает продуцировать вируснейтрализующие антитела к непрерывно образующимся антигенным вариантам возбудителя. Происходит «ускользание» вируса из-под иммунного надзора, что и вызывает длительную, а иногда пожизненную, персистенцию вируса в организме больного.
Сведения о чувствительности ВГС к внешним физико-химическим воздействиям малочисленны. По сравнению с ВГВ он менее устойчив. Возбудитель ГС легко инактивируется растворителями липидов, УФО, при температуре +60ºС в течении 30 мин, при кипячении – через 2 мин.
Эпидемиология. Распространенность ГС во многом совпадает с ГВ, что находит объяснение в общности многих черт эпидемиологии этих инфекций. К особенностям распределения ГС можно отнести меньшее различие в инфицированности между развивающимися и высокоразвитыми странами. Гиперэндемичные зоны по заболеваемости ГС, в сравнении с ГВ, не столь очерчены в связи с широким распространением наркомании в различных странах. Приблизительно 3% населения земного шара (170 млн. человек) инфицированы HCV. В различных странах встречаемость HCV-инфекции колеблется от 0,1 до 5%. В США около 4 млн. хронических носителей вируса, в Европе – 5 млн. (большинство в Восточной). В РФ острая HCV-инфекция регистрируется редко – 2-4 случая на 100 тыс. населения. В тоже время заболеваемость ХГС сохраняется на стабильно высоком уровне – 35 – 41 случай на 100 тыс. населения ежегодно.
Источником инфекции ГС являются больные острой и хронической формами заболевания. Учитывая преобладание латентных форм ГС, наибольшую эпидемическую опасность представляют больные скрыто протекающим гепатитом, особенно с наличием РНК HCV в крови.
Механизм заражения в основном парентеральный. При этом заражающая доза для ВГС в несколько раз больше, чем для ВГВ. В отличие от возбудителя ГВ естественные пути распространения вируса ГС имеют меньшее значение: риск инфицирования в быту, при половых контактах и при рождении ребенка от инфицированной матери относительно низок. Заражение происходит при гемотрансфузиях, других парентеральных вмешательствах, нанесении татуировок, пирсинге и т.п. У 40 – 50% больных установить путь инфицирования не представляется возможным.
Выявлены взаимосвязи между генотипом ВГС и путями инфицирования, а также возрастом больных. Показано, что 1 генотип преимущественно связан с переливаниями крови и встречается чаще у лиц более старшего возраста, тогда как 2 и 3 генотипы в большей степени распространены среди лиц молодого возраста, вводивших внутривенно психоактивные вещества
В связи с вариабельностью генома HCV у лиц, перенесших инфекционный процесс, не вырабатывается специфическая невосприимчивость к повторным заражениям. Возможно множественное инфицирование различными генотипами и субтипами возбудителя.
Патогенез и патологическая анатомия. Доминирующая роль биологических свойств HCV по сравнению с иммунным ответом – это главное отличие патогенеза от ГВ. Непременным условием развития инфекции является проникновение вируса в клетку, где и происходит его репликация (рис. 11).
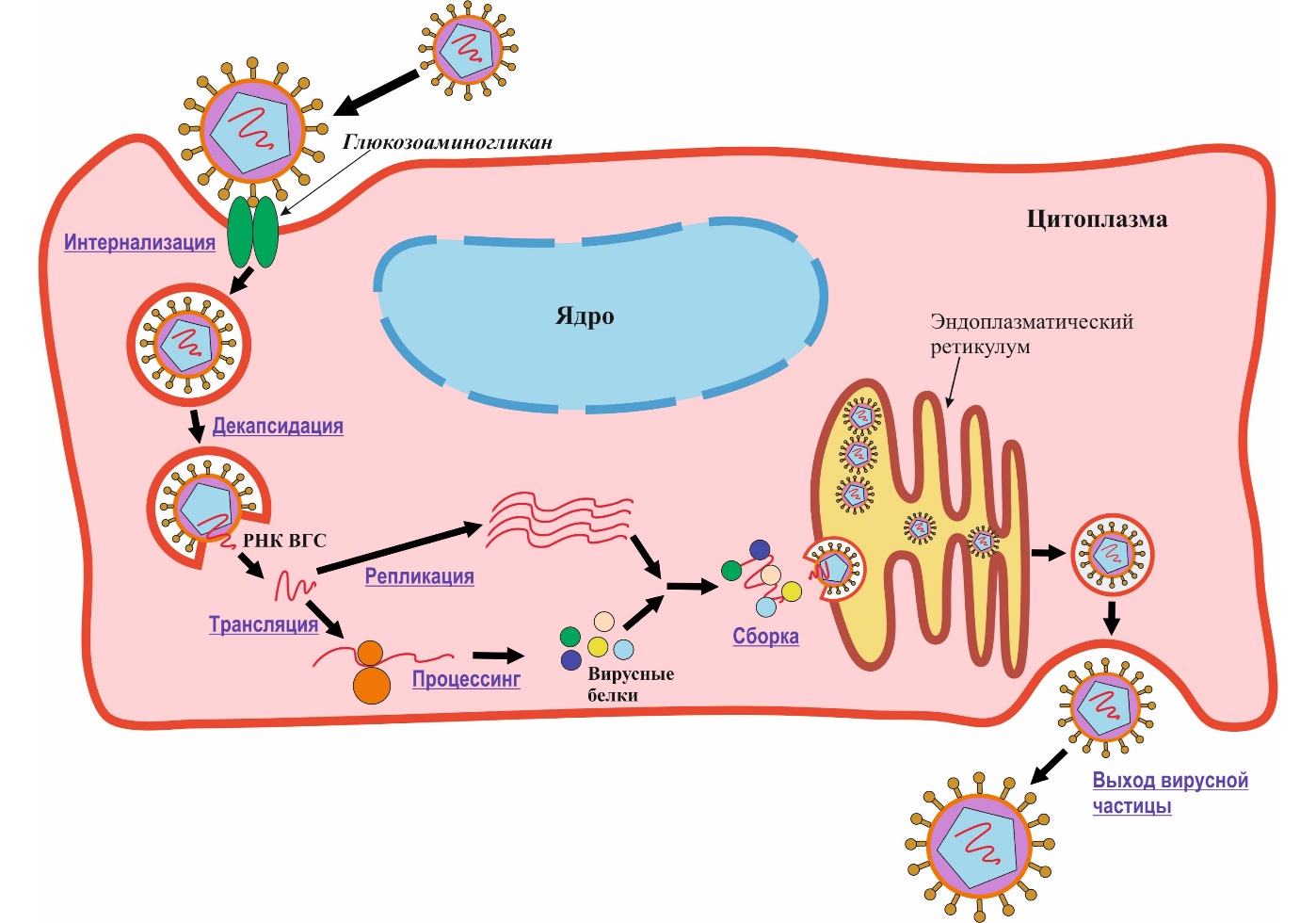
Рисунок 11. Жизненный цикл ВГС.
ВГС, в отличие от ВГВ, обладает прямым цитопатическим действием. Однако быстрой санации клеток от возбудителя не происходит, что обусловлено его слабой иммуногенностью.
Главным механизмом «ускользания» вируса из-под иммунного надзора является высокий уровень репликации (10¹¹-10¹²копий/сут.) и высокая изменчивость возбудителя, которая реализуется путем непрерывного обновления его антигенной структуры, прежде всего гипервариабельного участка 1 (HVR1) оболочечного белка Е2, к чему не успевает приспосабливаться иммунная система. В результате сохраняются гипервариабельные штаммы, они становятся преобладающими и поддерживают активную репликацию. Причем скорость мутаций превышает скорость репликации, что и формирует присущую ГС многолетнюю персистенцию инфекции.
При ХГС установлена внепеченочная репликация в клетках костного мозга, лимфатических узлов, селезенки, а также моноцитах и лимфоцитах, которая, безусловно, способствует и персистенции вируса, и развитию различных внепеченочных системных проявлений гепатита С.
В генезе поражения печени при HCV-инфекции рассматриваются как прямой цитопатический эффект вируса, так и иммунологически опосредованное повреждение гепатоцитов, которое реализуется не только в цитотоксическом действии лимфоцитов на вируссодержащие клетки-мишени, но и в развитии перекрестных аутоиммунных реакций, связанных с высоким сходством белковых структур вируса и клеток печени.
Уже на стадии первичного звена иммунного ответа при взаимодействии антигенов вируса с макрофагами и моноцитами отмечается иммунологический сбой – неэффективность презентации вирусных антигенов. Связывают это с низкой способностью распознавать белки ВГС Тоll-like и лектиновыми рецепторами типа С (СD209).
Реакция иммунной системы при ГС имеет ряд характерных особенностей. Прежде всего, это неэффективность гуморального звена. Антитела к антигенам HCV появляются довольно поздно, циркулируют в низких титрах и практически лишены вируснейтрализующих свойств. Слабая выраженность гуморального ответа связана, по всей видимости, с крайне низкой иммуногенностью ВГС.
В то же время Т-клеточному иммунному ответу отводится основная роль в патогенезе поражения печени, клиническом течении и исходах при HCV-инфекции. Характер иммунного ответа напрямую зависит от преимущественного участия либо Т-хелперов Iтипа (Th1), либо Т-хелперов II типа (Th2). Активация первых вызывает продукцию ИФН-g, ИЛ-2 и ФНО-a, которые играют ведущую роль в развитии иммунного ответа по клеточному типу. В свою очередь, вторые секретируют ИЛ-4, 5, 6, 9, 10, 13, стимулирующие, главным образом, гуморальное звено иммунитета. При ГС сбалансированная продукция лимфоцитами цитокинов нарушается. Так, преобладание цитокинов Th2 ассоциируется с длительной персистенцией вируса и хронизацией инфекционного процесса, тогда как выздоровление при ОГС сочетается с преимущественным участием цитокинов Th1.
Патогенез HCV-инфекции был пересмотрен после открытия внепеченочной репликации ВГС. Выявлена высокая лимфотропность вируса. Установлено присутствие ВГС у пациентов с неходжкинской В-клеточной лимфомой в три раза чаще, чем в общей популяции. Внепеченочная репликация играет важную роль в хронизации, а также предрасполагает к поражению других органов и систем с развитием внепеченочных проявлений. Более того, нахождение вируса в различных органах и тканях, прежде всего в иммунонедоступных местах, локализующихся за гисто-гематическими барьерами (глия нервной ткани, эпителий кишечника и почечных канальцев), рассматривается как резервуар HCV-инфекции и источник реинфицирования гепатоцитов.
Патологическая анатомия. Выделяется т. н. «гистологическая триада» HCV-инфекции: лимфоидные агрегаты (фолликулы) в перипортальной соединительной ткани и/или печеночных дольках, поражение желчных проточков и жировую дистрофию гепатоцитов.
Лимфоидные фолликулы могут быть как изолированными, так и в составе воспалительного инфильтрата. Они проходят путь формирования от плотных скоплений лимфоидных клеток в виде округлых агрегатов до совершенных лимфоидных фолликулов с герминативными центрами. В середине фолликулов находятся активированные В-лимфоциты в сочетании с множеством Т-лимфоцитов-хелперов, окруженные кольцом, образованным, преимущественно, цитотоксическими Т-лимфоцитами. По клеточному составу эти агрегаты напоминают первичные лимфоидные фолликулы в лимфатических узлах. Встречаемость данного маркера в биоптатах варьирует от 49 до 88%.
Второй типичный гистологический признак ГС – изменение желчных проточков – характеризуется деструкцией и гибелью их эпителиальной выстилки вследствие проникновения лимфоцитов под эпителий. Иногда развивается перидуктальный склероз с большим количеством фибрилл коллагена вокруг желчного проточка. Частота обнаружения поражений желчных проточков также колеблется в широких пределах от 11 до 91% случаев.
И третья морфологическая особенность ГС – жировая дистрофия (стеатоз) гепатоцитов, при которой включения липидов заполняют цитоплазму, смещая органеллы к периферии клеток. Стеатоз может носить мелко- и крупнокапельный характер. Этот признак регистрируется в 47–72% наблюдений.
Следует отметить, что все вышеуказанные морфологические изменения, хотя и довольно типичны для HCV-инфекции, все же не являются патогномоничными и могут встречаться при ряде других заболеваний печени.
Симптомы и течение заболевания. Инкубационный период при гепатите С продолжается от 20 до 150 сут., в среднем – 40-50 дней. ОГС, как правило, остается нераспознанным, так как патологический процесс обычно протекает латентно (субклинические, инаппарантные формы). Он может быть диагностирован лишь по повышению активности АлАТ, положительным результатам исследований на РНК HCV, несколько реже анти-HCV IgM, IgG и при отсутствии антител к неструктурному белку NS4, которые обычно появляются значительно позже, когда патологический процесс переходит в хроническую форму.
Для безжелтушных и начального периода желтушных (встречаются гораздо реже) форм ГС характерны астеновегетативный и диспепсический синдромы. Клиническая симптоматика скудная. Больные отмечают слабость, вялость, быструю утомляемость, ухудшение аппетита, иногда ощущение тяжести в правом подреберье. Жалобы большей частью выражены нерезко. В желтушном периоде признаки общей интоксикации незначительны. Проявления желтухи, как правило, минимальны (субиктеричность склер и слизистой неба, легкое окрашивание кожи, транзиторные холурия и ахолия), может быть выявлено слабо выраженное увеличение печени. Клинически манифестный острый ГС протекает преимущественно (в 75–85 % случаев) в легкой, реже – в среднетяжелой форме. ОПечН (энцефалопатия) развивается крайне редко. Спонтанная элиминация ВГС чаще наблюдается при манифестном остром гепатите, чем при латентно протекающем.
Течение ХГС характеризуется наличием вирусемии при полном или почти полном отсутствии клинических проявлений. Скрытая инфекция может продолжаться многие годы. В течение этого периода инфицированные лица в своем большинстве считают себя здоровыми, единственной жалобой может быть незначительная тяжесть в правом подреберье, которая возникает при нарушении режима питания и физических нагрузках. При объективном исследовании может быть выявлено небольшое увеличение печени с уплотнением ее консистенции. Спленомегалия чаще всего определяется только при УЗИ. Трансаминазы могут быть постоянно повышенными или нормальными. В некоторых случаях отмечается периодическое повышение АлАТ, что характеризует в определенной мере «волнообразность» течения. В крови закономерно обнаруживаются анти-HCV, анти-HCVns, РНК HCV. Нормальный уровень АлАТ не свидетельствует об отсутствии изменений в печени, и такие пациенты не могут рассматриваться как здоровые носители. У 30-50% таких больных может быть обнаружен активный гепатит или ЦП.
Цирроз печени развивается у 25–35% больных хроническим ГС. Вероятность развития ЦП у больных с активным гепатитом составляет 7,3% в год (5,1–9,5%). ЦП в течение многих лет остается компенсированным и не распознается. У многих больных HCV-цирроз первично диагностируется по данным гистологического исследования биоптатов печени. Темпы декомпенсации цирроза составляют 5,5% в год. Вероятность развития в течение года синдрома портальной гипертензии у больных с компенсированным циррозом составляет 3,6%, печеночной энцефалопатии – 0,4%, ГКЦ (гепатоцеллюлярная карцинома) – 1,5%.
Независимо от варианта развития течение HCV-цирроза бывает непрерывно прогрессирующим и медленно прогрессирующим с периодами длительной ремиссии. Часто в начальной стадии компенсированного ЦП отмечаются лишь метеоризм, боль и чувство тяжести в верхней половине живота, похудание, астенизация, снижение работоспособности. При осмотре выявляют увеличение печени с ее уплотнением и умеренную спленомегалию. Однако у 20% больных в начальной стадии ЦП протекает латентно, и его обнаруживают случайно во время профилактического осмотра или обследования по поводу другого заболевания, причем только морфологически или эквивалентными методиками (ультразвуковая эластометрия и др.).
У 5–7% больных хроническим ГС развивается ГЦК. Риск ее развития при отсутствии цирроза составляет 0,1% в год. ГЦК, ассоциированная с HCV, характеризуется медленным прогрессированием и мультифокальным характером поражения.
Диагноз и дифференциальный диагноз. Для ГС эпидпредпосылки те же, что и при ГВ, с акцентом на парентеральную (искусственную) передачу. Острый гепатит большей частью протекает бессимптомно с очень высокой вероятностью хронизации. Основным подтверждением диагноза является обнаружение в крови РНК HCV, несколько реже – анти-HCV IgM и IgG. Исключение хронического ГС осуществляется на основании выявления изменений в гепатобиоптатах при морфологическом исследовании печени или на основании данных ультразвуковой эластометрии (отсутствия фиброза). При ХГС помимо вышеописанных методов необходимо определить генотип ВГС, так как от этого будет зависеть схема и длительность противовирусной терапии.
Лечение. На доцирротических стадиях и вне клинико-лабораторного обострения лечение проводится амбулаторно у инфекциониста в поликлинических отделениях или в режиме дневного стационара инфекционных больниц. В остальных случаях больные подлежат госпитализации в инфекционный стационар.
Противовирусная терапия показана всем больным ХГС с наличием репликации вируса. Более подробно противовирусная терапия изложена в руководстве для врачей. В зависимости от генотипа ВГС применяются стандартные интерфероны α-2а и α-2b (по 3 млн. ед 3 раза в неделю), пегилированные интерфероны α-2а (180 мкг 1 раз в неделю) и α-2b (15 мкг/кг массы/нед.) в комбинации с рибавирином 800 – 1200 мг/сут. При выявлении 1 или 4 генотипа ВГС длительность противовирусной терапии составляет 48 недель. При 2 и 3 генотипах – 24 недели. Эффективность такой схемы терапии не превышает 55%.
Для лечения больных с генотипом 1 ХГС применяются ряд препаратов с прямым противовирусным действием – боцепревир, телапревир и симипревир (ингибиторы протеазы ВГС первого поколения), которые позволяют повысить эффективность интерферонсодержащей противовирусной терапии на 30%. Также применяются безинтерфероновые схемы лечения: комбинации препаратов - ингибиторов неструктурных белков ВГС. Основные схемы приведены ниже:
- даклатасвир 60 мг (ингибитор NS5A протеина ВГС) и асунапревир 100 мг. (блокатор протеазы HCV генотипа 1). Даклатасвир назначается 1 раз в сутки внутрь, асунапревир два раза в день внутрь. Общая продолжительность лечения составляет 24 недели.
- омбитасвир 12,5 мг (ингибитор NS5A протеина ВГС), паритапревир 75 мг (блокатор протеазы HCV генотипа 1), усиленный ритонавиром 50 мг, и дасабувир 250 мг (ненуклеозидный ингибитор РНК-зависимой РНК полимеразы ВГС). Омбитасвир, паритапревир и ритонавир принимается внутрь 1 раз в сутки утром, дасабувир – 1 раз в день внутрь вечером. Длительность терапии составляет 12-24 недели.
- софосбувир 400 мг (нуклеозидный ингибитор РНК-зависимой РНК полимеразы ВГС) и симепревир 150 мг (ингибиторы протеазы ВГС первого поколения). Софосбувир и симепревир принимаются 1 раз в сутки. Длительность терапии составляет 12 недель.
Больным со 2 и 3 генотипом ВГС (а также остальными генотипами) возможно назначение как стандартных, так и пегилированных интерферонов в сочетании с рибавирином в дозе 800 мг в сут. Эффективность лечения пациентов с не-1-м генотипом HCV составляет 60-80%. Возможно применение безинтерфероновой схемы – комбинации софосбувира 400 мг и даклатасвира в течение 12-24 недель.
Внедрение в практику безинтерфероновых схем противовирусной терапии позволило повысить эффективность лечения до 90 – 100% при всех генотипах HCV.
Прогноз и исходы заболевания. В 75-80% случаев острой HCV-инфекции наступает хронизация и в 20-25% – выздоровление. Без соответствующей терапии у 25-35% больных ХГС развивается ЦП, из которых у 5-7% возможно появление ГЦК. Эти осложнения ХГС являются основной причиной смерти больных. После диагностики цирротической стадии ХГС больному показана трансплантация печени.
Диспансерное наблюдение. Больные хроническим вирусным гепатитом С до начала противовирусной терапии и после ее завершения подлежат углубленному медицинскому обследованию 1 раз в 6 мес. Пациенты, перенесшие манифестные формы ОГС, подлежат наблюдению как при ОГВ.
Профилактика и мероприятия в очаге такие же, как при ГВ. До настоящего времени вакцина не разработана.
Военно-врачебная экспертиза. Проводится аналогично ВГВ.
Микст-гепатиты
Гемоконтактные микст-гепатиты с наибольшей частотой регистрируются у лиц, практикующих внутривенное введение психоактивных веществ. Это отчасти объясняет тот факт, что микст-инфекция преимущественно наблюдается у пациентов молодого возраста. В первую очередь это касается сочетания ГВ и ГС. Клинико-лабораторные и эпидемиологические данные у большинства больных свидетельствуют о наслоении ГВ на предшествующий ГС (острый ГВ на фоне хронического ГС) или о сочетанном заражении. В последнем случае клинические проявления в основном соответствуют моноинфекции ГВ. Частота хронизации при остром микст-гепатите В+С и остром ГС приблизительно одинаковая. Необходимо отметить, что более чем в половине случаев при микст-гепатитах В+С в клинической практике приходится иметь дело уже с обострениями хронического гепатита смешанной этиологии, особенностью которого является преобладание активности ВГС, которая определяет характер течения инфекции. У небольшой части больных могут выявляться и маркеры HDV-инфекции. Такой «тройной» микст-гепатит в острую фазу рассматривают как потенциально тяжелое заболевание, которое также обуславливает частую хронизацию. Назначение противовирусной терапии гемоконтактных микст-гепатитов зависит от наличия репликативной активности того или иного возбудителя.
ГА-микстинфекция. По данным ВОЗ в развитых странах отмечается снижение уровня заболеваемости ГА-моноинфекцией на фоне относительного увеличения ГА-микст-инфекции (ГА+ГВ, ГА+ГС и ГА+ГВ+ГС). Данное обстоятельство заставляет по-другому взглянуть на клинику и течение ГА-микст-инфекции. Нередко ГА протекает на фоне хронического ГВ или ГС. При этом микст-гепатит отличается от моноинфекции смешанным вариантом преджелтушного периода примерно в 75% случаев, большей частотой среднетяжелых форм, развитием холестатического синдрома, тенденцией к затяжному течению, длительным выздоровлением с сохраняющимся после выписки слабо выраженным цитолизом в 60-65%. В этой связи, выявление ГА-микст-инфекции требует обязательного определения маркеров активности репликации ВГВ (HBeAg, анти-HBc IgM, ДНК HBV) и ВГС (РНК HCV) для решения вопроса о необходимости этиотропной противовирусной терапии. Сочетание острого ГА и острых парентеральных гепатитов (В, С, D) отмечается крайне редко.
Дата: 2018-11-18, просмотров: 593.