Гепатит В (ГВ) – заболевание печени, вызываемое вирусом гепатита В, протекающее как в острой (преимущественно с выраженными функциональными нарушениями), так и в хронической форме (как правило, латентно), исходом которой нередко является цирроз печени.
Этиология. Вирус гепатита В (ВГВ, HBV) содержит ДНК, относится к семейству Hepadnaviridae. Вирус устойчив к различным физическим и химическим факторам: низким и высоким температурам (в том числе кипячению), замораживанию и последующему оттаиванию, воздействию органических кислот. Во внешней среде при комнатной температуре ВГВ может сохраняться до нескольких недель, в засохшем пятне крови, на лезвии бритвы или конце иглы. В сыворотке крови при температуре +30°С патогенные свойства вируса сохраняются в течение 6 мес., при температуре −20°С − около 15 лет; в сухой плазме – 25 лет. Инактивируется при автоклавировании в течение 30 мин., стерилизации сухим жаром при температуре 160°С в течение 60 мин., прогревании при 60°С в течение 10 ч.
Возбудитель ГВ – частица Дейна –- имеет диаметр 42-45 нм и состоит из внешней оболочки и сердцевины (нуклеокапсид). Белок вирусной оболочки представлен поверхностным антигеном (HBsAg), ранее именовавшимся «австралийским». Нуклеокапсид возбудителя содержит сердцевинный (core) антиген (НВсАg); близкий к нему антиген инфекционности (HBeAg), который представляет секретируемую растворимую часть HBcAg; недостаточно изученный HBxAg; ДНК и ферменты – ДНК-полимеразу и протеинкиназу. Каждый из антигенов ВГВ вызывает гуморальный иммунный ответ, проявляющийся выработкой соответствующих антител (анти-HBs, анти-НВс, анти-НВе). Убедительное подтверждение получило выявление наряду с обычными («дикими») штаммами вируса т. н. «мутантных вариантов». Первой была установлена мутация в зоне pre-S/S генома ВГВ, кодирующей синтез HBsAg. В результате новый штамм HBV с измененной структурой HBsAg стал недосягаемым для вакцинных анти-HBs. Вторая группа мутаций связана с участком pre-С генома ВГВ, кодирующем HBeAg, что приводит к невозможности его экспрессии, хотя организм продуцирует анти-НВе. При этом образование HBcAg не нарушается, а значит сохраняется репликация вируса. Наибольшая группа мутаций ВГВ обусловлена изменениями в последовательности аминокислот обратной транскриптазы (тирозин, метионин, аспартат, так называемые YMDD-мутации) и связана с широкими применением в лечении HBV-инфекции аналогов нуклеоз(т)идов.
Все антигены вируса и соответствующие им антитела могут служить индикаторами различных фаз инфекционного процесса.
HBsAg является маркером, свидетельствующим об инфицировании человека ВГВ. Он обнаруживается в сыворотке крови спустя 4-6 нед. после заражения, еще в инкубационном периоде (за 25-30 дней до появления клинических признаков), а также в преджелтушном и на протяжении всего острого периода гепатита. У большинства больных он исчезает в периоде реконвалесценции, однако у отдельных пациентов HBsAg продолжает обнаруживаться в крови месяцы и даже годы после начала заболевания (персистенция данного антигена более полугода свидетельствует о переходе инфекционного процесса в хроническую форму).
Антитела к поверхностному антигену (анти-HBs) большей частью начинают обнаруживаться в крови только в отдаленном периоде, спустя длительное время после исчезновения HBsAg. Продолжительность так называемой фазы «окна» (отсутствие HBsAg и анти-HBs) чаще составляет 3-4 мес. Выявление анти-HBs рассматривают как один из критериев развития постинфекционного протективного иммунитета и выздоровления после острого ГВ.
HBcAg выявляется только в биоптатах печени, что ограничивает возможности внедрения его диагностики в практику. Антитела к сердцевинному антигену (анти-HBc IgM) появляются при остром ГВ еще до желтухи или в первые дни разгара болезни. Они циркулируют в крови до 3-5 мес. Обнаружение анти-HBc IgM является для клиницистов наиболее важным подтверждением наличия у больного острого ГВ. Анти-HBc IgG обычно обнаруживаются практически в те же сроки, или несколько позже и сохраняются пожизненно.
HBeAg появляется у больного ГВ почти одновременно с HBsAg и свидетельствует о высокой ДНК-полимеразной активности. Наличие в сыворотке крови HBеAg и ДНК HBV являются показателями активной репликации вируса. Антитела к антигену инфекционности (анти-НВе) начинают появляться при исчезновении HBeAg. Значительное снижение HBeAg, ДНК HBV и появление анти-HBе указывают на вероятность доброкачественного течения острого инфекционного процесса. Длительная циркуляция в крови HBeAg и HBsAg, высокое содержание ДНК HBV свидетельствуют о затяжном течении инфекционного процесса и возможной хронизации заболевания.
Отличительной особенностью ВГВ является интеграция его генетического аппарата в ядро пораженной клетки в форме ковалентно замкнутой кольцевидной ДНК (ккзДНК). Необходимым свойством персистирующих вирусов является образование стабильных генных структур, не элиминирующихся, в частности, в ходе клеточного деления и способных к длительному воспроизводству вирусных геномов. Многие ДНК-содержащие вирусы способны интегрировать свои генетические элементы в клеточные, что позволяет им напрямую использовать клеточный репликативный аппарат. Так, ретровирусы встраивают линейную двухцепочечную ДНК в хромосомный аппарат клетки, в результате чего репликация происходит совместно с репликацией клеточного генома. В отличие от ретровирусов, геном гепаднавирусов в ядре представлен в виде отдельной ковалентно замкнутой кольцевой ДНК.
За пределами ядра после проникновения ВГВ в цитоплазму гепатоцита формируется кольцевидная ДНК с расслабленной цепью (РЦ-ДНК), отличающаяся от ккзДНК только тем, что «-» цепь ДНК является полной (с обратной полярностью по отношению к мРНК), в то время как «+» цепь представлена в виде нескольких молекул меньшей длины; 5'-конец «-» цепи ковалентно связан с Р-протеином; 5'–конец «+» цепи содержит РНК-олигонуклеотид, являющийся праймером для синтеза «+» цепи. При образовании ккзДНК все эти элементы должны быть удалены и обе цепи должны быть ковалентно связаны. Механизм трансформации РЦ-ДНК в ккзДНК окончательно не выяснен, отчасти в связи со сложностью идентифицирования ккзДНК в присутствии РЦ-ДНК даже с использованием ПЦР.
Установлено, что при естественном течении инфекционного процесса в каждом гепатоците может содержаться 50 и более копий ккзДНК, вероятно, в форме гистон-содержащих минихромосом. Наращивание количества сссДНК происходит по тому же механизму, что и образование первичной молекулы ккзДНК. Большое количество ккзДНК в сочетании с достаточно длительным персистированием (до 60 сут.) позволяет генетическим элементам сохраняться во время клеточного деления и противовирусной терапии. Ядерный транспорт РЦ-ДНК и образование зрелых вирусов с оболочкой являются конкурирующими процессами, поскольку в разгаре заболевания образование большого количества вирусных протеинов приводит к прекращению формирования ккзДНК. Клетки, содержащие только 1 копию сссДНК могут в ходе деления образовывать клон неинфицированных клеток, что отчасти может объяснять феномен исчезновения ккзДНК в ходе спонтанной элиминации ДНК HBV.
Все известные гепаднавирусные РНК, в том числе прегеномные и сердцевинные РНК образуются путем транскрипции ккзДНК клеточной РНК-полимеразой II и являются матрицей для экспрессии вирусных структур. Часть РНК подвергается сплайсингу и может быть упакована в новообразованные капсиды; роль их на сегодняшний день окончательно не установлена.
Основным продуктом транскрипции ккзДНК является прегеномная РНК (пгРНК); структура ее включает полный геном вируса и концевую последовательность из примерно 120 нуклеотидов. Первая функция пгРНК – участие в синтезе белков сердцевины и обратной транскриптазы; в отличие от ретровирусных Gag-Pol протеинов, Р-протеин экспрессируется как отдельный полипептид. Вторая, основная функция пгРНК – образование ДНК вируса. Стоит отметить, что клеточная РНК-полимераза совместно с обратной транскриптазой повышает вариабельность вирусного генома, однако степень влияния клеточной полимеразы окончательно не оценена.
Следующим этапом в репликации ВГВ является упаковка прегеномной РНК и обратной транскриптазы в образующиеся капсиды. Необходимыми элементами этого процесса являются инкапсидационный сигнал ε и Р-протеин, связывающийся с ε. Данное взаимодействие опосредует связывание димеров сердцевинных белков и таким образом приводит к формированию пгРНК-Р комплекса. Стоит отметить, что сердцевинная РНК не упаковывается в капсид, несмотря на наличие в ней всех последовательностей, характерных для пгРНК.После инкапсидации комплекса «pgРНК-Р-протеин» взаимодействие Р-ε инициирует обратную транскрипцию; первый нуклеотид, связанный с Р-протеином дает начало «-» цепи ДНК, затем формируется «+» цепь и образуется новая РЦ-ДНК.
Завершение обратной транскрипции до высвобождения вирусной частицы из клетки является вторым отличительным признаком гепаднавирусов. Также, в отличие от ретровирусов, обратная транскрипция гепаднавирусов происходит в интактных капсидах, в то время как обратная транскрипция ретровирусов происходит преимущественно вне оболочки.
Эпидемиология. ГВ является одной из самых распространенных инфекций человека. В мире ежегодно от различных клинических форм заболевания умирает около 600 тыс. человек. Нарастающим итогом около двух миллиардов людей во всем мире с момента открытия HBV были инфицированы этим вирусом, из них более 350 миллионов людей больны хроническим гепатитом В. К территориям с низкой частотой выявления ВГВ-инфекции относятся Северная, Западная и Центральная Европа, Северная Америка; со средней – Южная и Восточная Европа, Южная и Центральная Америка; с высокой – страны Восточной Азии и Африки южнее Сахары. Филогенетический анализ с использованием последовательностей целых геномов позволил выделить 8 генотипов ВГВ – A, B, C, D, E, F, G и H. Прототип генома ВГВ имеет длину в 3215 нуклеотидов, как при генотипах В, С, F и Н. Для европейской популяции, в том числе РФ, характерно превалирование больных с генотипом D.
После начала вакцинации против ГВ заболеваемость острыми формами инфекции в РФ снизилась более чем в 14 раз (с 19,8 на 100 тыс. населения в 2002 г. до 1,13 на 100 тыс. – в 2015 г.). В тоже время сохраняется стабильно высокий уровень больных хронической HBV-инфекцией (в 2015 г. зарегистрировано 10,79 случаев на 100 тыс. населения ХГВ и 13,88 на 100 тыс. так называемого «носительства ВГВ»).
Источником инфекции являются больные как манифестными, так и бессимптомными формами острого и хронического ГВ. Больной манифестной формой острого ГВ может быть заразен уже за 2-8 нед. до появления признаков заболевания. У большинства таких больных вирусемия прекращается с наступлением клинического выздоровления. Однако у части заразившихся возбудитель может присутствовать в крови в течение нескольких лет. Наибольшую эпидемическую опасность представляют больные бессимптомным ГВ, особенно в фазе активной вирусной репликации (реактивация хронического HBeAg-негативного гепатита В или иммунная толерантность (или клиренс) хронического HBeAg-позитивного гепатита В). Число выявляемых таких лиц ежегодно в несколько раз превышает число больных манифестным ГВ. Таким образом, больные хроническим ГВ могут сохранять эпидемическое значение в течение всей жизни. Длительное сохранение возбудителя в организме инфицированных обеспечивает существование вируса как биологического вида.
Механизм заражения ГВ – парентеральный. Контагиозность ВГB превышает контагиозность ВИЧ в 100 раз. Выделяют естественные пути передачи ВГВ (от матери к ребенку – вертикальный: перинатальный; при половых контактах с инфицированным человеком – половой; при других контактах с инфицированным человеком – горизонтальный: бытовой) и искусственные (при нарушении целостности кожных покровов и слизистых оболочек).
Дети, рожденные от HBsAg-позитивных матерей, при отсутствии профилактических мероприятий (пассивная, активная иммунизация, противовирусное лечение матерей в третьем триместре беременности) оказываются инфицированными в 20% случаев. Примерно у 95% из них развивается хронический гепатит B. В тоже время, инфицирование взрослого не вакцинированного человека в 95% случаев приводит к формированию острой HBV-инфекции. При обнаружении у матери HBeAg вероятность перинатального инфицирования ребенка возрастает до 40%. Необходимо отметить, что около 95% случаев вертикальной передачи происходит во время родов, и, примерно, 5% новорожденных заражаются ВГВ еще в утробе матери.
Общепризнана роль сексуальных контактов в распространении ГВ. Передача вируса происходит в результате контакта слизистых оболочек с семенной жидкостью, вагинальным секретом или менструальной кровью инфицированных ВГВ. У 18% больных острым ГВ происходит передача инфекции постоянным половым партнерам. Гораздо чаще инфицируются партнеры больных хроническим ГВ.
Горизонтальная передача чаще всего наблюдается среди детей, в семьях больных хроническим ГВ, в организованных коллективах при пользовании общими бритвенными приборами, зубными щетками, расческами, мочалками и пр. В перемещении вируса вследствие его высокой устойчивости во внешней среде могут, участвовать также обезличенные полотенца, носовые платки, постельное белье и др. ГВ является одной из самых опасных профессиональных инфекций для работников медицинских учреждений, а также для тех сотрудников, которые по роду своей профессиональной деятельности имеют контакт с кровью или другими контаминированными биологическими жидкостями.
Реализация искусственных путей передачи чаще всего происходит при разнообразных лечебно-диагностических манипуляциях в случаях использования недостаточно очищенного от крови и плохо простерилизованного медицинского или лабораторного инструментария, приборов, аппаратов. Наиболее трудоемка стерилизация эндоскопических инструментов. Высоко число лиц, инфицированных при внутривенном введении психоактивных веществ (наркотиков).
ГВ наблюдается преимущественно в виде спорадических случаев независимо от сезонов года. У лиц, перенесших инфекционный процесс, вырабатывается специфическая невосприимчивость к повторным заражениям.
Патогенез и патологическая анатомия. Патогенез ГВ имеет ряд принципиальных отличий. Парентеральный путь передачи возбудителя обеспечивает его гематогенный занос в печень. Вирусу не свойственно прямое повреждающее действие на гепатоциты. Их цитолиз осуществляется иммуноопосредовано, главным образом, за счет реакции со стороны клеточного звена иммунитета через цитотоксические Т-лимфоциты.
Установлено, что при ГВ усиливается продукция γ-интерферона, который активизирует систему HLA. В результате происходит экспрессия молекул гистосовместимости I класса в совокупности с пептидными антигенами на мембране гепатоцитов, которые распознаются наивными цитотоксическими Т-лимфоцитами. Последние пролиферируют и образуют клоны антиген-специфических киллеров, поражающих вирусинфицированные гепатоциты. В меньшей степени происходит экспрессия молекул гистосовместимости II класса с последующей пролиферацией Т-хелперов I типа, которые активируют бактерицидность и цитотоксичность макрофагов. Последние в свою очередь поглощают остатки некротизированных интралобулярных и перипортальных гепатоцитов.
Реакция со стороны гуморального звена менее значима в иммунопатогенезе и заключается в продукции специфических антител к антигенам ВГВ, их связывании с образованием иммунных комплексов и прекращении циркуляции в крови в свободном виде. Однако сила гуморального ответа не позволяет препятствовать формированию хронической инфекции.
Естественное течение ГВ и его иммунопатогенез схематично могут быть представлены следующим образом (рисунок 1). У взрослых заболевание протекает как с клиническими симптомами (30-40%), так и латентно (60-70%), но заканчивается, как правило, выздоровлением, что свидетельствует об адекватном иммунном ответе. Хронический гепатит развивается не более чем у 1% взрослых, перенесших острую инфекцию, причем либо латентно, либо в легкой форме, что связано с неполноценным иммунным ответом. Педиатры реже видят острый ГВ, так как имеется прямая корреляция между возрастом человека и наличием клинических проявлений в острой стадии болезни. У детей иммунная система еще «недостаточно зрелая» для распознавания ВГВ как «чужого» и не проявляет достаточной активности для избавления организма от возбудителя. Вот почему острый ГВ у большинства детей обычно протекает бессимптомно (90-95%), но очень часто приводит к развитию хронического ГВ (90%). Таким образом, адекватному иммунному ответу, обеспечивающему купирование инфекционного процесса, соответствует острый ГВ циклического течения с полным выздоровлением.
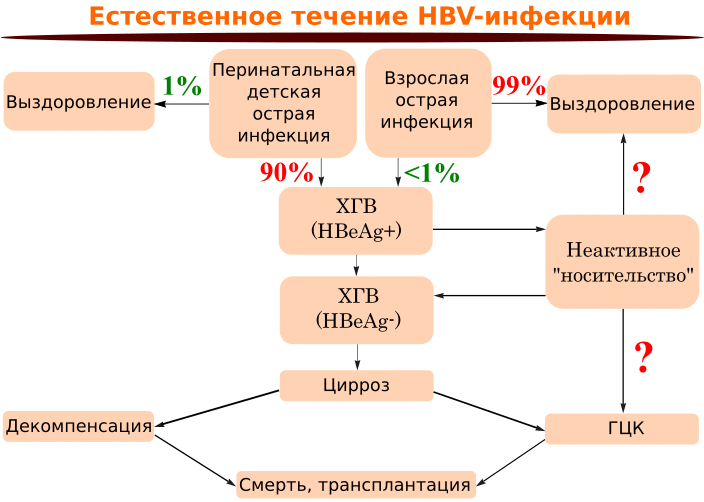
Рисунок 8. Естественное течение вирусного гепатита В
В разгар ОГВ поражение печени характеризуется цитолизом (повреждением гепатоцитов, нарушением структурно-функциональной целости мембран, разрушением органелл клетки), холестазом и мезенхимально-воспалительной реакцией (повреждением стромы и клеток ретикулогистиоцитарной системы). В основе цитолиза лежит нарушение внутриклеточных метаболических процессов, активация прооксидантных и угнетение антиоксидантных систем клеток. В результате на мембранах гепатоцитов происходит накопление свободных радикалов, усиливается перекисное окисление липидов, что приводит к повышению их проницаемости, выходу из гепатоцитов внутриклеточных ферментов (аминотрансфераз и др.), ионов калия. Последние заменяются натрием и кальцием, что ведет к задержке жидкости и набуханию клеток, изменению их рН, нарушению окислительного фосфорилирования со снижением биоэнергетического потенциала гепатоцитов. Нарушаются их разнообразные функции, в том числе детоксицирующая, синтетическая, ухудшаются утилизация глюкозы, эстерификация холестерина, процессы переаминирования и дезаминирования аминокислот. Наиболее ранним проявлением цитолитического синдрома является повышение активности в сыворотке крови таких внутриклеточных ферментов, как АлАТ и АсАТ, и др. Клинически значимым отражением нарушения пигментного обмена, детоксицирующей и секреторной функции печени является гипербилирубинемия, обусловленная снижением процессов захвата свободного билирубина гепатоцитами, его глюкуронидирования и экскреции в желчные пути. Угнетение синтетической функции печеночных клеток приводит к гипоальбуминемии, уменьшению практически всех факторов свертывания крови, особенно протромбина, ингибиторов коагуляции и фибринолиза. При критическом падении коагуляционного потенциала появляются кровоизлияния, а в тяжелых случаях – массивные кровотечения.
Холестаз отражает нарушение оттока желчи, как правило, в результате снижения секреторной функции печеночных клеток (гепатоцеллюлярный холестаз), причем в сочетании с цитолизом. В крови накапливаются не только различные фракции билирубина, но и желчные кислоты, холестерин, экскреторные ферменты (щелочная фосфатаза, γ-глутамилтранспептидаза и др.) и некоторые микроэлементы, в частности, медь.
Возникновение фульминантного гепатита большинство клиницистов связывает с развитием гипериммунного ответа, следствием чего является массивный некроз печени. При этом регенерация печеночной ткани не наступает или развивается медленно. Чрезмерный иммунный ответ может быть детерминирован иммуногенетически. Некоторые исследователи допускают, что определенную роль в генезе фульминантного течения гепатита могут иметь мутантные штаммы ВГВ, а также ускоренный апоптоз гепатоцитов, индуцированный HBV.
В случаях тяжелого цитолитического синдрома развивается гипокалиемический алкалоз, а процесс дезинтеграции мембран распространяется на внутриклеточные органеллы. В результате нарушения целостности лизосомных мембран происходит массивный выход протеолитических ферментов гидролаз, что ведет к саморазрушению клеток, которое может приобрести характер своеобразной цепной реакции с развитием массивного некроза печени и ОПечН. В этот период отмечаются изменения многих жизненно важных органов и систем (ЦНС, сердца, почек, надпочечников, поджелудочной железы), проявляющиеся их полнокровием, кровоизлияниями и некрозом клеток. С развитием ОПечН интоксикация приобретает черты специфических нарушений функций ЦНС, проявляющихся печеночной энцефалопатией. В основе патогенеза поражения нервной системы при ОПечН лежат глубокие обменные нарушения, обусловленные, с одной стороны, выпадением антитоксической барьерной функции печени. Ряд веществ, образующихся в результате извращенного обмена, оказывают церебротоксическое действие. Определенное значение имеет повышение в крови концентрации аммиака, фенола, некоторых аминокислот. Нарастает концентрация пировиноградной и молочной кислот, низкомолекулярных жирных кислот. С другой стороны, токсическим воздействием обладают и продукты распада самой печеночной ткани. Под влиянием церебротоксических веществ происходит «дезорганизация» обмена нервных клеток, прежде всего в коре головного мозга. Извращается цикл превращений трикарбоновых кислот, следствием чего является нарушение процессов биологического окисления и энергообразования, сопровождающихся развитием внутриклеточного ацидоза. Функция ЦНС при этом нарушается вплоть до развития коматозного состояния.
При благоприятном течении гепатита последней стадией патогенеза является освобождение организма от вирусов и формирование иммунитета.
Морфологические изменения при остром ГВ характеризуются некробиотическими процессами, выраженность которых варьирует в широких пределах от фокального и моноцеллюлярного до массивного и субмассивного некроза печени, что обусловливает тяжесть течения ГВ. При латентных формах острого ГВ некрозы могут не обнаруживаться, а гистологические изменения бывают представлены скудной портальной и внутридольковой инфильтрацией или только дистрофическими процессами. При бессимптомном течении острого ГВ лишь в 10% выявлялись морфологические признаки гепатита с минимальной и слабовыраженной активностью. В остальных случаях отмечались незначительные проявления вирусной инфекции, характеризующиеся наличием отдельных интралобулярных лимфоидных инфильтратов и единичных лимфоцитов в портальных трактах или дистрофические процессы.
Симптомы и течение острого гепатита В. Инкубационный период продолжается от 42 до 180 дней, в среднем 60 – 120 дней.
Начальный (преджелтушный) период. Заболевание в 50-55% случаев начинается с признаков смешанного варианта преджелтушного периода обычно без значительного повышения температуры тела. Симптомы интоксикации и диспепсические проявления выражены умеренно. У 30-35% больных наблюдается артралгический вариант начального периода, особенностью которого является усиление болей в крупных суставах по ночам и в утренние часы. У 10-12% больных могут появляться уртикарные высыпания на коже, сохраняющиеся 1-2 дня и сопровождающиеся эозинофилией в периферической крови. В 5-7% случаев признаки интоксикации полностью отсутствуют, а иктеричность склер и кожи, потемнение цвета мочи могут быть первыми клиническими проявлениями заболевания. Начальный период болезни длится 7-14 дней и более, однако при заражениях, связанных с переливанием крови, он может быть короче.
Желтушный период обычно продолжается 3-4 недели и характеризуется выраженностью и стойкостью клинических проявлений. Отмечаются более выраженная и продолжительная болезненность в правом подреберье. Сохраняется слабость, снижение аппетита доходит до анорексии. Нередки тошнота, и даже рвота. Часто отмечается зуд кожи. Печень всегда увеличена, при пальпации гладкая, с несколько уплотненной консистенцией. Как правило, отмечается увеличение селезенки. Могут быть положительными желчепузырные симптомы.
В периферической крови чаще выявляется лейкопения с лимфо- и моноцитозом, иногда – с плазматической реакцией. СОЭ снижена до 2-4 мм/час, в периоде реконвалесценции может ускоряться до 18-24 мм/ч с последующей нормализацией при отсутствии осложнений.
Гипербилирубинемия – более выраженная и стойкая, чем при ГА, особенно на 2-3 неделях желтушного периода. Наблюдается повышение активности аминотрансфераз в сыворотке крови при снижении альбумина и протромбинового индекса. При серологическом исследовании крови обнаруживаются HBsAg, анти-НВс IgM.
При тяжелом течении важны своевременное выявление и комплексная оценка признаков нарастания печеночной недостаточности и прогрессирования некротических процессов в печени: усиление общей мышечной слабости, головокружение, апатия, анорексия, тошнота, учащение рвоты, появление немотивированного возбуждения, нарушения памяти; прогрессирующее увеличение желтушной окраски кожи; уменьшение размеров печени, усиление болезненности ее края; появление геморрагического синдрома (петехиальная сыпь на коже, носовые кровотечения, кровоизлияния в местах инъекций, «дегтеобразный» стул, рвота с примесью крови); появление отечно-асцитического синдрома (отеки на стопах и нижней трети голеней, асцит); возникновение лихорадки, тахикардии, нейтрофильного лейкоцитоза; увеличение содержания общего билирубина в сыворотке крови при нарастании его непрямой фракции; уменьшение содержания холестерина ниже 2,6 ммоль/л, коэффициента эстерификации ниже 0,2. Особенно информативны выраженные изменения коагулограммы – удлинение времени рекальцификации и времени образования сгустка крови, снижение толерантности плазмы к гепарину, снижение протромбинового индекса ниже 50%, количества тромбоцитов – ниже 100×109/л.
Желтушный период ГВ характеризуется длительностью и стойкостью симптомов болезни. Нормализация активности аминотрансфераз при легкой форме происходит к 30-35-му дню болезни, при среднетяжелой – к 40-50-му, при тяжелой форме – 60-65-му дню.
При ГВ с холестатическим синдромом на фоне интенсивного цитолиза гепатоцитов (высокая активность аминотрансфераз, диспротеинемия, положительная тимоловая проба, низкие цифры протромбинового индекса) в разгаре желтушного периода появляются признаки холестаза (зуд кожи, выраженная гипербилирубинемия, повышение активности щелочной фосфатазы, γ-глутамилтранспептидазы, увеличение в крови желчных кислот, фосфолипидов, β-липопротеидов, холестерина). В редких случаях (как правило, у больных пожилого возраста) при ГВ развивается холестатическая форма, для которой характерен выраженный синдром холестаза при отсутствии или слабой выраженности цитолитического синдрома.
Острая печеночная недостаточность(ОПечН). Усиление дистрофических и воспалительных изменений в печени могут привести к ее острому или подострому некрозу с ОПечН, которая клинически выражается синдромом острой печеночной энцефалопатии (ОПЭ) и выраженным нарушением функции печени. Выделяют три стадии ОПечН: первую и вторую, относящиеся к прекоме, и третью – кому.
Первая стадия ОПечН (ей соответствует ОПЭ-I) характеризуется относительно незначительными нарушениями психики и сознания. Нарастают астения и адинамия. Настроение неустойчивое, апатия сменяется эйфорией. Поведение больных становится неадекватным, часто агрессивным. Они бурно реагируют на болевые раздражения (в том числе и на инъекции), а затем погружаются в дремоту. Больных беспокоят чувство тоски, тревоги, головокружения даже в горизонтальном положении. Изо рта улавливается «печеночный запах». Наблюдается зевота, повторная рвота. Важным признаком прекомы 1 является нарастающая сонливость днем. Эти признаки выявляются на фоне усиления желтушности кожи, сокращения размеров печени, геморрагического синдрома, ухудшения лабораторных показателей.
Чрезвычайно важно у больных тяжелыми формами вирусного гепатита своевременно выявлять снижение протромбинового индекса и еще нерезко выраженные нарушения психической деятельности, которые могут быть первыми предвестниками надвигающейся энцефалопатии. Используются простые тесты: «проба письма» и «проба счета». При первом учитываются изменения почерка больного при попытке написать что-нибудь или невозможность правильно нарисовать какую-либо геометрическую фигуру (круг, звезду, квадрат и т.п.). «Пробы счета» выявляют ошибки при последовательном вычитании, например, от 300 какой-нибудь однозначной цифры (7, 8, 9).
Во второй стадии ОПечН (ей соответствует ОПЭ-II) периоды возбуждения становятся менее продолжительными и все чаще сменяются сопорозным состоянием, из которых больных еще можно вывести окриком или болевым раздражением. Сознание спутано, больной дезориентирован во времени и пространстве, глотательный и роговичный рефлексы сохранены. Появляются мышечные подергивания и характерный «хлопающий» тремор кистей, напоминающий ритмичные взмахи крыльев птицы. Брадикардия сменяется тахикардией. Нередко повышается температура тела. Нарастает кровоточивость, у некоторых больных появляются рвота «кофейной гущей», а также черный «дегтеобразный» стул. Сопорозное состояние постепенно углубляется, переходя в кому. На электроэнцефалограмме (ЭЭГ) регистрируются θ-волны на фоне замедления α-ритма.
Третья стадия ОПечН (ей соответствуют ОПЭ-III и IV) отличается от предыдущей нарушением словесного контакта, утратой адекватной реакции на боль. Выявляются патологические рефлексы (Бабинского, клонус стопы и др.), симптомы орального автоматизма (хоботковый, Маринеску-Радовичи и др.). Дефекация и мочеиспускание становятся непроизвольными.
С углублением комы (ОПЭ-IV) наступает полная потеря реакции на все виды раздражителей, в т. ч. и на болевые. Арефлексия. Появляется симптом «плавающих глазных яблок», исчезает «хлопающий тремор». В терминальной стадии зрачки расширены и не реагируют на свет. Нарушения биохимических показателей крови и, особенно, коагулограммы значительны, но они лишь дополняют яркую клиническую симптоматику, которая сама по себе достаточна для проведения градации ОПЭ.
Условно выделяется ранняя и поздняя печеночная кома. Ранняя развивается в первые 10-14 дней болезни, поздняя – позже 14 дня.
При затяжных формах ГВ клинико-биохимические проявления разгара заболевания и особенно периода обратного его развития длительные – от 3 до 6 мес. Эти формы могут быть предстадией хронического гепатита. Установлено, что гематогенная циркуляция в стабильно высокой концентрации ДНК ВГВ более 3-х нед., HBeAg более 1 мес., HBsAg более 3-х мес., анти-HBc IgM характеризует прогредиентное течение ГВ, а, соответственно, более 5 нед., 2-х и 6 мес. прогнозирует вероятность хронизации.
Диагноз и дифференциальный диагноз. ГВ должен быть рассмотрен в случае, если заболевшему за 45–180 дней до начала болезни переливали кровь и ее компоненты, проводили оперативные вмешательства, эндоскопические исследования, инъекции (в том числе наркотиков) или, что случается гораздо реже, больной имел половой или тесный бытовой контакт с больным ГВ. Для клинически манифестного острого ГВ характерно постепенное начало болезни, длительный преджелтушный период с полиартралгией и возможными уртикарными высыпаниями на коже, отсутствие улучшения самочувствия или его ухудшение с появлением желтухи, длительный желтушный период с медленным исчезновением симптомов заболевания в периоде реконвалесценции.
Критерием раннего подтверждения диагноза служит обнаружение в крови HBsAg, HBeAg, анти-HBc IgM, а также ДНК ВГВ. Благоприятному циклическому течению гепатита соответствует быстрое исчезновение сначала HBeAg с появлением анти-HBe, ДНК HBV, затем и HBsAg c появлением анти-HBs. На смену ранним анти-HBc IgM появляются поздние анти-HBc IgG.
Дифференциальный диагноз проводится с теми же заболеваниями, что и при ГА. Кроме того, может возникнуть необходимость в исключении хронического ГВ (обострения или дебюта на стадии цирроза печени). Острый процесс отличается от хронического достоверно меньшей степенью активности патологического процесса в печени и отсутствием фиброза при исследовании гепатобиоптатов, а также более частым выявлением анти-HBc IgM.
Лечение. Терапевтические мероприятия такие же, как и при ГА. В случаях циклического течения ГВ назначение противовирусных средств не показано. Их целесообразно использовать при затяжном (прогредиентном) течении. В этом случае показано назначение нуклеоз(т)идных аналогов (ламивудин 100 мг/сут., телбивудин 600 мг/сут., энтекавир 0,5-1,0 мг/сут., тенофовир 300 мг/сут.).
Больные с тяжелой формой ГВ в сочетании с факторами риска, осложняющими течение болезни, а также при появлении у них признаков ОПечН подлежат интенсивной терапии. В случаях нарушения сознания особое значение приобретают наблюдение и уход за больными, исключающие осложнения, связанные с энцефалопатией. Купирование психомоторного возбуждения осуществляется оксибутиратом натрия (20% раствор по 10-20 мл внутривенно, медленно) или парентеральным введением диазепама (0,5% раствор 2 мл). Оксибутират натрия должен применяться с осторожностью в случаях гипокалиемии и всегда сочетаться с ее коррекцией (внутривенное капельное введение препаратов калия до 6 г в сутки при отсутствии энтерального его поступления с пищей). Необходимы промывания желудка (через назогастральный зонд) и высокие или сифонные клизмы для уменьшения аутоинтоксикаии. Этой же цели служит пероральное применение плохо всасывающихся антибиотиков (напр., рифаксимин по 400 мг дважды в сутки), энтеросорбентов. Назначают дробное энтеральное питание в сочетании с парентеральным энергообеспечением. Больным с угнетением сознания (сопор, кома) энтеральное питание проводят через назогастральный зонд. При этом можно применять обезжиренные безбелковые энпиты, детское питание.
Суточная доза ГКС не менее 180–240 мг преднизолона или других препаратов в эквивалентных дозах, которые вводят парентерально. Инфузионную терапию осуществляют с применением концентрированных глюкозокалиевых растворов с инсулином, альбумина, аминокислотных смесей, протеина при строгом соблюдении суточного баланса жидкости. Важным элементом инфузионной терапии является свежезамороженная плазма, которую следует применять при сниженном протромбиновом индексе (менее 50%). При желудочно-кишечных кровотечениях и других проявлениях геморрагического синдрома назначают ингибиторы протеаз и фибринолиза (5% раствор ε-аминокапроновой кислоты по 200 мл 2 раза в сутки, контрикал по 100–200 тыс. ЕД или гордокс по 800–1200 ЕД через каждые 3–4 ч).
Для устранения гипоксии и отека-набухания головного мозга проводят постоянную ингаляцию увлажненного кислорода через носовые катетеры со скоростью 5 л/час. Показана оксигенобаротерапия, которая в случаях раннего применения (по 2–3 сеанса в сутки) может предупредить развитие комы. Использование средств коррекции КОС и электролитного баланса осуществляется под соответствующим контролем. Из специальных методов лечения могут быть использованы различные варианты экстракорпоральной детоксикации.
Прогноз и исходы заболевания. У подавляющего большинства взрослых больных (95-99%) ОГВ заканчивается выздоровлением. У 1–5% заболевание приобретает хроническое течение. У 12-15% реконвалесцентов сохраняются астеновегетативный синдром, дискинезия желчевыводящих путей, хронический холецистохолангит, гепатомегалия без нарушения функции печени. Частота летальных исходов ГВ составляет 0,5-2%.
Правила выписки. Реконвалесценты могут быть выписаны из стационара при отсутствии жалоб, уменьшении печени до нормальных размеров, нормализации уровня билирубина в крови, при отрицательных реакциях мочи на уробилин и желчные пигменты. Допускается выписка при небольшом увеличении активности аминотрансфераз (в 2-3 раза) и при увеличении вертикального размера печени на 1-2 см.
Реабилитация. Объем мероприятий по восстановительному лечению соответствует ВГА.
Диспансерное наблюдение. Первый контрольный осмотр после выписки проводится через 15-30 дней в стационаре, где больной находился на излечении. Реконвалесценты, у которых субъективных и объективных отклонений не обнаружено, в дальнейшем обследуются в поликлинике через 3, 6, 12 мес. (клинический осмотр, общие анализы крови и мочи, исследование в крови содержания общего билирубина, активности АЛТ и АСТ). В течение 6 месяцев противопоказаны профилактические прививки, кроме противодифтерийного и противостолбнячного анатоксинов и антирабической вакцины. Запрещается алкоголь. Женщинам рекомендуется избегать беременности в течение года после выписки. При ухудшении состояния здоровья больной направляется в стационар для продолжения лечения.
Профилактика и противоэпидемические мероприятия в очаге осуществляются в соответствии с санитарно-эпидемиологическими правилами «Профилактика вирусного гепатита B» (СП 3.1.1.2341-08).
Мероприятия по профилактике должны быть ориентированы на активное выявление источников инфекции и разрыв естественных и искусственных путей заражения, а также проведение вакцинопрофилактики в группах риска.
В первую очередь вакцинации подлежат контингенты, относящиеся к группам высокого риска заражения гепатитом В: медицинские работники; студенты медицинских учреждений; больные, получающие повторные гемотрансфузии или находящиеся на гемодиализе; семейное окружение больных хроническим ГВ; лица, вводящие внутривенно психоактивные вещества. При достаточном количестве вакцины прививки против ГВ можно проводить всем группам населения, Схема иммунизации взрослых состоит из трех прививок: две первые с интервалом в 1 месяц, третья через 6 месяцев. Ревакцинация проводится через 7-10 лет.
Среди подлежащих вакцинации групп населения будет некоторое число лиц, имеющих HBsAg или антитела к вирусу ГВ в результате перенесенной инфекции. Эти две категории не нуждаются в вакцинации, однако она не наносит им вреда. Вакцинация не отягощает течение хронического ГВ. У лиц, перенесших ГВ и имеющих антитела к данному вирусу, вакцинация может оказать лишь бустерный эффект.
С 2001 г. в РФ в рамках Национального календаря прививок всем новорожденным проводится вакцинопрофилактика. Особое внимание уделяется детям, родившимся у матерей, больных ХГВ (вакцинацию у них проводят четырехкратно: первые три прививки с интервалом в один месяц, при этом первое введение вакцины осуществляется в первые 24 ч жизни, а четвертое введение препарата проводят в возрасте 12 мес.).
Защитный уровень антител в крови 10 МЕ и выше достигается после полного курса иммунизации у 85-95% вакцинированных. После двух прививок антитела образуются лишь у 50-60% вакцинированных.
Иммунопрофилактика по экстренным показаниям проводится у тех людей, у кого произошел контакт с возбудителем, при этом ее эффективность повышается при одновременном введении вакцины и специфического иммуноглобулина, содержащего антитела к вирусу ГВ.
Военно-врачебная экспертиза. Военнослужащим, перенесшим ГВ в тяжелой форме, представляется отпуск по болезни на 30 суток.
Дата: 2018-11-18, просмотров: 410.