Ацетаты. А. 2 мл раствора ацетата (20–60 мг ацетат-иона) нагревают с равным количеством серной кислоты концентрированной и 0,5 мл спирта 96 %; появляется характерный запах этилацетата.
CH3COONa + C2H5OH + H2SO4 →CH3COOС2Н5 + NaHSO4 +СО2
Б. К 2 мл нейтрального раствора ацетата (20–60 мг ацетат-иона) прибавляют 0,2 мл 3 % раствора железа(III) хлорида; появляется красно-бурое окрашивание, исчезающее при прибавлении разведенных минеральных кислот.
3CH3COONa + FeCl3 → Fe(CH3COO)3 + 3NaCl
3Fe(CHOO)3 + 2H2O → [Fe3(OH)2(CH3COO)6]CH3COO + 2CH3COOH [Fe3(OH)2(CH3COO)6]CH3COO + 9HCl → 3FeCl3 + 7CH3COOH + 2H2O
Бензоаты. К 2 мл нейтрального раствора бензоата (10–20 мг бензоат-иона) прибавляют 0,2 мл 3 % раствора железа(III) хлорида; образуется розовато-желтый осадок, растворимый в эфире.
6С6H5COO−+2Fe3++10H2O → (С6H5COO)3Fe ⋅ Fe(OH)3 ⋅ 7H2O+3C6H5COOH
Салицилаты. К 2 мл нейтрального раствора салицилата (2–10 мг салицилат-иона) прибавляют 2 капли 3 % раствора железа(III) хлорида; появляется сине-фиолетовое или красно-фиолетовое окрашивание, которое сохраняется при прибавлении небольшого количества уксусной кислоты разведенной 30 %, но исчезает при прибавлении хлористоводородной кислоты разведенной 8,3 %. При этом образуется белый кристаллический осадок.
Тартраты. А. К 1 мл раствора тартрата (около 20 мг тартрат-иона) прибавляют кристаллик калия хлорида, 0,5 мл спирта 96 %; образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах и растворах гидроксидов щелочных металлов.
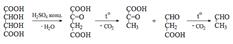
Б. 0,25 мл раствора тартрата (около 5 мг тартрат-иона) нагревают с 1 мл серной кислоты концентрированной и несколькими кристаллами резорцина; через 15–30 споявляется вишнево-красное окрашивание.
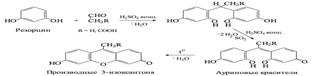
Цитраты. А. К 1 мл нейтрального раствора цитрата (2–10 мг цитрат-иона) прибавляют 1 мл 20 % раствора кальция хлорида; раствор остается прозрачным; при кипячении образуется белый осадок, растворимый в хлористоводородной кислоте разведенной 8,3 %.

Б. К лекарственному средству (1–2 мг цитрат-иона) прибавляют 0,5 мл уксусного ангидрида и нагревают; через 20–40с появляется красное окрашивание.
При дегидратации лимонной кислоты образуется аконитовая кислота (HOOCCH=C(COOH)CH2COOH), при циклизации и декарбоксилированиикоторой получаются соединения фуранового и пиранового рядов. Носителем окраски, по-видимому, является 6-ацетоксипиранон-2, образующийся в результате этих превращений:
22.ОФС в ГФ 13: определение азота в органических соединениях методом Къельдаля. Химизм метода, аппаратурное оформление, варианты реализации метода. Пример применения.
Метод основан на минерализации лекарственного средства под воздействием серной кислоты концентрированной при нагревании в присутствии катализаторов. В качестве катализаторов возможно использование смеси калия сульфата, меди сульфата и/или селена и/или титана диоксида. При этом азот превращается в аммония сульфат. При прибавлении натрия гидроксида выделяется аммиак, который перегоняют с паром в приемник, содержащий кислоту для его поглощения: борную – в методе прямого титрования (1 и 2); серную или хлористоводородную – в методе обратного титрования (3). В методах 1 и 2 поглощенный аммиак титруют раствором хлористоводородной или серной кислоты, в методе 3 избыток кислоты оттитровывают раствором натрия гидроксида. По результатам титрования рассчитывают содержание азота. Различают следующие варианты метода: 1) метод Къельдаля, 2) микрометод Къельдаля, 3) метод Къельдаля (обратное титрование).
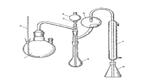
Прибор для определения азота (рисунок) состоит из парообразователя – круглодонной колбы (1) вместимостью 3 л с предохранительной трубкой (2), сменных колб Къельдаля с длинным горлом (3) для конденсации водяных паров и защиты от потери вещества, воронки (4) с зажимом или краном (5) для прибавления натрия гидроксида, брызгоуловителя (6), прямого холодильника (7) и сменных конических колб-приемников (8). Стеклянная посуда должна быть термостойкой. Работу на приборе осуществляют в вытяжном шкафу. Вместо описанного прибора могут быть использованы установки для автоматического определения азота по Къельдалю, определение проводят потенциометрически.
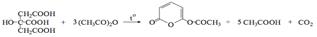
Метод Къельдаля В колбу Къельдаля (3) вместимостью 200 – 300 мл (другие объемы от 50 до 500 мл должны быть указаны в фармакопейной статье) помещают точную навеску (указывают в фармакопейной статье) или точный объем образца лекарственного средства (0,5 – 10,0 мл) с содержанием азота около 14 – 35 мг, три стеклянных шарика для пенящихся веществ и 1 г растертой смеси калия сульфата и меди сульфата, взятых в соотношении 10 : 1. Для трудносжигаемых веществ дополнительно в колбу (3) прибавляют 0,05 г металлического селена и/или 1 мл концентрированного раствора водорода пероксида. Прибавляют 7 мл серной кислоты концентрированной и осторожно вращают колбу для стекания кислоты со стенок и ее перемешивания с содержимым колбы. Постепенно нагревают колбу (3), закрытую стеклянной воронкой, на электронагревательном приборе и далее кипятят содержимое в течение нескольких часов до получения раствора светло-зеленого цвета. На стенках колбы не должно оставаться обугленного вещества. Кипячение продолжают еще 30 мин или более до просветления раствора. Если при кипячении происходит сильное пенообразование, то рекомендуется снять колбу Къельдаля с нагревательного прибора и дать пене осесть, затем снова продолжают нагревание, не допуская попадания пены в горло колбы. После охлаждения колбы Къельдаля в нее осторожно прибавляют 20 мл воды, вращая колбу для перемешивания содержимого, вновь охлаждают и присоединяют колбу к собранному прибору для определения азота (рисунок), заранее промытому путем пропускания через него пара. В парообразователь наливают воду, не менее половины объема, подкисленную 0,5 М или 0,05 М раствором серной кислоты по индикатору метиловому красному (2 – 3 капли) до слабо-розового цвета, для связывания аммиака, который может попасть из воздуха. Для обеспечения равномерного кипения воды в парообразователь помещают стеклянные шарики. В приемник перед началом отгонки наливают 20 мл борной кислоты раствора 4 % и прибавляют 0,25 мл (5 капель) смешанного индикатора. Нижний конец внутренней трубки холодильника должен быть опущен в раствор, находящийся в приемнике. После сборки прибора в холодильник пускают воду и доводят до кипения воду в парообразователе. Затем в колбу (3) из воронки медленно по каплям прибавляют 40 мл натрия гидроксида раствора 30 %, следя за тем, чтобы раствор в колбе (3) энергично перемешивался поступающим паром. Для обеспечения большей герметичности прибора в воронке следует оставлять некоторый избыток натрия гидроксида раствора 30 %. Собирают около 100 мл отгона (или количество, указанное в фармакопейной статье). Во время отгонки колбу Къельдаля нагревают так, чтобы объем жидкости в ней оставался постоянным. По окончании отгонки приемник опускают таким образом, чтобы трубка холодильника находилась над поверхностью жидкости, находящейся в приемнике. Трубку холодильника промывают снаружи водой, продолжая подачу пара в колбу (3) в течение 1 – 2 мин; промывную воду собирают в тот же приемник. После этого прекращают нагревание парообразователя и немедленно отсоединяют колбу Кьельдаля от прибора. По окончании отгонки дистиллят титруют хлористоводородной кислоты раствором 0,1 М или серной кислоты раствором 0,05 М (должно быть указано в фармакопейной статье) до перехода окраски смешанного индикатора из зеленой в красно-фиолетовую. Проводят контрольный опыт таким же образом и с теми же реактивами, но без испытуемого образца; полученный результат используют для внесения поправки при расчете содержания азота.
 Метод Къельдаля (обратное титрование) А. Б. Данный метод применяют преимущественно в препаратах крови. В колбу Къельдаля с помощью калиброванной пипетки вносят 0,5 – 1,0 мл испытуемого раствора, содержащего 8 – 32 мг азота (или 50 – 200 мг белка), затем вносят растертую смесь (около 1 г) калия сульфата и меди сульфата (3:1) и от 2 до 4 мл серной кислоты концентрированной в зависимости от содержания белка. Содержимое колбы кипятят. Для ускорения сжигания несколько раз прибавляют по 5 капель концентрированного раствора водорода пероксида и продолжают кипятить, пока раствор не станет голубым или бесцветным. По окончании сжигания смесь охлаждают. В парообразователь наливают воду, нагревают до кипения и проверяют аппарат на герметичность. Присоединяют колбу Къельдаля к прибору для определения азота или количественно переносят содержимое колбы в реакционный сосуд прибора, используя 30 мл воды. Отгон собирают в приемник, куда предварительно наливают от 10,0 до 25,0 мл серной кислоты раствора 0,05 М в зависимости от содержания белка. Приемник присоединяют так, чтобы нижний конец трубки холодильника был опущен в раствор. Воду в парообразователе нагревают до кипения. В колбу Къельдаля или в реакционный сосуд прибора с минерализатом через воронку прибавляют около 20 мл натрия гидроксида раствора 15 М до появления коричневой окраски минерализата. После этого быстро и герметично закрывают зажим воронки и отгоняют аммиак в течение 5 мин. Затем опускают приемник с серной кислоты раствором 0,05 М так, чтобы нижний конец трубки холодильника не касался поверхности жидкости, и продолжают перегонку еще 5 мин. Отгон титруют натрия гидроксида раствором 0,1 М до перехода сиреневой окраски в зеленую (индикатор – 0,05 мл смешанного индикатора). Параллельно проводят контрольный опыт. 1 мл натрия гидроксида раствора 0,1 М соответствует 1,401 мг азота.
Метод Къельдаля (обратное титрование) А. Б. Данный метод применяют преимущественно в препаратах крови. В колбу Къельдаля с помощью калиброванной пипетки вносят 0,5 – 1,0 мл испытуемого раствора, содержащего 8 – 32 мг азота (или 50 – 200 мг белка), затем вносят растертую смесь (около 1 г) калия сульфата и меди сульфата (3:1) и от 2 до 4 мл серной кислоты концентрированной в зависимости от содержания белка. Содержимое колбы кипятят. Для ускорения сжигания несколько раз прибавляют по 5 капель концентрированного раствора водорода пероксида и продолжают кипятить, пока раствор не станет голубым или бесцветным. По окончании сжигания смесь охлаждают. В парообразователь наливают воду, нагревают до кипения и проверяют аппарат на герметичность. Присоединяют колбу Къельдаля к прибору для определения азота или количественно переносят содержимое колбы в реакционный сосуд прибора, используя 30 мл воды. Отгон собирают в приемник, куда предварительно наливают от 10,0 до 25,0 мл серной кислоты раствора 0,05 М в зависимости от содержания белка. Приемник присоединяют так, чтобы нижний конец трубки холодильника был опущен в раствор. Воду в парообразователе нагревают до кипения. В колбу Къельдаля или в реакционный сосуд прибора с минерализатом через воронку прибавляют около 20 мл натрия гидроксида раствора 15 М до появления коричневой окраски минерализата. После этого быстро и герметично закрывают зажим воронки и отгоняют аммиак в течение 5 мин. Затем опускают приемник с серной кислоты раствором 0,05 М так, чтобы нижний конец трубки холодильника не касался поверхности жидкости, и продолжают перегонку еще 5 мин. Отгон титруют натрия гидроксида раствором 0,1 М до перехода сиреневой окраски в зеленую (индикатор – 0,05 мл смешанного индикатора). Параллельно проводят контрольный опыт. 1 мл натрия гидроксида раствора 0,1 М соответствует 1,401 мг азота.
Рисунок – Прибор для определения азота.
1 – парообразователь; 2 – предохранительная трубка; 3 – колба Къельдаля; 4 – воронка; 5 – кран или зажим; 6 – брызгоуловитель; 7 – холодильник; 8 – колба-приемник
24.Определение воды в лекарственных препаратах по ГФ13: потеря массы при высушивании, метод Фишера, метод дистилляции (Дина и Старка).
Метод К. Фишера (полумикрометод)
Метод основан на химическом взаимодействии воды с компонентами реактива К. Фишера. Реактив К. Фишера представляет собой раствор серы диоксида, йода и пиридина (или другого основания, например, имидазола) в метаноле. Взаимодействие реактива с водой протекает в две стадии стехиометрически по уравнениям:
H2O + SO2 + I2 + 3C5H5N ® 2C5H5N · HI + C5H5NSO3
C5H5NSO3 + CH3OH ® HSO4CH3 × C5H5N
Используемые растворы и реактивы должны быть безводными. Их хранят и применяют в условиях, исключающих возможность воздействия на них атмосферной влаги.
Йодсернистый реактив представляет собой раствор, содержащий пиридин безводный, монометиловый эфир этиленгликоля, йод и серу диоксид Использование реактивов такого состава должно быть предварительно валидировано для подтверждения в каждом конкретном случае стехиометрии реакции и отсутствия несовместимости между испытуемым веществом и реактивом. При определении воды в твердых веществах, нерастворимых в метаноле, тонко измельченную навеску вещества взбалтывают с метанолом, после чего титруют реактивом К. Фишера. Пропанол и другие алканолы имеют большую растворяющую способность для молекул с длинной цепью и могут использоваться как таковые или в смеси с метанолом при анализе высокомолекулярных соединений. 2-Метоксиэтанол (монометиловый эфир этиленгликоля) применяют в тех случаях, когда в присутствии метанола протекают побочные реакции (этерификация, образование кеталей и т. п.).. Хлороформ является хорошим растворителем для жиров и может использоваться в смеси с метанолом, содержание которого обычно составляет 50 %, но не менее 25 %. Формамид улучшает растворимость полярных веществ и может добавляться в метанол для определения воды в протеинах. Не рекомендуется использование в качестве рабочей среды чистые апротонные растворители, которые нарушают стехиометрию реакции К. Фишера. Масса навески, время взбалтывания навески с растворителем, а также наименование растворителя, должны быть указаны в фармакопейной статье. С помощью реактива К. Фишера может быть определена как гигроскопическая, так и кристаллизационная вода. При этом воду можно определять в органических и неорганических соединениях, в различных растворителях и летучих веществах.
Прибор для титрования по методу К. Фишера представляет собой закрытую систему, состоящую из бюретки, снабженной осушительной трубкой, заполненной, осушающим агентом, (например, молекулярными ситами), сосуда для подачи реактива и колбы для титрования, соединенных с бюреткой. Колба для титрования представляет собой сосуд вместимостью 60–100 мл с двумя платиновыми электродами, трубкой для подвода азота, 3 осушительной трубкой, заполненной, осушающим агентом, (например, молекулярными ситами), и пробкой, в которую вставляется кончик бюретки. Испытуемое вещество вносят в сосуд через трубку, расположенную с противоположной стороны по отношению к трубке-осушителю, и закрываемую притертой пробкой. Перемешивание раствора в процессе титрования осуществляют при помощи магнитной мешалки или продуванием высушенного азота через раствор. Конечную точку титрования определяют амперометрически. Электрическая схема состоит из потенциометра с сопротивлением 2000 Ом, подключенного к источнику постоянного тока с напряжением 1,5 В и обеспечивающего необходимую разность потенциалов. Конечную точку титрования допускается определять визуально по изменению окраски титруемой жидкости от желтой до красновато-коричневой при условии обеспечения необходимой точности. При этом необходимо проводить контрольный опыт. Допускается использование автоматических титраторов в соответствии с инструкцией производителя. Если нет других указаний в фармакопейной статье, используют методику
Методика А. Точную навеску испытуемого вещества, содержащую приблизительно от 30 до 50 мг воды, помещают в сосуд для титрования, в который предварительно внесено 5,0 мл метанола безводного. Перемешивают 1 мин и титруют реактивом К. Фишера, прибавляя его при приближении к конечной точке по 0,1–0,05 мл. 4 Параллельно проводят контрольный опыт (титруют 5,0 мл метанола безводного).
Определение воды методом дистилляции
Прибор.
Определение проводят в приборе (рис. 1), состоящем из стеклянной круглодонной колбы (1) вместимостью от 250 до 500 мл, приемника (2), представляющего собой градуированную пробирку или бюретку вместимостью 6–10 мл с ценой деления 0,1 мл, и холодильника (3).
Методика
В колбу (1) отвешивают с точностью до 1 % указанное в фармакопейной статье количество испытуемого вещества (от 10,0 до 20,0 г (точная навеска), содержащее от 2 до 3 мл воды), прибавляют 100 мл толуола или Рис. 1. Прибор для определения воды методом дистилляции 1 – колба, 2 – приемник, 3 – холодильник 8 ксилола и несколько кусочков пористого материала (например, несколько кусочков пемзы). Колбу нагревают на электроплитке или песчаной бане до кипения. Кипячение ведут так, чтобы конденсирующийся растворитель не скапливался в холодильнике, а спокойно стекал навстречу поднимающимся парам жидкости со скоростью от 2 до 4 капель в секунду. Кипячение прекращают, когда объем воды в приемнике перестанет увеличиваться и верхний слой растворителя в приемнике станет прозрачным. Внутреннюю трубку холодильника промывают толуолом и продолжают нагревание еще 5 мин, после чего приемник охлаждают до комнатной температуры и стряхивают со стенок приемника все капли воды. Вся отогнанная вода собирается в нижней части приемника. После полного разделения слоев отмечают объем отогнанной воды.
25. Определение плотности жидкостей и твердых веществ пикнометрическим методом по ГФ13. Оценочное определение плотности жидкостей с помощью ареометра .
Дата: 2019-07-30, просмотров: 972.