Алюминий. Около 15 мг лекарственного средства растворяют в 2 мл воды. К полученному раствору или к 2 мл раствора, приготовленного как указано в частной фармакопейной статье, прибавляют 0,5 мл хлористоводородной кислоты разведенной 8,3 % и 0,5 мл реактива тиоацетамида; осадок не образуется. Затем по каплям прибавляют раствор натрия гидроксида разведенный 8,5 %; образуется гелеобразный белый осадок, растворимый при последующем прибавлении раствора натрия гидроксида разведенного 8,5 %. Постепенно прибавляют 10 % раствор аммония хлорида; снова образуется гелеобразный белый осадок. Тиоацетамид в кислой среде гидролизуется с образованием сульфид ионов (вместо токсичного сероводорода).
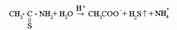
Соль сульфида алюминия имеет высокую степень растворимости и по- этому осадок не образуется, в отличие от ионов (Be2+, Pb2+, Sn2+, Sn4+ и Sb3+), взаимодействующих с S2- с образованием осадка. Перечисленные ионы как и Al3+ обладают амфотерными свойствами и с гидроксидом натрия образуют гелеобразные осадки. Для исключения ложноположительных реакций и проводится реакция с тиоацетамидом. После прибавления гидроксида натрия образуется осадок: Al3++3OH- →Al(OH)3 ¯ ;
при последующем добавлении гидроксида натрия осадок растворяется:
Al(OH)3 ¯ +OH-(избыток) →[Al(OH)4]-
После добавления к полученному раствору аммония хлорида, вновь выпадает гелеобразный осадок:
[Al(OH)4]-+NH4+ →Al(OH)3 ¯ +NH3+H2O.
Аммоний.1 мл раствора соли аммония (2–6 мг аммоний-иона) нагревают с 0,5 мл 10 % раствора натрия гидроксида; выделяется аммиак, обнаруживаемый по запаху и по посинению влажной красной лакмусовой бумаги. NH4+ + OH- → NH3↑ + H2O
Висмут. А. Указанное в частной фармакопейной статье количество лекарственного средства (около 50 мг висмут-иона) взбалтывают с 3 мл хлористоводородной кислоты разведенной 8,3 % и фильтруют. К фильтрату прибавляют 1 мл 2 % раствора натрия сульфида или сероводорода; образуется коричневато-черный осадок, растворимый при прибавлении равного объема азотной кислоты концентрированной.
1)2BiONO3 + 3Na2S + 4HCI → 2Bi2S3↓ + 2NaNO3 + 4 NaCI + 2H2O 2)2Bi3+ + 3S2- → Bi2S3↓
Железо (II). К 2 мл раствора соли железа(II) (около 20 мг железо(II)-иона) прибавляют 0,5 мл хлористоводородной кислоты разведенной 8,3 % и 1 мл 5 % раствора калия феррицианида; образуется синий осадок. FеСl2 + K3[Fe(CN)6] ® 2КСl + KFeFe(CN)6¯
Железо(III).А. К 2 мл раствора соли железа(III) (около 1 мг железо(III)-иона) прибавляют 0,5 мл хлористоводородной кислоты разведенной 8,3 % и 1–2 капли 5 % раствора калия ферроцианида; образуется синий осадок. Fe3+ + 4К+ + [Fe(CN)6]4- → KFeFe(CN)6¯ + 3К+
Б. К 2 мл раствора соли железа(III) (около 1 мг железо(III)-иона) прибавляют 0,5 мл хлористоводородной кислоты разведенной 8,3 % и 1–2 капли 5 % раствора аммония тиоцианата; появляется красное окрашивание. Fe3+ + 6CNS- → [Fe(CNS)6]3-
В. К раствору соли железа(III) (около 1 мг железо(III)-иона) прибавляют раствор аммония сульфида; образуется черный осадок, растворимый в разведенных минеральных кислотах.
1)2Fe3+ + 3S2- → 2FeS↓ + S 2) Fe2+ + S2- → FeS↓
Калий. А. К 2 мл раствора соли калия (10–20 мг калий-иона) прибавляют 1 мл 20 % раствора винной кислоты, 1 мл 10 % раствора натрия ацетата, 0,5 мл спирта 96 % и встряхивают; постепенно образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах и растворах гидроксидов щелочных металлов. KCI + H2C4H4O6 → KHC4H4O6↓ + HCI
Б. К 2 мл раствора соли калия (5–10 мг калий-иона), предварительно прокаленной для удаления солей аммония, прибавляют 0,5 мл уксусной кислоты разведенной 30 % и 0,5 мл 10 % раствора натрия кобальтинитрита; образуется желтый кристаллический осадок.
Na3[Co(NO2)6] + 2KCI → K2Na[Co(NO2)6↓ + 2NaCI
В. Соль калия, внесенная в бесцветное пламя, окрашивает его в фиолетовый цвет или при рассматривании через синее стекло – в пурпурно-красный.
Кальций.А. К 1 мл раствора соли кальция (2–20 мг кальций-иона) прибавляют 1 мл 4 % раствора аммония оксалата; образуется белый осадок, нерастворимый в уксусной кислоте разведенной 30 % и 10 % растворе аммиака, растворимый в разведенных минеральных кислотах. C2O42- + Ca2+ ® СаС2О4¯
Б. Соль кальция, смоченная хлористоводородной кислотой 25 % и внесенная в бесцветное пламя, окрашивает его в кирпично-красный цвет.
Магний. К 1 мл раствора соли магния (2–5 мг магний-иона) прибавляют 1 мл 10 % раствора аммония хлорида, 1 мл 10 % раствора аммиака и 0,5 мл 5 % раствора натрия фосфата; образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах и уксусной кислоте. МgCl2 + Na2HPO4 + NH3 NH4Cl NH4МgPO4¯+ 2 NaCl
Натрий. А. К 2 мл раствора натриевой соли (7–10 мг натрий-иона) прибавляют 2 мл 15 % раствора калия карбоната и нагревают до кипения; осадок не образуется. К раствору прибавляют 4 мл раствора калия пироантимоната и нагревают до кипения. Охлаждают в ледяной воде и при необходимости потирают внутренние стенки пробирки стеклянной палочкой; образуется плотный осадок белого цвета.
Na + + K [ Sb ( OH )6] ® Na [ Sb ( OH )6] ↓ + K + Б. Соль натрия, смоченная хлористоводородной кислотой 25 % и внесенная в бесцветное пламя, окрашивает его в желтый цвет.
Цинк. А. К 2 мл нейтрального раствора соли цинка (5–20 мг цинк-иона) прибавляют 0,5 мл 2 % раствора натрия сульфида или сероводорода; образуется белый осадок, нерастворимый в уксусной кислоте разведенной 30 % и легко растворимый в хлористоводородной кислоте разведенной 8,3 %. Zn2+ + S2-® ZnS¯
Б. К 2 мл раствора соли цинка (5–20 мг цинк-иона) прибавляют 0,5 мл 5 % раствора калия ферроцианида; образуется белый осадок, нерастворимый в хлористоводородной кислоте разведенной 8,3 %. 3Zn2+ + 2K+ + 2[Fe(CN)6]4- ® K2Zn3[Fe(CN)6]2¯
Серебро.(Аg+)
1.Реакция восстановления Ag+ из аммиачного раствора серебра нитрата до металлического серебра при нагревании с раствором формальдегида (реакция «серебряного зеркала»):
AgNO3 + 2NH4OH →[Ag(NH3)2]NO3 + 2Н2O
t0
2[Ag(NH3)2]NO3 + HCOH + H2O → 2Ag↓ + HCOONH4 + 2NH4NO3 + NH3↑
Металлическое серебро образует на стенках пробирки тонкую блестящую пленку - «серебряное зеркало».
2. Реакция осаждения кислотой хлороводородной или натрия хлоридом. Образуется белый творожистый осадок AgCl:
AgNO3 + HCl → AgCl↓+HNO3
Белый творожистый
Осадок серебра хлорида нерастворим в кислоте азотной разведенной, растворяется в растворе аммиака с образованием комплексного соединения:
AgCl + 2NH4OH→[Ag(NH3)]Cl + 2Н2O
3. Реакция осаждения раствором натрия гидроксида или раствором аммиака:
2AgN03 + 2NH4OH → Ag2O↓ + 2NH4NO3
черный осадок
Осадок серебра оксида нерастворим в избытке натрия гидроксида, растворяется в избытке раствора аммиака с образованием комплексного соединения:
Ag2O + 4NH4OH → 2[Ag(NH3)2]OH +ЗН2O
Свинец.1. Калия йодид образует с солями свинца (ΙΙ) желтый осадок дийодида свинца, растворимый в избытке реактива с образованием бесцветного раствора:
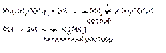
2. Растворы хромата калия и дихромата калия образуют с растворами солей свинца желтый осадок хромата свинца:
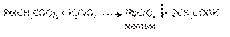
23. ОФС в ГФ 13: определение азотосодержащих веществ (первичных, вторичных, третичных аминов) методом нитриметрии. Сущность метода, химизм и особенности проведения титриметрической реакции, индикаторы, пример применения.
Нитритометрия – метод титриметрического анализа, при котором в качестве титрованного раствора используется раствор натрия нитрита. Применяется для количественного определения соединений, содержащих первичную или вторичную ароматическую аминогруппу, для определения гидразидов, а также ароматических нитросоединений после предварительного восстановления нитрогруппы до аминогруппы. Методика. Если не указано иначе, точную навеску образца лекарственного средства, указанную в фармакопейной статье, растворяют в смеси 10 мл воды и 10 мл хлористоводородной кислоты разведенной 8,3 %. Прибавляют воду до общего объема 80 мл, 1 г калия бромида и при постоянном перемешивании титруют натрия нитрита раствором 0,1 М. В начале титрования прибавляют раствор натрия нитрита со скоростью 2 мл/мин, а в конце (за 0,5 мл до эквивалентного количества) – 0,05 мл/мин. Титрование проводят при температуре раствора 15 — 20 ºС, однако в некоторых случаях требуется охлаждение до 0 — 5 ºС. При потенциометрическом титровании в качестве индикаторного применяют платиновый электрод, в качестве электродов сравнения используют хлорсеребряный или насыщенный каломельный электрод. При амперометрическом титровании на электроды накладывают разность потенциалов 0,3 — 0,4 В, если не указано иначе в фармакопейной статье. Точку эквивалентности определяют электрометрическими методами (потенциометрическое титрование, титрование «до полного прекращения тока») или с помощью внутренних индикаторов и внешнего индикатора (йодкрахмальная бумага). В качестве внутренних индикаторов используют тропеолин ОО (4 капли раствора), тропеолин ОО в смеси с метиленовым синим (4 капли раствора тропеолина ОО и две капли раствора метиленового синего), нейтральный красный (две капли в начале и две капли в конце титрования). Титрование с тропеолином ОО проводят до перехода окраски от красной к желтой, со смесью тропеолина ОО с метиленовым синим – от красно-фиолетовой к голубой, с нейтральным красным – от красно-фиолетовой к синей. Выдержку в конце титрования с нейтральным красным увеличивают до 2 мин. Титрование с йодкрахмальной бумагой ведут до тех пор, пока капля титруемого раствора, взятая через 1 мин после прибавления натрия нитрита раствора 0,1 М, не будет немедленно вызывать синее окрашивание на бумаге. В некоторых случаях выдержка может быть увеличена, о чем должно быть указано в фармакопейной статье. Параллельно проводят контрольный опыт.
21.ИК-спектрометрические методы идентификации лекарственных средств. Связь химического строения и спектральных характеристиками веществ. Аппаратурное оформление метода. Подготовка образцов для исследования.
ИК –спектр химического соединения является одной из его наиболее важных характеристик.
ИК область спектра занимает диапазон длин волн от границы видимой до микроволновой области (0,75 до 200 мк). Однако, обычно под ИК областью подразумевают более узкий интервал от 2,5 до 16 мк. Для характеристики ИК излучения более часто используют волновые числа (величины обратные длинам волн – обратные сантиметры, см -1). Так, интервал 2,5-16 мк соответствует 4000-625 см -1 .
Инфракрасные спектры (колебательные спектры) (ИК-спектры) возникают вследствие поглощения энергии электромагнитного излучения при колебаниях ядер атомов в молекулах или ионах, которые сопровождаются изменением дипольных моментов, и представляют собой зависимость пропускания или поглощения от длины волны (λ) или частоты колебаний (ν). Применение ИК-спектроскопии в анализе лекарственных средств ИК-спектроскопия используется: - при установлении структуры новых БАВ получаемых путем химического синтеза или выделяемых из природных объектов (животное или растительное сырье, продукты жизнедеятельности микроорганизмов); изучении строения метаболитов; - при испытании на подлинность лекарственных веществ; определении доброкачественности лекарственных соединений; - количественном анализе; - контроле технологического процесса в промышленном производстве фармпрепаратов (полнота протекания). Идентификация лекарственного вещества может быть проведена путем сопоставления ИК-спектра исследуемого вещества с аналогичным спектром его стандартного образца или с рисунком стандартного спектра, приведенного в фармакопейной статье. ИК-спектр испытуемого образца должен иметь полное совпадение полос поглощения с полосами поглощения стандартного спектра по положению и относительной интенсивности. Спектр содержит некоторый набор полос разной интенсивности, который определяется химическим составом образца. Каждое вещество обладает своим неповторимым химическим составом и строением образующих его молекул и, соответственно, своим уникальным спектром поглощения, который служит так называемым «молекулярным отпечатком» для данного вещества. Молекула, состоящая из N атомов, имеет 3N степеней свободы – это число независимых параметров для описания положения всех атомов молекулы в декартовых координатах (x, y, z). В нелинейной молекуле из всех 3N независимых параметров три степени свободы приходятся на поступательное движение молекулы как целого и три – на вращательное движение молекулы вокруг ее главных осей. Оставшиеся 3N-6 степеней свободы представляют собой так называемые нормальные колебания – независимые повторяющиеся сами по себе движения молекулы. Для линейной молекулы характерно 3N-5 нормальных колебаний, так как линейные молекулы имеют три поступательных и две вращательных степени свободы молекулы как целого. Полное колебательное движение молекулы можно представить в виде комбинации нормальных колебаний.
Подготовка проб Существуют различные способы подготовки исследуемого образца в ИК-спектрофотометрии: 1. Растворы веществ В связи с тем, что в ИК-области поглощает любое вещество, в качестве растворителей используют соединения простейшей структуры, спектры которых состоят из минимального числа полос, и наиболее часто – CCl4 и CS2. Для растворов применяют цилиндрические кюветы толщиной 0,1-1 мм с окнами из солевых пластин. Необходимый для заполнения кюветы объем раствора 0,1- 1,0 мл при концентрации 0,05-10%.
2. Тонкие пленки (< 0,01 мм) жидкого вещества, помещенные 55 между солевыми пластинами, удерживаемыми капиллярными силами. 3. Пасты, приготовляемые тщательным растиранием твердого образца с вазелиновым маслом и помещаемые в виде тонкого слоя между солевыми пластинами. Само вазелиновое масло поглощает в области 2900 и 1400 см-1 Методика получения пасты с вазелиновым маслом более проста и экспрессна. 4. Твердые вещества в виде тонкого порошка 0,5-1 г тщательно перемешанные с порошком бромида калия ≈100 мг и затем спрессованные в специальном устройстве под давлением в тонкую пластину. Приборы для регистрации ИК-спектров. Могут быть использованы инфракрасные спектрофотометры, снабженные оптической системой (призмы или дифракционные решетки), выделяющей монохроматическое излучение в измеряемой области, или спектрофотометры с Фурье-преобразованием. В последних используется полихроматическое излучение и рассчитывается спектр в заданной области частот путем Фурье-преобразования исходных данных. В таких приборах вместо диспергирующего прибора используется интерферометр, а обработка спектральных данных производится с помощью компьютера.
ОФС ГФ13: реакции подлинности (идентификации) на анионы: бромиды, йодиды, карбонаты, гидрокарбонаты, сульфаты, сульфиты, сульфиды, фосфаты, хлориды, силикаты, нитраты, нитриты. ( Химизм процессов обязателен).
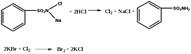
Бромиды. А. К 1 мл раствора бромида (2–30 мг бромид-иона) прибавляют 1 мл хлористоводородной кислоты разведенной 8,3 %, 0,5 мл 5 % раствора хлорамина, 1 мл хлороформа и взбалтывают; хлороформный слой окрашивается в желто-бурый цвет.
Б. К 2 мл раствора бромида (2–10 мг бромид-иона) прибавляют 0,5 мл азотной кислоты разведенной 16 % и 0,5 мл 2 % раствора серебра нитрата; образуется желтоватый творожистый осадок, нерастворимый в азотной кислоте разведенной 16 % и трудно растворимый в 10 % растворе аммиака.
NaBr + AgNO3 → AgBr↓ + NaNO3
AgBr + 2NH3. 2H2O → [Ag(NH3)2]Br
Йодиды . А. К 2 мл раствора йодида (3–20 мг йодид-иона) прибавляют 0,2 мл серной кислоты разведенной 16 %, 0,2 мл 10 % раствора натрия нитрита или 3 % раствора железа(III) хлорида и 2 мл хлороформа; при взбалтывании хлороформный слой окрашивается в фиолетовый цвет.
2KI + 2NaNO2 + 2H2SO4 → I2 + 2NO↑ + Na2SO4 + K2SO4 + 2H2O
Б. К 2 мл раствора йодида (2–10 мг йодид-иона) прибавляют 0,5 мл азотной кислоты разведенной 16 % и 0,5 мл 2 % раствора серебра нитрата; образуется желтый творожистый осадок, нерастворимый в азотной кислоте разведенной 16 % и 10 % растворе аммиака.
I- + Ag+ → AgI↓
В. При нагревании 0,1 г лекарственного средства с 1 мл серной кислоты концентрированной выделяются пары фиолетового цвета.
2KI + 2H2SO4 → I2↑ + SO2↑+ K2SO4 + 2H2O
Карбонаты (Гидрокарбонаты). А. К 0,2 г карбоната (гидрокарбоната) или к 2 мл раствора карбоната (гидрокарбоната) (1:10) прибавляют 0,5 мл хлористоводородной кислоты разведенной 8,3 %; выделяется газ, при пропускании которого через раствор кальция гидроксида образуется белый осадок.
NaHCO3 + НСl ® NaCl + CO2 + Н2О
СО2 + Са(ОН)2 ® СаСО3 ¯ + Н2О
Б. К 2 мл раствора карбоната (1:10) прибавляют 5 капель насыщенного раствора магния сульфата; образуется белый осадок (гидрокарбонат образует осадок только при кипячении смеси).
4Na2CO3 + 4MgSO4 + 4 Н 2 О ® 3MgCO3.Mg(OH)2.3H2O¯ + CO2+ 4Na2SO4
В. Раствор карбоната (1:10) при прибавлении 1 капли 1 % раствора фенолфталеина окрашивается в красный цвет (отличие от гидрокарбоната).
СО32- + НOН ® ОН- + НСО3-
НСО3- + НОН ® ОН- + Н2О + CO2
Сульфаты.К 2 мл раствора сульфата (5–50 мг сульфат-иона) прибавляют 0,5 мл 5 % раствора бария хлорида; образуется белый осадок, нерастворимый в разведенных минеральных кислотах.
SO42- + Ba2+ → BaSO4↓
Сульфиты. А. К 2 мл раствора сульфита (10–30 мг сульфит-иона) прибавляют 2 мл хлористоводородной кислоты разведенной 8,3 % и встряхивают; постепенно выделяется сернистый газ, обнаруживаемый по характерному резкому запаху.
SO32- + 2H+ → H2SO3 → SO2↑ + H2O
Б. К 2 мл раствора сульфита (2–20 мг сульфит-иона) прибавляют 0,5 мл 5 % раствора бария хлорида; образуется белый осадок, растворимый в хлористоводородной кислоте разведенной 8,3 % (отличие от сульфатов).
SO32- + Ba2+ → BaSO3↓
BaSO3 + 2HCI → BaCI2 + H2O + SO2↑
Фосфаты. А. К 1 мл раствора фосфата (10–30 мг фосфат-иона), нейтрализованного до рН около 7,0, прибавляют несколько капель 2 % раствора серебра нитрата; образуется желтый осадок, растворимый в азотной кислоте разведенной 16 % и 10 % растворе аммиака.
PO43- + 3Ag+ → Ag3PO4↓
Ag3PO4 ¯ + 6NH4OH → 3[Ag(NH3 )2]3+ + PO43-+6H2O
Б. К 1 мл раствора фосфата (10–30 мг фосфат-иона) прибавляют 1 мл 10 % раствора аммония хлорида, 1 мл 10 % раствора аммиака и 0,5 мл 10 % раствора магния сульфата; образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах.
Na3PO4 + 3NH4CI + NH3. Н 2 О + М gSO4 ® NH4 М gPO4¯+ 3NaCl + (NH4)2SO4
MgNH4PO4¯ +3HCl®MgCl2+NH4Cl+H3PO4
В. К 1 мл раствора фосфата (10–30 мг фосфат-иона) в азотной кислоте разведенной 16 % прибавляют 2 мл 10 % раствора аммония молибдата и нагревают; образуется желтый кристаллический осадок, растворимый в 10 % растворе аммиака.
H3PO4 + 12(NH4)MoO4 + 21HNO3 ® (NH4)3PO4 ·12MoO3¯ + 21NH4NO3 + 12H2O
(NH4)3PO4· 12 MoO3 ¯ + 23NH4OH ® 12(NH4)2 MoO4 + (NH4)2HPO4+11H2O
Хлориды.К 2 мл раствора хлорида (2–10 мг хлорид-иона) прибавляют 0,5 мл азотной кислоты разведенной 16 % и 0,5 мл 2 % раствора серебра нитрата; образуется белый творожистый осадок, нерастворимый в азотной кислоте разведенной 16 % и растворимый в 10 % растворе аммиака. Для солей органических оснований испытание растворимости образовавшегося осадка проводят после отфильтровывания и промывания осадка водой.
Cl- + Ag+ → AgCl↓
AgCl¯ + 2NH4OH ® [Ag(NH3)2]++ Cl- + 2H2O
Нитраты. А. К лекарственному средству (около 1 мг нитрат-иона) прибавляют 2 капли раствора дифениламина; появляется синее окрашивание.
Б. К лекарственному средству (2–5 мг нитрат-иона) прибавляют по 2–3 капли воды и серной кислоты концентрированной, кусочек металлической меди и нагревают; выделяются пары бурого цвета.
2NaNO3 + H2SO4 → Na2SO4+ 2HNO3
Cu + HNO3 → Cu(NO3)2 + NO2↑ + H2O
Нитриты.А. К лекарственному средству (около 1 мг нитрит-иона) прибавляют 2 капли раствора дифениламина; появляется синее окрашивание.
Дата: 2019-07-30, просмотров: 1270.