Принципы классификации ЛС, используемые в фармацевтической химии.
Известно несколько типов калссификации ЛС.
1)Химическая классификация разделяет ЛС на 2 большие группы:ЛС неорганической природы:в соответствии с положениями в периодической системе элементов,к ним относятся препараты s-,p-,d-элементов. ЛС органической природы :к ним относятся органическрие соединения, имеющие ту или иную структуру и содержащие те или иные функциональные группы. Напр :алифатические соединения среди прочих включают Лсальдегидов, эфиров, аминокислот;к ароматическим относятся фенолы,ароматическиекислоты.ЛС органической природы могут быть разделны на подгруппы в зависимости от способа получения :природные, синтетические, полусинтетические.
Фармаколлгическая классфикация отражает действие ЛП на ту или иную систему организма(сердечно-сосудистая , нервная).Внутри групп фармакологической классификации препаратов может рассматриваться фармакотерапевтическая классификация- ЛП группируются в зависимости от применения для лечения определенного заболевания (противомикробные, противовирусные, снотворные и т.д).
6.Источники и спососбы получения ЛС .
Для получения неорганических ЛС используется минеральное сырье(природные источники). Например, для приготовления ЛС натрия хлорида используются природные растворы-воды озер и морей. Синтетические органические ЛС получают из продуктов переработки каменного угля, нефти, дерева и т.д.Выделенные при этом индивидуальные органические соединения являются реагентами в органическом синтезе ЛВ.Так осуществлен полный химический синтез антибиотика левомицетина- и алкалоида кофеина. Источником получении органических ЛВ является лекарственное растительное сырье .Из него получают алкалоиды, терпены, гликозиды, витамины, ЭМ. Растительное сырье используют также для получения галеновых препаратов. Гормональные препараты готовят из сырья животного происхождения. Для получения антибиотиков используют различные микроорганизмы. Известны полусинтетические антибиотики, которые являются синтетическими производными антибиотков, выделнных и з микроорганизмов.(пенициллины).Полусинтетический способ используется и для получения алкалоидов, витаминов, гормонов. В ХХ в. Было создано большое число новых синтетических ЛС-противоопухолевых,гипотензивных,сердечно-сосудистых,антибиотиков,сульфаниламидных препаратов.Номенклатура ЛС растет с каждым годом.
Методы осадительного титрования в фармации.Аргентометрия:метод Мора ,Фольгарда,метод Фаянса.
Метод осадительного титрования основан на применении реакций осаждения, в результате которых образуются малорастворимые соединения. Аргентометрия – метод объемного анализа, основанный на применении стандартного раствора (титранта) ионов серебра.
Метод Мора-определение галогенид-ионов прямым титрованием раствором нитрата серебра в присутствии индикатора -раствора хромата калия .применяется для определения хлоридов и бромидов.Этот метод не позволяет определить I и NCS,т.к при титровании происходит соосаждение хромата калия с осадками AgI,AgNCS.
Метод Фаянса-определение галогенид-ионов прямым титрованием раствором нитрата серебра в присутствии адсорбционных индикаторов-флуоресцеина ,эозина. Метод позволяет определить хлориды, бромиды, йодиды, цианиды, тиоцианаты.
Метод Фольгарда–обратное титрование избытка катионов серебра раствором тиоционата аммония NH4SCNили калия KSCNв присутсвии индикатора –соли железа, обычно, железоаммонийных квасцов.NH4Fe(SO4)2*12H2O
Оценка подлинности ЛВ.
Идентификация на основании электронного спектра. Спектр ЛВ сравнивается со спектром стандартного образца этого вещества .Например, УФ-спектр фуросемида 0,0005% раствора фуросемида в 0,01М растворе NaOH имеет два максимума поглощения-при 228 и 271 нм и один минимум –при 249нм.,тогда ка 0,005%раствор фуросемида в том же растворителе содержит один максимум при 333нм и минимум при 295нм.
Идентификации на основании коэффициента поглощения. Например ,коэффициент поглощения парацетамола в 0,1М растворе НС1 и при 240 нм равен 880л/моль см.
2)оценка чистоты ЛВ. Готовят раствор ЛВ определенной концентрации и измеряют величину оптической плотности при определенной длине волны. Например, оптическая плотность 16% раствора анальгина при 400нм не должна превышать 0,1. Обнаружение специфических примесей по появлению дополнительных полос поглощения в электронном спектре. Например, максимум поглощения адреналина находится при 278нм,а его специфической примеси –адреналона при 310нм.
3)Определение количественного содержания ЛВ. Спектрофотометрической константой является удельный показатель поглощения,который расчитывают по формуле:Е1%1см=А/С*L
11.Рефрактометрия в фармацевтическом анализе .
Рефрактометрия – метод анализа лекарственных средств, основанный на определении показателя преломления испытуемого вещества. Показателем преломления (индексом рефракции) называют отношение скорости света в вакууме к скорости света в испытуемом веществе (абсолютный показатель преломления). На практике определяют так называемый относительный показатель преломления (n), который является отношением скорости света в воздухе к скорости света в испытуемом веществе.
Показатель преломления зависит от температуры и длины волны света, при которой проводят определение. В растворах показатель преломления зависит также от концентрации вещества и природы растворителя. Рефрактометрию применяют для установления подлинности и чистоты вещества. Метод применяют также для определения концентрации вещества в растворе, которую находят по графику зависимости показателя преломления раствора от концентрации раствора. На графике выбирают интервал концентраций, в котором наблюдается линейная зависимость между показателем преломления и концентрацией. В этом интервале концентрацию испытуемого раствора (Х, %) вычисляют по формуле: X = (n – no)/F,
Где : n – показатель преломления испытуемого раствора; nо – показатель преломления растворителя при той же температуре; F – фактор, равный величине прироста показателя преломления при увеличении концентрации испытуемого раствора на 1 % (устанавливается экспериментально).
Для определения показателя преломления применяют рефрактометры. Определение проводят при температуре (20 ± 0,5) ºС и длине волны линии D спектра натрия (589,3 нм). Показатель преломления, определенный при таких условиях, обозначается индексом n20D. Современные приборы откалиброваны таким образом, что отсчеты, полученные по их шкалам, соответствуют показателям преломления для D линии спектра натрия. При проведении измерений следует соблюдать указания в отношении соответствующего источника света, приведенные в инструкции к прибору. Если используют белый свет, то рефрактометр снабжен компенсирующей системой. Цена деления термометра не должна превышать 0,5 ºС. Обычно измерения показателя преломления проводят на рефрактометрах Аббе, в основу которых положено явление полного внутреннего отражения при прохождении светом границы раздела двух сред с разными показателями преломления. Диапазон измеряемых показателей преломления при измерении в проходящем свете 1,3 – 1,7. Точность измерения показателя преломления должна быть не ниже ± (2 · 10-4). Могут быть использованы рефрактометры других типов с такой же или большей точностью. Рефрактометры юстируют по эталонным жидкостям, значения показателей преломления которых обозначены на этикетке, или по дистиллированной воде, для которой n20D = 1,3330 и n25D = 1,3325 (Δn/Δ = – 0,000085).
ОФС ГФ13: реакции подлинности (идентификации) на анионы: бромиды, йодиды, карбонаты, гидрокарбонаты, сульфаты, сульфиты, сульфиды, фосфаты, хлориды, силикаты, нитраты, нитриты. ( Химизм процессов обязателен).
Бромиды. А. К 1 мл раствора бромида (2–30 мг бромид-иона) прибавляют 1 мл хлористоводородной кислоты разведенной 8,3 %, 0,5 мл 5 % раствора хлорамина, 1 мл хлороформа и взбалтывают; хлороформный слой окрашивается в желто-бурый цвет.
Б. К 2 мл раствора бромида (2–10 мг бромид-иона) прибавляют 0,5 мл азотной кислоты разведенной 16 % и 0,5 мл 2 % раствора серебра нитрата; образуется желтоватый творожистый осадок, нерастворимый в азотной кислоте разведенной 16 % и трудно растворимый в 10 % растворе аммиака.
NaBr + AgNO3 → AgBr↓ + NaNO3
AgBr + 2NH3. 2H2O → [Ag(NH3)2]Br
Йодиды . А. К 2 мл раствора йодида (3–20 мг йодид-иона) прибавляют 0,2 мл серной кислоты разведенной 16 %, 0,2 мл 10 % раствора натрия нитрита или 3 % раствора железа(III) хлорида и 2 мл хлороформа; при взбалтывании хлороформный слой окрашивается в фиолетовый цвет.
2KI + 2NaNO2 + 2H2SO4 → I2 + 2NO↑ + Na2SO4 + K2SO4 + 2H2O
Б. К 2 мл раствора йодида (2–10 мг йодид-иона) прибавляют 0,5 мл азотной кислоты разведенной 16 % и 0,5 мл 2 % раствора серебра нитрата; образуется желтый творожистый осадок, нерастворимый в азотной кислоте разведенной 16 % и 10 % растворе аммиака.
I- + Ag+ → AgI↓
В. При нагревании 0,1 г лекарственного средства с 1 мл серной кислоты концентрированной выделяются пары фиолетового цвета.
2KI + 2H2SO4 → I2↑ + SO2↑+ K2SO4 + 2H2O
Карбонаты (Гидрокарбонаты). А. К 0,2 г карбоната (гидрокарбоната) или к 2 мл раствора карбоната (гидрокарбоната) (1:10) прибавляют 0,5 мл хлористоводородной кислоты разведенной 8,3 %; выделяется газ, при пропускании которого через раствор кальция гидроксида образуется белый осадок.
NaHCO3 + НСl ® NaCl + CO2 + Н2О
СО2 + Са(ОН)2 ® СаСО3 ¯ + Н2О
Б. К 2 мл раствора карбоната (1:10) прибавляют 5 капель насыщенного раствора магния сульфата; образуется белый осадок (гидрокарбонат образует осадок только при кипячении смеси).
4Na2CO3 + 4MgSO4 + 4 Н 2 О ® 3MgCO3.Mg(OH)2.3H2O¯ + CO2+ 4Na2SO4
В. Раствор карбоната (1:10) при прибавлении 1 капли 1 % раствора фенолфталеина окрашивается в красный цвет (отличие от гидрокарбоната).
СО32- + НOН ® ОН- + НСО3-
НСО3- + НОН ® ОН- + Н2О + CO2
Сульфаты.К 2 мл раствора сульфата (5–50 мг сульфат-иона) прибавляют 0,5 мл 5 % раствора бария хлорида; образуется белый осадок, нерастворимый в разведенных минеральных кислотах.
SO42- + Ba2+ → BaSO4↓
Сульфиты. А. К 2 мл раствора сульфита (10–30 мг сульфит-иона) прибавляют 2 мл хлористоводородной кислоты разведенной 8,3 % и встряхивают; постепенно выделяется сернистый газ, обнаруживаемый по характерному резкому запаху.
SO32- + 2H+ → H2SO3 → SO2↑ + H2O
Б. К 2 мл раствора сульфита (2–20 мг сульфит-иона) прибавляют 0,5 мл 5 % раствора бария хлорида; образуется белый осадок, растворимый в хлористоводородной кислоте разведенной 8,3 % (отличие от сульфатов).
SO32- + Ba2+ → BaSO3↓
BaSO3 + 2HCI → BaCI2 + H2O + SO2↑
Фосфаты. А. К 1 мл раствора фосфата (10–30 мг фосфат-иона), нейтрализованного до рН около 7,0, прибавляют несколько капель 2 % раствора серебра нитрата; образуется желтый осадок, растворимый в азотной кислоте разведенной 16 % и 10 % растворе аммиака.
PO43- + 3Ag+ → Ag3PO4↓
Ag3PO4 ¯ + 6NH4OH → 3[Ag(NH3 )2]3+ + PO43-+6H2O
Б. К 1 мл раствора фосфата (10–30 мг фосфат-иона) прибавляют 1 мл 10 % раствора аммония хлорида, 1 мл 10 % раствора аммиака и 0,5 мл 10 % раствора магния сульфата; образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах.
Na3PO4 + 3NH4CI + NH3. Н 2 О + М gSO4 ® NH4 М gPO4¯+ 3NaCl + (NH4)2SO4
MgNH4PO4¯ +3HCl®MgCl2+NH4Cl+H3PO4
В. К 1 мл раствора фосфата (10–30 мг фосфат-иона) в азотной кислоте разведенной 16 % прибавляют 2 мл 10 % раствора аммония молибдата и нагревают; образуется желтый кристаллический осадок, растворимый в 10 % растворе аммиака.
H3PO4 + 12(NH4)MoO4 + 21HNO3 ® (NH4)3PO4 ·12MoO3¯ + 21NH4NO3 + 12H2O
(NH4)3PO4· 12 MoO3 ¯ + 23NH4OH ® 12(NH4)2 MoO4 + (NH4)2HPO4+11H2O
Хлориды.К 2 мл раствора хлорида (2–10 мг хлорид-иона) прибавляют 0,5 мл азотной кислоты разведенной 16 % и 0,5 мл 2 % раствора серебра нитрата; образуется белый творожистый осадок, нерастворимый в азотной кислоте разведенной 16 % и растворимый в 10 % растворе аммиака. Для солей органических оснований испытание растворимости образовавшегося осадка проводят после отфильтровывания и промывания осадка водой.
Cl- + Ag+ → AgCl↓
AgCl¯ + 2NH4OH ® [Ag(NH3)2]++ Cl- + 2H2O
Нитраты. А. К лекарственному средству (около 1 мг нитрат-иона) прибавляют 2 капли раствора дифениламина; появляется синее окрашивание.
Б. К лекарственному средству (2–5 мг нитрат-иона) прибавляют по 2–3 капли воды и серной кислоты концентрированной, кусочек металлической меди и нагревают; выделяются пары бурого цвета.
2NaNO3 + H2SO4 → Na2SO4+ 2HNO3
Cu + HNO3 → Cu(NO3)2 + NO2↑ + H2O
Нитриты.А. К лекарственному средству (около 1 мг нитрит-иона) прибавляют 2 капли раствора дифениламина; появляется синее окрашивание.
Вода очищенная
Вода очищенная служит для изготовления перечня жидких лекарственных препаратов и является основой, из которой приготовляют воду для инъекций.
Основные показатели качества:
-pH от 5,0 до 7,0.
-Содержание хлоридов, сульфатов, нитратов, восстанавливающих веществ, кальция, диоксида углерода, тяжелых металлов — отсутствие.
-Содержание аммиака — 0,00002% (в препарате) или не более 0,05 мг/л.
-Микробиологическая чистота — не более 100 микроорганизмов в 1 мл.
-Бесцветность, прозрачность, без вкуса и запаха.
Метод предварительной очистки воды зависит от характера и содержания загрязняющих примесей:
1)Отстаивание, кипячение — для отделения летучих веществ. 2)Отстаивание, фильтрование — удаление механических примесей и взвешенных веществ. 3)Реагентное удаление аммиака. 4)Кипячение или обработка раствором гидроксида кальция — для снижения временной (карбонатной) жесткости воды. 5)Удаление органических веществ обработкой раствором перманганата калия.
Хранение и распределениеВода очищенная хранится и распределяется в условиях, предотвращающих рост микроорганизмов и исключающих возможность любой другой контаминации.
 Хранение воды очищенной осуществляют в специальных сборниках, оно не должно превышать 3 сут.
Хранение воды очищенной осуществляют в специальных сборниках, оно не должно превышать 3 сут.
Вода для инъекций Вода для инъекций должна соответствовать всем требованиям, предъявляемым к воде очищенной. Дополнительное требование по качеству — отсутствие пирогенности, то есть способности некоторых веществ повышать температуру тела, что характерно для продуктов метаболизма микроорганизмов. Если необходимо сделать запас воды для инъекций на срок до 24 часов, ее подвергают стерилизации. В асептических условиях вода для инъекций может храниться не более суток в температурных диапазонах 5-10 ºС или 80-95 ºС. В целях контроля качества вода для инъекций дополнительно проверяется на отсутствие восстанавливающих веществ, ионов аммония и диоксида углерода. Ежеквартально вода для инъекций подвергается полному химическому анализу. Хранение и распределение Воду для инъекций хранят и распределяют в условиях, предотвращающих рост микроорганизмов и исключающих возможность любой другой контаминации. Хранение воды для инъекций осуществляют в специальных сборниках при условии постоянной циркуляции при температуре не ниже 85 ºС, в течение не более 1 сут.
Количественное определение.
1. Прямая аргентометрия, точка эквивалентности устанавливается потенциметрически (ГФУ); пересчет на сухое вещество, (s=1): NaCl + AgNO3 à AgCl + NaNO3
2. Аргентометрия по Фольгарду в присутствии дибутилфталата (обратное титрование) (ГФУ); (s=1):
NaCl + AgNO3 à AgCl + NaNO3
AgNO3 + NH4SCN AgSCN + NH4NO3
3NH4SCN + Fe(NH4)(SO4)2 Fe(SCN)3↓ + 2(NH4)2SO4
3. Аргентометрия по Мору, прямое титрование, индикатор – калия хромат, (s=1):
NaCl + AgNO3 à AgCl + NaNO3
2AgNO3 + K2CrO4 à Ag2CrO4 + 2KNO3
3. Меркуриметрия ; индикатор – дифенилкарбазон; (s=2): 2NaCl + Hg(NO3)2 àHgCl2 + 2NaNO3
Применение. Основная функция натрия хлорида – обеспечение постоянного осмотического давления крови. Калия хлорид используется при гипокалиемии (вследствие приема диуретиков); антиаритмическое средство. Хранение. В хорошо укупоренной таре.
Чистота
1. Прозрачность и цветность 10% раствора в в 1М НСI в сравнении с эталонными растворами
2. pH водного раствора (3,1-3,7). 3. Предельное содержание общих примесей - тяжелые металлы в сульфатной золе, мышьяк, хлориды. 4. Остаточные органические растворители. 5. Потеря в массе при высушивании не более 0,5% 6. Микробиологическая чистота, для нестерильных ЛС.
Специфические примеси 5. Недопустимые примеси посторонних АК определяют методом тонкослойной хроматографии. Проявляют нингидрином.
Количественного определения Алкалиметрический метод (вариант нейтрализации) определения аминокислот, содержащих две карбоксильные группы.
ФС Х II для кислоты глутаминовой (субстанция и таблетки). Алкалиметрия по бромтимоловому синему до перехода желтой окраски в голубовато-зеленую (рН 6,0 – 7,6) или нейтральному красному.
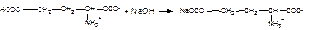 Кстех = 1/1; fэкв = 1,
Кстех = 1/1; fэкв = 1,
Метод Кьельдаля 1 стадия. В колбу Кьельдаля помещают точную навеску вещества, добавляют концентрированную серную кислоту и смесь сульфата калия и сульфата меди (для увеличения Т°кипения), нагревают. Смесь кипятят до тех пор, пока раствор не просветлеет (станет светло-зеленым). и После этого продолжают сжигание (минерализацию) в течение 30 минут (для метионина 4-4,5 часа). Образуются неорганические соединения: вода, углекислый газ и сульфат аммония.
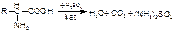
C→CO2; N→(NH4)2SO4→NH3
2 стадия. После этого к охлажденной смеси добавляют воду, подсоединяют колбу к парообразователю, добавляют избыток 30% гидроксида натрия (для нейтрализации H 2 SO 4) и пропускают пар. Азот органического соединения, после минерализации его связанный серной кислотой в сульфат аммония, отгоняют с водяным паром количественно в виде аммиака в приемник с борной кислотой. Образуется смесь метабората и тетрабората аммония.
3 стадия. Смесь после полного окончания перегонки титруется 0,1М хлороводордной кислотой. Индикатор смешанный: метиловый красный и метиленовый синий 1:1 или м/о + м/с.
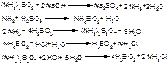 Параллельно проводят контрольный опыт.
Параллельно проводят контрольный опыт.
3.Формольное титрование по Сёренсену (алкалиметрия после взаимодействия с формальдегидом). Для блокирования аминогруппы предварительно добавляют формальдегид, образуется устойчивое N-метиленпроизводное,. Индикатор – фенолфталеин или потенциометрически.
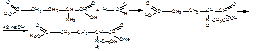
Кстех = 1/2; fэкв = 1/2; М.э. = М.м/2
1. Ацидиметрический метод неводного титрованияВ среде безводной уксусной кислоты подавляются кислотные свойства групп кислотного характера и усиливаются основные свойства групп основного характера.
2. Спектрофотометрический метод в видимой области спектра. Для получения окрашенных продуктов используют реакцию с нингидрином (гранулы кислоты глутаминовой для детей). Поляриметрический метод расчет по значению угла вращения и удельному вращению.
Хранение: ХУТ, защищающая от действия света. Применение Для лечения заболеваний ЦНС: эпилепсии, психозов, депрессивных состояний.
Реакции
1.ФС реакция с нингидрином – синее (сине-фиолетовое) окрашивание.
Таблетки аминалона: реакция подлинности – нингидриновая проба после хроматографического отделения аминалона на пластинах Силуфол ТСХ.
2.ФС раствор препарата нейтрализуют по ф/фт раствором щелочи до розового окрашивания, затем добавляют формальдегид, также нейтрализованный до розового окрашивания по ф/фт, окраска исчезает
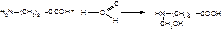
1.Реакция с роданидом калия (на аминалон специфическая). Смесь препарата и реактива нагревают, при этом фильтровальная бумага, импрегнированная ацетатом свинца над пробиркой, чернеет (сероводород). Реакция протекает по типу взаимодействия роданида калия с солями аммония:
KSCN + NH4+ → NH4SCN + K+
При нагревании роданид аммония перегруппировывается в изомерную тиомочевину:
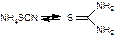
Тиомочевина может переходить в имидную форму, разлагающуюся с выделением сероводорода:
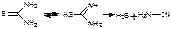
H2S + Pb(CH3COO)2 → PbS↓ + 2CH3COOH
2.с сульфатом меди в щелочной среде – реакция образования окрашенных хелатных солей синего цвета.
Количественное определение 1.ФС Ацидиметрический метод неводного титрования для субстанции . Кислотно–основное титрование. Среда – ледяная уксусная к-та. Титрант – хлорная к-та, растворенная в ледяной уксусной к-те Инд. – кристаллический фиолетовый.
Реакция нитрозирования

Пп-нитрозофенол Бенбензохинон
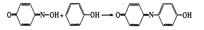
Реагирует с избытком фенола образуется индофенольный краситель
Подлиннность
1.УФ-спектрофотометрия. УФ-спектр 0,001% водного раствора ПАСК-Nа, который имеет 2 максимума поглощения– 265нм и 299нм (свидетельствует о наличии фенольного гидроксила и ПАА). ФС Соотношение оптических плотностей при длинах волн 265 и 299 нм должно быть в пределах 1,50-1,56 (указывает на отсутствие поглощающих при данных длинах волн примесей). Величины удельных показателей поглощения при максимумах поглощения равны соответственно 736 и 483.
2. Температура плавления Т°пл=122оС.
Реакции подлинности
1. ФС Реакция на фенольный гидроксил – в кислой средес раствором хлорида железа (III): образуетсякомплексное соединение (фиолетово-красное окрашивание).
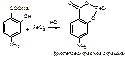
Водные растворы ПАС-натрия имеют рН 6,5-8,5, в этой среде с хлоридом железа образуется комплекс коричнево-красного цвета. Поэтому проводят подкисление разведенной хлороводородной кислотой. 2.ФС Реакция образования азокрасителя, основанная на наличии в структуре: первичной ароматической аминогруппы и фенольного гидроксила. А)В методике ФС после диазотирования раствором нитрита натрия в кислой среде проводят азосочетание с β-нафтолом в щелочной среде, появляется красное окрашивание (ЛВ диазосоставляющая):
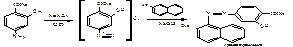
Б) в методике МФ- IIпосле диазотирования ЛВ в качестве азосоставляющей берется α-нафтиламин. Реакция проводится в кислой среде. Образуется красное окрашивание, переходящее в оранжевое при добавлении раствора гидроксида натрия (ЛВ диазосоставляющая):
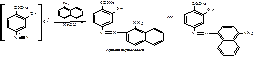
В) следующий вариант образования азокрасителя основан на наличии фенольного гидроксила.
Г) есть еще один вариант, основанный на том, что ПАС-натрия имеет в структуре одновременно ПАА и фенольный гидроксил. В щелочной среде сочетается как фенол:
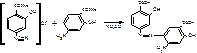 В кислой среде ПАС-натрия сочетается как амин, присоединение идет в 3-положении (пара- к ПАА).
В кислой среде ПАС-натрия сочетается как амин, присоединение идет в 3-положении (пара- к ПАА).
3.На ион натрия–окрашивает пламя горелки в желтый цветФС.
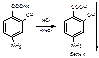 4. Реакция на карбоксильную группу – выделение свободной ПАСК(слабая к-та) из ее соли минеральной кислотой:
4. Реакция на карбоксильную группу – выделение свободной ПАСК(слабая к-та) из ее соли минеральной кислотой:
5. Реакция на карбоксильную и гидроксильную группы – с солями тяжелых металлов (с меди (II) сульфатом образует травянисто-зелёное окрашивание
Чистота 1.Прозрачность и цветность раствора, т.к. ПАС-натрия – лабильное вещество.
2.м-аминофенол (допустимая в пределах эталона примесь). Источников появления этой примеси два – 1) процесс получения (исходное вещество синтеза) и 2) процесс декарбоксилирования, который идет уже при 70-80оС.
Количественное определение
1.Фармакопейный метод – нитритометрический, основанный на реакции диазотирования первичной ароматической аминогруппы натрия нитритом в кислой среде в присутствии катализатора - калия бромида. индикатор внешний – йодкрахмальная бумага. Титруют до появления синего пятна на бумаге.
 йодкрахмальная бумага
йодкрахмальная бумага
NaNO2 + HCl → HNO2 + NaCl
KI + HCl → HI + KCl
2HNO2 + 2HI → I2+ 2NO↑ + 2H2O
Суммарно:
2NaNO2 + 2KI + 4HCl → I2 + 2NO↑ + 2NaCl + 2KCl + 2H2O
1.Броматометрический и йодхлорметрический методы (см. определение производных п-аминобензойной кислоты). f = ¼ 2.Ацидиметрия (см. определение салицилата натрия).f = 1
Хранение Хранят в хорошо укупоренной таре, в сухом, защищенном от света месте, предохраняя от окисления и образования примесей продуктов разложения. Применение Внутрь для лечения различных форм туберкулёза по 2,0-3,0 г.
18.Производные фенилпропионовой кислоты: ибупрофен. Синтез. Физические свойства. Определение подлинности. Испытание на чистоту. Количественное определение. Условия хранения. Фармакологическое действие .
d,l-2-(4-изобутилфенил)-пропионовая кислота
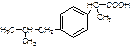
Описание белый или почти белый кристаллический порошок с характерным запахом. Тпл=75-77,5оС. Практически не растворим в воде, растворим в органических растворителях.
Подлинность
1.ИК-спектр ФС, снятый в диске с калия бромидом, в области 4000-400 см-1 должен иметь полное совпадение полос поглощения с полосами поглощения спектра стандартного образца.
2.УФ-спектр ФС раствора препарата в 0,1М натрия гидроксиде имеет максимумы при длинах волн 265 и 273 нм, а также плечо от 257 до 261 нм.
3.ВЭЖХ метод ФС.
4.ТСХ в таблетках – сравнение со стандартом (свидетелем).
Чистота 1. Цветность определяют спектрофотометрическим методом.
Оптическая плотность указанного раствора при длине волны λ=440 нм должна быть не более 0,28.
2.Посторонние примеси определяют: методом ГЖХ (по отношению суммы площадей пиков, обусловленных примесями, к площади пика ибупрофена). методом ТСХ
Количественное определение
1.ФС Алкалиметрия, вариант нейтрализации (по карбоксильной группе), растворитель и среда – этанол, индикатор – – тимоловый синий (от желтого до голубовато-серого).
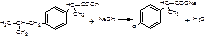 R-СООН + NаОН → R-СООNа+Н2О f экв,ибупрофена =1
R-СООН + NаОН → R-СООNа+Н2О f экв,ибупрофена =1
Ставят контрольный опыт (титруют без ЛВ)
2.ФС Метод ВЭЖХ (таблетки, растворы для инъекций). Количественное содержание рассчитывают по площади пика, которая пропорциональна количеству ЛВ в пробе.
Производные фенилуксусной кислоты: диклофенак натрия. Синтез (уравнения хим. реакций). Физические свойства. Определение подлинности: физические и химические методы. Испытание на чистоту. Количественное определение. Условия хранения. Фармакологическое действие.
Diclofenac – Natrium (Ortophenum, Voltaren) 2-[(2,6-дихлорфенил)-амино]-фенилуксусной кислоты натриевая соль
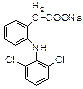
Получение – синтез
1)исходные вещества – 2,6-дихлорацетанилид и бромбензол
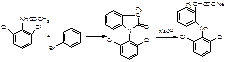
2)конденсацией 2-хлорфенилуксусной кислоты с 2,6-дихлоранилином с последующей нейтрализацией образующейся кислоты рассчитанным количеством натрия гидроксида:
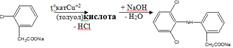
Описание
Белый или с кремоватым оттенком до светло-кремового цвета кристаллический порошок без запаха.
Подлинность
1. ИК -спектр, снятый в диске с калия бромидом, в области 4000-400 см-1 должен иметь полное совпадение полос поглощения с полосами поглощения спектра стандартного образца.
2. УФ-спектр в области 240-350 нм в растворе 0,1М натрия гидроксида имеет максимум поглощения при 276±2 нм и минимум при 249±2 нм
Реакции подлинности
1Реакция вытеснения органической кислоты сильной минеральной кислотой из ее соли и образование индолинона.
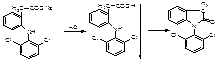
2Ион натрия доказывают по окрашиванию бесцветного пламени в желтый цвет.
3Ионы хлорав фильтрате после восстановительной минерализации ковалентно связанного хлора (прокаливания в тигле и растворения остатка в воде) дают реакцию с раствором серебра нитрата.
4Реакции окисления: а) Реактив Марки при наслаивании на раствор препарата образует зелено-белое кольцо б) При действии окислителей С нитритом натрия (на фрагмент дифениламина) – синее окраш-е .в) При обработке кристаллов конц серной кислотой на часовом стекле, они приобретают малиновое окрашивание.
5Реакции соле- и комплексообразования (по карбоксильной и амино- группе).
С нитратом серебра АgNО3 – белый осадок
С хлоридом железа (III) FеСl3 – жёлто-коричневый осадок
С сульфатом меди CuSО4 – светло-зеленый осадок
Чистота
1. Цветность определяют спектрофотометрическим методом. Оптическая плотность указанного раствора при длине волны λ=440 нм должна быть не более 0,28.
2. Специфические примеси (продукты синтеза – наличие соответствующей кислоты и индолинона) определяют методом ВЭЖХ.
Подвижная фаза: метанол – 0,1% раствор ортофосфорной кислоты (6:4). Детектор – спектрофотометр (длина волны 254 нм).
Количественное определение
1.Ацидuметрический мeтод титрования в среде протогенного растворителя (неводное титрование). Титруют хлорной кислотой в среде ледяной уксусной кислоты (субстанция диклофенака-натрия). Точку эквивалентности устанавливают по ФС потенциометрически или по индикатору кристаллическому фиолетовому. f .экв. (диклофенана-натрия) = 1. Суммарно:
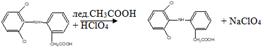
Титрант: 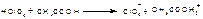
2. Спектрофотометрия в УФ-области спектра (лекарственные препараты: мази, таблетки).
3. Метод ВЭЖХ для диклофенака-натрия (таблетки, растворы для инъекций).
4.Ацuдuметрическuй метод титрования в водной среде (вариант вытеснения) в присутствии эфира, который извлекает органическую кислоту и тем самым сдвигает равновесие реакции вправо
R–СООNа + НСl → R–COOH↓ + NaCl f экв. = 1
Хранение в сухом, защищенном, от света месте при комнатной температуре, в хорошо укупоренной, таре. Применение противовоспалительное, жаропонижающее, анальгезирующее. Раствор в ампулах, таблетки, мази и гели для наружного применения.
Тетракаин гидрохлорид. Химическая формула. Названия. Физические свойства тетракаина гидрохлорида. Определение подлинности препарата: физические и химические методы (уравнения реакций, аналитические эффекты). Количественное определение препарата. Условия хранения. Фармакологическое действие.
1.Тетракаина гидрохлорид (ФП Дикаин)
Получение Синтез
1. получение п-бутиламинобензойной кислоты :
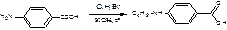
2. получение хлорангидрида п-бутиламинобензойной кислоты:
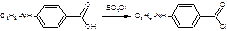
3. конденсация с диметиламиноэтанолом:
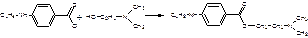
Описание: белый кристаллический порошок без запаха. Легко растворим в воде и спирте, трудно растворим в хлороформе, практически не растворим в эфире.
Подлинность
1. ФСУФ-спектр поглощения в области 220-350нм в присутствий фосфатного буфера с рН6 имеет макс поглощения при 227 нм и мин поглощения при 249 нм.
2. ФСИК-спектр в области 4000 – 400 см -1 в калия бромиде.
3. ФС и ГФХ Т°пл 147-150 градусов в цельсий
В структуре дикаина имеется вторичная ароматическая аминогруппа, сложно-эфирная группа и третичная алифатическая аминогруппа.
1. Реакции на вторичную ароматическую аминогруппу:
реакция образования азокрасителя отрицательная. Дикаин содержит вторичную ароматическую аминогруппу:
1.ГФХ реакция Витали-Морена дикаина смачивают конц. азотной кислотой образуется нитропроизводное дикаина желтого цвета. Затем охлажденный остаток обрабатывают спиртовым раствором гидроксида калия, образуется соль аци-формы, имеющая хиноидную структуру (калиевая соль орто-хиноидного соединения) и окрашенная в кроваво-красный цвет:
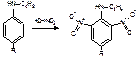
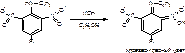
2.ГФХкак соль азотистого основания при взаимодействии с роданидом аммония образует соль – роданид дикаина – белый кристаллический осадок с определенной Т°пл (130-132оС)
дикаин ∙ НС1 + NH 4 SCN → дикаин ∙ HSCN ↓ + NH 4 CI Т°пл
3.ГФХ реакция на хлорид-ионы
для доказательства наличия сложноэфирной группы можно провести щелочной гидролиз дикаина:
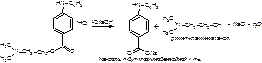
осадок
При подкислении НС1 выделяется осадок п-бутиламинобензойной кислоты, который растворяется в избытке хлороводородной кислоты, а при последующем действии нитрита натрия выпадает осадок N-нитрозопроизводного этой кислоты:
Чистота
ГФХОбщая степень очистки – прозрачность и цветность спиртового раствора, хлориды, кислотность, сульфатная зола, потеря в весе при высушивании.
допустимые: сульфаты, органические примеси в пределах эталона.
По ФС
1посторонние примеси(п-аминобензойную кислоту) методом ТСХ на пластинах "Силуфрол 254", детектируют в УФ свете
2микробиологическая чистота.
Количественное определение
1ФС и ГФХ– нитритометрия, но т.к. дикаин является вторичным ароматическим амином – продукт его взаимодействия с нитритом натрия в среде хлороводородной кислоты N -нитрозопроизводное. Индикатор внутренний – нейтральный красный или тропеолин 00.
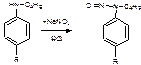
2По связанной с азотистым основанием хлороводородной кислоте
А) Алкалиметрическое титрование
Дикаин ∙ НС1 + NaOH → Дикаин ↓ + NaCl + H2O
основание
Индикатор – фенолфталеин, наблюдают за окраской водного слоя.
Б) Аргентометрическое титрование (вариант Фаянса).
Индикатор – бромфеноловый синий, после добавления индикатора
раствор подкисляют разведенной уксусной кислотой до желто-зеленого окрашивания раствора.
Титруют от желто-зеленого до фиолетового окрашивания:
Дикаин ∙ НС1 + AgNO 3 → AgCl ↓ + Дикаин ∙ HNO 3
3Прямое броматометрическое титрование. Индикатор – метиловый красный, разрушаясь избыточной каплей титранта обесцвечивается в точке эквивалентности.
Условия храненияСписок А. В хорошо укупоренной таре. Применение Дикаин – сильное местноанестизирующее средство.
Терминология:ЛС,субстанция для фармацевтического использования,ЛФ,гомеопатическиеЛС,оригинальноеЛС,генерическоеЛС,иммуннобиологическое,радиофармацевтическое.
Биодоступность- полнота и скорость всасывания ЛВ, которые характеризуются его количеством,поступившим в организм, после применения ЛП.
Биоэквивалентность -равенство биодоступности в допустимых пределах одних и тех же ЛП, приготовленных разными производителями.
Валидация-оценка и дкументальное подтверждение соответствия производственного процесса и качества продукции утвержжденным требованиям.
Вспомогательное вещество-относительно индефферентное в химич-о и биолоч-о отношении в-во, разрешенное к медицинскому применению в целях получения ЛФ, придания или сохранения определенывх свойств ЛП.
Качество ЛП-совокупность свойств, которые придают ЛП способность соответствовать своему назначению и отвечают требованиям НД.
Лекарственная форма - состояние, придаваемое ЛС или лекарственному растительному сырью, удобное для применения, обеспечивающее необходимый лечебный эффект.
Лекарственное (фармацевтическое) сырье - ЛС, лекарственное растительное сырье, вспомогательные вещества, разрешенные к медицинскому применению для производства лекарственных препаратов или другой фармацевтической продукции или полуфабрикатов. Фактически понятие «сырье» включает все исходные материалы, поступающие в производство для переработки с целью получения готового продукта или полуфабриката.
Фармацевтические субстанции - лекарственные средства в виде действующих веществ биологического, биотехнологического, минерального или химического происхождения, обладающие фармакологической активностью, предназначенные для производства, изготовления лекарственных препаратов и определяющие их эффективность.
Лекарственные средства - вещества, применяемые для профилактики, диагностики и лечения болезни, предотвращения беременности, полученные из крови, плазмы крови, а также органов, тканей человека или животного, растений, микроорганизмов, минералов методами синтеза или с применением биологических технологий.
Лекарственные препараты - дозированные ЛС в определенной лекарственной форме, готовые к применению.
Оригинальные лекарственные средства - ЛС, поступившие в обращение с зарегистрированными собственными названиями.
Воспроизведенные ЛС (дженерики) - ЛС, поступившие в обращение после истечения срока действия исключительных патентных прав на оригинальные ЛС.
Радиоактивное средство - ЛС, применяемое в медицинской практике в связи с его способностью к ионизирующему излучению.
Сильнодействующее средство - ЛС с высокой биологической активностью, прописывание, отпуск, хранение и учет которого производятся по особым правилам, установленным Минздравом России.
Наркотическое средство-ядовитое или сильнодействующее ЛС,требующего ограниченного применения и отнесенное к НС в соответствии с законодательством.
4.Правила выбора названий ЛС.МНН фармацевтических субстанций.
Лекарственные средства, как правило, имеют по несколько наименований (названий). Число синонимов синтетического лекарственного вещества достигает нескольких десятков и даже сотен. Химическое название отражает структуру JIB и присваивается в соответствии с правилами международной химической терминологии.
Однозначное название, как правило, имеют алкалоиды (пилокарпин, морфин, атропин). Они даются исходя кз наименований производящих растений. Аналогично происхождение названий других БАВ растительного и животного происхождения, в т.ч. гликозидов, ферментов, гормонов (инсулин, кортизон, тестостерон). Наименования JIC из числа антибиотиков происходят от их продуцентов (пенициллин, цефалоспорин). Целый ряд названий синтетических ЛС формируется из слогов их полного химического названия (парацетамол, промедол, хлорпромазин, нифедипин и др.). Нередко название присваивается на основе терапевтического действия (панадол, спазмолитин, апрессин, анальгин и др.). Иногда сочетаются в названии элементы химического строения и терапевтического действия. Некоторые производители включают в наименование часть названия фирмы.
Одним из важнейших направлений стандартизации JIC, которые регистрируются в Российской Федерации, является правильность присвоения им названий.
Комиссия по международным названиям ВОЗ с целью упорядочения и унификации названийJIC во всех странах мира разработала международную классификацию, в основу которой заложена определенная система формирования терминологии JIB. Принцип этой системы INN — МНН (InternationalNonproprietaryNames — международные непатентованные наименования) заключается в том, что в названии JIB ориентировочно дается его групповая принадлежность.
Многим отечественным JIB также присвоено МНН. Однако целый ряд из них имеют традиционную для России латинскую терминологию (Resorcinum, Mentholum), которая сохранилась в НД. Поэтому при изучении фармацевтической химии будет использована в основном номенклатура МНН, а при ее отсутствии — сохранившиеся латинские названия. В качестве основного синонима будут также приводиться торговые названия, под которыми JIC зарегистрировано или производится в Российской Федерации.
Дата: 2019-07-30, просмотров: 507.