Для выявления продуктов амплификации в режиме «реального времени» используют следующие наиболее распространённые подходы.
1. Выщепление 5' – концевой метки («TaqMan®»)
Данная методика основана на использовании 5'-экзонуклеазной активности полимеразы. В реакционную смесь добавляют ДНК-зонды, в состав которых входит флуоресцентная метка в 5'– положении и гаситель флуоресценции в 3'– положении. Эти зонды имеют места посадки внутри амплифицируемой области. Гаситель поглощает испускаемое флуоресцентной меткой излучение (молекулы гасителей, находясь в непосредственной близости с флуорофором, значительно снижают уровень флуоресценции – эффект гашения), а фосфатная группа в 3'-положении блокирует полимеразу.
В ходе ПЦР во время стадии отжига праймеров происходит присоединение ДНК-зонда к комплементарной цепи ДНК, причём, чем больше продуктов амплификации образуется в ходе ПЦР, тем больше зондов свяжется с соответствующими ампликонами (рис. 10).
 
| Гибридизация зонда со специфич. участком ДНК |
Рис. 10. Стадия отжига праймеров.
Во время стадии элонгации полимераза синтезирует комплементарную цепь ДНК и при достижении зонда начинает его расщеплять благодаря 5'– экзонуклеазной активности (свойство полимеразы разрушать двухцепочечный участок ДНК, встречающийся на её пути во время синтеза, отщепляя фрагменты размером от одного до нескольких нуклеотидов) (рис. 11).

| Элонгация и расщепление зонда Taq-полимеразой: высвобождение флуоресцентной метки |
| Рис. 11. Стадия элонгации |
Таким образом, происходит разъединение флуоресцентной метки и гасителя, что приводит к увеличению детектируемого свечения. Очевидно, чем больше ампликонов было наработано в ходе ПЦР на данный момент времени, тем интенсивнее будет свечение (рис. 12).

| Достраивание цепи – накопление флуоресцентного сигнала |
Рис. 12. Окончание стадии элонгации
2. Использование зондов с комплементарными концевыми последовательностями (molecular beacons)
Данная методика отличается от описанной выше тем, что концевые последовательности зонда представляют собой взаимно комплементарные области, поэтому при температуре отжига праймеров они схлопываются и образуют «шпильки», флуорофор и гаситель присоединяются к концевым нуклеотидам. Внутренняя область зондов содержит нуклеотидную последовательность, комплементарную амплифицируемой области. Зонды добавляют в реакционную смесь наряду с праймерами и остальными компонентами реакции. Поскольку при образовании «шпильки» в структуре зонда флуорофор и гаситель оказываются в непосредственной близости друг от друга, то перед началом реакции флуоресценция отсутствует (рис. 13.1). Во время реакции при повышении температуры происходит денатурация «шпильки», и зонды приобретают способность гибридизоваться. Зонды, не присоединившиеся к ДНК – матрице, остаются в схлопнутом состоянии, так что происходит тушение флуоресценции. Те же зонды, которые отжигаются на матрице, разворачиваются, флуоресцентная метка и гаситель расходятся в разные стороны (рис. 13.2). Таким образом увеличивается интенсивность свечения.
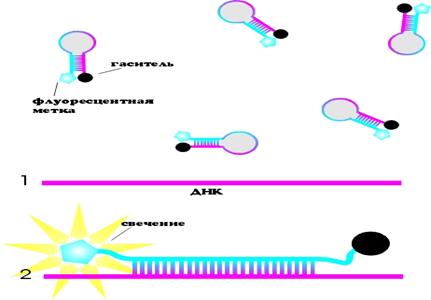
| Наличие комплементарных концевых последовательностей приводит к образованию шпильки и к гашению флуоресценции При гибридизации зонда с ДНК –матрицей происходит удаление флуоресцентной метки от гасителя |
Рис. 13. Схема гибридизации зонда с ДНК – матрицей.
3. Применение 2-х зондов с резонансным переносом энергии (LightCycler assay).
Этот способ детекции накопления продуктов амплификации отличается повышенной специфичностью, т.к. увеличение флуоресценции происходит при комплементарном связывании с ампликонами сразу 2-х ДНК-зондов. Принцип метода заключается в переносе энергии от одного флуорофора, находящегося на 3'– конце первого зонда, ко второму флуорофору, находящемуся на 5'– конце второго зонда, причём расстояние между флуорофорами составляет 1-3 нуклеотида (рис. 14).
При одновременном связывании обоих зондов с ДНК-матрицей испускаемое первым флуорохромом излучение передаётся на второй флуорофор, а его излучение детектируется прибором. Таким образом возрастает специфичность анализа.
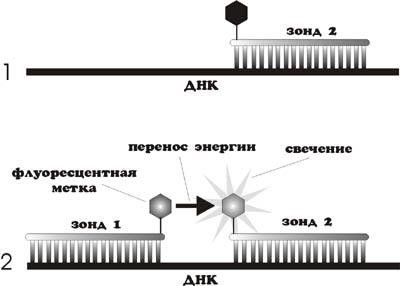
Рис. 14. Применение 2-х зондов с резонансным переносом энергии (LightCycler assay)
4. Использование интеркалирующих агентов
Этот метод детекции основан на том, что флуоресценция бромистого этидия и красителя SYBR Green I значительно возрастает при их внедрении в двухцепочечные молекулы ДНК (рис. 15). Таким образом можно наблюдать за накоплением продуктов амплификации. Но увеличение флуоресценции может быть связано как с накоплением специфического фрагмента, так и неспецифического (праймер-димеры, шмер). Для получения корректных результатов необходимо дополнительное изучение полученных ампликонов с помощью построения «кривых плавления». Для этого после окончания ПЦР реакционную смесь нагревают и непрерывно измеряют флуоресценцию. По достижении температуры плавления продукта амплификации флуоресценция резко снижается.
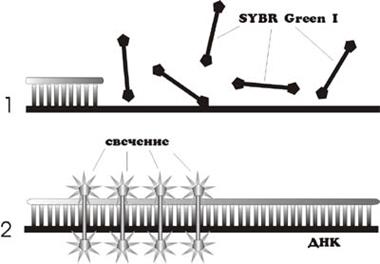
| • Низкий уровень флуоресценции интеркалирующих агентов в свободном состоянии • При связывании с двухцепочечной ДНК их флуоресценция резко возрастает • Уровень флуоресценции прямо пропорционален количеству образующихся ампликонов |
Рис. 15. Схема внедрения красителя в двухцепочечные молекулы ДНК
Так как кинетика накопления продуктов амплификации связана с исходным количеством матрицы, это даёт возможность точно оценить её количество, т.е. сигнал флуоресценции в ходе ПЦР возрастает пропорционально количеству продукта амплификации.
 Мониторинг сигнала позволяет построить кинетическую кривую реакции (кривую флуоресценции), при этом момент заметного увеличения сигнала и отрыва его от фонового зависит от исходного количества ДНК-мишени. Кинетическая кривая ПЦР в координатах "Интенсивность флуоресценции — цикл амплификации" имеет сигмовидную форму (рис 16).
Мониторинг сигнала позволяет построить кинетическую кривую реакции (кривую флуоресценции), при этом момент заметного увеличения сигнала и отрыва его от фонового зависит от исходного количества ДНК-мишени. Кинетическая кривая ПЦР в координатах "Интенсивность флуоресценции — цикл амплификации" имеет сигмовидную форму (рис 16).
В ней можно выделить три стадии: стадию инициации (когда ПЦР-продукты еще не детектируются флуоресцентной меткой), экспоненциальную стадию (в которой наблюдается экспоненциальная зависимость количества флуоресценции от цикла ПЦР), плато (стадию насыщения). Пороговым циклом (threshold cycle, C(t)) называется такой цикл амплификации, на котором достигается некий заданный уровень интенсивности флуоресценции – пороговая флуоресценция. Величина порогового цикла является важной характеристикой, прямо пропорциональной логарифму количества копий исходной матрицы. Именно это позволяет проводить полуколичественную и количественную, а также сравнительную оценку образцов.
Полученные в ходе исследования данные – кривые накопления флуоресцентного сигнала – анализируют по нескольким каналам детекции с помощью программного обеспечения прибора (фото 22).
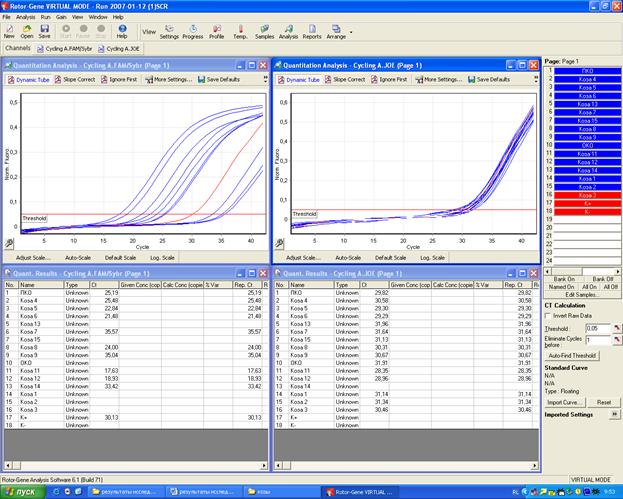
Фото 22. Результаты исследований, полученные при использовании прибора RotorGene 6000 и его программного обеспечения
Результаты реакции интерпретируют на основании наличия (или отсутствия) пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией (Treshold) в виде графика зависимости интенсивности флуоресценции от количества циклов, что соответствует наличию (или отсутствию) значения порогового цикла «Ct» в соответствующей графе в таблице результатов.
Для проведения ПЦР и детекции результатов в режиме «реального времени» необходим специальный прибор, в котором были бы совмещены термоциклер и флуоресцентный детектор. В большинстве ветеринарных лабораториях Российской Федерации используют два прибора для проведения ПЦР и детекции продуктов ПЦР в режиме «реального времени» - «RotorGene 6000», производства Corbett Reseаrch (Австралия) и iQ 4-5, производства BioRad (США). Эти модели представлены на фото 23-24.
В последние годы в России был создан более простой вариант детекции продуктов ПЦР в закрытой системе – флуориметрия после ПЦР, так называемая гибридизационно-флуоресцентная детекция с измерением уровня флуоресцентного сигнала по окончании ПЦР (FEP – Fluorescence detection with End Point analysis) – анализ «по конечной точке». Он состоит в том, что в реакционную смесь добавляют специальные флуоресцирующие зонды, по завершении процесса амплификации пробирки извлекают из термоциклера и помещают во флуориметр, где и происходит измерение свечения зонда с записью и обработкой результатов в компьютере. Метод обладает всеми преимуществами ПЦР в реальном времени по устранению контаминаций и снижению трудоемкости, но не является количественным – по интенсивности флуоресцентных сигналов после ПЦР возможны лишь самые приближенные оценки содержания возбудителя в пробе. На российском рынке используют 2 прибора для флуориметрической детекции: «Джин» («ДНК-технология», Россия) и «ALA-1» (Biosan, Латвия). На фото 25 представлен «ALA-1» (Biosan, Латвия).
Таким образом, флуориметическая детекция продуктов ПЦР в режиме «реального времени» и с измерением уровня флуоресцентного сигнала по окончании ПЦР радикально снижает трудоемкость анализа и меняет весь стиль работы. Ее внедрение означает переход генодиагностики на качественно новую ступень. Кроме того, флуоресцентная детекция продуктов ПЦР в 2-3 раза чувствительнее электрофорезной детекции.
Заключение.
Огромным преимуществом ПЦР является то, что этот метод позволяет выявить генетический материал непосредственно самого возбудителя, даёт возможность амплифицировать искомый участок нуклеиновых кислот, даже если анализируемый материал содержит сложную смесь молекул, или нуклеиновых кислот, присутствующую в ничтожно малых количествах, возможен анализ препаратов, содержащих деградированную ДНК. Для диагностики многих болезней методом ПЦР не требуется сохранения целостности структур возбудителя и его биологической активности. В качестве источника нуклеиновых кислот подходит любой биологический и патологический материал. Основным требованием успешного проведения реакции служит целостность генетического материала.
Эффективность, простота исполнения, высокие показатели чувствительности и специфичности предопределили широкие возможности практического применения метода ПЦР в различных областях медицины и ветеринарии.
В настоящее время метод ПЦР широко используется при диагностике инфекционных болезней, в том числе вызванных возбудителями, трудно культивируемыми и медленно растущими, а также требующими особых условий культивирования; при генотипировании, оценке вирулентности и определении устойчивости к антибиотикам различных микроорганизмов и вирусов; в генодиагностике и генетической дактилоскопии; в пренатальной диагностике и биологическом контроле препаратов крови; для контроля бактериемии и вирусемии; для оценки стадии болезни, прогноза и эффективности проводимого лечения. С помощью метода ПЦР в одной пробе можно определять неограниченное количество возбудителей острых, хронических, персистирующих и латентных инфекций, а также варианты возбудителей, которые трудно диагностировать другими методами. Исследуемый материал подвергается обеззараживанию уже в процессе предварительной обработки, тем самым исключается возможность инфицирования персонала в процессе проведения ПЦР.
Полимеразная цепная реакция обладает значительными преимуществами по сравнению с классическими методами лабораторного исследования. В случаях, когда традиционные методы лабораторной диагностики оказываются фактически неэффективными или принципиально неприемлемыми, единственными методами становятся методы, основанные на прямой идентификации генетического материала возбудителя.
Внедрение в ветеринарную лабораторную практику нового приборного обеспечения для автоматической экстракции нуклеиновых кислот для постановки ПЦР и детекции результатов в режиме «реального времени» позволит поднять лабораторную диагностику инфекционных болезней на другой, более высокий уровень.
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ.
1. Батинг, Г. и др. Анализ генома. Методы / Батинг Г., Контор Ч., Коллинз Ф. – М.: Мир, 1990. – С. 176-190.
2. Белоусова Р.В., Преображенская Э.А., Третьякова И.В. Ветеринарная вирусология / Под ред. проф. Р.В.Белоусовой. – М.:КолосС, 2007. – С.169-172.
3. Вартапетян, А.Б. Полимеразная цепная реакция / Вартапетян А.Б. // Молекулярная биология – М.: Наука, 1991. – Вып.4. – С. 926-936.
4. Глик Б., Пастернак, Дж. Молекулярная биотехнология. Принципы и применение. – М., 2002. – 540 с.
5. Гусева, Е.В. и др. Применение ПЦР в диагностике инфекционных заболеваний животных / Гусева Е.В., Сатина Т.А. – Владимир, 1995, 44 с.
6. Иванова, М.М. и др. Современные методы ДНК-диагностики: Лекция / Иванова М.М., Лазарев В.Н., Белоусова Р.В., Народицкий Б.С. – М.: МВА, 1997, 19 с.
7. Иванова, М.М. и др. Использование метода ПЦР для амплификации и последующей детекции генетического материала в животноводстве и ветеринарии: Методические рекомендации / Иванова М.М., Лазарев В.Н. // Современные методы биотехнологии в растениеводстве, животноводстве и ветеринарии. – М.: МСХА, 1998. – С. 59-82.
8. Морз, С. А. Быстрый молекулярный анализ для диагностики инфекционных заболеваний / Морз С. А. // Молекулярная медицина, 2005, №3. – С.51.
9. Мюллис, К. Необычайная история о том, как родилась полимеразная цепная реакция / Мюллис К. // В мире науки, 1990, №6.
10. МУ 1.3.1794-03 "Организация работы при исследованиях методом ПЦР материала, инфицированного микроорганизмами I-II групп патогенности" // Минздрав России, 2003.
11. Обухов, И.Л. Применение ПЦР в ветеринарии // Аграрная Россия, № 2. – М., 2002. – С. 62-64.
12. Правила проведения работ в диагностических лабораториях, использующих метод полимеразной цепной реакции (основные положения). Утв. 27.01.97. – М., 1997, 5с.
13. Щелкунов, С.Н. Генетическая инженерия.– 2-е изд.–Новосибирск, 2004. – 490 с.
14. Ahlquist, P. RNA-dependent RNA polymerase, viruses, and RNA silencing / Ahlquist P. // Science, 2002. – Vol. 296. – P. 1270-1273.
15. Bankowski, M. J. Real-time nucleic acid amplification in clinical microbiology / Bankowski M. J., Anderson S. M. // Clin. Microbiol. News, 2004, № 26(9) – Р.15.
16. Bernard, P.S. Color multiplexing hybridization probes using the apolipoprotein E locus as a model system for genotyping / Pritham G.H., Wittwer C.T. //Analytycal Biochemistry, 1999. - № 273.- p. 221-228.
17. Boom, R., Salimans, M.M.H. // J.Clin.Micbiol., 1990. – Vol.28. –N.2. – P.495-503.
18. Bustin, S.A. et al. Pitfalls of quantitative real-time reverse-trasncription polymerase chain reaction / Bustin S.A., Nolan T. // J. Biomol, 2004. – N15. – P.155–166.
19. Coutlee, F. Coamplification of HIV type 1 and beta-globin gene DNA sequences in a nonisotopic polimerase chain reaction assay to control for amplification efficiency / He Y., Saint-Antoine P., Olivier C., Kessous A. // AIDS Res. Hum. Retroviruses.-1995.-№ 11.- p.363-371.
20. Espy, M. J. et al. Real-Time PCR in Clinical Microbiology: Applications for Routine Laboratory Testing / Espy M. J., Uhl J. R., L. Sloan M., Buckwalter S. P., Jones M. F., Vetter E. A., Yao J. D. C., Wengenack N. L., Rosenblatt J. E., Cockerill F. R., Smith T. F. // Clin Microbiol Rev., 2006, №19(1).– Р.165–256.
21. Garrett, P.E. Quality control for nucleic acid tests: common ground and special issue / Garrett P.E. // J. Clin. Virol., 2001, №20.– Р.15-21.
22. Harriman, W.D. et al. A video technique for the quantifikation of DNA in gels stained with ethidium bromide / Harriman W.D., Wabl M. // Analyt. Biochem., 1995.–Vol.228, N2.– P.336-342.
23. Heid, C.A. Real-time quantitative PCR / Heid C.A. // Genome Res., 1996, N6.– P.986-994.
24. Higuchi, R. et al. Kinetic PCR analysis: Real-time monitoring of DNA amplification reactions / Higuchi R., Fockler C., Dollinger G., Watson R. // BioTechnol., 1993.– Vol.11.– P. 1026-1030.
25. Klein, D. Quantification using real-time PCR technology: applications and limitations / Klein D. // Trends. Mol. Med., 2002, N8. – P. 257–260.
26. Knepp, J. H. et al. Comparison of automated and manual nucleic acid extraction methods for detection of enterovirus RNA / Knepp, J.H., Geahr M.A., Forman M.S., Valsamakis A. // J. Clin. Microbiol., 2003, №41.– Р . 3532-3536.
27. Kwok, S. et al. Avoiding false positives with PCR / Kwok S., Higuchi R. // Nature, 1989.– Vol.339. – P.237-238.
28. Luu-The, V. et al. Improved real-time RT-PCR method for high-throughput measurements using second derivative calculation and double correction / Luu-The V., Paquet N., Calvo E., Cumps J. // Biotechniques, 2005, N.38. – P. 287–293.
29. Mackay, I.M. Real-time PCR in the microbiology laboratory / Mackay I.M. // Clin Microbiol Infect., 2004.– Vol.10. – P.190–212.
30. MolBiol.ru: http://molbiol.ru/e-mail: redactor@molbiol.ru
31. Molecular biology techniques manual: standard PCR protocol. / Coyne V.E., James M.D., Reid Sh.J., Rybicki E.P., 1994, 10 p.
32. Mullis, K., Falona, F. Specific synthesis of DNA in vitro via a polymerase-catalyzed chaine reaction. // Meth. Enzymol., 1987. – V.155. – P.335-350.
33. www.pcr.ru
34. www.pubmed.ru
35. Powledge, T.M. The polymerase chain reaction. / Powledge T.M. // Adv. Physiol. Educ., 2004, N28.– P.44–50.
36. Reischl, U. et al. Rapid Cycle Real-time PCR: Methods and Applications / Reischl U., Wittwer C.T., Cockerill F. / Microbiology and Food Analysis. – New York: Springer-Verlag, 2002.
37. Smith, T. F. et al. Development, implementation, and trend analysis of real-time PCR tests for the clinical microbiology laboratory / Smith T. F., Uhl J. R., Espy M. J., Sloan L. M., Vetter E. A., Jones M. F., Rosenblatt J. E., Cockerill F. R. / Clin. Microbiol., 2004, № 26.– Р.145-154.
38. Sykes, P.J. Quantitation of targets for PCR by use of limiting dilution / Neoh S.H., Brisco M.J., Hughes E., Condon J., Morley А.А. // BioTechniques.-1995.-№ 13.- p.444-449.
39. Tyagi, S. Molecular beacons: probes that fluoresce upon hybridization / Kramer F.R. // Nat Biotechnol.-1996.-№ 14.- p.303-308.
При подготовке учебного пособия были использованы материалы, предоставленные ФГУН ЦНИИ эпидемиологии Роспотребнадзора и ООО «Интерлабсервис» (г. Москва).
Приложение 1
Краткий словарь терминов
Аллель – одна из двух альтернативных структурных форм гена.
Амплификация (gene amplification) – увеличение числа копий какого-либо гена в данной клетке или в пробирке методом ПЦР; процесс образования дополнительных копий участков хромосомной ДНК, как правило, содержащих определенные гены, либо сегменты структурного гетерохроматина; амплификация может быть ответом клеток на селективное воздействие; один из механизмов активации онкогенов в процессе развития опухоли.
Антипараллельная ориентация – противоположная направленность цепей в двухцепочечных (двуспиральных) молекулах нуклеиновых кислот.
Бактериофаг – вирус, инфицирующий бактерии.
Биологическая безопасность – система медико-биологических, организационных и инженерно-технических мероприятий и средств, направленных на защиту работающего персонала, населения и окружающей среды от воздействия патогенных биологических агентов.
Биомасса – клеточная масса, образующаяся в результате жизнедеятельность живых организмов.
Бокс биологической безопасности – конструкция, используемая для физической изоляции (удержания и контролируемого удаления из рабочей зоны) микроорганизмов с целью предотвращения возможности заражения персонала и контаминации воздуха рабочей зоны и окружающей среды.
Боксированное помещение (бокс) – изолированное помещение с тамбуром (предбоксником).
Вирион – вирусная частица.
Ген ( Gene ) – транскрибируемый участок хромосомы, кодирующий функциональный белок, либо тРНК или рРНК.
Генетический код ( Genetic code ) – cистема записи генетической информации в виде последовательности нуклеотидов, в которой каждые три нуклеотида, составляющие кодон, кодируют одну аминокислоту.
Ген-мишень – клонированный ген; ген, подвергаемый специфическому воздействию; ген, интересующий исследователя.
Геном ( Genome ) – cовокупность генов гаплоидного набора хромосом данного организма.
Генотипирование – определение всех аллелей всех локусов данной хромосомы.
Гибридизация ( Hybridization ) – отжиг двух полинуклеотидных цепей, часто из разных источников, с образованием ДНК/РНК или ДНК/ДНК гибридов, стабилизируемых водородными связями
3' - гидроксильная группа – гидроксильная группа, связанная с 3'-атомом углерода сахарного остатка (рибозы или дезоксирибозы) концевого нуклеотида молекулы нуклеиновой кислоты.
Гуанин ( G ) ( Guanine ) – пуриновое основание, комплементарное цитозину; одно из четырех азотистых оснований, входящих в состав ДНК или РНК.
Дезоксирибоза (Deoxyribose ) – пятиуглеродный моносахарид, входящий в состав ДНК.
Дезоксирибюонуклеаза I , ДНКаза – фермент, расщепляющий двухцепочечную ДНК.
Дезоксирибонуклеиновая кислота (ДНК) – полимер, состоящий из дезокрибонуклеотидов, видоспецифичный носитель генетической информации.
Денатурация ( Denaturation ) – 1. расхождение цепей двухцепочечной молекулы ДНК или РНК; 2. нарушение нативной конформации биологических макромолекул в результате разрушения нековалентных (водородных) связей.
ДНК-зонд ( DNA - probe ) – фрагмент ДНК, меченный тем или иным способом и использующийся для гибридизации со специфическим участком в молекуле ДНК. Позволяет идентифицировать комплементарные ему нуклеотидные последовательности.
| ДНК - полимераза ( DNA - polymerase ) – фермент, катализирующий синтез полинуклеотидной цепи из отдельных нуклеотидов с использованием другой цепи в качестве матрицы и ДНК-затравки со свободной 3! – ОН - группой. |
ДНК - полимераза Taq (Taq - DNA - polymerase ) – термостабильная ДНК-полимераза (сохраняет активность при 95º С), выделенная из бактерии Thermus aquatius.
ДНК рекомбинантная – молекулы ДНК, создаваемые методами генетической инженерии.
Зонд ( Probe ) – 1. соединение, меченное тем или иным способом и использующееся для выявления родственных биохимических молекул в сложном образце; 2. олигонуклеотид, использующийся для выявления комплементарных последовательностей с помощью гибридизации.
Интеграция ( Integration ) – встраивание чужеродной ДНК (обычно с помощью гомологичной рекомбинации) в хромосому хозяйской клетки.
Комплементарная ДНК, кДНК – молекула ДНК, синтезированная на РНК-матрице с участием РНК-зависимой ДНК-полимеразы (обратной транскриптазы).
Комплементарные нуклеотидные последовательности – полинуклеотидные последовательности, которые взаимодействуют между собой в соответствии с правилами спаривания оснований: аденин (А) образует пару с тимином (Т) (или урацилом (У) в РНК), гуанин (Г) – с цитозином (Ц).
Лизис – разрушение клеточных стенок под действием ферментов, содержащихся в лизосомах, или других агентов.
Матричная РНК, мРНК ( Messenger RNA ) – молекула РНК, в которой заключена информация об аминокислотной последовательности определенной белковой молекулы.
Матричная цепь ( Template strand ) – цепь ДНК или другой полинуклеотид, использующийся ДНК-полимеразой в качестве матрицы для синтеза комплементарной цепи.
Мишень ( Taget ) – в самом широком смысле – биологический объект (ткань, молекула, клетка, микроорганизм), которая интересует исследователя.
Молекулярная диагностика – выявление молекулярно-биологическими методами патогенного микроорганизма, специфического вещества или измененной нуклеотидной последовательности, ответственных за то или иное заболевание.
Нуклеозид ( Nucleoside ) – пуриновое или пиримидиновое азотистое основание, ковалентно связанное с пятиуглеродным сахаром (пентозой); если сахаром является рибоза, то мы имеем дело с рибонуклеозидом, если дезоксирибоза, то с дезоксирибонуклеозидом.
Нуклеотид ( Nucleotide ) – нуклеозид, к которому присоединены одна или более фосфатная группа; присоединение происходит по 5'-углеродному атому сахарного кольца.
Обратная транскриптаза ( Reverse transcriptase ) – РНК-зависимая ДНК-полимераза, использующая молекулу РНК в качестве матрицы для синтеза комплементарной цепи ДНК.
Обратная транскрипция – полимеразная цепная реакция ( Reverse transcription - polymerase chain reaction ). Способ получения в большом количестве кДНК, состоящий из двух этапов. Вначале in vitro синтезируют кДНК, используя обратную транскриптазу, мРНК в качестве матрицы и oligo (dT) в качестве праймера. Затем кДНК амплифицируют с помощью полимеразной цепной реакции (ПЦР), используя два праймера: один комплементарен участку первой цепи кДНК, а второй – другой цепи, комплементарной первой.
Олигонуклеотид – короткий сегмент одноцепочечной ДНК, обычно получаемый химическим путем.
Отжиг ( Annealing ) – процесс образования двухцепочечных молекул (ДНК-ДНК или ДНК-РНК) из одиночных полинуклеотидных комплементарных цепей.
Патогенные биологические агенты – патогенные для человека микроорганизмы (бактерии, вирусы, хламидии, риккетсии, простейшие, грибы, микоплазмы), генно-инженерно-модифицированные микроорганизмы, яды биологического происхождения (токсины), гельминты, а также материал (включая кровь, другие биологические жидкости и экскреты организма), подозрительный на содержание перечисленных агентов.
Пиримидины ( Pyrimidinc ) – один из двух типов азотистых оснований, входящих в состав нуклеиновых кислот; к пиримидинам относятся тимин, цитозин и урацил. Второй тип оснований – пурины; к ним относятся аденин и гуанин.
Плазмида ( Plasmide ) – внехромосомный генетический элемент, способный к длительному автономному существованию и репликации, двухцепочечная кольцевая ДНК длиной 1-200 тыс. п.о.
Полимеразная цепная реакция, ПЦР ( Polymerase chain reaction ) – метод амплификации специфического сегмента ДНК с помощью термостабильной ДНК-полимеразы с использованием олигонуклеотидных ДНК-зондов, комплементарных последовательностям противоположных цепей ДНК, фланкирующим амплифицируемый сегмент. Процесс состоит из серии циклически повторяющихся реакций: денатурации ДНК, отжига праймеров, синтеза ДНК.
Полинуклеотид – линейный полимер, состоящий из 20 и более нуклеотидов, соединенных друг с другом фосфодиэфирными связями. Полинуклеотидами являются, например, молекулы ДНК и РНК.
Праймер ( Primer ) – короткий олигонуклеотид, который гибридизуется с матрицей и служит затравкой при её копировании.
Прокариоты ( Procaryotes ) – организмы, у которых нет ограниченных мембранами ядра и органелл, к прокариотам относятся все бактерии.
Протеиназы, протеолитические ферменты ( Protease ) – ферменты, расщепляющие пептидные связи в белковых молекулах.
Пиримидины – один из двух типов азотистых оснований, входящих в состав нуклеиновых кислот, к ним относят тимин, урацил и цитозин.
Пурины (Риппе) – второй тип азотистых оснований, входящих в состав нуклеиновых кислот; к пуринам относятся аденин и гуанин.
Ренатурация ( Renaturation ) – воссоединение цепей двухцепочечной ДНК, разошедшихся при денатурации.
Репликация ( Replication ) – процесс самовоспроизведения (синтеза) ДНК.
Рибоза ( Ribose ) – пятиуглеродный моносахарид, входит в состав РНК.
Рибонуклеиновая кислота, РНК ( Ribonucleic acid , RNA ) – нуклеиновая кислота, состоящая из рибонуклеотидов, у которых сахаром является рибоза, а одним из пиримидинов – урацил (вместо тимина).
Рибосома ( Ribosome ) – клеточная органелла, рибонуклеопротеидная частица, при участии которой осуществляется синтез белка (трансляция); состоит из двух субчастиц – большой и малой.
Рибосомная РНК, рРНК ( Ribosomal RNA , rRNA ) – РНК, входящая в состав рибосом.
Температура плавления, Tm ( Melting temperature ) – температура, при которой происходит разрыв половины водородных связей в полинуклеотидном дуплексе.
Тимин, T ( Thymine ) – пиримидиновое основание; одно из четырех азотистых оснований, входящих в состав ДНК.
Трансгенный организм ( Transgenic organism ) – организм, геном которого содержит чужеродный генетический материал, включённый методами генной инженерии.
Транскрипт ( Transcript ) – молекула РНК, синтезированная на специфической ДНК как на матрице.
Транскрипция ( Transcription ) – процесс синтеза РНК, катализируемый РНК-полимеразой, в котором в качестве матрицы используется одна из цепей ДНК.
Трансляция ( Translation ) – синтез полипептидной цепи рибосомой с использованием в качестве матрицы мРНК.
Транспортная РНК, тРНК ( Transfer RNA) –- молекула РНК, выступающая в роли адаптера при специфическом переносе аминокислот к растущей полипептидной цепи в процессе трансляции.
Трансформация ( Transformation ) – перенос генетической информации в бактериальные клетки с участием плазмид или без них, но всегда без участия вирусов; часто приводит к изменению фенотипа реципиентной клетки; превращение нормальных клеток животных в опухолевые.
Урацил, U ( Uracil ) – пиримидиновое основание; одно из четырех азотистых оснований, входящих в состав РНК.
Фосфодиэфирная связь ( Phosphodiester bond ) – связь между фосфатными группами при 3'- и 5' – углеродных атомах соседних нуклеотидов одной полинуклеотидной цепи.
Xpo мос o м a ( Chroraosome ) – структура, основу которой составляет конденсированная молекула ДНК; носитель генетической информации; способна к воспроизведению с сохранением структурно-функциональной индивидуальности в ряду поколений; у эукариот находится в ядре клетки, у прокариот - непосредственно в цитоплазме.
Цитозин, С ( Cytosine ) – одно из четырех азотистых оснований, входящих в состав ДНК и РНК.
Элонгация ( Elongation ) – последовательное присоединение мономеров к полимерной цепи.
Эукариоты ( Eukaryotes ) – организмы, у которых: 1) имеется ядро, где содержатся хромосомы; 2) в цитоплазме присутствуют различные органеллы - митохондрии, хлоропласта и т.п. К эукариотам относятся животные, растения, грибы, некоторые водоросли.
Приложение 2
Дата: 2019-07-31, просмотров: 591.