ОСНОВЫ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ
С РАЗНЫМИ ФОРМАТАМИ ДЕТЕКЦИИ
У Ч Е Б Н О Е П О С О Б И Е
МОСКВА 2018
УДК 619:616:98:578–078 (075.8)
М.С. Калмыкова, Е.И. Ярыгина, И.В. Третьякова
ОСНОВЫ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ С РАЗНЫМИ ФОРМАТАМИ ДЕТЕКЦИИ
УЧЕБНОЕ ПОСОБИЕ
Учебное пособие предназначено для обучающихся по направлению подготовки 06.03.01 – Биология, аспирантов, слушателей Института повышения квалификации.
Основы полимеразной цепной реакции
С разными форматами детекции
Введение
Успехи современной ветеринарной лабораторной практики часто зависят от того, удаётся ли обнаружить патогенные вирусы, бактерии, грибы, паразитические микроорганизмы в организме животных и других объектах ветеринарного надзора. Известно, что профилактику и лечение любой инфекционной болезни значительно облегчает ранняя и точная идентификация вызвавшего его патогенного агента. Для проведения многих диагностических тестов необходимо сначала вырастить культуру или накопить биомассу потенциально-патогенного агента и лишь затем проанализировать его основные свойства, т.е. провести идентификацию. Во многих ситуациях такие тесты очень эффективны и обладают достаточно высокой специфичностью. Однако часто они бывают очень трудоёмкими, дорогостоящими, длительными и обладают низкой чувствительностью. Кроме того, ограничена возможность выявления труднокультивируемых или некультивируемых патогенных микроорганизмов.
Чтобы устранить эти принципиальные ограничения, были разработаны методы молекулярной диагностики, в основе которых лежат методы обнаружения специфических нуклеиновых кислот.
Любой метод выявления патогенных агентов должен быть достаточно простым и обладать высокой специфичностью и чувствительностью. Специфичный диагностический тест должен давать положительный ответ только на искомый агент, чувствительный – обнаруживать очень малые количества такого агента даже на фоне большого количества других агентов, находящихся в исследуемом образце. Простота метода подразумевает, что он является эффективным, доступным и недорогим для рутинного применения.
Информация обо всём многообразии свойств любого организма заключена в его генетическом материале. Геном вирусов, как и других биологических объектов, является той уникальной структурой, которая наиболее полно и адекватно отражает биологическую сущность данного вируса, является его исчерпывающей характеристикой на молекулярном уровне. Поэтому использование информации, заложенной в структуре нуклеиновых кислот, является надёжным критерием их идентификации. С этой целью можно использовать методы, позволяющие выявлять специфические фрагменты генома возбудителя болезни, на основании которых и делается заключение о наличии или отсутствии этого возбудителя в исследуемом материале. Одним из таких методов является полимеразная цепная реакция (ПЦР).
Полимеразная цепная реакция ( Polymerase chain reaction – PCR ) – это уникальная методика, равной которой нет среди других хорошо известных методов , заключается в размножении выбранного фрагмента генома возбудителя во много миллионов раз с помощью термостабильной ДНК-полимеразы в термоциклере, обеспечивающем необходимое для процесса циклическое изменение температуры по заданной программе.
Строение ДНК
Для понимания сущности полимеразной цепной реакции необходимо вспомнить строение ДНК.
Дезоксирибонуклеиновая кислота (ДНК) – один из двух типов нуклеиновых кислот, обеспечивающих хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов. В клетках эукариот (например, животных или растений) ДНК находится в ядре клетки в составе хромосом, а также в некоторых клеточных органоидах (митохондриях и пластидах). В клетках прокариотических организмов (бактерий) кольцевая или линейная молекула ДНК прикреплена изнутри к клеточной мембране, встречаются также небольшие автономные, преимущественно кольцевые молекулы ДНК, называемые плазмидами. Кроме того, одно- или двухцепочечные молекулы ДНК могут образовывать геном ДНК-содержащих вирусов.
Первые данные о химических свойствах ДНК появились в 1868 г. К началу 40-х годов ХХ в. было установлено, что молекула ДНК – это линейный полимер.
В 1953 году Джеймс Уотсон и Френсис Крик, основываясь на данных рентгеноструктурного анализа кристаллов ДНК, пришли к выводу, что молекула ДНК состоит из двух полимерных цепей, образуя двойную спираль.
Согласно предложенной ими модели, ДНК построена в виде двойной спирали, состоящей из двух полинуклеотидных цепей, сплетенных друг с другом так, что на каждый виток спирали приходится 10 пар оснований. Каждый нуклеотид, в свою очередь, состоит из пятиуглеродного сахара (дезоксирибозы у ДНК и рибозы у РНК), остатка фосфорной кислоты и одного из четырёх азотистых оснований (рис. 1).
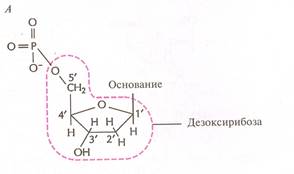
Рис. 1. Схема строения нуклеотида
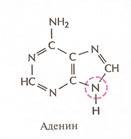
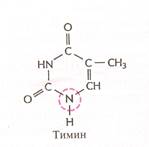
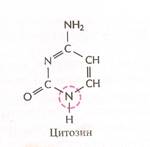
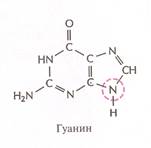
Нуклеотиды соединены между собой ковалентно в длинные цепи, которые в большинстве случаев (кроме некоторых вирусов, содержащих одноцепочечную ДНК) попарно объединяются при помощи водородных связей в структуру, называющуюся двойной спиралью. Водородные связи образуются между обращёнными друг к другу азотистыми основаниями. Основания, входящие в молекулу ДНК, относятся к двум группам: пурины (аденин и гуанин) и пиримидины (тимин и цитозин) (рис. 2). Пурины комплементарны пиримидинам, т.е. аденин образует связи только с тимином, гуанин – с цитозином. Между аденином и тимином образуются двойные водородные связи, между гуанином и цитозином – тройные.
Дезоксиаденозинтрифосфат - дАТФ
| Дезокситимидинтрифосфат - дТТФ
|
Дезоксицитидинтрифосфат - дЦТФ
| Дезоксигуанозинтрифосфат - дГТФ
|
Рис. 2. Строение четырёх нуклеотидов ДНК
Для двухцепочечных молекул ДНК мольные доли аденина и тимина равны, так же как и мольные доли гуанина и цитозина. Этот факт, открытый и изученный Э. Чаргаффом, был одним из важнейших среди тех данных, которые привели к открытию двойной спирали ДНК. Последовательность нуклеотидов в одной цепи однозначно определяет последовательность нуклеотидов в другой цепи. Поскольку водородные связи нековалентны, они легко разрываются и восстанавливаются. Цепочки двойной спирали могут расходиться под действием ферментов или при высокой температуре (95ºС).
Остов каждой спирали состоит из регулярно чередующихся фосфатов и сахаров. Фосфатные группы формируют фосфодиэфирные связи между третьим и пятым атомами углерода соседних молекул дезоксирибозы в результате взаимодействия между 3'-гидроксильной группой одной молекулы дезоксирибозы и 5'-фосфатной группой другой.
Асимметричные концы цепи ДНК называются 5' (пять штрих) и 3' (три штрих). Полярность цепи играет важную роль при синтезе ДНК (удлинение цепи возможно только путём присоединения новых нуклеотидов к свободному 3' концу). По своему химическому строению две цепи молекулы ДНК ориентированы противоположно (цепи «антипараллельны» друг другу, 3'-конец одной цепи связан с 5 '-концом другой, и наоборот) (рис. 3).
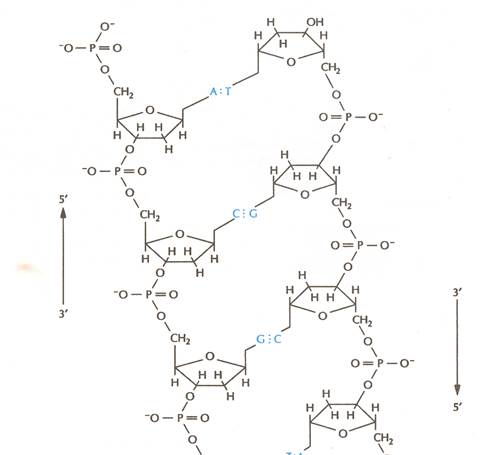
Рис. 3. Образование цепи ДНК
Носитель генетической информации должен удовлетворять двум основным требованиям: воспроизводиться (реплицироваться) с высокой точностью и детерминировать (кодировать) синтез белковых молекул. Модель Уотсона – Крика полностью отвечает этим требованиям.
Краткий словарь терминов
Аллель – одна из двух альтернативных структурных форм гена.
Амплификация (gene amplification) – увеличение числа копий какого-либо гена в данной клетке или в пробирке методом ПЦР; процесс образования дополнительных копий участков хромосомной ДНК, как правило, содержащих определенные гены, либо сегменты структурного гетерохроматина; амплификация может быть ответом клеток на селективное воздействие; один из механизмов активации онкогенов в процессе развития опухоли.
Антипараллельная ориентация – противоположная направленность цепей в двухцепочечных (двуспиральных) молекулах нуклеиновых кислот.
Бактериофаг – вирус, инфицирующий бактерии.
Биологическая безопасность – система медико-биологических, организационных и инженерно-технических мероприятий и средств, направленных на защиту работающего персонала, населения и окружающей среды от воздействия патогенных биологических агентов.
Биомасса – клеточная масса, образующаяся в результате жизнедеятельность живых организмов.
Бокс биологической безопасности – конструкция, используемая для физической изоляции (удержания и контролируемого удаления из рабочей зоны) микроорганизмов с целью предотвращения возможности заражения персонала и контаминации воздуха рабочей зоны и окружающей среды.
Боксированное помещение (бокс) – изолированное помещение с тамбуром (предбоксником).
Вирион – вирусная частица.
Ген ( Gene ) – транскрибируемый участок хромосомы, кодирующий функциональный белок, либо тРНК или рРНК.
Генетический код ( Genetic code ) – cистема записи генетической информации в виде последовательности нуклеотидов, в которой каждые три нуклеотида, составляющие кодон, кодируют одну аминокислоту.
Ген-мишень – клонированный ген; ген, подвергаемый специфическому воздействию; ген, интересующий исследователя.
Геном ( Genome ) – cовокупность генов гаплоидного набора хромосом данного организма.
Генотипирование – определение всех аллелей всех локусов данной хромосомы.
Гибридизация ( Hybridization ) – отжиг двух полинуклеотидных цепей, часто из разных источников, с образованием ДНК/РНК или ДНК/ДНК гибридов, стабилизируемых водородными связями
3' - гидроксильная группа – гидроксильная группа, связанная с 3'-атомом углерода сахарного остатка (рибозы или дезоксирибозы) концевого нуклеотида молекулы нуклеиновой кислоты.
Гуанин ( G ) ( Guanine ) – пуриновое основание, комплементарное цитозину; одно из четырех азотистых оснований, входящих в состав ДНК или РНК.
Дезоксирибоза (Deoxyribose ) – пятиуглеродный моносахарид, входящий в состав ДНК.
Дезоксирибюонуклеаза I , ДНКаза – фермент, расщепляющий двухцепочечную ДНК.
Дезоксирибонуклеиновая кислота (ДНК) – полимер, состоящий из дезокрибонуклеотидов, видоспецифичный носитель генетической информации.
Денатурация ( Denaturation ) – 1. расхождение цепей двухцепочечной молекулы ДНК или РНК; 2. нарушение нативной конформации биологических макромолекул в результате разрушения нековалентных (водородных) связей.
ДНК-зонд ( DNA - probe ) – фрагмент ДНК, меченный тем или иным способом и использующийся для гибридизации со специфическим участком в молекуле ДНК. Позволяет идентифицировать комплементарные ему нуклеотидные последовательности.
| ДНК - полимераза ( DNA - polymerase ) – фермент, катализирующий синтез полинуклеотидной цепи из отдельных нуклеотидов с использованием другой цепи в качестве матрицы и ДНК-затравки со свободной 3! – ОН - группой. |
ДНК - полимераза Taq (Taq - DNA - polymerase ) – термостабильная ДНК-полимераза (сохраняет активность при 95º С), выделенная из бактерии Thermus aquatius.
ДНК рекомбинантная – молекулы ДНК, создаваемые методами генетической инженерии.
Зонд ( Probe ) – 1. соединение, меченное тем или иным способом и использующееся для выявления родственных биохимических молекул в сложном образце; 2. олигонуклеотид, использующийся для выявления комплементарных последовательностей с помощью гибридизации.
Интеграция ( Integration ) – встраивание чужеродной ДНК (обычно с помощью гомологичной рекомбинации) в хромосому хозяйской клетки.
Комплементарная ДНК, кДНК – молекула ДНК, синтезированная на РНК-матрице с участием РНК-зависимой ДНК-полимеразы (обратной транскриптазы).
Комплементарные нуклеотидные последовательности – полинуклеотидные последовательности, которые взаимодействуют между собой в соответствии с правилами спаривания оснований: аденин (А) образует пару с тимином (Т) (или урацилом (У) в РНК), гуанин (Г) – с цитозином (Ц).
Лизис – разрушение клеточных стенок под действием ферментов, содержащихся в лизосомах, или других агентов.
Матричная РНК, мРНК ( Messenger RNA ) – молекула РНК, в которой заключена информация об аминокислотной последовательности определенной белковой молекулы.
Матричная цепь ( Template strand ) – цепь ДНК или другой полинуклеотид, использующийся ДНК-полимеразой в качестве матрицы для синтеза комплементарной цепи.
Мишень ( Taget ) – в самом широком смысле – биологический объект (ткань, молекула, клетка, микроорганизм), которая интересует исследователя.
Молекулярная диагностика – выявление молекулярно-биологическими методами патогенного микроорганизма, специфического вещества или измененной нуклеотидной последовательности, ответственных за то или иное заболевание.
Нуклеозид ( Nucleoside ) – пуриновое или пиримидиновое азотистое основание, ковалентно связанное с пятиуглеродным сахаром (пентозой); если сахаром является рибоза, то мы имеем дело с рибонуклеозидом, если дезоксирибоза, то с дезоксирибонуклеозидом.
Нуклеотид ( Nucleotide ) – нуклеозид, к которому присоединены одна или более фосфатная группа; присоединение происходит по 5'-углеродному атому сахарного кольца.
Обратная транскриптаза ( Reverse transcriptase ) – РНК-зависимая ДНК-полимераза, использующая молекулу РНК в качестве матрицы для синтеза комплементарной цепи ДНК.
Обратная транскрипция – полимеразная цепная реакция ( Reverse transcription - polymerase chain reaction ). Способ получения в большом количестве кДНК, состоящий из двух этапов. Вначале in vitro синтезируют кДНК, используя обратную транскриптазу, мРНК в качестве матрицы и oligo (dT) в качестве праймера. Затем кДНК амплифицируют с помощью полимеразной цепной реакции (ПЦР), используя два праймера: один комплементарен участку первой цепи кДНК, а второй – другой цепи, комплементарной первой.
Олигонуклеотид – короткий сегмент одноцепочечной ДНК, обычно получаемый химическим путем.
Отжиг ( Annealing ) – процесс образования двухцепочечных молекул (ДНК-ДНК или ДНК-РНК) из одиночных полинуклеотидных комплементарных цепей.
Патогенные биологические агенты – патогенные для человека микроорганизмы (бактерии, вирусы, хламидии, риккетсии, простейшие, грибы, микоплазмы), генно-инженерно-модифицированные микроорганизмы, яды биологического происхождения (токсины), гельминты, а также материал (включая кровь, другие биологические жидкости и экскреты организма), подозрительный на содержание перечисленных агентов.
Пиримидины ( Pyrimidinc ) – один из двух типов азотистых оснований, входящих в состав нуклеиновых кислот; к пиримидинам относятся тимин, цитозин и урацил. Второй тип оснований – пурины; к ним относятся аденин и гуанин.
Плазмида ( Plasmide ) – внехромосомный генетический элемент, способный к длительному автономному существованию и репликации, двухцепочечная кольцевая ДНК длиной 1-200 тыс. п.о.
Полимеразная цепная реакция, ПЦР ( Polymerase chain reaction ) – метод амплификации специфического сегмента ДНК с помощью термостабильной ДНК-полимеразы с использованием олигонуклеотидных ДНК-зондов, комплементарных последовательностям противоположных цепей ДНК, фланкирующим амплифицируемый сегмент. Процесс состоит из серии циклически повторяющихся реакций: денатурации ДНК, отжига праймеров, синтеза ДНК.
Полинуклеотид – линейный полимер, состоящий из 20 и более нуклеотидов, соединенных друг с другом фосфодиэфирными связями. Полинуклеотидами являются, например, молекулы ДНК и РНК.
Праймер ( Primer ) – короткий олигонуклеотид, который гибридизуется с матрицей и служит затравкой при её копировании.
Прокариоты ( Procaryotes ) – организмы, у которых нет ограниченных мембранами ядра и органелл, к прокариотам относятся все бактерии.
Протеиназы, протеолитические ферменты ( Protease ) – ферменты, расщепляющие пептидные связи в белковых молекулах.
Пиримидины – один из двух типов азотистых оснований, входящих в состав нуклеиновых кислот, к ним относят тимин, урацил и цитозин.
Пурины (Риппе) – второй тип азотистых оснований, входящих в состав нуклеиновых кислот; к пуринам относятся аденин и гуанин.
Ренатурация ( Renaturation ) – воссоединение цепей двухцепочечной ДНК, разошедшихся при денатурации.
Репликация ( Replication ) – процесс самовоспроизведения (синтеза) ДНК.
Рибоза ( Ribose ) – пятиуглеродный моносахарид, входит в состав РНК.
Рибонуклеиновая кислота, РНК ( Ribonucleic acid , RNA ) – нуклеиновая кислота, состоящая из рибонуклеотидов, у которых сахаром является рибоза, а одним из пиримидинов – урацил (вместо тимина).
Рибосома ( Ribosome ) – клеточная органелла, рибонуклеопротеидная частица, при участии которой осуществляется синтез белка (трансляция); состоит из двух субчастиц – большой и малой.
Рибосомная РНК, рРНК ( Ribosomal RNA , rRNA ) – РНК, входящая в состав рибосом.
Температура плавления, Tm ( Melting temperature ) – температура, при которой происходит разрыв половины водородных связей в полинуклеотидном дуплексе.
Тимин, T ( Thymine ) – пиримидиновое основание; одно из четырех азотистых оснований, входящих в состав ДНК.
Трансгенный организм ( Transgenic organism ) – организм, геном которого содержит чужеродный генетический материал, включённый методами генной инженерии.
Транскрипт ( Transcript ) – молекула РНК, синтезированная на специфической ДНК как на матрице.
Транскрипция ( Transcription ) – процесс синтеза РНК, катализируемый РНК-полимеразой, в котором в качестве матрицы используется одна из цепей ДНК.
Трансляция ( Translation ) – синтез полипептидной цепи рибосомой с использованием в качестве матрицы мРНК.
Транспортная РНК, тРНК ( Transfer RNA) –- молекула РНК, выступающая в роли адаптера при специфическом переносе аминокислот к растущей полипептидной цепи в процессе трансляции.
Трансформация ( Transformation ) – перенос генетической информации в бактериальные клетки с участием плазмид или без них, но всегда без участия вирусов; часто приводит к изменению фенотипа реципиентной клетки; превращение нормальных клеток животных в опухолевые.
Урацил, U ( Uracil ) – пиримидиновое основание; одно из четырех азотистых оснований, входящих в состав РНК.
Фосфодиэфирная связь ( Phosphodiester bond ) – связь между фосфатными группами при 3'- и 5' – углеродных атомах соседних нуклеотидов одной полинуклеотидной цепи.
Xpo мос o м a ( Chroraosome ) – структура, основу которой составляет конденсированная молекула ДНК; носитель генетической информации; способна к воспроизведению с сохранением структурно-функциональной индивидуальности в ряду поколений; у эукариот находится в ядре клетки, у прокариот - непосредственно в цитоплазме.
Цитозин, С ( Cytosine ) – одно из четырех азотистых оснований, входящих в состав ДНК и РНК.
Элонгация ( Elongation ) – последовательное присоединение мономеров к полимерной цепи.
Эукариоты ( Eukaryotes ) – организмы, у которых: 1) имеется ядро, где содержатся хромосомы; 2) в цитоплазме присутствуют различные органеллы - митохондрии, хлоропласта и т.п. К эукариотам относятся животные, растения, грибы, некоторые водоросли.
Приложение 2
Приложение 5
СОДЕРЖАНИЕ
| № п/п | Название раздела | Страницы |
| 1. | Введение | 3-4 |
| 2. | История открытия полимразной цепной реакции | 4-10 |
| 3. | Строение ДНК | 10-14 |
| 4. | Понятие о полимеразной цепной реакции. Основные компоненты ПЦР | 14-18 |
| 5. | Полимеразная цепная реакция 5.1. Модификации полимеразной цепной реакции, наиболее часто используемые в тест-системах разных прооизводителей | 19-21 22-24 |
| 6. | Выделение нуклеиновых кислот из исследуемого материала | 24-28 |
| 7. | Электрофоретическая детекция продуктов амплификации | 28-31 |
| 8. | Применение метода ПЦР в ветеринарии. Принципы организации ПЦР-лаборатории | 31-36 |
| 9. | Гибридизационно-флуоресцентная детекция 9.1. Подходы, используемые в технологии real-time | 36-38 39-46 |
| 10. | Заключение | 46-47 |
| 11. | Список использованной литературы | 48-51 |
| 12. | Краткий словарь терминов | 52-59 |
| 13. | Приложение 2. Тест-опрос по теме «Основы полимеразной цепной реакции» | 60-61 |
| 14. | Приложение 3. Тест-опрос по теме «Методы выделения ДНК и РНК» | 62-63 |
| 15. | Приложение 4. Тест-опрос по теме «ПЦР с детекцией в режиме «реального времени» | 64-65 |
| 16. | Приложение 5. Тест-опрос по теме «Методы детекции пролдуктов ПЦР» | 66-67 |
ОСНОВЫ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ
Дата: 2019-07-31, просмотров: 478.