Метод ПЦР в ветеринарии применяют для:
- выявления ДНК (РНК) возбудителей инфекционных болезней в биологическом (патологическом) материале от животных и птиц, в объектах внешней среды, в кормах для животных и пищевых продуктах;
- эпизоотологического мониторинга инфекционных болезней животных и птиц;
- определения видовой принадлежности бактериальных культур, а также для обнаружения контаминатов в культуре клеток;
- идентификации генетически-модифицированных источников (ГМИ) растительного происхождения в пищевых продуктах;
- научных целей при генотипировании штаммов или других видов анализа.
Основной проблемой ПЦР-диагностики, ограничивающей её применение, являются ложноположительные результаты. Их основной источник – это продукты ПЦР, попадающие в окружающую среду и далее могущие оказаться в исходной реакционной смеси. При детекции продуктов ПЦР электрофорезом в агарозном геле такие заносы (контаминации) являются весьма вероятными. Как раз на предотвращение контаминаций направлены очень высокие (и даже завышенные) требования к помещениям и организации работ для ПЦР-лабораторий, утверждённые Департаментом ветеринарии в 1997 году. Эти требования, тем не менее, не решают проблему полностью.
Правила определяют принципы организации лаборатории и этапы проведения ПЦР-исследования – отбор проб, первичная обработка, хранение, условия транспортировки, обеззараживание материала, выделение нуклеиновых кислот, проведение ПЦР (ОТ-ПЦР), учёт и регистрация результатов при исследовании объектов ветеринарного надзора.
Принципиальная схема организации ПЦР-лаборатории с детекцией методом электрофореза представлена на рис. 7.
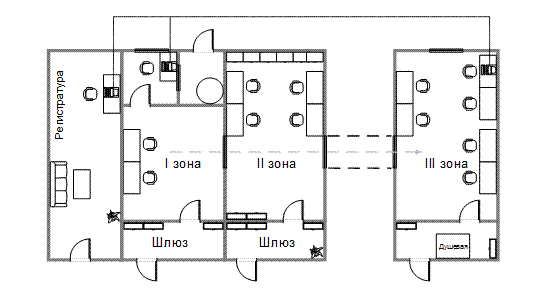
Рис. 7. Схема организации ПЦР-лаборатории с детекцией методом электрофореза.
Рабочая зона ПЦР-лаборатории в соответствии с этапами ПЦР-анализа должна включать следующий минимальный набор самостоятельных помещений:
- приема, регистрации, разбора, первичная обработка материала;
- подготовка проб и выделение НК (I зона);
- приготовление реакционных смесей, проведение ПЦР и обратная транскрипция (ОТ), гибридизационно-флуоресцентная детекция и учёт результатов ПЦР в режиме «реального времени» или по конечной точке флуоресценции (II зона);
- детекция и учёт результатов методом электрофореза.
Помещения, где проводят работы по выделению и амплификации НК, располагают как можно дальше от помещения для детекции и учёта результатов ПЦР с целью исключения движения воздушного потока и предотвращения контаминации продуктами амплификации (ампликонов), поскольку в процессе ПЦР фрагменты ДНК накапливаются в огромных количествах и являются идеальными продуктами для реамплификации.
Работа в ПЦР-лаборатории должна быть организована в одном направлении: от зон выделения и амплификации НК к зоне детекции и учёта результатов ПЦР. В разных зонах лаборатории должны работать отдельные сотрудники.
Не допускается выполнение ПЦР-исследований в помещениях для проведения работ с использованием культуральных (накопление патогенных биологических агентов) и генно-инженерных методов.
Все работы по подготовке исследуемых проб и выделению нуклеиновых кислот проводят в ламинарном боксе II-III класса защиты (фото 11-12). В боксе размещают всё необходимое для выделения нуклеиновых кислот оборудование: высокоскоростную центрифугу (фото 13-14), вортекс (фото 15-16), твёрдотельный термостат (некоторые модели представлены на фото 17-20), набор автоматических пипеток.
Каждая рабочая зона должна иметь свой набор лабораторной мебели, оборудования, реагентов, автоматических пипеток, расходных материалов, лабораторной посуды, защитной одежды, обуви, уборочного инвентаря и др. Имущество должно иметь маркировку, использование его в других помещениях или для проведения других работ запрещено.
Работы по подготовке реакционной смеси для ПЦР, внесению выделенных нуклеиновых кислот в ПЦР-смесь проводят в ПЦР-боксах, оснащённых ультрафиолетовыми лампами (фото 21).
Для проведения ПЦР-исследований необходимо использовать только одноразовые микропробирки и наконечники, имеющие сертификат « DNase , RNase and Endotoxins / Pyrogens free ». Для избежания аэрозольного загрязнения автоматических пипеток используют наконечники с антиаэрозольным фильтром. Пробирки и наконечники для автоматических пипеток используют однократно. При переходе от одной пробы к другой обязательно меняют наконечники с целью предотвращения перекрестной контаминации в процессе выделения ДНК, РКН или при раскапывании реакционной смеси.
Все работы в ПЦР-лаборатории проводят в спецодежде с использованием одноразовых перчаток.
Вторым недостатком ПЦР-исследования является получение ложноотрицательных результатов ПЦР. Причинами могут стать потери НК на этапе их выделения, ингибирование активных компонентов реакционной ПЦР-смеси, а также генотипическая изменчивость вирусов. Однако есть преимущество ПЦР-анализа, которое сразу же было оценено в диагностике – это гарантия достоверности отрицательного результата благодаря возможности контролировать процесс изнутри. Введение в ПЦР параллельно с анализируемым образцом специально сконструированных ДНК –внутренних стандартов (ВКО) – позволяет подтвердить, что в пробе при отсутствии возбудителя ПЦР прошла нормально и с обычной высокой чувствительностью.
Другими причинами получения ложноотрицательных результатов могут явиться:
· отсутствие возбудителя в исследуемой пробе в связи с неправильным отбором материала для ПЦР-исследования, без учёта тропизма возбудителя, мест его возможной локализации в организме животного, путей миграции и выведения из организма;
· из-за малого объёма изучаемого образца пробы (100-200 мкл), при некорректно проведённой пробоподготовке, возбудитель может не попасть в реакционную пробирку.
В связи с этим повышение достоверности результатов лабораторных исследований, проводимых с использованием метода ПЦР, зависит от соблюдения ряда факторов:
- физиологического состояния животного на момент взятия биологического материала;
- стадии развития патологического процесса;
- свойств биологического материала (стабильность при хранении и транспортировке и возможный метаболизм in vitro);
- порядка и условий отбора, хранения, транспортировки материала (требования к температурному режиму, времени доставки, первичной пробоподготовки и т.д.).
При отборе материала для ПЦР-исследования необходимо соблюдать меры, предупреждающие заражение людей, контаминирование объектов внешней среды, возможности переноса возбудителя от одной пробы к другой.
Отбор биологического материала проводят с учётом места максимальной локализации возбудителя и возможных путей его выделения в окружающую среду.
Материал от каждого животного или другого объекта ветеринарного надзора отбирают отдельным стерильным инструментарием в одноразовые контейнеры, флаконы, пробирки, пакеты и т.д. Контейнеры должны обеспечивать герметичность, стерильность, целостность образцов, а также исключать при открывании образование аэрозоля. Кроме того, контейнеры должны быть удобны для транспортировки.
Инструментарий (ножницы, пинцеты, шпатели) фламбируют над пламенем горелки, предварительно погрузив их в 96º-ный спирт; ступки, пестики после автоклавирования фламбируют с помощью подожжённого ватного тампона, смоченного спиртом.
При использовании для отбора материала стеклянных многоразовых пробирок, флаконов необходима уверенность, что они свободны от клеток живых или убитых возбудителей и их фрагментов. При этом следует учитывать, что обычно применяемые методы стерилизации (кипячение, автоклавирование и т.д.) недостаточны для разрушения ДНК. После автоклавирования лабораторную посуду дополнительно выдерживают в течение 2 ч. в сухожаровом шкафу при температуре не ниже 180оС или обрабатывают в течение 1-2 ч. 1N раствором соляной кислоты, 10%-ным раствором гипохлорита натрия или хлорамина Б, смесью концентрированной серной кислоты с двухромовокислым калием (хромпик) и затем промывают дистиллированной водой.
Материал упаковывают в отдельные пакеты с номерами, составляют сопроводительную, в которой указывают дату взятия и условия хранения материала до момента доставки в лабораторию. Транспортировку биологического материала осуществляют в термоконтейнерах с замороженными охлаждающими элементами или в термосе со льдом.
Для ПЦР-исследований используют цельную кровь, мочу, фекалии, сперму, смывы и соскобы с конъюнктивы, из полости носа, из ротоглотки, с поверхности зубов, трахеальные смывы, носовую и влагалищную слизь, выделения из половых органов, содержимое грудной и брюшной полостей, абортплоды, околоплодную жидкость, содержимое бурс, абсцессов и пр., куриные эмбрионы, молоко, фрагменты паренхиматозных органов (в т.ч. абортплода), головного мозга, лимфатических узлов, плаценты, плодных оболочек, семенников, кишечника и др., объекты внешней среды (вода, почва, смывы с различных объектов), корма и продукты питания, бактериальные культуры, вируссодержащую культуральную жидкость, гистопрепараты и многое другое.
Отбор материалов, предварительную его обработку, выделение и амплификацию нуклеиновых кислот, а также учёт результатов ПЦР проводят в соответствии с наставлениями или инструкциями к ПЦР-тест-системам.
Дата: 2019-07-31, просмотров: 873.